2. 北京农学院奶牛营养学北京市重点实验室, 北京 102206
2. Beijing Key Laboratory of Dairy Nutrition, Beijing Agricultural College, Beijing 102206, China
反刍动物瘤胃是一个厌氧的系统,瘤胃内的细菌、原生动物、真菌、古菌和病毒组成的瘤胃微生物群构成了一个复杂的共生网络,将低品质的纤维和其他植物性物质转化为可用于宿主反刍动物的能量,良好的微生物群环境对宿主反刍动物的维持、免疫功能和总体生产效率至关重要[1-2]。根据细菌对营养成分利用及产物的特点,瘤胃内细菌主要包括纤维分解菌、淀粉降解菌、蛋白质分解菌、脂肪降解菌、酸利用菌和乳酸产生菌等[3]。生产中为追求生产性能的提高,奶牛饲粮中精料比例也逐渐增高,而饲粮精粗比的断层式改变可能会导致瘤胃急性或亚急性酸中毒、消化道微生物菌群紊乱、蹄病、酮病等一系列负面危害[4]。海带作为褐藻的一种,在我国每年的海藻产量中位列第一[5]。作为一种优质的非常规饲料资源,海带含有诸多生物活性物质和营养物质,如蛋白质、氨基酸、多不饱和脂肪酸、维生素、矿物质、褐藻酸钠和多糖多酚等[6-7],但海带由于能值低,不能用作饲粮能量饲料的主要来源。研究发现,用海藻饲喂畜禽动物,能提高其营养物质消化率,促进矿物质的吸收,改善肠道菌群结构并能提高免疫功能[8-9]。
高通量测序技术由于其能全面地反映样品微生物结构的优点,而被广泛应用于研究反刍动物瘤胃微生物区系[10]。本试验对采食不同精料水平的奶牛瘤胃环境的变化进行分析,将精粗比改变所造成的瘤胃发酵环境变化与高精料中添加部分海带粉所产生的影响进行纵向对比,探讨海带粉对饲喂高精料饲粮奶牛瘤胃发酵环境的优化效果,同时通过16S rDNA高通量测序技术探讨海带粉作为饲料原料对瘤胃菌群结构的影响,以期在微生物水平下探寻海带粉对饲喂高精料饲粮奶牛瘤胃菌群结构的调控,为海藻饲料在反刍动物中的应用提供一定参考价值。
1 材料与方法 1.1 试验饲粮试验用海带于2017年7月在山东威海采集(褐藻,纯度100%,西安万方生物有限公司),并制成灰绿色粉末状的海带粉。试验用海带粉为同一批次,密封保存,试验期间成分稳定,其营养组成列于表 1。根据NRC(2001)[11]配制3种全混合日粮(TMR),分别为45%低精料饲粮、55%高精料饲粮和55%高精料+5%海带粉饲粮,3种饲粮的能量水平均达到或超过荷斯坦奶牛的能量需求。TMR组成及营养水平见表 2。通过四分法收集TMR样品,储存在-20 ℃待分析。通过在105 ℃烘箱中干燥直至获得恒定重量测定干物质含量[12];通过凯氏定氮法测定粗蛋白质含量[12];使用Soxhlet装置测定粗脂肪含量[12];根据Van Soest等[13]描述的方法,使用热稳定淀粉酶(No.A3306,Sigma)的方法测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)的含量。使用电感耦合等离子体质谱(ICP-MS)仪(上海安捷伦公司),采用电感祸合等离子体发射质谱法测定钙、磷、钾、镁、碘的含量,使用标准曲线法定量,平行测定2次取其平均值。根据雷帮星等[14]的方法,使用SM800多功能酶标仪(上海永创公司)测定甘露醇的含量。海藻酸钠的含量采用重量法[15]测定。
|
|
表 1 海带粉的营养组成(除特别注明外,均为干物质基础) Table 1 Nutrient composition of kelp powder (DM basis, unless otherwise stated) |
|
|
表 2 TMR组成及营养水平(风干基础) Table 2 Composition and nutrient levels of TMR (air-dry basis) |
选用15头体况良好、泌乳量相近、体重(605±36) kg的荷斯坦奶牛进行饲养试验,将其随机分为共3组,每组5头,分别饲喂45%低精料饲粮、55%高精料饲粮和55%高精料+5%海带粉饲粮,试验期35 d。试验牛每天饲喂3次(07:00、13:00和18:00),每天用全自动管道式挤奶机挤奶3次(09:00、15:00和20:00)。试验期间,每组奶牛分栏独立饲养,自由采食和饮水。牛舍地面每天打扫2次,每周彻底消毒1次,替换垫料1次,保证卫生清洁和动物福利健康。
1.3 样本收集及处理在试验最后1 d,在晨饲前使用口腔瘤胃液采样器采集瘤胃液,经无菌4层纱布过滤后,使用便携式pH计(Testo-205,Testo AG,Lenzkirch,德国)立即测量每个样品的pH,然后分装到无菌冻存管中,迅速投入液氮中带回实验室-80 ℃保存,用于瘤胃其他发酵参数和菌群结构的测定。分别根据Broderick等[16-17]的方法测定瘤胃液氨态氮(NH3-N)和微生物蛋白(MCP)浓度,通过气相色谱仪(GC-2010,Shimadzu,Kyoto,日本)进行挥发性脂肪酸(VFA)浓度分析。
1.4 总DNA抽提和PCR扩增使用E.Z.N.A.® Soil试剂盒(Omega Bio-Tek,Norcross,GA,美国)对瘤胃样本进行总DNA的抽提,DNA浓度和纯度利用NanoDrop 2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3~V4可变区进行PCR扩增[18],扩增程序为:95 ℃预变性3 min;27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s);最后72 ℃延伸10 min,10 ℃直到停止使用(PCR仪:ABI GeneAmp® 9700型)。扩增体系为20 μL,包括4 μL 5×FastPfu缓冲液、2 μL 2.5 mmol/L dNTPs、0.8 μL上游引物(5 μmol/L)、0.8 μL下游引物(5 μmol/L)、0.4 μL FastPfu聚合酶、10 ng DNA模板。
1.5 Illumina Miseq测序使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, 美国)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega, 美国)进行定量。根据Illumina MiSeq平台(Illumina, San Diego, 美国)标准操作规程将纯化后的扩增片段构建PE 2×300的文库。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.6 数据处理原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接。使用的UPARSE软件(version 7.1,http://drive5.com/uparse/),根据97%的相似度对序列进行操作分类单元(OTU)聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier (http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。
1.7 统计与分析所测各指标数据结果均以平均值和均值标准误(SEM)表示。根据以下模型,使用SAS 9.1软件包的GLM程序统计分析瘤胃发酵参数的试验数据:
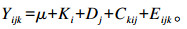
|
式中:Yijk是一个因变量;μ是所有观察的平均值;Ki是海带粉i的随机效应;Dj是饲粮j的随机效应;Ckij是海带粉×饲粮的随机效应,而Eijk~N(0, σe2)表示残留误差。P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 高精料饲粮和海带粉对奶牛瘤胃发酵参数的影响如表 3所示,相比45%低精料饲粮,55%高精料饲粮显著降低了奶牛瘤胃pH和乙酸、丁酸、异丁酸的比例(P < 0.05),显著增加了丙酸的比例以及总挥发性脂肪酸(TVFA)的浓度(P < 0.05)。相比55%高精料饲粮,在55%高精料饲粮中添加5%海带粉后,瘤胃pH和TVFA浓度显著升高(P < 0.05),与此同时NH3-N及MCP的浓度显著降低(P < 0.05),并且丁酸、异丁酸和异戊酸的比例显著增加(P < 0.05),而乙酸、丙酸、戊酸的比例未发生显著变化(P>0.05)。
|
|
表 3 高精料饲粮和海带粉对奶牛瘤胃发酵参数的影响 Table 3 Effects of high concentrate diet and kelp powder on rumen fermentation parameters of dairy cows |
本试验中,20个样本共产生797 223条有效序列,797 223个优化序列数目,平均序列长度为439.43 nt。3个组的样品稀释曲线趋于平缓,随着测序深度的增加,OTU数量将不再增加,趋于饱和,说明测序数量比较合理。在细菌群落中,在所有样品中鉴定出17个门,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是3个优势菌门,分别占总细菌群落的50.86%、39.37%和4.56%,放线菌门和其他菌门分别占总细菌群落的1.56%和3.65%,其他一些菌门[软壁菌门(Tenericutes)、Saccharibacteria、蓝细菌(Cyanobacteria)、黏胶球形菌门(Lentisphaerae)、Synergistetes和迷踪菌门(Elusimicrobia)]占总细菌群落的比例均小于1%,并且有些菌门如放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)和绿弯菌门(Chloroflexi)并非始终存在于所有瘤胃样本中。
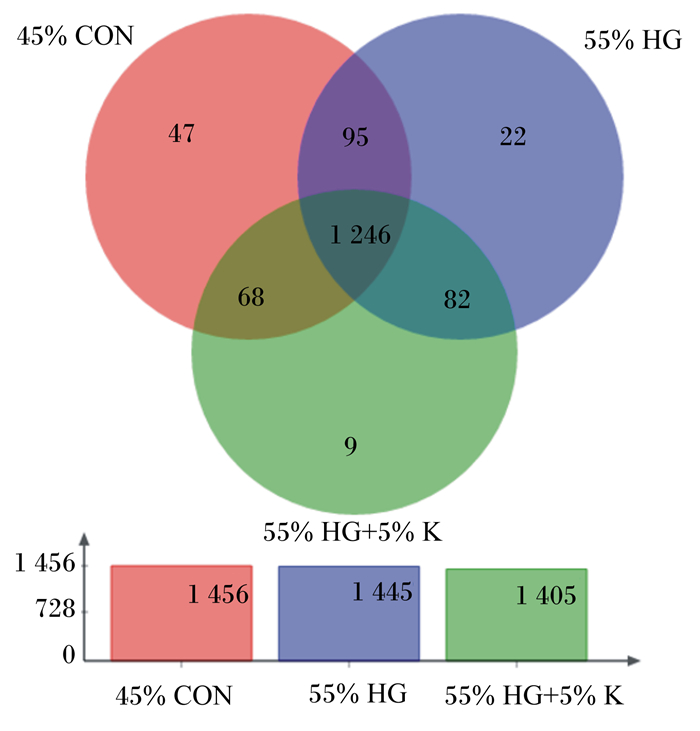
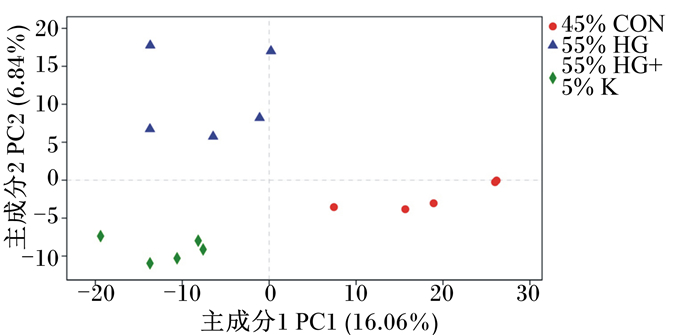
α多样性分析可反映微生物群落的丰富度和多样性,α多样性指数中其中反映群落丰富度是Chao1、ACE和Sobs指数,反映群落多样性的是Shannon和Simpson指数,反映测序深度是覆盖度(Good’s coverage)。由表 4可知,在OTU数目和覆盖度方面各组之间差异不显著(P>0.05),表明测序深度在各组之间是可比较的。就精料水平而言,与45%低精料饲粮相比,55%高精料饲粮显著升高了Simpson指数(P < 0.05),但显著降低了Shannon指数(P < 0.05),对其他α多样性指数无显著影响(P>0.05);相比55%高精料饲粮,在55%高精料饲粮中添加5%海带粉同样显著升高了Simpson指数(P < 0.05),显著降低了Shannon指数(P < 0.05),对其他α多样性指数无显著影响(P>0.05)。选用相似水平为97%的OUT分类学水平进行物种Venn图分析,用于统计3个组所共有和独有的OTU数目,从图 1中可以直观看出,3组样本的OUT重叠较高,55%高精料饲粮组样本OUT数目比45%低精料饲粮组OUT数目增加,而55%高精料饲粮中添加5%海带粉后,OUT数目尤其是特有的OUT数目降低。基于样本OTU水平偏最小二乘判别分析(PLS-DA)对3个组的样本进行比较,主坐标分析(PCoA)图(图 2)显示,3组样本明显分离,主成分1(PC1)和主成分2(PC2)在样品差异性贡献率上分别为16.06%和6.84%。进一步的ANOSIM分析显示海带粉的添加对饲喂55%高精料饲粮奶牛瘤胃细菌群落结构的影响显著(R2=0.432,P=0.011)。
|
图 1 OUT水平下3组样本物种差异Veen图 Fig. 1 Veen diagram of sample species differences in 3 groups under OUT level |
|
图 2 瘤胃细菌群落结构的PCoA图 Fig. 2 PCoA diagram of rumen microbial community structure |
|
|
表 4 各组瘤胃样本的OUT数目、丰富度和多样性指数 Table 4 Number of OUT, richness and diversity indices in ruminal samples from each group |
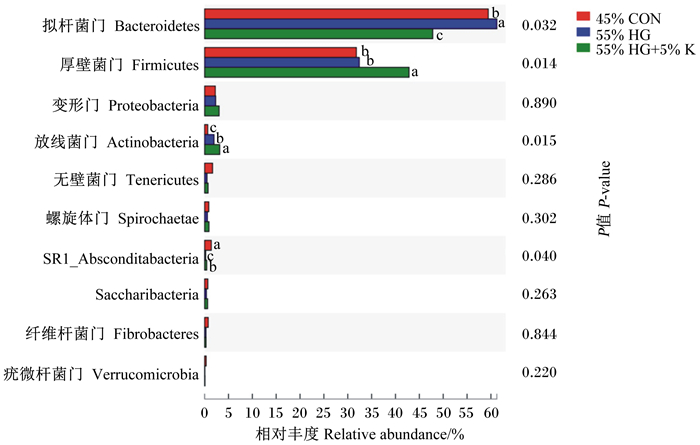
由图 3可知,在门水平上,拟杆菌门、厚壁菌门和变形菌门为瘤胃中主要的细菌类别。与45%低精料饲粮相比,55%高精料饲粮显著增加了拟杆菌门和放线菌门的相对丰度(P < 0.05),显著降低了SR1_Absconditabacteria的相对丰度(P < 0.05);而在55%高精料饲粮中添加5%海带粉后拟杆菌门的相对丰度变化趋势发生逆转,表现为显著降低(P < 0.05),厚壁菌门和放线菌门的相对丰度显著增加(P < 0.05)。其他主要菌门的相对丰度不受饲粮精料水平和海带粉添加的显著影响(P>0.05)。
|
数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Date columns with different small letter superscripts mean significant difference (P < 0.05). The same as below. 图 3 门水平下组间物种丰富度差异 Fig. 3 Species richness differences among groups at phylum level |
所有样本获得的相对丰度≥0.1%的细菌归为32个属,主要以普雷沃氏菌属(Prevotella)和瘤胃球菌属(Rumenococcus)为主。在属水平上,对相对丰度≥0.1%的前15个菌属了进一步分析,如图 4所示。相对于45%低精料饲粮,55%高精料饲粮显著增加了Ruminococcus_2和毛螺菌科NK3A20类群(Lachnospiraceae_NK3A20_group)的相对丰度(P < 0.05),显著降低了Prevotella_1和普雷沃氏菌科UCG-003(Prevotellaceae_UCG-003)的相对丰度(P < 0.05);而在55%高精料饲粮中添加5%海带粉后,进一步显著降低了Prevotella_1的相对丰度(P < 0.05),同时进一步显著增加了Ruminococcus_2的相对丰度(P < 0.05)。其他主要菌属的相对丰度各组间无显著差异(P>0.05)。
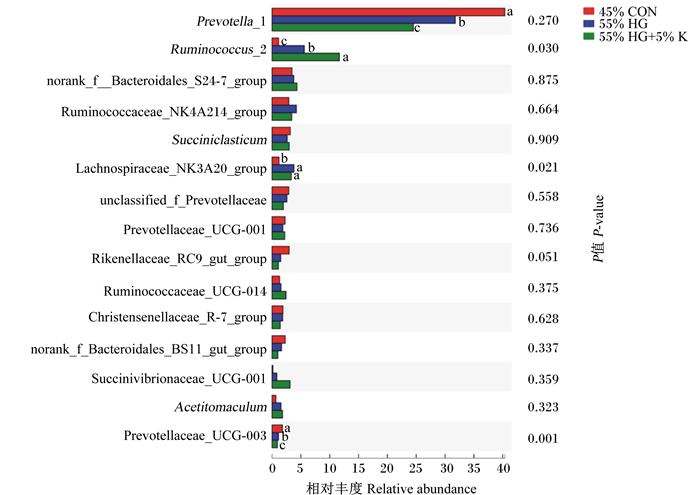
|
Prevotella_1:普雷沃氏菌属1;Ruminococcus_2:瘤胃球菌属2;norank_f__Bacteroidales_S24-7_group:norank_f_拟杆菌目S24-7类群;Ruminococcaceae_NK4A214_group:瘤胃球菌科NK4A214类群;Succiniclasticum:琥珀酸菌属;Lachnospiraceae_NK3A20_group:毛螺菌科NK3A20类群;unclassified_f_Prevotellaceae:未分类普雷沃氏菌科;Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道类群;Ruminococcaceae_UCG-014:瘤胃球菌科UCG-014;Christensenellaceae_R-7_group:克里斯滕森菌科R-7类群;norank_f_Bacteroidales_BS11_gut_group:norank_f_拟杆菌目BS11肠道类群;Succinivibrionaceae_UCG-001:琥珀酸弧菌科UCG-001;Acetitomaculum:聚乙酸菌属;Prevotellaceae_UCG-003:普雷沃氏菌科UCG-003。 图 4 属水平下组间物种丰富度差异 Fig. 4 Species richness differences among groups at genus level |
Dohme等[19]发现,奶牛瘤胃pH随着饲粮精粗比的提高而降低。本试验中,55%高精料饲粮组瘤胃pH比45%低精料饲粮组低,与上述结论一致。与此同时,本试验还发现在55%高精料饲粮中添加5%海带粉可以通过增加瘤胃pH,减少瘤胃酸性环境来改善瘤胃发酵,原因可能是海带粉中含有的碱性元素(钾、钙、钠、镁等)较多,在瘤胃内形成碱性氧化物[20]以及5%的添加量降低了饲粮中碳水化合物的比例。
NH3-N浓度是瘤胃氮代谢中最重要的指标之一,同时也是MCP合成的底物[21]。瘤胃中NH3-N浓度的变化反映了饲粮瘤胃降解率与NH3-N利用率之间的平衡关系[22]。本试验中,相比55%高精料饲粮,在55%高精料饲粮中添加5%海带粉显著降低了奶牛瘤胃中NH3-N浓度,表明其作为饲粮成分可降低瘤胃NH3-N浓度。研究表明,瘤胃中NH3-N的适宜浓度为5~25 mg/dL[23],本试验所得NH3-N浓度在适宜浓度范围内。Whitelaw等[24]指出,瘤胃中NH3-N的浓度变化受诸多因素的影响,如饲粮蛋白质溶解度、瘤胃壁吸收度、瘤胃液流出速度和食糜排空率等。据Owens等[25]报道,食糜的排空率与瘤胃液的流速受到饲料摄入量和颗粒饲料粒径的影响。Einarson等[26]发现,当颗粒饲料粒径减小时,食糜的排空率将增加,导致瘤胃蛋白质消化率降低和瘤胃中NH3-N浓度降低。而海带粉中含有丰度的褐藻胶,遇水后变为半胶质、物理特性变黏[27],这会增加食糜的流动性。Devant等[22]研究发现,瘤胃中微生物与饲粮的接触程度会受限于颗粒饲料的长度,较大的颗粒饲料会减少饲粮与微生物的接触面积,导致较低的蛋白质降解率,从而会使瘤胃微生物的合成能力减弱,造成瘤胃中NH3-N浓度升高。此外,由于海带粉中粗蛋白质含量低,仅为干物质含量的(7.0±1.3)%[28],因此其作为蛋白质资源用途有限[29]。综上所述,55%高精料+5%海带粉饲粮组瘤胃中NH3-N浓度降低的可能是海带粉自身的蛋白质转化率低、瘤胃壁对NH3-N的吸收量增加、瘤胃内容物排空率增大所致。
抑菌试验表明,海带多酚可以抑制消化道微生物如大肠杆菌,枯草芽孢杆菌和金黄色葡萄球菌的生长[30]。研究发现,大型藻类中的一些成分可以减少细菌、原生动物、古细菌、真菌的复杂瘤胃微生物群[31]和与饲粮发酵相关的噬菌体的数量[32-33],使瘤胃旁路蛋白质增加,MCP合成减少,导致蛋白质降解速率快于合成速率。Duric等[34]研究表明,较小饲料颗粒可以显著增加食糜流速和瘤胃液流出量,本试验中发现海带粉中存在的褐藻胶等物质遇水易使食糜黏结成糊状,而海带粉中较高含量的矿物质可能同时导致了饮水量的增加,进而增加了瘤胃内容物的流出速度,因此本试验中55%高精料+5%海带粉饲粮瘤胃中MCP浓度的降低可归因于瘤胃内容物流速加快导致的NH3-N浓度的物理性降低和海带粉自身多糖、多酚等物质的抗菌作用。
饲粮中精料的水平会影响瘤胃发酵的类型和VFA的组成。精料水平增加将导致瘤胃中乙酸的比例逐渐降低,丙酸的比例逐渐增加[35-36]。本试验中,55%高精料饲粮组瘤胃中乙酸和丁酸的比例显著低于45%低精料饲粮组,丙酸的比例则显著高于45%低精料饲粮组,与上述研究结论一致。而55%高精料饲粮中5%海带粉的添加对乙酸和丙酸的比例未产生显著影响,究其原因可能是海带粉营养组成中NDF的含量与其他粗饲料差别不大。此外,试验饲粮的粗脂肪含量按照45%低精料饲粮组、55%高精料饲粮组、55%高精料+5%海带粉饲粮的顺序依次递减,而瘤胃TVFA的产生量却正好相反,这在一定程度上佐证了海带粉的添加对试验结果的影响。
3.2 海带粉对饲喂高精料奶牛瘤胃菌群结构的影响饲粮影响瘤胃发酵参数主要通过影响瘤胃微生物区系或功能来实现[37]。研究表明,饲粮精料水平的提高会降低瘤胃中纤维降解菌和真菌的数量,当精料增加到一定水平时,瘤胃内的低pH环境最终会抑制纤维降解菌的生长[38]。Mao等[39]研究表明,在饲喂高精料饲粮引起的亚急性酸中毒的奶牛瘤胃内,变形菌门和拟杆菌门的比例显著降低,而厚壁菌门和放线菌门的比例则提高;在属水平上,Prevotella、密螺旋体属(Treponema)、厌氧支原体属(Anaeroplasma)等属细菌的比例在高精料饲粮组中较低,但Rumenococcus、奇异菌属(Atopobium)和梭菌目(Clostridiales)等细菌的比例较高。Wetzels等[40]发现,在门水平上,相比低精料饲粮,高精料饲粮饲养的奶牛具有更高的厚壁菌门丰度和更低的变形菌门丰度,因为变形菌门对低pH敏感,而且在低pH下,厚壁菌门仍然可以很容易地降解可发酵的碳水化合物。本试验发现,相比45%低精料饲粮,55%高精料饲粮饲养的奶牛瘤胃细菌在门水平上增加了放线菌门和厚壁菌门的相对丰度,同时降低了SR1_Absconditabacteria的相对丰度;在属水平上显著增加Ruminococcus_2和Lachnospiraceae_NK3A20_group的相对丰度,显著降低了Prevotella_1和Prevotellaceae_UCG-003的相对丰度。本试验中饲粮精料水平对瘤胃菌群结构的影响与上述研究结果一致。海带中含有海藻多糖和多酚,具有较强的抗氧化活性和抗菌活性,能抑制动物体内活性氧自由基的产生并促进其清除[41]。本试验中,在55%高精料饲粮中添加5%海带粉后,瘤胃样本OUT数目及独有的OUT数目降低,瘤胃内拟杆菌门的相对丰度变化趋势相比于精料水平增加的变化发生逆转降低,同时进一步增加了厚壁菌门和放线菌门的相对丰度;在属水平上,55%高精料饲粮中5%海带粉的添加改变了Prevotella_1和Ruminococcus_2的比例,使得Prevotella_1的相对丰度降低,Ruminococcus_2的相对丰度增加。Kang等[42]用新鲜小球藻液体作为添加剂饲喂肉鸡,发现肠道乳酸菌的数量显著增加,且对肉鸡肠道微生物群落中的大肠杆菌和沙门氏菌的数量无显著影响,试验中肉鸡肠道微生物区系的改善主要与小球藻中多糖和多酚的作用有关。吕钟钟等[43]研究显示,给小鼠灌服海藻膳食纤维可以显著增加消化道肠杆菌和肠球菌的数量,减少有害产气荚膜梭菌的数量,并且随着灌服剂量的增加,减少的幅度逐渐增大。Leonard等[44]给20头妊娠母猪和产后的80头仔猪饲喂海藻提取物,研究其对猪肠道形态、微生物群落和免疫状况的影响,发现海藻提取物组断奶仔猪结肠中大肠杆菌种群和肠杆菌科的数量显著减少,结肠中具有更高水平的黏蛋白2(MUC2)mRNA丰度。据此推测,海带粉对瘤胃菌群结构的影响可能是海带粉中多糖和多酚等物质的抑菌作用引起的。
普雷沃氏菌是拟杆菌门的主要细菌,含有较多高活性的半纤维素降解酶,广泛存在于瘤胃和动物后肠道中,在瘤胃中可降解并利用淀粉、蛋白质和植物细胞壁多糖[45]。本试验发现其在45%低精料饲粮组奶牛的瘤胃中所占比例较高,表明该属细菌与纤维消化密切相关[46]。瘤胃中的Rumenococcus主要包括白色瘤胃球菌和黄色瘤胃球菌,是主要的纤维降解菌,瘤胃球菌的生长都需要异戊酸、异丁酸和生物素,并且许多球菌需要氨,对氨的利用优先于氨基酸[45]。本试验中,55%高精料饲粮中5%海带粉的添加使得瘤胃中异戊酸和异丁酸的比例显著增加。异丁酸和异戊酸比例的增加促进了瘤胃中瘤胃球菌的生长,从而进一步加速了对氨的利用,这也印证了前文中提及的NH3-N浓度下降的结果。
4 结论① 海带粉可缓解饲喂高精料饲粮造成的奶牛瘤胃pH下降,并可降低瘤胃中NH3-N和MCP的浓度,同时还可增加瘤胃挥发性脂肪酸中异丁酸和异戊酸的比例,改善高精料饲粮下的瘤胃发酵模式。
② 海带粉改变了瘤胃内细菌区系环境。海带粉对饲喂高精料饲粮奶牛瘤胃中细菌的α多样性没有显著影响,但是显著降低了瘤胃中Prevotella_1的相对丰度,显著增加了Ruminococcus_2的相对丰度。
| [1] |
CAMMACK K M, AUSTIN K J, LAMBERSON W R, et al. RUMINNAT NUTRITION SYMPOSIUM:tiny but mighty:the role of the rumen microbes in livestock production[J]. Journal of Animal Science, 2018, 96(2): 752-770. |
| [2] |
HUWS S A, CREEVEY C J, OYAMA L B, et al. Addressing global ruminant agricultural challenges through understanding the rumen microbiome:past, present, and future[J]. Frontiers in Microbiology, 2018(9): 02161. |
| [3] |
焦万洪, 李莉. 牛瘤胃内主要细菌结构与功能探查[J]. 中国畜禽种业, 2016, 12(2): 84. DOI:10.3969/j.issn.1673-4556.2016.02.063 |
| [4] |
孙燕勇, 徐明, 高民, 等. 亚急性瘤胃酸中毒对反刍动物瘤胃上皮及内环境影响的研究进展[J]. 动物营养学报, 2018, 30(4): 1253-1261. DOI:10.3969/j.issn.1006-267x.2018.04.007 |
| [5] |
喻自清. 海藻产业发展大有前途[J]. 农业知识, 2016(36): 20-21. |
| [6] |
BALDRICK F R, SUNG C, MCFADDEN K, et al. The effect of seaweed derived polyphenols on inflammation and oxidative stress in vivo-the SWAFAX study[J]. Proceedings of the Nutrition Society, 2014, 73(OCE2): 18-20. |
| [7] |
OVERTON T R, YASUI T. Practical applications of trace minerals for dairy cattle[J]. Journal of Animal Science, 2014, 92(2): 416-426. DOI:10.2527/jas.2013-7145 |
| [8] |
HUHEIHEL M, ISHANU V, TAL J, et al. Activity of Porphyridium sp.polysaccharide against herpes simplex viruses in vitro and in vivo[J]. Journal of Biochemical and Biophysical Methods, 2002, 50(2/3): 189-200. |
| [9] |
梁冰, 于学成, 吴力克, 等. 螺旋藻在体外对双歧杆菌及乳杆菌增殖的促进作用[J]. 中国微生态学杂志, 1999, 11(4): 208-210. DOI:10.3969/j.issn.1005-376X.1999.04.008 |
| [10] |
周旭, 闵力, 赵圣国, 等. 高通量测序技术在瘤胃产甲烷菌群研究中的应用[J]. 家畜生态学报, 2018, 39(5): 1-5,86. DOI:10.3969/j.issn.1673-1182.2018.05.001 |
| [11] |
NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington, D.C.: National Academy Press, 2001.
|
| [12] |
HORWITZ W.Official methods of analysis of AOAC International[M].16th ed.Gaithersburg, Md.: AOAC International, 1995.
|
| [13] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [14] |
雷帮星, 高海波, 税小波, 等. 人工发酵古尼虫草中甘露醇的测定[J]. 菌物研究, 2004, 2(1): 40-44. DOI:10.3969/j.issn.1672-3538.2004.01.005 |
| [15] |
蒋新国, 奚念朱. 海藻酸钠的含量及分子量测定[J]. 上海医科大学学报, 1990, 17(1): 61-64. |
| [16] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [17] |
BRODERICK G, MICHAEL CRAIG W. Metabolism of peptides and amino acids during in vitro protein degradation by mixed rumen organisms[J]. Journal of Dairy Science, 1989, 72(10): 2540-2548. DOI:10.3168/jds.S0022-0302(89)79394-2 |
| [18] |
DENNIS K L, WANG Y W, BLATNER N R, et al. Adenomatous polyps are driven by microbe-instigated focal inflammation and are controlled by IL-10-producing T cells[J]. Cancer Research, 2013, 73(19): 5905-5913. DOI:10.1158/0008-5472.CAN-13-1511 |
| [19] |
DOHME F, DEVRIES T J, BEAUCHEMIN K A. Repeated ruminal acidosis challenges in lactating dairy cows at high and low risk for developing acidosis:ruminal pH[J]. Journal of Dairy Science, 2008, 91(9): 3554-3567. DOI:10.3168/jds.2008-1264 |
| [20] |
高敬尧, 王宏燕, 许毛毛, 等. 生物炭施入对农田土壤及作物生长影响的研究进展[J]. 江苏农业科学, 2016, 44(10): 10-15. |
| [21] |
王梦芝, 喻礼怀, 王洪荣, 等. 不同分子形式氮源对瘤胃微生物发酵及蛋白合成的影响[J]. 中国畜牧杂志, 2010, 46(5): 20-24. |
| [22] |
DEVANT M, FERRET A, GASA J, et al. Effects of protein concentration and degradability on performance, ruminal fermentation, and nitrogen metabolism in rapidly growing heifers fed high-concentrate diets from 100 to 230 kg body weight[J]. Journal of Animal Science, 2000, 78(6): 1667-1676. DOI:10.2527/2000.7861667x |
| [23] |
MCDONALD P, EDWARDS R A. The influence of conservation methods on digestion and utilization of forages by ruminants[J]. Proceedings of the Nutrition Society, 1976, 35(2): 201-211. DOI:10.1079/PNS19760033 |
| [24] |
WHITELAW F G, MILNE J S, CHEN X B. The effect of a rumen microbial fermentation on urea and nitrogen metabolism of sheep nourished by intragastric infusion[J]. Experimental Physiology, 1991, 76(1): 91-101. DOI:10.1113/expphysiol.1991.sp003484 |
| [25] |
OWENS F N, ZINN R A, KIM Y K. Limits to starch digestion in the ruminant small intestine[J]. Journal of Animal Science, 1986, 63(5): 1634-1648. DOI:10.2527/jas1986.6351634x |
| [26] |
EINARSON M S, PLAIZIER J C, WITTENBERG K M. Effects of barley silage chop length on productivity and rumen conditions of lactating dairy cows fed a total mixed ration[J]. Journal of Dairy Science, 2004, 87(9): 2987-2996. DOI:10.3168/jds.S0022-0302(04)73430-X |
| [27] |
卢伟丽.卡拉胶和褐藻胶流变学特性及凝胶特性的研究[D].硕士学位论文.青岛: 中国海洋大学, 2008.
|
| [28] |
SCHIENER P, BLACK K D, STANLEY M S, et al. The seasonal variation in the chemical composition of the kelp species Laminaria digitata, Laminaria hyperborea, Saccharina latissima and Alaria esculenta[J]. Journal of Applied Phycology, 2015, 27(1): 363-373. |
| [29] |
MCHUGH D J.A guide to the seaweed industry[R].FAO Fisheries Technical Paper 441.Rome: FAO, 2003.
|
| [30] |
史建鑫, 陈钢, 李栋林, 等. 超声辅助提取昆布多酚及其抑菌活性的研究[J]. 食品研究与开发, 2017, 38(8): 50-55. DOI:10.3969/j.issn.1005-6521.2017.08.011 |
| [31] |
KAMRA D N. Rumen microbial ecosystem[J]. Current Science, 2005, 89(1): 124-135. |
| [32] |
MACHADO L, MAGNUSSON M, PAUL N A, et al. Effects of marine and freshwater macroalgae on in vitro total gas and methane production[J]. PLoS One, 2014, 9(1): e85289. DOI:10.1371/journal.pone.0085289 |
| [33] |
YANG C, ROOKE J A, CABEZA I, et al. Nitrate and Inhibition of ruminal methanogenesis:microbial ecology, obstacles, and opportunities for lowering methane emissions from ruminant livestock[J]. Frontiers in Microbiology, 2016, 7: 132. |
| [34] |
DURIC M, ZHAO G Y, ORSKOV E R, et al. Indirect measurement of saliva secretion in sheep fed diets of different structures and the effect of such diets on ruminal fluid kinetics and fermentation pattern[J]. Experimental Physiology, 1994, 79(5): 823-830. DOI:10.1113/expphysiol.1994.sp003810 |
| [35] |
ZEBELI Q, TAFAJ M, WEBER I, et al. Effects of dietary forage particle size and concentrate level on fermentation profile, in vitro degradation characteristics and concentration of liquid-or solid-associated bacterial mass in the rumen of dairy cows[J]. Animal Feed Science and Technology, 2008, 140(3/4): 307-325. |
| [36] |
PITT R E, CROSS T L, PELL A N, et al. Use of in vitro gas production models in ruminal kinetics[J]. Mathematical Biosciences, 1999, 159(2): 145-163. DOI:10.1016/S0025-5564(99)00020-6 |
| [37] |
PETRI R M, SCHWAIGER T, PENNER G B, et al. Changes in the rumen epimural bacterial diversity of beef cattle as affected by diet and induced ruminal acidosis[J]. Applied and Environmental Microbiology, 2013, 79(12): 3744-3755. DOI:10.1128/AEM.03983-12 |
| [38] |
孙云章, 毛胜勇, 姚文, 等. 不同精粗比底物下瘤胃真菌和纤维降解细菌共培养发酵特性及菌群变化[J]. 微生物学报, 2006, 46(3): 422-426. DOI:10.3321/j.issn:0001-6209.2006.03.017 |
| [39] |
MAO S Y, ZHANG R Y, WANG D S, et al. Impact of subacute ruminal acidosis (SARA) adaptation on rumen microbiota in dairy cattle using pyrosequencing[J]. Anaerobe, 2013, 24: 12-19. DOI:10.1016/j.anaerobe.2013.08.003 |
| [40] |
WETZELS S U, MANN E, METZLER-ZEBELI B U, et al. Pyrosequencing reveals shifts in the bacterial epimural community relative to dietary concentrate amount in goats[J]. Journal of Dairy Science, 2015, 98(8): 5572-5587. DOI:10.3168/jds.2014-9166 |
| [41] |
崔艳秋, 罗鼎真, 王晓民. 褐藻多糖硫酸酯的抗炎与抗氧化活性研究进展[J]. 药学学报, 2008, 43(12): 1186-1189. DOI:10.3321/j.issn:0513-4870.2008.12.004 |
| [42] |
KANG H K, SALIM H M, AKTER N, et al. Effect of various forms of dietary Chlorella supplementation on growth performance, immune characteristics, and intestinal microflora population of broiler chickens[J]. The Journal of Applied Poultry Research, 2013, 22(1): 100-108. DOI:10.3382/japr.2012-00622 |
| [43] |
吕钟钟, 张文竹, 李海花, 等. 海藻复合膳食纤维改善小鼠胃肠道功能的实验研究[J]. 中国海洋药物, 2009(6): 31-35. |
| [44] |
LEONARD S G, SWEENEY T, BAHAR B, et al. Effects of dietary seaweed extract supplementation in sows and post-weaned pigs on performance, intestinal morphology, intestinal microflora and immune status[J]. British Journal of Nutrition, 2011, 106(5): 688-699. DOI:10.1017/S0007114511000997 |
| [45] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [46] |
MATSUI H, OGATA K, TAJIMA K, et al. Phenotypic characterization of polysaccharidases produced by four Prevotella type strains[J]. Current Microbiology, 2000, 41(1): 45-49. |




