2. 福建光华百斯特生态农牧发展有限公司, 福州 350003
2. Fujian Guanghua Best Eco-Agriculture Development Co., Ltd., Fuzhou 350003, China
我国规模化猪场多数饲养国外引进的瘦肉型猪种,后备种猪不发情或发情推迟的比例高达20%~30%,初情率较低,进入配种环节的淘汰率较高[1],直接影响养猪场的正常生产和经济效益。后备母猪初情期能否正常启动关系母猪终身的繁殖性能和利用年限[2]。业已证明,营养调控是解决后备母猪初情期启动问题的关键技术之一[3]。能量是动物营养的基础,能量摄入水平影响着机体生长速度和体组成并影响母猪繁殖性能,猪饲粮中的能量以碳水化合物、脂类及蛋白质3种形式存在,在动物的消化道内分别被水解为葡萄糖、氨基酸和脂肪酸后吸收。有研究表明,提高饲粮能量(脂肪或淀粉来源)水平可促进后备母猪血液中代谢激素胰岛素样生长因子-Ⅰ(IGF-Ⅰ)、促黄体素(LH)和雌二醇(E2)的分泌,饲喂脂肪来源的高能饲粮有利予后备母猪初情期的启动[4-5]。饲粮蛋白质(氨基酸)影响着后备母猪初情期的启动,后备母猪机体瘦肉沉积量与初情日龄呈显著负相关关系[6]。饲粮纤维主要在猪的后肠发酵,其中半纤维素与纤维素被降解为挥发性脂肪酸,添加纤维可促进后备母猪胃肠道发育,改善母猪繁殖性能[7],但提高饲粮纤维水平却降低了妊娠母猪对E2的分泌[8]。生产中常常通过增加饲粮纤维用量来调控后备母猪的生长速度、生殖体况,并改善胃肠道消化环境,但增加饲粮纤维用量是否会对其生殖机能的发育产生影响?目前由不同淀粉、脂肪、蛋白质和纤维水平组成的等能饲粮对后备母猪初情期启动和血清相关指标的影响研究鲜有报道。因此,本试验拟在等能等氮条件下探讨3种不同饲粮能量结构对后备母猪初情日龄、血清代谢产物和激素浓度的影响,以期为后备母猪的科学培育提供技术参考。
1 材料与方法 1.1 试验设计采用单因子随机试验设计,参照NRC(2012)[9]80~120 kg阶段猪的营养需要配制3种等能等氮试验饲粮,以淀粉水平为43.52%的常用后备母猪饲粮作为对照组(组2),组1、组3饲粮淀粉水平分别在组2的基础上增加和减少约14.50%,其中组1饲粮含有49.70%淀粉、2.81%粗脂肪(EE)和8.95%中性洗涤纤维(NDF);组2饲粮含有43.52%淀粉、5.68%EE和12.53%NDF;组3饲粮含有37.13%淀粉、8.73%EE和16.02% NDF。3种饲粮中其余营养素水平相同,均满足猪的营养需要。饲粮组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
选用90头(135±7)日龄、平均体重为(61.97±4.37) kg的长白×大白杂交后备母猪,根据体重相近的原则均衡分成3个组(每组5个重复,每个重复6头猪),分别饲喂3种由不同淀粉、EE及NDF水平构成的饲粮,预饲5 d后开始试验,在猪群第1个个体出现发情后的1个月结束试验,试验期68 d。试验猪舍为双列式构造,每栏面积12 m2,试验猪小群饲养,60~100 kg阶段自由采食粉料,每日07:30、11:30、15:00各喂料1次,以料槽略有余料为标准投放饲粮量,100 kg至试验结束阶段根据母猪体况进行适当限量饲喂,每日喂料2次,自由饮水,饲养管理按后备母猪操作规程进行。饲养试验在福建光华百斯特生态农牧发展有限公司猪场进行。
1.3 样品采集饲粮样品:以组为单位从每个包装袋取饲粮150 g(共1 500 g),混合均匀后按照四分法采集饲粮样品,冷藏保存待测。
血清样品:组内猪只首次出现发情时,试验猪群经过16 h禁食后,每个重复随机抽取3头猪,前腔静脉采集血液约10 mL,分离血清样品于-20 ℃贮存,待测血清指标。
1.4 测定指标及方法 1.4.1 生长性能预试期结束时试验猪禁食16 h的体重作为初始体重。试验结束时统计每个栏累计喂料量,再计算平均日采食量(ADFI)和平均消化能日摄入量。
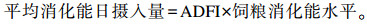
|
组内猪只出现发情征状时,试验猪逐只在左侧最后肋骨处距离背中线6.5 cm处测定背膘厚,测定仪器为亚卫畜牧广州新技术有限公司生产的亚卫8800型背膘测定仪。
1.4.3 初情日龄、发情率试验母猪体重约80 kg后,每天07:00—07:30和14:00—14:30查看母猪发情状况,以出现静立反射为标志。初情日龄系指母猪从出生到第1次发情的时间间隔;发情率系指发情母猪头数占母猪总头数的比例,其统计时间为母猪出现发情后的1个月。
1.4.4 血清指标血清葡萄糖(GLU)、甘油三酯(TG)和总胆固醇(TC)浓度采用比色法测定,仪器为奥林巴斯(Olympus)公司的AU2700生化分析仪。血清胰岛素(INS)、IGF-Ⅰ、瘦素(Leptin)、促性腺激素释放激素(GnRH)、促卵泡素(FSH)、LH和E2浓度采用酶联免疫吸附试验(ELISA)方法测定,仪器为芬兰Labsystems Multiskan MS公司的352型酶标仪。上述指标测定所用试剂盒均购自上海朗顿生物技术有限公司。
1.5 数据统计分析先用Excel 2007软件对数据进行处理,再用SPSS 13.0统计软件进行方差分析,并采用Duncan氏法对差异显著的数据进行多重比较,以P < 0.05表示差异显著,P>0.05表示差异不显著。试验结果采用平均值±标准差表示。
2 结果与分析 2.1 不同饲粮能量结构对后备母猪背膘厚、初情日龄和发情率的影响由表 2可知,随着饲粮淀粉水平的降低和EE、NDF水平的增加,后备母猪背膘厚呈下降趋势,但3组间差异不显著(P>0.05);初情日龄以组1最小,但3组间差异不显著(P>0.05);发情率组1和组2比组3均提高10百分点,但3组间差异不显著(P>0.05)。
|
|
表 2 不同饲粮能量结构对后备母猪背膘厚、发情日龄和发情率的影响 Table 2 Effects of different dietary energy structures on backfat thickness, age of puberty and estrus ratio of replacement gilts |
由表 3可知,随着饲粮淀粉水平的降低和EE、NDF水平的增加,后备母猪血清TG浓度逐渐升高,但组间差异不显著(P>0.05);不同饲粮能量结构对后备母猪血清TG和GLU浓度无显著影响(P>0.05)。
|
|
表 3 不同饲粮能量结构对后备母猪血清代谢产物浓度的影响 Table 3 Effects of different dietary energy structures on serum metabolite concentrations of replacement gilts |
由表 4可知,随着饲粮淀粉水平的降低和EE、NDF水平的增加,后备母猪血清INS浓度呈现下降趋势,但组间差异未达显著水平(P>0.05);血清IGF-Ⅰ、Leptin浓度组1显著高于组3(P < 0.05),组1与组2间、组2与组3差异不显著(P>0.05)。
|
|
表 4 不同饲粮能量结构对后备母猪血清代谢激素浓度的影响 Table 4 Effects of different dietary energy structures on serum metabolic hormone concentrations of replacement gilts |
由表 5可知,随着饲粮淀粉水平的降低和EE、NDF水平的增加,后备母猪血清GnRH浓度逐渐下降,组1显著高于组2和组3(P < 0.05),组2与组3组间差异不显著(P>0.05);血清LH浓度组1显著高于组3(P < 0.05),组1与组2间、组2与组3间差异不显著(P>0.05),血清E2、FSH浓度各组间差异不显著(P>0.05)。
|
|
表 5 不同饲粮能量结构对后备母猪血清生殖激素浓度的影响 Table 5 Effects of different dietary energy structures on serum reproductive hormone concentrations of replacement gilts |
本试验结果表明,随着饲粮淀粉水平的降低和EE、NDF水平的增加,后备母猪背膘厚和发情率呈降低趋势,初情日龄呈上升趋势,主要的原因是,本试验中组2、组3饲粮虽然添加了3%和6%豆油,但也相应增加了NDF水平,而高纤维饲粮会显著降低能量和干物质的表观消化率[10],并影响脂肪酸的吸收[11],所以血清TG和TC浓度虽然比组1有所提高,但组间差异不显著,而组1含较高水平的淀粉,淀粉经消化分解成为GLU,通过糖脂代谢途径转化为甘油和脂肪酸,再转化为体脂储存;此外,过多增加的饲粮纤维不仅增加了饲料容积,而且影响饲料的适口性,所以组1的平均日采食量和平均消化能日摄入量均高于组3,提高能量摄入量亦能增加体脂沉积。上述2个原因使得组1的后备母猪背膘厚高于组3,而背膘厚的增加有利于促进后备母猪初情期启动、改善母猪后续繁殖性能[12-13]。由此说明,与饲粮添加脂肪并增加纤维水平相比,提高饲粮淀粉水平在一定程度上增加了后备母猪的背膘厚,缩短了初情日龄。
3.2 不同饲粮能量结构对后备母猪血清代谢产物、代谢激素和生殖激素浓度的影响血清生化指标可反映动物机体代谢情况,血清TG、TC和GLU浓度常作为反映机体能量代谢的指标,亦被视为初情启动的代谢信号[14]。本试验结果表明,随着饲粮淀粉水平的降低和EE、NDF水平的增加,血清TG、TC浓度无显著变化,这与周东胜等[5]的研究结果不一致,主要区别在于二者试验饲粮的能量组成不同,本试验组2和组3饲粮中除了含淀粉和油脂外,也含有较多的NDF,而高饲粮纤维能显著影响脂肪的消化吸收[9-10],使得猪只通过肠道吸收的脂肪减少,导致与以淀粉为主要能量来源的组1相比,血清TG、TC浓度差异不显著。淀粉的主要生理功能是为机体提供GLU[15],本试验结果表明,随着饲粮淀粉水平的降低和EE、NDF水平的增加,后备母猪血清GLU浓度无显著变化,这与王长宁等[16]的研究结果不一致,王长宁等[16]的研究认为随着饲粮淀粉水平的降低和豆油、NDF水平的增加,肥育猪血清GLU浓度会升高,产生不同结果的原因可能与血液采集时间有关,本试验是在后备母猪禁食16 h后采集血液,此时,机体会通过糖脂代谢途径有效调节血液中GLU和脂肪酸的浓度,以保证机体维持稳定的血液GLU浓度[5]。
本试验结果显示,随着饲粮淀粉水平的降低和EE、NDF水平的增加,后备母猪血清INS浓度逐渐下降,这与Ferguson等[17]的试验结果一致。周东胜等[5]的研究认为低能量摄入不利于肝脏调节IGF-Ⅰ最大分泌,而高淀粉饲粮能促进肝脏分泌INS和IGF-Ⅰ,本试验中后备母猪平均消化能日摄入量与周东胜等[5]试验中的低能量组相近,因此,在本试验饲粮能量水平下,随着饲粮淀粉水平的降低,后备母猪血清IGF-Ⅰ浓度出现显著降低。但本试验中血清Leptin浓度的变化情况与周东胜等[5]的试验结果不一致,可能的原因是随着饲粮淀粉水平的降低和EE、NDF水平的增加,后备母猪的背膘厚呈现出下降趋势,而血液中Leptin主要由脂肪细胞分泌,后备母猪背膘厚的增加能够促进Leptin的分泌;另有研究表明,母猪妊娠期采食高纤维水平(12.4% vs. 3.2%)的饲粮后,分娩前血液中Leptin浓度显著降低[18],说明饲粮纤维对猪血清Leptin的分泌也有一定影响,因此出现本试验中随着饲粮淀粉水平的降低和EE、NDF水平的增加,血清Leptin浓度逐步降低的现象。
营养通过改变激素分泌影响动物卵巢发育而调控情期启动[3]。血清中代谢激素INS、IGF-Ⅰ和Leptin浓度的变化是情期启动的代谢信号[19-20],能介导GnRH的分泌,通过下丘脑-垂体-性腺(HPG)轴促进垂体前叶促性腺激素LH的分泌[20],而GnRH和LH是母猪情期启动和发情表现的重要信号[13]。本试验结果表明,随着饲粮淀粉水平的降低和EE、NDF水平的增加,后备母猪血清INS浓度呈现下降趋势,血清IGF-Ⅰ、Leptin浓度则呈现显著降低,促使后备母猪血清GnRH和LH浓度显著下降,该试验结果与上述相关报道相符合。周虚等[21]研究认为后备母猪在初情期前的早期血清FSH浓度较低,临近初情期血清FSH浓度逐渐升高,本试验结果表明,不同饲粮能量结构对后备母猪血清FSH浓度没有显著影响,这个结果与周虚等[21]的报道相一致。此外,本试验得出不同饲粮能量结构对后备母猪血清E2浓度无显著影响,主要原因是3个试验组间血清TC浓度差异不显著,而血清TC是体内卵巢合成雌性激素的前体物,能促进E2的分泌,因此,各组间血清E2浓度相应呈现出差异不显著。
4 结论① 不同饲粮能量结构对后备母猪血清TG、TC和GLU浓度无显著影响。
② 过多降低后备母猪饲粮淀粉水平并提高EE、NDF水平,会影响血清中代谢激素IGF-Ⅰ、Leptin和生殖激素GnRH、LH的分泌,不利于初情期启动。
| [1] |
TUMMARUK P, TANTASUPARUK W, TECHAKUMPHU M, et al. Age, body weight and backfat thickness at first observed oestrus in crossbred Landrace×Yorkshire gilts, seasonal variations and their influence on subsequence reproductive performance[J]. Animal Reproduction Science, 2007, 99(1/2): 167-181. |
| [2] |
张守全. 如何通过影响母猪的初情期来提高繁殖性能[J]. 中国猪业, 2013(8): 65-66. |
| [3] |
宋琼莉, 邹志恒, 陈国良. 影响后备母猪初情期的因素[J]. 江西畜牧兽医杂志, 2002(4): 18-19. DOI:10.3969/j.issn.1004-2342.2002.04.010 |
| [4] |
周平.不同能量水平和来源对后备母猪体成分、初情日龄和发情率的影响[D].硕士学位论文.雅安: 四川农业大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10626-2008198002.htm
|
| [5] |
周东胜, 吴德, 卓勇, 等. 能量水平和来源对后备母猪血液代谢产物、激素分泌及卵泡液成分的影响[J]. 畜牧兽医学报, 2009, 40(5): 683-690. DOI:10.3321/j.issn:0366-6964.2009.05.013 |
| [6] |
PATTERSON J L, BALL R O, WILLIS H J, et al. The effect of lean growth rate on puberty attainment in gilts[J]. Journal of Animal Science, 2002, 80(5): 1299-1310. DOI:10.2527/2002.8051299x |
| [7] |
VEUM T L, CRENSHAW J D, CRENSHAW T D, et al. The addition of ground wheat straw as a fiber source in the gestation diet of sows and the effect on sow and litter performance for three successive parities[J]. Journal of Animal Science, 2009, 87(3): 1003-1012. |
| [8] |
冯冬冬.日粮纤维水平对妊娠母猪繁殖性能的影响[D].硕士学位论文.雅安: 四川农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10626-2010244751.htm
|
| [9] |
NRC.Nutrient requirements of swine[S].10th ed.Washington, D.C.: National Academy Press, 1998.
|
| [10] |
MOORE R J, KORNEGAY E T, GRAYSON R L. Growth, nutrient utilization and intestinal morphology of pigs fed high-fiber diets[J]. Journal of Animal Science, 1988, 66(6): 1570-1579. DOI:10.2527/jas1988.6661570x |
| [11] |
张金枝.日粮能量结构对母猪繁殖和泌乳性能的影响研究[D].博士学位论文.杭州: 浙江大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10335-2010144256.htm
|
| [12] |
周虚, 于淼瑛, 刘立文, 等. 能量对初情期前母猪卵巢LHR和FSHR mRNA表达的影响(英文)[J]. 中国兽医学报, 2009, 29(1): 97-105. |
| [13] |
STERNING M, RYDHMER L, ELIASSON-SELLING L. Relationships between age at puberty and interval from weaning to estrus and between estrus signs at puberty and after the first weaning in pigs[J]. Journal of Animal Science, 1998, 76(2): 353-359. DOI:10.2527/1998.762353x |
| [14] |
HE D Q, FUNABASHI T, SANO A, et al. Effects of glucose and related substrates on the recovery of the electrical activity of gonadotropin-releasing hormone pulse generator which is decreased by insulin-induced hypoglycemia in the estrogen-primed ovariectomized rat[J]. Brain Research, 1999, 820(1/2): 71-76. |
| [15] |
WISEMAN J. Variations in starch digestibility in non-ruminants[J]. Animal Feed Science and Technology, 2006, 130(1/2): 66-77. |
| [16] |
于长宁, 李艳娇, 张柏林, 等. 不同供能物质组成饲粮对育肥猪养分表观消化率、血清生化指标和激素水平的影响[J]. 动物营养学报, 2015, 27(3): 902-909. DOI:10.3969/j.issn.1006-267x.2015.03.030 |
| [17] |
FERGUSON E M, ASHWORTH C J, EDWARDS S A. Effect of different nutritional regimens before ovulation on plasma concentrations of metabolic and reproductive hormones and oocyte maturation in gilts[J]. Reproduction, 2003, 126(1): 61-71. DOI:10.1530/rep.0.1260061 |
| [18] |
QUESNEL H, MEUNIER-SALAÜN M C, HAMARD A, et al. Dietary fiber for pregnant sows:influence on sow physiology and performance during lactation[J]. Journal of Animal Science, 2009, 87(2): 532-543. DOI:10.2527/jas.2008-1231 |
| [19] |
LONGO K M, SUN Y H, GORE A C. Insulin-like growth factor-Ⅰ effects on gonadotropin-releasing hormone biosynthesis in GT1-7 cells[J]. Endocrinology, 1998, 139(3): 1125-1132. DOI:10.1210/endo.139.3.5852 |
| [20] |
GAMBA M, PRALONG F P. Control of GnRH neuronal activity by metabolic factors:the role of leptin and insulin[J]. Molecular and Cellular Endocrinology, 2006, 254-255: 133-139. DOI:10.1016/j.mce.2006.04.023 |
| [21] |
周虚, 董伟. 北京黑猪性成熟过程中外周血清促黄体素浓度变化[J]. 兽医大学学报, 1993, 13(3): 261-264. |




