2. 山东大学(威海)海洋学院, 威海 264209
2. Marine College, Shandong University(Weihai), Weihai 264209, China
水产动物各种疾病的出现对水产养殖业生产和可持续发展造成了危害。为了控制疾病的发生与爆发,可以通过提高鱼类自身的免疫力以抵抗病原体的侵入。在养殖鱼类饲料中使用免疫增强剂就是一种增强养殖鱼类免疫状态的有效手段,β-葡聚糖即为免疫增强剂的一种。β-葡聚糖是一类非淀粉多糖,在自然界中含量丰富,普遍存在于细菌、真菌、酵母和植物的细胞壁中。酵母β-葡聚糖是使用最广泛的β-葡聚糖,因其制备原料——酿酒酵母(Saccharomyces cerevisiae)来源于啤酒的酿造,资源极其丰富。
鱼类摄取β-葡聚糖后经肠道进入血液,与宿主的特定受体相互识别和作用以启动机体先天性免疫应答,对细胞溶菌酶活性、吞噬作用、补体活性、呼吸爆发水平和细胞因子产量及炎症反应进行调节,并进一步增强获得性免疫应答。另外,β-葡聚糖作为益生元,能够影响鱼类黏膜免疫及胃肠道微生物群的组成和活性。β-葡聚糖结构的不同可能是造成其生物活性差异的关键性因素。
迄今为止,有很多综述文献对酵母β-葡聚糖的结构、功能及其对免疫系统的作用进行了总结,本文将在前人研究与报道的基础上做进一步的完善,就其免疫调节作用机制和结构与功能的关系等做出较为完整的综述,并提出一些有待商榷的问题和建议,为后续的研究提供参考。
1 酵母β-葡聚糖的化学结构和链构象葡聚糖是高分子质量的葡萄糖聚合物,这类多聚物目前很难被人工合成,需从自然界生物中提取得到。根据它们链内的联系被广泛地分为α-连接或β-连接。自然发生的D-葡萄糖相对于L-葡萄糖占主导地位,自身可形成一个吡喃葡萄糖基。植物β-葡聚糖可来自于谷物的胚乳,包括燕麦和大麦,含β-(1,3)和β-(1,4)连接[1]。商业中从酿酒酵母中分离得到的酵母多糖依赖外界物理和化学生长条件,在细胞大小、形状和颜色上有丰富的多样性[2]。通常酵母细胞壁的主要成分是多糖,占80%~90%,主要是β-葡聚糖和甘露寡糖。酵母β-葡聚糖一般有2种类型:分支的β-(1,3)-D-葡聚糖和β-(1,6)-D-葡聚糖,二者物理性质不同。β-(1,3)-D-葡聚糖具有一个高分子质量的线性主链和随意分散的β-(1,6)-D-葡萄糖基侧链,且侧链通常连接在O-6上,不溶于碱;由β-(1,6)-D-葡聚糖作为主链的多糖较短(10~100 ku),有1或2个β-(1,3)连接单元作为侧链,可溶于碱[3-4],如图 1。酵母β-D-葡聚糖不溶于水,呈中性,不带电荷。由于其分子内多羟基的相互作用,形成了致密的三螺旋结构[5]。由于复杂的糖苷键连接、分支结构和频率、多个分子内和分子间氢键的相互作用等,不同分支度的葡萄糖残基的化学结构表现出丰富的多样性[6],为其发挥多种生理功能奠定了基础。
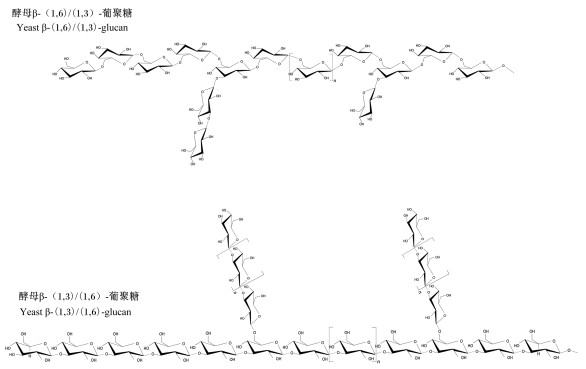
|
图 1 酵母β-葡聚糖结构 Fig. 1 Structural elements of yeast β-glucans[3] |
随着水产行业的迅速发展,为了提高养殖鱼类的生长性能和疾病抵抗力,β-葡聚糖作为鱼类免疫增强剂的使用越来越受到关注。无论是可溶性大分子还是不可溶微粒形式的β-葡聚糖,都可作为免疫调节剂参与先天性免疫和获得性免疫。它们可以直接或间接作用于免疫系统,通过激活单核细胞、巨噬细胞和中性粒细胞触发一系列活动,如图 2所示。本文将讨论β-葡聚糖免疫刺激作用的可能机制,包括受体识别、信号转导以及对相关基因表达、黏膜免疫及肠道菌群的影响。
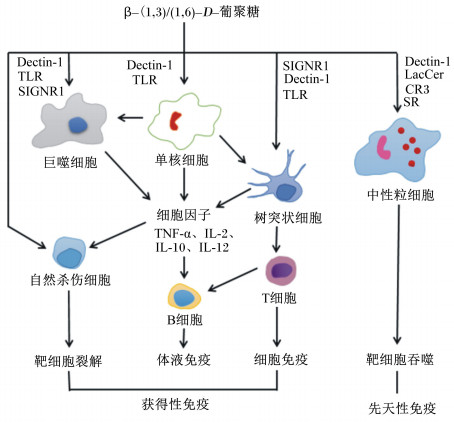
|
TLRs:Toll样受体Toll-like receptors;LacCer:乳糖神经酰胺lactosylceramide;CR3:补体受体3 complement receptor 3;SRs:清道夫受体scavenger receptors;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;IL-2:白细胞介素-2 interleukin-2;IL-10:白细胞介素-10 interleukin-10;IL-12:白细胞介素-12 interleukin-12。 图 2 免疫激活相关的可能的β-葡聚糖受体和信号转导通路 Fig. 2 Immune activation related possible β-glucan receptors and signaling pathways[6] |
β-葡聚糖口服后穿过肠道进入体内,再由吞噬细胞经淋巴系统运送至免疫器官,后将其释放进入血液中发挥作用。Løkka等[7]用肛门插管的方法研究大西洋鲑肠道对酵母细胞的摄取机制,在插管后不同时间段取样,分别在肠上皮中巨噬细胞样细胞核附近和肠腔中大单核细胞内部发现了酵母,表明其在肠道上皮中的摄取和转运可能与巨噬细胞样细胞有关。
通常,多糖主要通过识别先天性免疫细胞上的受体对免疫系统进行调节,这在宿主防御中起重要作用,也为修饰宿主免疫应答提供了机会。这些受体被称为模式识别受体(pattern recognition receptors, PRRs),主要包括Dectin-1、Toll样受体(Toll-like receptors, TLRs)、补体受体3(complement receptor 3, CR3)、清道夫受体(scavenger receptors, SRs)和乳糖神经酰胺(lactosylceramide,LacCer),它们由不同的免疫细胞表达在细胞表面或细胞内,包括但不限于巨噬细胞、单核细胞、中性粒细胞、树突状细胞和自然杀伤细胞。β-葡聚糖自身作为病原相关分子模式(pathogen-associated molecular patterns, PAMPs)与PRRs相互作用以调节其免疫活性。病原相关分子模式指一种“危险”信号,是指病原存在时,免疫应答激活所需的,由病原产生、供宿主识别的特异性结构保守成分[8]。
Dectin-1属于非经典C型凝集素样家族,主要连接蛋白质配体,也是最主要的β-葡聚糖受体[9],但在鱼类中还未证实有Dectin-1的存在,目前已证实Dectin-1存在于哺乳动物基因组中。
CR3属于β2-整合素家族,是另一种特征性β-葡聚糖受体。CR3为由α、β 2条肽链以非共价结合构成的异二聚体糖蛋白,在其异质二聚体蛋白的α链亚基(CD11b)内有2个结合域:一个与β-葡聚糖结合,另一个与iC3b结合。β-葡聚糖与CR3结合后激活iC3b通路,从而杀伤肿瘤细胞[10]。CR3能够调节白细胞渗出,作为微生物的受体和黏附分子促进微生物受补体成分iC3b的调理作用[11]。CR3表达在单核细胞/巨噬细胞、中性粒细胞、树突状细胞和一些T和B淋巴细胞上,具有广泛的配体,使其可能与其他低亲和力受体整合聚集[12]。β-葡聚糖在巨噬细胞中的积聚可独立于CR3发生,而与中性粒细胞的结合则依赖于CR3的表达[11]。
SRs是巨噬细胞等表面的一组异质性蛋白质分子,能与细菌细胞壁成分等多种配体结合,并将其从血液中移除。β-葡聚糖与清道夫受体的结合伴随着肿瘤坏死因子(tumor necrosis factor,TNF)产量的减少,可能增强对内毒素的清除作用[13]。成胶结构的巨噬细胞受体(macrophage receptor with collagenous structure,MARCO)是一种清道夫受体,存在于一些鱼类中,Benard等[14]对斑马鱼的敲除试验证明MARCO在对海鱼分枝杆菌(Mycobacterium marinum)的快速吞噬作用中起一定作用。而B类SRs家族成员CD36在斑马鱼和鲤中的作用尚未明确[15]。
LacCer是一种含疏水性神经酰胺脂质和亲水性糖成分的鞘糖脂,存在于白细胞和内皮细胞等的细胞膜中。作为β-葡聚糖受体,LacCer能促进巨噬细胞促炎症蛋白-2(macrophage inflammatory protein-2,MIP-2)的产生,哺乳动物转录因子-κB(nuclear factor-κB,NF-κB)家族的激活以及中性粒细胞氧化爆发的增加,从而增强抗菌活性[11]。
TLRs是先天性免疫应答相关的Ⅰ型跨膜蛋白,通过PRRs的形式参与对微生物特异性结构或危险相关分子模式[PAMPs、损伤相关分子模式(damage-associated molecular patterns DAMPs)]的感知。TLRs对分子模式的识别可能出现在各种细胞间隙中,包括质膜、内含体、溶酶体和内质溶酶体[15]。不同TLRs能相互组合或与其他受体协同作用,识别不同配体。Pietretti等[16]在鲤中对多种β-葡聚糖诱导活性氧、氮产生及相关细胞因子表达调节的研究证明,未经处理的酵母聚糖和分支的β-(1,3)/(1,6)-葡聚糖相比于失去TLRs刺激活性的酵母聚糖和凝胶多糖(选择性Dectin-1激动剂)有更强的巨噬细胞活化性能,尽管鱼类基因组中没有Dectin-1存在,而后两者也能刺激鲤巨噬细胞,说明β-葡聚糖在鲤巨噬细胞中可能受包括TLRs和噬菌作用受体等多个PRRs识别。
2.2 信号转导鱼类免疫器官主要包括肾脏、脾脏、胸腺、消化道淋巴组织以及黏膜相关淋巴组织(mucosa-associated lymphoid tissue,MALT)等。鱼类免疫学研究证明,与哺乳动物等高等脊椎动物一样,鱼类免疫包括先天性(非特异性)免疫和获得性(特异性)免疫。Alcorn等[17]对红鲑鱼(Oncorhynchus nerka)的研究表明,先天性免疫在多数温度下都能被激活,但获得性免疫如淋巴细胞分化和抗体应答等则趋向于依赖较高的温度。因此,鱼类更依赖于先天性免疫系统来抵御病害的侵入。先天性免疫主要通过单核细胞/巨噬细胞、嗜中性粒细胞、自然杀伤细胞等进行吞噬和杀伤病原,还可分泌多种免疫相关细胞因子,介导炎症反应。鱼类获得性免疫主要通过T、B淋巴细胞发挥作用。T淋巴细胞通过抗原递呈细胞识别抗原并通过细胞毒作用杀伤抗原,B淋巴细胞分泌以免疫球蛋白(immunoglobulin,Ig)M为主的抗体分子,结合补体途径中和病毒和细菌等病原的致病性,但与哺乳动物相比,鱼类抗体的免疫功能还处于较低水平[18]。
β-葡聚糖与受体的结合激活先天性免疫,而后树突状细胞递呈抗原,激活抗原特异性初始T淋巴细胞,启动获得性免疫,先天性免疫细胞参与获得性免疫应答的全过程,能协同效应T淋巴细胞和抗体发挥免疫效应,并能通过产生不同的细胞因子影响获得性免疫应答的类型[19]。对鱼类饲料添加剂免疫增强作用的研究主要集中在对非特异性免疫参数的评估上,即对先天性免疫系统的作用结果。
先天性免疫系统通过细胞和体液成分发挥功能,细胞水平的主要成分为白细胞,主要是单核细胞、巨噬细胞和粒细胞。中性粒细胞和巨噬细胞主要负责识别和吞噬病原体,细胞通讯和激活,启动获得性免疫应答及解决随后的炎症反应并产生组织修复过程中的生物活性分子。这个微生物杀伤机制利用一系列活动促进炎症反应,触发各种抗微生物过程,包括细胞激活、氧化自由基和细胞因子的产生[20]。β-葡聚糖对鱼类白细胞功能的调节是一个活跃的研究领域,可能有助于确定准确的相关受体和描述新的激活途径[21]。Sánchez-Martínez等[22]在饲料中添加0.05% β-(1,3)/(1,6)-葡聚糖饲喂斑点叉尾(Ictalurus punctatus)至第4周,其血细胞吞噬活性显著高于对照组,且脾脏和头肾中有更多活性细胞,表明β-葡聚糖可有效改善其先天性免疫系统。Guzmán-Villanueva等[23]对金头鲷(Sparus aurata)的研究显示,饲料中添加β-(1,3)/(1,6)-葡聚糖可有效提高其生长率和血清抗蛋白酶活性,在饲喂2或4周后还观察到吞噬活性增加。Do Huu等[24]在卵形鲳鲹(Trachinotus ovatus Linnaeus)饲料中添加不同水平的β-葡聚糖,观察到红细胞(0.20% β-葡聚糖)、总白细胞(0.05%~0.20% β-葡聚糖)及淋巴细胞和单核细胞数量(0.10%~0.40% β-葡聚糖)显著增加,表明其免疫效应增强。
除了细胞成分,体液成分也参与先天性免疫应答,主要包括溶菌酶、补体系统和细胞因子。溶菌酶具有杀菌作用,可水解细菌细胞壁肽聚糖的β-(1,4)-糖苷键,从而溶解细胞[25],存在于鱼类的血浆和黏膜中。补体由病原表面识别启动,促进有效促炎症介质产生,通过C3b等补体调理素对病原表面进行调理素作用,通过膜攻击复合物的装配定向溶解病原表面。补体系统的激活主要通过经典途径、凝集素途径和旁路途径[26]。β-葡聚糖对鱼类补体系统作用的研究主要集中在旁路途径。Ai等[27]在大黄鱼饲料中分别添加0.09%和0.18% β-葡聚糖提取物,饲喂8周后观察到较低剂量组头肾巨噬细胞中血清溶菌酶、吞噬及呼吸爆发活性有一定量增加,哈维氏弧菌(Vibrio harveyi)攻毒后的死亡率降低。另外,El-Boshy等[28]在尼罗罗非鱼饲料中添加0.1% β-葡聚糖,饲喂21 d后,不仅上述参数增加,还观察到血清杀菌活性、一氧化氮含量和淋巴细胞转化指数显著增加。Dawood等[29]将β-葡聚糖、维生素C以及两者混合添加到饲料中分别饲喂给3组真鲷(Pagrus major),结果表明,同时添加β-葡聚糖和维生素C组真鲷的体脂含量、血细胞比容、血清和黏膜溶菌酶与超氧化物歧化酶活性、补体旁路途径及黏膜分泌均显著增加;添加β-葡聚糖组真鲷具有更高的血清过氧化酶活性;在饲料中添加β-葡聚糖或同时添加β-葡聚糖和维生素C能有效提高真鲷体液和黏膜的免疫应答。Chettri等[30]用β-葡聚糖浸浴虹鳟(Oncorhynchus mykiss),观察到补体成分C3的含量显著上调,这与Pionnier等[31-32]对幼鲤的研究结果一致。
细胞因子是参与先天性免疫应答和获得性免疫应答的重要效应和调节分子。β-葡聚糖能影响特定细胞因子的基因表达和产量等,且大多数研究表明β-葡聚糖对炎症反应起诱导效应。Lokesh等[33]用鳗弧菌感染大西洋鳕(Gadus morhua)后发现,饲料中添加纯化β-葡聚糖能显著增加其前肠和直肠中促炎症细胞因子白细胞介素(interleukin,IL)-1β及直肠中抗炎症细胞因子IL-10的表达。Falco等[34]在鲤饲料中添加MacroGard ®[一种商业免疫增强剂,主要成分是β-(1,3)/(1,6)-葡聚糖]喂养14 d后,发现肠道和头肾中TNF-α2的表达量显著下调,肠道中IL-10的表达量上调,随后用杀鲑气单胞菌(Aeromonas salmonicida)进行攻毒试验,证明能刺激头肾中TNF-α1和TNF-α2的表达,而肠道中TNF-α1、TNF-α2、IL-1β和IL-6的表达量均显著下调,表明β-葡聚糖对各个器官的作用不同,在肠道中可能可以预防急性和潜在的危险反应,同时增强头肾在攻毒条件下的炎症反应;而Falco等[35]的试验结果显示,在饲喂添加MacroGard的饲料25 d后,鲤脾脏、头肾和中肠中几乎所有被分析的细胞因子基因(IL-1β、IL-10、TNF-α1、TNF-α2和CXCa)的表达均有下调趋势,但肝脏和中肠中抗黏液病毒基因的表达显著上调;Miest等[36]给大菱鲆饲喂添加MacroGard ®的饲料24 h后,也发现主要促炎症细胞因子(TNF-α、IL-1β)的转录水平降低,表明β-葡聚糖对其获得性免疫的调节可能与作用时间相关。Biswas等[37]给鲤饲喂添加酿酒酵母提取物(包含核苷酸和β-葡聚糖)的饲料10 d,测定其免疫参数,结果显示,饲喂1 d后,IL-1β、TNF-α、IL-12p35、IL-12p40和干扰素(interferon,IFN)-γ2在头肾中的表达量显著增加;饲喂1、5和7 d后,CXC趋化因子表达量增加而IL-10表达量减少;饲喂3 d后,肾细胞的吞噬活性和超氧阴离子产量显著增加;在鱼体内注射嗜水气单胞菌(Aeromonas hydrophila)6 h后观察到鲤对细菌的抵抗力增加。Sirimanapong等[38]研究表明,0.1%的真菌来源和商业酵母来源β-葡聚糖在感染爱德华氏菌(Edwardsiella ictaluri)24 h后对巴丁鱼(Pangasianodon hypophthalmus)肝脏、肾脏和脾脏中免疫基因的表达有刺激作用,且前者在感染后24 h时使免疫基因表达表现出一种显著不同的模式。Guzmán-Villanueva等[23]对金头鲷的研究发现,在饲喂添加β-(1,3)/(1,6)-葡聚糖饲料4周后,IL-1β和INF-γ表达显著上调,已知INF-γ可诱导初始T淋巴细胞向辅助性T(Th)1或Th2细胞分化,参与体液和细胞免疫;而饲喂1周后抗菌抗体IgM基因的表达趋于下调,但血清IgM含量升高,表明IgM释放量增加而产量没有增加。
另外,在β-葡聚糖对鱼类后代免疫增强作用的研究中发现,转移的溶菌酶、C3和B因子直接与早期斑马鱼胚胎的抗菌防御相关。Jiang等[39]对斑马鱼卵的研究证明β-葡聚糖能显著增加补体成分C3和B因子的含量,经β-(1,3)-葡聚糖处理的胚胎对细菌有更强的抵抗力。溶菌酶是一种母体免疫因子,在斑马鱼胚胎发育阶段起重要作用。Wang等[40]研究表明β-葡聚糖能通过诱导母体到卵的分子转移并刺激卵母细胞的内源生成来增加斑马鱼后代体内的溶菌酶活性。这些证据证明了β-葡聚糖能够增强鱼类后代的先天性免疫应答,可为β-葡聚糖对鱼类胚胎免疫状态和疾病抵抗方面作用的研究提供参考。
2.3 对黏膜免疫及肠道菌群的影响鱼类抵抗病原体的机制主要集中在入口处,即与外界环境相接触的表面:鳃、鼻、胃肠道和皮肤。硬骨鱼类的黏膜免疫器官主要是MALT,它是一种次级淋巴器官,分为肠道相关淋巴组织(GALT)、皮肤相关淋巴组织(SALT)和鳃相关淋巴组织(GIALT)[41]。巨噬细胞、淋巴细胞、粒细胞和浆细胞等广泛分布于鱼类上皮组织中。鱼类黏膜表面还覆盖着一层黏液,其中含有丰富的免疫相关因子,如凝集素、黏蛋白、抗菌肽、毒素和IgM、IgT/IgZ等[41-42]。黏膜表面的非自身刺激首先被识别,导致局部变化并产生信使物质(激素、细胞因子和肽),激活整体的生理反应[43],提高系统水平上的免疫应答。总的来说,黏膜表面有先天性免疫功能的细胞和因子与共生菌群共同发挥抵御病原的关键作用[41]。通过饲料途径使用免疫增强剂可以增强免疫系统以抵御病原,包括对肠上皮防御机制、肠上皮完整性及肠道菌群等的作用。
β-葡聚糖对鱼类黏膜免疫作用的研究较少。在人类和小鼠中,β-葡聚糖识别Dectin-1受体后优先诱导IL-17产生Th17,对于黏膜处胞外细菌和真菌的消灭有重要意义。其中Th17应答的概念对水产养殖中添加β-葡聚糖以增强对细菌和真菌的黏膜防御功能也有重要的作用[44]。Schmitt等[45]对虹鳟肠道免疫机制的研究证明,β-葡聚糖能增加近端小肠上皮屏障中黏膜分泌细胞的数量,黏液分泌的增加有助于阻止细菌黏附;且宿主防御肽(host defense peptides,HDPs)在上皮层内表达丰富,说明HDPs与黏膜免疫应答密切相关。评估结果显示,酵母聚糖能在转录和蛋白质水平上增加虹鳟肠上皮细胞系RTgutGC中HDPs、抗菌肽和IL-1β的产量。Dawood等[29]的试验表明,与添加维生素C相比,在饲料中添加β-葡聚糖后真鲷的黏膜杀菌活性更高,这可能与黏膜中溶菌酶活性的增强有关。Kiron等[46]对大西洋鲑口服β-(1,3)/(1,6)-葡聚糖的作用机制进行了研究,认为口服β-(1,3)/(1,6)-葡聚糖组肠道中胶转蛋白(transgelin,TAGLN)和β-肌动蛋白(β-actin,ACTB)的超表达以及丰富的杯状细胞可能证明大西洋鲑对β-葡聚糖的吸收;IgT表达的上调,载脂蛋白A4(apolipoprotein A4,Apoa4)、核糖体蛋白L9(ribosomal protein L9,RPL9)和Ckt的超表达以及丰富的免疫细胞可能表明葡聚糖分子能影响免疫应答和新陈代谢,为肠道水平上β-葡聚糖的作用机制提供了线索。
不易消化的β-葡聚糖可能诱导肠道菌群组成的转变,从而间接影响免疫系统。另外,肠道菌群还可能利用其自身的生理效应产生糖酵解酶,将β-葡聚糖等不易消化的多糖水解成单糖或二糖,使之能被运送到细胞中进一步代谢成为短链脂肪酸,从而酸化肠道环境[47]。Kühlwein等[48]研究发现,在鲤饲料中添加β-葡聚糖能调节其肠道中的微生物群落,经2周饲喂后观察到肠道原地及外来微生物群的多样性、物种丰度和操作分类单元(OTUs)数目减少,经4周饲喂后观察到原地微生物群的各项参数持续减少而外来微生物群无变化。但在Jung-Schroers等[49]的试验中,在鲤饲料中添加β-葡聚糖,经2周饲喂后,鲤的肠道菌群多样性显著增加。产生不同的试验结果可能是由于样本、鱼体大小和分析方法不同造成的。Carda-Diéguez等[50]在欧洲鲈(Dicentrarchus labrax)饲料中添加β-葡聚糖饲喂4~8周后,对其肠道菌群进行焦磷酸测序,结果显示,其肠道菌群组成在科分类水平上有一个短暂的转变:经4周的饲喂,微生物群落内的优势种完全改变,再饲喂4周后,又恢复到原来的组成。上述结果表明β-葡聚糖对肠道菌群有一定影响,但可能是暂时的,仍需进一步研究。此外,长期饲喂β-葡聚糖对鲤肠道中TLR3表达的影响也可能是对肠道菌群组成作用的一个间接效应[21]。在小鼠肠道中有一种特定的共生菌群可以诱导TLR3的表达,促进IFN-β的产生[51]。另外,Miest等[36]在大菱鲆饲料中添加β-葡聚糖后,炎症应答和压力应答显著减少,表明β-葡聚糖使鱼体拥有一个更健康的肠道菌群。Do Huu等[24]在卵形鲳鲹饲料中分别添加0.05%、0.10%和0.20% β-葡聚糖,观察到其肠道中弧菌数目均显著减少。Kühlwein等[48]对鲤的研究证明饲料中添加β-葡聚糖还能显著增加肠道微绒毛的长度和密度。
3 影响β-葡聚糖免疫调节作用的因素β-葡聚糖结构的多样性使其具有各种不同的生物活性,发挥不同的免疫调节作用。β-(1,3)-葡聚糖相比于β-(1,4)-葡聚糖和β-(1,6)-葡聚糖具有更强的免疫刺激活性。对β-葡聚糖生物活性的研究主要集中在溶解性上,由于β-葡聚糖需从饲料中溶出以穿过肠道作用于血细胞,可溶性β-葡聚糖比不溶性β-葡聚糖的免疫调节作用更强。通过羧甲基化或磺化作用等修饰不溶性β-葡聚糖或超声波解聚和机械活化等物理方法能提高β-葡聚糖的溶解度,从而增强其活性。石纪奎等[52]对酿酒酵母β-葡聚糖进行了机械改性,使其溶解率从11%提高至37%,由此制备的β-葡聚糖具有更高的免疫活性。β-葡聚糖的生物活性也与纯度及一级结构、分子质量、分支程度、电荷和三级结构等理化参数相关,由来源、提取方法和提取后修饰等决定[11]。
迄今,多糖的合成仍很困难,几乎所有的多糖都来源于自然,因此提取方法就显得至关重要。Pengkumsri等[53]比较了几种常用的酿酒酵母β-葡聚糖提取方法(采用酸、碱、次氯酸钠等提取)后得出,用1.0 mol/L氢氧化钠(NaOH)80 ℃处理酵母2 h后离心,再用蒸馏水充分混合后离心,然后溶解在1.0 mol/L醋酸(CH3COOH)中(80 ℃,2 h),最后烘干得到的β-葡聚糖产量和质量最高。但由于大量β-葡聚糖降解并扩散至上清液中,上述方法提取得到的产量仍较低,且通常会导致β-葡聚糖结构被破坏(部分水解、氧化、还原、降解和去分支等),这不仅会导致β-葡聚糖化学结构的不确定性,还会影响它们的生物功能[6]。Liu等[54]将诱导自溶、热水、均质化、有机溶剂及蛋白酶相结合,使β-葡聚糖链不被降解且酵母细胞完全分散,从而提取得到酵母细胞壁最初比例为91%(质量分数)的高产量和93%(质量分数)高纯度的β-葡聚糖。如何大量分离出高纯度的具有生物活性的多糖对于后续的研究十分重要,仍需进一步探索。
4 小结和展望酵母β-葡聚糖能作为鱼类的免疫增强剂,口服后在肠道中被吞噬细胞吞噬经淋巴系统进入血液,与免疫细胞上不同模式识别受体结合后激活细胞,促进细胞因子的分泌,同时增强体液中溶菌酶活性和补体系统的作用,还能诱导肠道菌群组成的转变,进一步增强机体的先天性及获得性免疫应答。
但对β-葡聚糖的研究由于不同试验间施用剂量的多少和持续时间的长短等没有统一的规定,无法总结出相对统一的结论,目前仍缺少对β-葡聚糖受体识别、下游信号转导和免疫刺激机制的具体解释。另外,β-葡聚糖对鱼类不同生长阶段的作用效应,以及母体口服β-葡聚糖后对后代胚胎免疫状态及抗病能力的影响等方面的研究主要停留在斑马鱼等模式种类上,还需在更多种类中进行试验。值得关注的是,β-葡聚糖与肠道菌群的相互作用可能有助于机体形成一个对抗外来病原的有效策略,包括对模式识别受体和炎症性细胞因子表达等的调节。而各种β-葡聚糖不同的结构特点可能是决定其生物活性的关键,因此,理解其确定的结构与功能关系,研究出能够大量提取高纯度的β-葡聚糖并将其修饰成特定的结构以获取所需功能的方法,对于后续β-葡聚糖在水产养殖中的应用有极为重要的意义。
致谢: 感谢山东大学(威海)海洋学院白楠老师对文稿所提的宝贵意见。| [1] |
YUN C H, ESTRADA A, VAN KESSEL A, et al. β-glucan, extracted from oat, enhances disease resistance against bacterial and parasitic infections[J]. FEMS Immunology & Medical Microbiology, 2003, 35(1): 67-75. |
| [2] |
AGUILAR-USCANGA B, FRANÇOIS J M. A study of the yeast cell wall composition and structure in response to growth conditions and mode of cultivation[J]. Letters in Applied Microbiology, 2003, 37(3): 268-274. DOI:10.1046/j.1472-765X.2003.01394.x |
| [3] |
SAMUELSEN A B C, SCHREZENMEIR J, KNUTSEN S H. Effects of orally administered yeast-derived beta-glucans:a review[J]. Molecular Nutrition & Food Research, 2014, 58(1): 183-193. |
| [4] |
LESAGE G, BUSSEY H. Cell wall assembly in Saccharomyces cerevisiae[J]. Microbiology and Molecular Biology Reviews, 2006, 70(2): 317-343. |
| [5] |
WILLIAMS D L, MCNAMEE R B, JONES E L, et al. A method for the solubilization of a(1→3)-β-D-glucan isolated from Saccharomyces cerevisiae[J]. Carbohydrate Research, 1991, 219: 203-213. DOI:10.1016/0008-6215(91)89052-H |
| [6] |
LIU Q Y, DUAN B C, XU X J, et al. Progress in rigid polysaccharide-based nanocomposites with therapeutic functions[J]. Journal of Materials Chemistry B, 2017, 5(29): 5690-5713. DOI:10.1039/C7TB01065F |
| [7] |
LØKKA G, FALK K, AUSTBØ L, et al. Uptake of yeast cells in the Atlantic salmon(Salmo salar L.) intestine[J]. Developmental & Comparative Immunology, 2014, 47(1): 77-80. |
| [8] |
VALLEJOS-VIDAL E, REYES-LÓPEZ F, TELES M, et al. The response of fish to immunostimulant diets[J]. Fish & Shellfish Immunology, 2016, 56: 34-69. |
| [9] |
DENNEHY K M, BROWN G D. The role of the β-glucan receptor Dectin-1 in control of fungal infection[J]. Journal of Leukocyte Biology, 2007, 82(2): 253-258. DOI:10.1189/jlb.1206753 |
| [10] |
XIA Y, ROSS G D. Generation of recombinant fragments of CD11b expressing the functional β-glucan-binding lectin site of CR3(CD11b/CD18)[J]. The Journal of Immunology, 1999, 162(12): 7285-7293. |
| [11] |
THOMPSON I J, OYSTON P C, WILLIAMSON D E. Potential of the β-glucans to enhance innate resistance to biological agents[J]. Expert Review of Anti-infective Therapy, 2010, 8(3): 339-352. DOI:10.1586/eri.10.10 |
| [12] |
GOODRIDGE H S, WOLF A J, UNDERHILL D M. β-glucan recognition by the innate immune system[J]. Immunological Reviews, 2009, 230(1): 38-50. |
| [13] |
VERESCHAGIN E I, VAN LAMBALGEN A A, DUSHKIN M I, et al. Soluble glucan protects against endotoxin shock in the rat:the role of the scavenger receptor[J]. Shock, 1998, 9(3): 193-198. DOI:10.1097/00024382-199803000-00006 |
| [14] |
BENARD E L, ROOBOL S J, SPAINK H P, et al. Phagocytosis of mycobacteria by zebrafish macrophages is dependent on the scavenger receptor Marco, a key control factor of pro-inflammatory signalling[J]. Developmental & Comparative Immunology, 2014, 47(2): 223-233. |
| [15] |
FINK I R, BENARD E L, HERMSEN T, et al. Molecular and functional characterization of the scavenger receptor CD36 in zebrafish and common carp[J]. Molecular Immunology, 2015, 63(2): 381-393. DOI:10.1016/j.molimm.2014.09.010 |
| [16] |
PIETRETTI D, VERA-JIMENEZ N I, HOOLE D, et al. Oxidative burst and nitric oxide responses in carp macrophages induced by zymosan, MacroGard and selective Dectin-1 agonists suggest recognition by multiple pattern recognition receptors[J]. Fish & Shellfish Immunology, 2013, 35(3): 847-857. |
| [17] |
ALCORN S W, MURRAY A L, PASCHO R J. Effects of rearing temperature on immune functions in sockeye salmon(Oncorhynchus nerka)[J]. Fish & Shellfish Immunology, 2002, 12(4): 303-334. |
| [18] |
DÍAZ-ROSALES P, MUÑOZ-ATIENZA E, TAFALLA C. Role of teleost B cells in viral immunity[J]. Fish & Shellfish Immunology, 2019, 86: 135-142. |
| [19] |
曹雪涛. 医学免疫学[M]. 6版.北京: 人民卫生出版社, 2013: 119-128.
|
| [20] |
SILVA M T, CORREIA-NEVES M. Neutrophils and macrophages:the main partners of phagocyte cell systems[J]. Frontiers in Immunology, 2012, 3: 174. |
| [21] |
PETIT J, WIEGERTJES G F. Long-lived effects of administering β-glucans:indications for trained immunity in fish[J]. Developmental & Comparative Immunology, 2016, 64: 93-102. |
| [22] |
SÁNCHEZ-MARTÍNEZ J G, RÁBAGO-CASTRO J L, DE LA LUZ VÁZQUEZ-SAUCEDA M, et al. Effect of β-glucan dietary levels on immune response and hematology of channel catfish Ictalurus punctatus juveniles[J]. Latin American Journal of Aquatic Research, 2017, 45(4): 690-698. DOI:10.3856/vol45-issue4-fulltext-5 |
| [23] |
GUZMÁN-VILLANUEVA L T, TOVAR-RAMÍREZ D, GISBERT E, et al. Dietary administration of β-1, 3/1, 6-glucan and probiotic strain Shewanella putrefaciens, single or combined, on gilthead seabream growth, immune responses and gene expression[J]. Fish & Shellfish Immunology, 2014, 39(1): 34-41. |
| [24] |
DO HUU H, SANG H M, THANH THUY N T. Dietary β-glucan improved growth performance, Vibrio counts, haematological parameters and stress resistance of pompano fish, Trachinotus ovatus Linnaeus, 1758[J]. Fish & Shellfish Immunology, 2016, 54: 402-410. |
| [25] |
MAGNADÓTTIR B. Innate immunity of fish(overview)[J]. Fish & Shellfish Immunology, 2006, 20(2): 137-151. |
| [26] |
DUNKELBERGER J R, SONG W C. Complement and its role in innate and adaptive immune responses[J]. Cell Research, 2010, 20(1): 34-50. |
| [27] |
AI Q H, MAI K S, ZHANG L, et al. Effects of dietary β-1, 3 glucan on innate immune response of large yellow croaker, Pseudosciaena crocea[J]. Fish & Shellfish Immunology, 2007, 22(4): 394-402. |
| [28] |
EL-BOSHY M E, EL-ASHRAM A M, ABDELHAMID F M, et al. Immunomodulatory effect of dietary Saccharomyces cerevisiae, β-glucan and laminaran in mercuric chloride treated Nile tilapia(Oreochromis niloticus) and experimentally infected with Aeromonas hydrophila[J]. Fish & Shellfish Immunology, 2010, 28(5/6): 802-808. |
| [29] |
DAWOOD M A O, KOSHIO S, EL-SABAGH M, et al. Changes in the growth, humoral and mucosal immune responses following β-glucan and vitamin C administration in red sea bream, Pagrus major[J]. Aquaculture, 2017, 470: 214-222. DOI:10.1016/j.aquaculture.2016.12.036 |
| [30] |
CHETTRI J K, KANIA P W, BUCHMANN K. Immunomodulation of rainbow trout(Oncorhynchus mykiss) fry by bath exposure to a β-glucan from Euglena gracilis[J]. Aquaculture Research, 2013, 44(9): 1407-1415. DOI:10.1111/are.2013.44.issue-9 |
| [31] |
PIONNIER N, FALCO A, MIEST J, et al. Dietary β-glucan stimulate complement and C-reactive protein acute phase responses in common carp(Cyprinus carpio) during an Aeromonas salmonicida infection[J]. Fish & Shellfish Immunology, 2013, 34(3): 819-831. |
| [32] |
PIONNIER N, FALCO A, MIEST J J, et al. Feeding common carp Cyprinus carpio with β-glucan supplemented diet stimulates C-reactive protein and complement immune acute phase responses following PAMPs injection[J]. Fish & Shellfish Immunology, 2014, 39(2): 285-295. |
| [33] |
LOKESH J, FERNANDES J M O, KORSNES K, et al. Transcriptional regulation of cytokines in the intestine of Atlantic cod fed yeast derived mannan oligosaccharide or β-glucan and challenged with Vibrio anguillarum[J]. Fish & Shellfish Immunology, 2012, 33(3): 626-631. |
| [34] |
FALCO A, FROST P, MIEST J, et al. Reduced inflammatory response to Aeromonas salmonicida infection in common carp(Cyprinus carpio L.) fed with β-glucan supplements[J]. Fish & Shellfish Immunology, 2012, 32(6): 1051-1057. |
| [35] |
FALCO A, MIEST J J, PIONNIER N, et al. β-glucan-supplemented diets increase poly(I:C)-induced gene expression of Mx, possibly via TLR3-mediated recognition mechanism in common carp(Cyprinus carpio)[J]. Fish & Shellfish Immunology, 2014, 36(2): 494-502. |
| [36] |
MIEST J J, ARNDT C, ADAMEK M, et al. Dietary β-glucan(MacroGard) enhances survival of first feeding turbot(Scophthalmus maximus) larvae by altering immunity, metabolism and microbiota[J]. Fish & Shellfish Immunology, 2016, 48: 94-104. |
| [37] |
BISWAS G, KORENAGA H, TAKAYAMA H, et al. Cytokine responses in the common carp, Cyprinus carpio L. treated with baker's yeast extract[J]. Aquaculture, 2012, 356-357: 169-175. DOI:10.1016/j.aquaculture.2012.05.019 |
| [38] |
SIRIMANAPONG W, THOMPSON K D, OOI E L, et al. The effects of feeding β-glucan to Pangasianodon hypophthalmus on immune gene expression and resistance to Edwardsiella ictaluri[J]. Fish & Shellfish Immunology, 2015, 47(1): 595-605. |
| [39] |
JIANG C Y, WANG P, LI M Y, et al. Dietary β-glucan enhances the contents of complement component 3 and factor B in eggs of zebrafish[J]. Developmental & Comparative Immunology, 2016, 65: 107-113. |
| [40] |
WANG P, JIANG C Y, LIU S S, et al. Trans-generational enhancement of C-type lysozyme level in eggs of zebrafish by dietary β-glucan[J]. Developmental & Comparative Immunology, 2017, 74: 25-31. |
| [41] |
LAZADO C C, CAIPANG C M A. Mucosal immunity and probiotics in fish[J]. Fish & Shellfish Immunology, 2014, 39(1): 78-89. |
| [42] |
ROMBOUT J H W M, YANG G W, KIRON V. Adaptive immune responses at mucosal surfaces of teleost fish[J]. Fish & Shellfish Immunology, 2014, 40(2): 634-643. |
| [43] |
PARRA D, REYES-LOPEZ F E, TORT L. Mucosal immunity and B cells in teleosts:effect of vaccination and stress[J]. Frontiers in Immunology, 2015, 6: 354. |
| [44] |
DALMO R A, BØGWALD J. β-glucans as conductors of immune symphonies[J]. Fish & Shellfish Immunology, 2008, 25(4): 384-396. |
| [45] |
SCHMITT P, WACYK J, MORALES-LANGE B, et al. Immunomodulatory effect of cathelicidins in response to a β-glucan in intestinal epithelial cells from rainbow trout[J]. Developmental & Comparative Immunology, 2015, 51(1): 160-169. |
| [46] |
KIRON V, KULKARNI A, DAHLE D, et al. Recognition of purified beta 1, 3/1, 6 glucan and molecular signalling in the intestine of Atlantic salmon[J]. Developmental & Comparative Immunology, 2016, 56: 57-66. |
| [47] |
SWENNEN K, COURTIN C M, DELCOUR J A. Non-digestible oligosaccharides with prebiotic properties[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(6): 459-471. DOI:10.1080/10408390500215746 |
| [48] |
KVHLWEIN H, EMERY M J, RAWLING M D, et al. Effects of a dietary β-(1, 3)(1, 6)-D-glucan supplementation on intestinal microbial communities and intestinal ultrastructure of mirror carp(Cyprinus carpio L.)[J]. Journal of Applied Microbiology, 2013, 115(5): 1091-1106. DOI:10.1111/jam.2013.115.issue-5 |
| [49] |
JUNG-SCHROERS V, ADAMEK M, JUNG A, et al. Feeding of β-1, 3/1, 6-glucan increases the diversity of the intestinal microflora of carp(Cyprinus carpio)[J]. Aquaculture Nutrition, 2016, 22(5): 1026-1039. DOI:10.1111/anu.2016.22.issue-5 |
| [50] |
CARDA-DIÉGUEZ M, MIRA A, FOUZ B. Pyrosequencing survey of intestinal microbiota diversity in cultured sea bass(Dicentrarchus labrax) fed functional diets[J]. FEMS Microbiology Ecology, 2014, 87(2): 451-459. DOI:10.1111/1574-6941.12236 |
| [51] |
KAWASHIMA T, KOSAKA A, YAN H M, et al. Double-stranded RNA of intestinal commensal but not pathogenic bacteria triggers production of protective interferon-β[J]. Immunity, 2013, 38(6): 1187-1197. DOI:10.1016/j.immuni.2013.02.024 |
| [52] |
石纪奎, 李永富, 史锋. 机械活化酿酒酵母葡聚糖改善其水溶性[J]. 食品与生物技术学报, 2015, 34(5): 536-541. DOI:10.3969/j.issn.1673-1689.2015.05.015 |
| [53] |
PENGKUMSRI N, SIVAMARUTHI B S, SIRILUN S, et al. Extraction of β-glucan from Saccharomyces cerevisiae:comparison of different extraction methods and in vivo assessment of immunomodulatory effect in mice[J]. Food Science and Technology, 2017, 37(1): 124-130. |
| [54] |
LIU X Y, WANG Q, CUI S W, et al. A new isolation method of β-D-glucans from spent yeast Saccharomyces cerevisiae[J]. Food Hydrocolloids, 2008, 22(2): 239-247. DOI:10.1016/j.foodhyd.2006.11.008 |




