猪肉品质的评价一般包括感官评定指标和肉营养成分指标。影响猪肉品质的因素中,目前研究热点以肌内脂肪、肌纤维等性状为主[1]。影响猪肉品质因素中最关键的因素是脂肪沉积[2]。动物脂肪沉积是脂肪合成和分解代谢的一种平衡状态,脂肪沉积的增加或减少会影响猪肉品质。目前,肌内脂肪含量与猪肉的嫩度、多汁性和猪肉香味呈正相关[3-5],因此,肌内脂肪含量是评定肌肉多汁性等肉质性状的重要因素。由于动物机体的脂肪沉积以及代谢的调控主要是受到酶和激素的共同作用,通过调控脂肪沉积和脂肪代谢相关基因从而调控脂肪沉积的减少或增加,达到改善肉质的需求。目前,已经鉴定的脂肪沉积和脂肪代谢相关基因包括脂肪细胞决定和分化因子1(ADD1)、脂肪量和肥胖相关基因(FTO)、过氧化物酶体增殖物激活受体γ(PPARγ)、水通道蛋白3(AQP3)、瘦素(leptin)、脂联素(adiponectin)、脂肪酸合成相关酶、脂肪酸分解相关酶、半乳糖凝集素3(galectin-3)等,本文主要综述以上几种基因的研究现状,为调控猪脂肪沉积、改善猪肉品质提供合理的科学依据。
1 ADD1基因ADD1是参与脂肪细胞分化的转录因子,属于固醇调节原件结合蛋白家族,固醇调节原件结合蛋白家族主要调节血浆中胆固醇含量。ADD1主要是通过参与调节脂肪酸合成酶、低密度脂蛋白、葡萄糖激酶等脂肪酸合成和葡萄糖代谢相关基因的表达,进而调控动物体内脂肪的合成。前人研究发现,ADD1主要在脂肪组织和肝脏中表达[6-7],且ADD1 mRNA表达与猪的脂肪细胞分化相关[8-9]。同时,ADD1调节肌细胞中的葡萄糖代谢和脂质代谢[10-11]。在人类研究中,ADD1基因多态性与肥胖及二型糖尿病有关[12]。李江凌等[13]研究发现,藏猪通过限制性片段长度多态性聚合酶链反应(PCR-RELP)检测出的3种基因型的肌内脂肪含量和嫩度存在差异,推测ADD1基因可以作为肌内脂肪选育的分子标记。Dong等[14]研究表明,抑制CCAT元件增强结合蛋白(C/EBPs)的活性可以减弱早期ADD1的产生,抑制脂肪细胞在体内的分化,因此C/EBPs对ADD1诱导的脂肪细胞分化具有调控作用。有研究指出CCAT/元件增强结合蛋白α(C/EBPα)与ADD1启动子区域结合能够促进C/EBPα的表达[15]。C/EBPα在磷脂合成和代谢中发挥重要作用,它通过调控脂肪生成基因的表达,从而参与脂肪的合成和分解。盘道兴[16]研究表明,通过开展从江香猪、江口萝卜猪和大白猪的ADD1基因多态性分析,发现exon8-G87A位点存在同义突变,同时发现该基因在2种地方猪种的皮下脂肪中表达量显著高于瘦肉型大白猪,且ADD1基因的表达量与这3种猪的肉质性能呈正相关。
2 FTO基因FTO基因首次是在小鼠研究中发现,后续进行的很多研究发现FTO基因与肥胖症相关,其单核苷酸多态性变异作用于肥胖基因,影响体内脂质的合成和代谢。有研究报道,FTO基因通过调节脂肪细胞的成脂功能调控机体肥胖[17],它通过调控Iroquois基因家族的IRX3和IRX5基因促进白色脂肪细胞内解偶联蛋白1(UCP1)基因的表达,致使白色脂肪细胞变成棕色脂肪细胞,调控机体的能量代谢[18]。此外,有研究发现,FTO基因极显著提高磷酸化组蛋白H3表达,而siRNA干扰FTO基因的表达,促进甘油三酯积累,形成脂肪沉积[19-20]。Chen等[21]研究猪FTO基因的亚细胞定位和组织分布,结果表明猪FTO基因在皮下脂肪组织中高表达,且在猪肌内前体脂肪细胞中过表达,进而促进脂肪细胞的增殖和脂质沉积,同时增加了PPARγ和C/EBPα mRNA的表达水平。综上所述,FTO基因可通过影响脂肪细胞的成脂功能或调控脂质合成和分解基因的方式,调控脂肪沉积, 从而改善肉品质。
3 PPARγ基因在1990年,Issemann和Green研究发现,过氧化物酶体增殖物激活小鼠肝脏中类固醇激素受体超家族成员,这个受体被命名为过氧化物酶体增殖剂激活受体(PPAR)[20-22],包括PPARα、PPARβ、PPARγ 3种形式[22-23]。PPARγ基因是脂质平衡中关键调节因子,PPARγ有PPARγ1和PPARγ2 2种亚型,其中PPARγ2主要在脂肪组织中表达。一项研究报道,miRNA-130b通过抑制PPARγ基因表达从而抑制脂肪沉积,并显示出显著下调PPARγ基因表达的能力,说明PPARγ基因是脂肪生成的重要调节因子,可控制脂肪细胞分化、增殖和脂质的聚集[24]。盘道兴[16]探究江口萝卜猪、从江香猪和大白猪3种品种猪PPARγ基因与肌内脂肪含量的相关性,结果表明同一品种猪PPARγ基因表达量与肌内脂肪含量呈正相关。Ma等[25]利用转基因鼠,验证猪钙调神经磷酸结合蛋白1(Myoz1)启动子上调猪肌肉组织中PPARγ2基因的表达,结果表明,Myoz1启动子通过调控PPARγ2基因的表达改善猪肉品质。
4 AQP3基因水通道蛋白家族(AQPs)是一类在渗透压作用下将甘油等小分子物质跨膜双向转运的整合膜蛋白。Rodríguez等[26]在脂肪细胞亚细胞水平将AQP3同时定位于细胞质和细胞的质膜上,发现AQP3将甘油从细胞质内运输到膜外的作用,参加了脂肪分解的过程。Tardelli等[27]研究发现在肝星状细胞中脂联素介导的PPARα通路增加了AQP3基因的表达;而Chen等[28]研究表明,胃癌细胞AQP3的缺失导致胃癌细胞凋亡增加,是由于AQP3的缺失减少甘油的摄取和脂肪生成从而抑制细胞自噬。有学者研究关中黑猪AQP3基因组织表达谱,分析发现该基因在皮下脂肪组织中表达量最高,同时在细胞水平上验证AQP3基因,结果显示干扰AQP3基因后肌内脂肪的增殖受到了抑制,EDU染色和CCK-8检测也得到相同的结果,该结果说明AQP3基因可能促进猪肌内脂肪细胞的增殖和分化[29]。
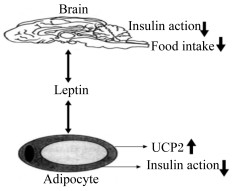
5 瘦素基因瘦素是ob基因的编码产物,该基因主要是由白色脂肪细胞分泌的蛋白质类激素,作用是通过下丘脑反馈调节从而抑制脂肪的形成[30]。瘦素一方面是通过增加脂肪细胞的解偶联蛋白2(UCP2)的表达从而减弱胰岛素作用;另一方面是作用于下丘脑调控多种神经递质、神经肽和下丘脑激素的分泌和表达来控制食物摄取、产热和胰岛素作用(图 1)[31]。李永能等[32]研究瘦素对猪脂肪细胞FTO基因mRNA表达的影响,结果表明,150 ng/mL瘦素处理猪脂肪细胞导致细胞内甘油三酯含量降低,并且对FTO基因的表达调控也呈现出相似规律。黄艳娜等[33]研究陆川猪瘦素基因克隆与生物信息学分析发现,陆川猪与其他猪种相比,存在第73位点的T→C突变,由于目前研究发现瘦素基因对脂肪代谢有影响,推测该基因可作为陆川猪脂肪沉积研究的候选基因之一。最近有研究表明,参与啮齿动物动物脂肪代谢功能的食欲素基因通过调控脂肪细胞中瘦素的分泌,从而调节脂肪细胞的生成和葡萄糖的摄取[34]。
|
Brain:大脑;Insulin action:胰岛素作用:Food intake:食物摄取;Leptin:瘦素;UCP2:解偶联蛋白2 uncoupling protein 2;Adipocyte:脂肪细胞。 图 1 瘦素调节作用示意图 Fig. 1 Diagram of leptin regulation function[31] |
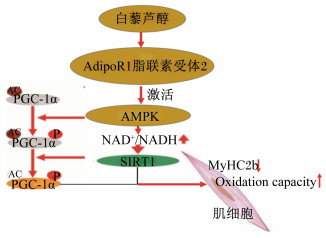
脂联素是由脂肪组织特异性分泌的激素蛋白,最重要的功能是调节糖脂代谢。脂联素通过激活腺苷酸活化蛋白激酶(AMPK)促进骨骼肌脂肪酸氧化,降低脂质在骨骼肌中堆积,减少游离脂肪酸(FFA)进入肝脏,改善肝脏的胰岛素抵抗,降低肝糖的生成和极低密度脂蛋白(VLDL)的合成。在重组猪脂联素对猪屠宰性能的影响的研究中发现,注射重组猪脂联素能显著提高猪肝脏、背脂、背肌等组织中脂联素基因的表达水平,并改善屠宰率、背膘厚和眼肌面积[35]。有关于白藜芦醇对于骨骼肌肌纤维的研究发现,白藜芦醇通过上调脂联素受体1(AdipoR1)表达激活了AMPK信号通路上游和下游的基因的表达,增加了肌细胞氧化能力,同时下调肌球蛋白重链2b(MyHC2b)基因的表达,导致肌纤维类型向氧化型转化,从而改善肉质(图 2)[36]。在肥胖型猪和瘦肉型猪中,血清中脂联素的含量与肌内脂肪含量呈极显著正相关[37]。研究发现,睾丸提取物通过过氧化物酶体增殖物激活受体信号通路增强3T3-L1脂肪细胞中的脂联素表达和分泌,主要是通过促进脂肪细胞分化和通过与大豆苷元不同的机制增强脂联素分泌来改善脂质代谢功能障碍[38]。
|
AdipoR1:脂联素受体1 adiponectin receptor 1;AMPK:腺苷酸活化蛋白激酶AMP-activated protein kinase;NAD+/NADH:烟酰胺腺嘌呤二核苷酸nicotinamide adenine dinucleotide;SIRT1:沉默信息调节因子1 silent information regulator 1;PGC-1α:过氧化物酶体增生激活受体γ协同刺激因子1α peroxisomal hyperplasia activates the receptor γ costimulatory 1α;MyHC2b:肌球蛋白重链2b myosin heavy chain 2b;Oxidation capacity:氧化能力;AC:乙酰化acetylation;P:磷酸化phosphorylation。 图 2 脂联素受体1调控机理示意图 Fig. 2 Diagram of AdipoR1 regulation mechanism[36] |
脂肪酸合成酶(FAS)和乙酰辅酶A羧化酶(ACC)是长链脂肪酸合成的限速酶,其中FAS是催化乙酰辅酶A和丙二酰辅酶A从头合成长链脂肪酸的关键限速酶,脂肪酸是参与膜生物发生过程中脂质的必需成分,并且是能量代谢中的关键底物,因此,脂肪酸在控制动物脂肪沉积过程中起到重要作用。在肥胖猪饲粮中长期添加甜菜碱,结果表明肌内脂肪含量增加,其中脂肪酸合成的相关基因表达上调,补充甜菜碱具有调节肌内脂肪和胆固醇积累的潜在机制,说明甜菜碱参与脂质合成[39]。脂肪酸合成酶的多态性位点和肌内脂肪的含量分布存在正相关关系。通过对9月龄猪皮下脂肪和肌肉组织之间与脂肪代谢候选基因的核苷酸多态性分析,初步结果表明,FAS基因与肌肉和脂肪中的脂肪酸含量存在关联[40]。在研究猪卵母细胞脂质沉积的过程中,通过加权基因共表达网络分析筛选到8个枢纽基因,其中之一就是FAS基因,推测猪卵母细胞与脂肪组织在脂肪沉积方面有很多的共表达基因[41]。有研究者在胎儿宫内发育迟缓猪的饲粮中添加高水平胆碱,结果表明胆碱通过降低还原型辅酶Ⅱ的活性和改变脂质代谢相关基因(FAS和ACC)的表达来调节肝脏脂质代谢[42]。另一位研究者通过给猪口服短链脂肪酸,降低背肌和腹脂中FAS和ACC基因的表达,减少脂肪生成和增加各组织的脂解作用,从而减少断奶仔猪的脂肪沉积[43]。
8 脂肪酸分解相关酶基因激素敏感脂肪酶(HSL)和脂蛋白脂酶(LPL)主要催化甘油三酯分解释放游离脂肪酸参与氧化供能[44]。LPL和HSL分别是水解血清和脂肪细胞中甘油三酯的关键限速酶,水解产物为沉积脂肪提供原料,说明LPL和HSL可以作为调控肉品质关键点。张雄[45]采用超声波活体构建从江香猪肌内脂肪预测模型,并且研究从江香猪中LPL基因与肌内脂肪的关系,结果表明,不同月龄阶段LPL基因呈现先降低后升高的趋势,与肌内脂肪含量呈显著正相关。Zhang等[46]通过猪模型研究白藜芦醇对脂肪代谢的影响,结果发现白藜芦醇降低脂肪组织中LPL和HSL活性,提高了肌肉组织中ACC和FAS活性,这说明白藜芦醇可以改善血脂水平,减少体脂沉积是通过影响脂肪代谢中重要的限速酶。Duan等[47]研究过量亮氨酸和亮氨酸代谢产物(β-羟基-β-甲基丁酸)对猪脂肪组织中脂质代谢的作用,结果发现过量的亮氨酸及其代谢产物上调ACC的表达并且下调HSL的表达,从而增加脂质储存。综上所述,HSL和LPL是脂肪分解途径中关键限速酶,通过营养手段调控脂肪酸合成和分解关键酶的活性调控脂肪沉积,从而调控肉品质。
9 半乳糖凝集素3基因半乳糖凝集素3是半乳糖凝集素家族的重要成员之一,是一类糖结合蛋白。肥胖症和糖尿病中发现半乳糖凝集素3在脂肪组织和肝脏中特定表达[48]。目前认为半乳糖凝集素3与脂肪代谢有关系,促进脂肪合成。有研究表明,半乳糖凝集素3在小鼠前体脂肪细胞中的蛋白表达水平增加,并且能够刺激小鼠前体脂肪细胞的增殖[49]。为进一步验证该基因的表达与脂肪形成有关,将半乳糖凝集素3基因敲除型小鼠和未敲除小鼠相比,发现白色脂肪组织PPARγ等脂肪合成相关基因mRNA表达下调,并且白色脂肪组织与体重比值明显减少[50]。刘美娟[51]检测了猪和大鼠7种不同组织中半乳糖凝集素3基因表达水平,结果表明在脂肪组织中的表达水平最高,并且在二甲双胍的处理下,半乳糖凝集素3基因在鼠脂肪组织中的表达显著降低,与此同时,成脂基因PPARγ表达显著增加。由于半乳糖凝集素3与脂多糖相互作用,通过糖识别这一特性,它能够激活细胞外信号调节激酶1/2(ERK1/2)信号通路[52]。但是目前研究半乳糖凝集素3基因在脂肪分解发生的作用有一定的争议。ERK1/2信号通路磷酸化能够下调PPARγ等脂肪合成相关转录因子的基因表达,进而抑制脂肪合成。也有人发现半乳糖凝集素3通过抑制糖原合成激酶3活性影响Wnt/β-连环蛋白(Wnt/β-catenin)信号通路来抑制相关脂肪合成代谢[53]。综上所述,半乳糖凝集素3主要集中在对肥胖和葡萄糖代谢疾病影响的研究,但是该基因对脂肪代谢影响同样值得研究,以期在今后调控猪肉品质中得到应用。
10 小结随着社会发展和人民生活水平提高,人们对肉品质的要求越来越高,为了满足该需求,在高瘦肉率和低背膘厚的基础上改善肉品质具有重要意义。目前,猪肉品质主要通过营养和分子手段进行调控,但营养手段调控猪肉品质需要结合分子生物技术进一步深入研究改善肉品质的调控机理。ADD1、FTO、PPARγ、AQP3、瘦素、脂联素、半乳糖凝集素3等基因对猪的脂肪沉积起着重要作用,能够通过对这些主要候选基因的调控,得到瘦肉率高、肌内脂肪含量高的优质肉。随着分子生物技术的迅猛发展,相信在不久的将来,科研人员就能利用这些主要候选基因来调控猪的脂肪沉积,进而改善猪肉品质。
| [1] |
潘增祥, 陈杰, 黄瑞华, 等. 猪脂肪及肌肉组织中基因表达信息分析[J]. 遗传学报, 2005(3): 264-274. |
| [2] |
WOOD J D, ENSER M, FISHER A V, et al. Fat deposition, fatty acid composition and meat quality:a review[J]. Meat Science, 2008, 78(4): 343-358. DOI:10.1016/j.meatsci.2007.07.019 |
| [3] |
曾勇庆, 王根林, 魏述东, 等. 含不同比例莱芜猪血缘杂交猪胴体品质及肉质特性的研究[J]. 遗传, 2005(1): 65-69. |
| [4] |
HU H M, WANG J Y, ZHU R S, et al. Effect of myosin heavy chain composition of muscles on meat quality in Laiwu pigs and Duroc[J]. Science in China Series C:Life Sciences, 2008, 51(2): 127-132. DOI:10.1007/s11427-008-0016-x |
| [5] |
LU P, LI D F, YIN J D, et al. Flavour differences of cooked longissimus muscle from Chinese indigenous pig breeds and hybrid pig breed(Duroc×Landrace×Large White)[J]. Food Chemistry, 2008, 107(4): 1529-1537. DOI:10.1016/j.foodchem.2007.10.010 |
| [6] |
GERBENS F, DE KONING D J, HARDERS F L, et al. The effect of adipocyte and heart fatty acid-binding protein genes on intramuscular fat and backfat content in Meishan crossbred pigs[J]. Journal of Animal Science, 2000, 78(3): 552-559. DOI:10.2527/2000.783552x |
| [7] |
GARDAN D, GONDRET F, LOUVEAU I. Lipid metabolism and secretory function of porcine intramuscular adipocytes compared with subcutaneous and perirenal adipocytes[J]. AJP-Endocrinology and Metabolism, 2006, 291(2): E372-E380. DOI:10.1152/ajpendo.00482.2005 |
| [8] |
CHEN J, YANG X J, XIA D, et al. Sterol regulatory element binding transcription factor 1 expression and genetic polymorphism significantly affect intramuscular fat deposition in the longissimus muscle of Erhualian and Sutai pigs[J]. Journal of Animal Science, 2008, 86(1): 57-63. DOI:10.2527/jas.2007-0066 |
| [9] |
YUE T, FANG Q, YIN J D, et al. S-adenosylmethionine stimulates fatty acid metabolism-linked gene expression in porcine muscle satellite cells[J]. Molecular Biology Reports, 2010, 37(7): 3143-3149. DOI:10.1007/s11033-009-9893-8 |
| [10] |
GOSMAIN Y, LEFAI E, RYSER S, et al. Sterol regulatory element-binding protein-1 mediates the effect of insulin on hexokinase Ⅱ gene expression in human muscle cells[J]. Diabetes, 2004, 53(2): 321-329. |
| [11] |
HAUSMAN G J, DODSON M V, AJUWON K, et al. Board-invited review:the biology and regulation of preadipocytes and adipocytes in meat animals[J]. Journal of Animal Science, 2009, 87(4): 1218-1246. DOI:10.2527/jas.2008-1427 |
| [12] |
EBERLÉ D, CLÉMENT K, MEYRE D, et al. SREBF-1 gene polymorphisms are associated with obesity and type 2 diabetes in French obese and diabetic cohorts[J]. Diabetes, 2004, 53(8): 2153-2157. DOI:10.2337/diabetes.53.8.2153 |
| [13] |
李江凌, 刘锐, 陈晓晖, 等. ADD1基因多态性位点与猪肌内脂肪含量、嫩度及背膘厚的关联性研究[J]. 中国猪业, 2013(6): 44-45. DOI:10.3969/j.issn.1673-4645.2013.06.023 |
| [14] |
DONG X Y, TANG S Q, ZHANG W, et al. GPR39 activates proliferation and differentiation of porcine intramuscular preadipocytes through targeting the PI3K/AKT cell signaling pathway[J]. Journal of Receptors and Signal Transduction, 2016, 36(2): 130-138. DOI:10.3109/10799893.2015.1056308 |
| [15] |
PAYNE V A, AU W S, LOWE C E, et al. C/EBP transcription factors regulate SREBP1c gene expression during adipogenesis[J]. Biochemical Journal, 2010, 425(1): 215-223. |
| [16] |
盘道兴.不同猪种脂肪细胞分化因子的差异表达研究[D].硕士学位论文.贵阳: 贵州大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10657-1016777440.htm
|
| [17] |
牛丛丛.脂肪和肥胖相关基因(FTO)的转录调控及其功能研究[D].硕士学位论文.武汉: 华中农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10504-1012457868.htm
|
| [18] |
张雨林, 詹济华, 谭洋, 等. 肥胖相关基因FTO、FNDC5、PRDM16的研究进展[J]. 生命的化学, 2017, 37(6): 971-979. |
| [19] |
周波.猪FTO原核表达及其对猪肌内前体脂肪细胞增殖和分化的影响[D].硕士学位论文.雅安: 四川农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10626-1017013057.htm
|
| [20] |
DREYER C, KREY G, KELLER H, et al. Control of the peroxisomal β-oxidation pathway by a novel family of nuclear hormone receptors[J]. Cell, 1992, 68(5): 879-887. DOI:10.1016/0092-8674(92)90031-7 |
| [21] |
CHEN X L, ZHOU B, LUO Y L, et al. Tissue distribution of porcine FTO and its effect on porcine intramuscular preadipocytes proliferation and differentiation[J]. PLoS One, 2016, 11(3): e151056. |
| [22] |
KLIEWER S A, FORMAN B M, BLUMBERG B, et al. Differential expression and activation of a family of murine peroxisome proliferator-activated receptors[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(15): 7355-7359. DOI:10.1073/pnas.91.15.7355 |
| [23] |
SHER T, YI H F, MCBRIDE O W, et al. cDNA cloning, chromosomal mapping, and functional characterization of the human peroxisome proliferator activated receptor[J]. Biochemistry, 1993, 32(21): 5598-5604. DOI:10.1021/bi00072a015 |
| [24] |
HE K, WANG Q S, WANG Z, et al. Association study between gene polymorphisms in PPAR signaling pathway and porcine meat quality traits[J]. Mammalian Genome, 2013, 24(7/8): 322-331. |
| [25] |
MA J J, CHAI J, SHANG Y Y, et al. Swine PPAR-γ2 expression upregulated in skeletal muscle of transgenic mice via the swine myozenin-1 gene promoter[J]. Transgenic Research, 2015, 24(3): 409-420. |
| [26] |
RODRÍGUEZ A, CATALÁN V, GÓMEZ-AMBROSI J, et al. Insulin- and leptin-mediated control of aquaglyceroporins in human adipocytes and hepatocytes is mediated via the PI3K/Akt/mTOR signaling cascade[J]. The Journal of Clinical Endocrinology & Metabolism, 2011, 96(4): E586-E597. |
| [27] |
TARDELLI M, CLAUDEL T, BRUSCHI F V, et al. Adiponectin regulates AQP3 via PPARα in human hepatic stellate cells[J]. Biochemical and Biophysical Research Communications, 2017, 490(1): 51-54. DOI:10.1016/j.bbrc.2017.06.009 |
| [28] |
CHEN L, LI Z, ZHANG Q, et al. Silencing of AQP3 induces apoptosis of gastric cancer cells via downregulation of glycerol intake and downstream inhibition of lipogenesis and autophagy[J]. OncoTargets and Therapy, 2017, 10: 2791-2804. DOI:10.2147/OTT |
| [29] |
杨晶.猪肌内脂肪差异性沉积关键基因鉴定及AQP3的功能研究[D].硕士学位论文.杨凌: 西北农林科技大学, 2018.
|
| [30] |
MADEIRA A, MOURA T F, SOVERAL G. Aquaglyceroporins:implications in adipose biology and obesity[J]. Cellular and Molecular Life Sciences, 2015, 72(4): 759-771. DOI:10.1007/s00018-014-1773-2 |
| [31] |
BARB C R, HAUSMAN G J, HOUSEKNECHT K L. Biology of leptin in the pig[J]. Domestic Animal Endocrinology, 2001, 21(4): 297-317. DOI:10.1016/S0739-7240(01)00123-0 |
| [32] |
李永能, 黄英, 杨明华, 等. 瘦素(leptin)对猪脂肪细胞FTO基因mRNA表达的影响[J]. 云南农业大学学报, 2014, 29(5): 666-671. DOI:10.3969/j.issn.1004-390X(n).2014.05.008 |
| [33] |
黄艳娜, 何少婧, 李莉, 等. 陆川猪瘦素基因的克隆及序列分析[J]. 黑龙江畜牧兽医, 2015(21): 92-95. |
| [34] |
PRUSZYNSKA-OSZMALEK E, KOLODZIEJSKI P A, KACZMAREK P, et al. Orexin A but not orexin B regulates lipid metabolism and leptin secretion in isolated porcine adipocytes[J]. Domestic Animal Endocrinology, 2018, 63: 59-68. DOI:10.1016/j.domaniend.2017.12.003 |
| [35] |
朱耀武, 陈宇光, 罗佳捷. 重组猪脂联素对沙子岭猪屠宰性能的影响[J]. 湖南饲料, 2015(4): 32-33. DOI:10.3969/j.issn.1673-7539.2015.04.016 |
| [36] |
程晓芳.白藜芦醇通过脂联素信号通路调控肌纤维类型转化的研究[D].硕士学位论文.南宁: 广西大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10593-1017225537.htm
|
| [37] |
杨雪梅, 顾以韧, 陶璇, 等. 不同猪种脂联素和胰岛素含量与肌内脂肪含量关系研究[J]. 养猪, 2015(4): 60-62. DOI:10.3969/j.issn.1002-1957.2015.04.032 |
| [38] |
ALBUQUERQUE A, NEVES J A, REDONDEIRO M, et al. Long term betaine supplementation regulates genes involved in lipid and cholesterol metabolism of two muscles from an obese pig breed[J]. Meat Science, 2017, 124: 25-33. DOI:10.1016/j.meatsci.2016.10.012 |
| [39] |
崔波, 耿忠诚, 潘兴玲, 等. 甜菜碱与蛋氨酸螯合铬对三江白猪血清生化指标及皮下脂肪组织脂肪酸合成酶基因mRNA表达的影响[J]. 中国生物制品学杂志, 2011, 24(5): 554-557. |
| [40] |
RENAVILLE B, BACCIU N, LANZONI M, et al. Association of single nucleotide polymorphisms in fat metabolism candidate genes with fatty acid profiles of muscle and subcutaneous fat in heavy pigs[J]. Meat Science, 2018, 139: 220-227. DOI:10.1016/j.meatsci.2018.02.005 |
| [41] |
娄鹏博.加权基因共表达网络分析(WGCNA)筛选猪卵母细胞脂肪沉积相关基因[D].硕士学位论文.雅安: 四川农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10626-1017013129.htm
|
| [42] |
LI W, LI B, LV J Q, et al. Choline supplementation improves the lipid metabolism of intrauterine-growth-restricted pigs[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(5): 686-695. DOI:10.5713/ajas.15.0810 |
| [43] |
JIAO A R, DIAO H, YU B, et al. Oral administration of short chain fatty acids could attenuate fat deposition of pigs[J]. PLoS One, 2018, 13(5): e196867. |
| [44] |
LAFONTAN M, LANGIN D. Lipolysis and lipid mobilization in human adipose tissue[J]. Progress in Lipid Research, 2009, 48(5): 275-297. DOI:10.1016/j.plipres.2009.05.001 |
| [45] |
张雄.从江香猪肌内脂肪预测模型构建及LPL基因相关研究[D].硕士学位论文.贵阳: 贵州大学, 2017. https://www.ixueshu.com/document/433886e12d561a78381c0aab81c124ec.html
|
| [46] |
ZHANG C, LUO J Q, YU B, et al. Effects of resveratrol on lipid metabolism in muscle and adipose tissues:a reevaluation in a pig model[J]. Journal of Functional Foods, 2015, 14: 590-595. DOI:10.1016/j.jff.2015.02.039 |
| [47] |
DUAN Y H, ZHANG L Y, LI F N, et al. β-hydroxy-β-methylbutyrate modulates lipid metabolism in adipose tissues of growing pigs[J]. Food & Function, 2018, 9(9): 4836-4846. |
| [48] |
PUGLIESE G, IACOBINI C, PESCE C M, et al. Galectin-3:an emerging all-out player in metabolic disorders and their complications[J]. Glycobiology, 2015, 25(2): 136-150. |
| [49] |
KIWAKI K, NOVAK C M, HSU D K, et al. Galectin-3 stimulates preadipocyte proliferation and is up-regulated in growing adipose tissue[J]. Obesity, 2007, 15(1): 32-39. |
| [50] |
BAEK J H, KIM S J, KANG H G, et al. Galectin-3 activates PPARγ and supports white adipose tissue formation and high-fat diet-induced obesity[J]. Endocrinology, 2015, 156(1): 147-156. DOI:10.1210/en.2014-1374 |
| [51] |
刘美娟.Galectin-3基因的表达规律及其在脂肪代谢中的调控作用[D].硕士学位论文.临汾: 山西师范大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10118-1017279798.htm
|
| [52] |
GAO X G, BALAN V, TAI G H, et al. Galectin-3 induces cell migration via a calcium-sensitive MAPK/ERK1/2 pathway[J]. Oncotarget, 2014, 5(8): 2077-2084. |
| [53] |
FUNASAKA T, RAZ A, NANGIA-MAKKER P. Nuclear transport of galectin-3 and its therapeutic implications[J]. Seminars in Cancer Biology, 2014, 27: 30-38. DOI:10.1016/j.semcancer.2014.03.004 |




