2. 四川农业大学动物营养研究所, 成都 611130
2. Institute of Animal Nutrition, Sichuan Agricultural University, Chengdu 611130, China
鱼类非特异性免疫系统在抵御病原微生物中发挥重要作用。吞噬细胞、溶菌酶(lysozyme,LZM)、抗菌肽、补体(complement,C)、白细胞介素(interleukin,IL)等非特异性免疫细胞和因子是消除外来病原的重要基础[1]。新近研究表明,营养物质能有效提高鱼类的非特异性免疫功能[2]。异亮氨酸(isoleucine,Ile)是鱼类的必需氨基酸,研究表明Ile能保障鱼类鳃和肠道组织物理屏障功能正常,提高LZM、酸性磷酸酶(acid phosphatase,ACP)活性和C含量,促进β-防御素(β-defensin)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、IL-10和转化生子因子-β(transforming growth factor beta,TGF-β)等重要免疫因子转录,增强鱼类非特异性免疫功能[3-11]。本文简要总结Ile对鱼类非特异性免疫功能的影响,以期为进一步深入研究Ile对鱼类非特异性免疫功能的调控作用及机制提供参考。
1 Ile对黏膜物理屏障功能的影响 1.1 Ile能够提升活性氧(reactive oxygen species,ROS)清除能力, 降低细胞氧化损伤细胞在正常和病理情况下均会产生ROS,过多的ROS会引起组织的氧化应激,导致氧化损伤[5-6]。蛋白质羰基(protein carbonyl,PC)和丙二醛(malondial-dehyde,MDA)分别是蛋白质和脂肪的氧化产物,其含量可反映上皮细胞的氧化损伤程度。胞外乳酸脱氢酶(lactate dehydrogenase,LDH)活性是评价上皮细胞结构完整性的关键标识[9]。体内和体外试验均表明适宜水平的Ile能够降低鱼类鳃、肠道和肠细胞PC、MDA含量与LDH活性(表 1),而Ile缺乏或水平过高,PC、MDA含量和LDH活性均显著高于最适水平组。因此,适宜水平的Ile能够降低鱼类鳃和肠道的氧化损伤,维持细胞的完整性,保护物理屏障功能,而Ile缺乏或过量可能会导致细胞氧化损伤。
|
|
表 1 饲料中添加Ile对鱼类组织中氧化产物含量的影响 Table 1 Effects of dietary Ile on oxidation product content in tissues of fish |
抗超氧阴离子(anti superoxide anion,ASA)和抗羟自由基(anti hydroxyl radical,AHR)活性能敏感反映细胞对ROS的清除能力。饲料中补充9.3 g/kg Ile 8周,草鱼鳃ASA与AHR活性分别提升82.8%和82.5%[6],说明Ile能提升细胞对ROS的清除能力。另外,鱼类的ROS清除能力还与酶性和非酶性系统有关。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、谷胱甘肽硫转移酶(glutathione S-transferase,GST)和谷胱甘肽还原酶(glutathione reductase,GR)是清除鱼体内ROS的重要抗氧化酶[3, 6]。研究发现,适宜添加量的Ile能显著提高鱼类抗氧化酶活性(表 2);而与Ile最适添加量相比,Ile缺乏或过量均导致抗氧化酶活性降低,其原因可能是Ile缺乏或过量时,会破坏体内氨基酸平衡,阻碍其他氨基酸吸收,影响体内酶代谢,导致酶活性下降[7, 11]。因此,适宜添加量的Ile可能通过提高鱼类抗氧化酶活性,进而提升ROS清除能力,而Ile缺乏或过量会对抗氧化酶活性产生抑制效果。此外,由表 2还可看出,组织中酶活性达到最大时,肉食性鱼类对Ile的需求量较杂食性鱼类高,这可能与其自身蛋白质需求和代谢有关。
|
|
表 2 Ile最适添加量对鱼类抗氧化酶活性的影响 Table 2 Effects of Ile optimal addition on antioxidant enzyme activities of fish |
|
|
表 3 Ile最适添加量对鱼类血清中非特异性免疫因子活性/含量的影响 Table 3 Effects of Ile optimal addition on non-specific immune factor activities/contents in serum of fish |
谷胱甘肽(glutathione,GSH)是鱼类不可或缺的抗氧化物,能有效清除ROS[12]。研究发现,饲料中补充Ile能够提高建鲤和草鱼组织中GSH含量[3, 6, 13]。因此,Ile可能通过提升GSH的含量,增强鱼体对ROS的清除能力。此外,Ile还能够通过其初级代谢产物α-酮-H-甲基戊酸(alpha ketone-H-methyl valerate,KMV)直接清除ROS[14]。Huang等[15]研究发现,KMV降低了小鼠神经细胞PC12、原代神经元细胞和成纤维细胞氧化应激状态下ROS的含量。但关于Ile代谢产物KMV是否影响鱼类黏膜组织中ROS清除能力及分子机制有待进一步研究。
抗氧化酶活性与抗氧化酶基因表达有关,核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)能够促进SOD、CAT、GPx和GST基因的表达,从而提高抗氧化酶活性。Kelch样ECH相关蛋白1(Kelch-like ECH related protein 1,Keap1)是Nrf2的负调控因子,能够抑制Nrf2核移位[3, 6]。在小鼠上的研究发现,下调Keap1基因表达增加了Nrf2核移位,并通过抗氧化反应元件(antioxidant response element,ARE)促进抗氧化相关基因的转录[16]。而适宜水平的Ile显著下调建鲤肠道和草鱼鳃中Keap1 mRNA表达水平,上调Nrf2 mRNA表达水平[3, 6]。上述结果表明,Ile调节抗氧化酶基因转录可能与下调Keap1基因转录促进Nrf2核移位有关。在人上的研究发现,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)活性提高会促进Nrf2基因转录[17]。而在建鲤上的研究发现,Ile上调了其肠道mTOR基因的表达[3]。因此,Ile促进鱼类肠道Nrf2基因表达可能与上调mTOR基因表达有关,但具体调节机制有待进一步研究。
1.2 Ile通过调节紧密连接(tight junctions,TJs)基因的表达提高细胞间紧密连接功能鱼体内细胞间TJs蛋白主要由胞质蛋白闭锁小带蛋白(zonula occludens,ZO)和跨膜蛋白occludin、claudins组成,是维持细胞间物理屏障功能的重要蛋白,其基因和蛋白表达下降,会引起TJs结构和功能的改变,损害细胞间物理屏障功能[18]。在草鱼鳃中的研究发现,铜(Cu)应激会降低TJs基因的表达,导致TJs结构破坏,削弱物理屏障功能,而添加Ile能显著提高Cu应激后claudin-3、claudin-b、claudin-c、ZO-1和occludin mRNA表达水平[6]。关于Ile上调草鱼鳃中TJs基因表达的机制尚不清楚。研究表明,ROS会显著降低TJs基因的表达[18-19],而适宜水平的Ile显著降低草鱼鳃中ROS含量[6]。因此,Ile可能通过降低鳃中ROS含量,进而促进TJs基因表达。此外,蛋白激酶C(protein kinase C,PKC)能够调节occludin蛋白中丝氨酸/苏氨酸位点的磷酸化状态。PKC被激活后,可以磷酸化occludin丝氨酸/苏氨酸位点,并向TJs处移位,保护TJs结构[20]。对建鲤的研究发现,适宜水平的Ile显著上调了肝胰脏中PKC alpha、beta1、beta2、epsilon、eta1和eta2 mRNA表达水平[21]。因此,Ile可能通过激活PKC基因,进而上调TJs mRNA表达水平,但具体机制有待进一步研究。然而,在建鲤肠道中发现,适宜水平的Ile下调了occludin、claudin-3和claudin-7 mRNA表达水平[3],这与草鱼鳃中TJs基因表达趋势相反。此外,在鸡上的研究发现,低蛋白质饲粮中添加Ile,对其肠道claudin-1、occludin mRNA表达水平无显著影响[22]。因此,Ile调节TJs基因表达可能受机体状态、组织差异和物种差异的影响。关于Ile下调TJs基因表达的原因尚不清楚。研究发现,细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)和p38蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)是调控TJs基因表达的重要分子[23]。抑制ERK1/2活性下调了马-达二氏犬肾(Madin-Darby canine kidney,MDCK)细胞claudin-3的mRNA表达水平[24],上调了p38的mRNA表达水平,降低了人胃上皮细胞occludin蛋白的表达[25]。而在建鲤肠道中发现,7.0和9.5 g/kg Ile显著下调了ERK1 mRNA表达水平,这与claudin-3 mRNA表达水平变化趋势相似。当Ile添加量为11.9 g/kg时,p38 mRNA表达水平达到最大,这与occuldin mRNA表达水平变化呈相反趋势[3]。因此,Ile下调TJs基因表达可能与下调ERK1和上调p38基因的转录有关。另外,肠道中大肠杆菌和嗜水气单胞菌等有害菌数量增多会破坏动物肠道屏障结构,而乳酸杆菌等肠道益生菌的数量增多对肠道起到保护作用。在建鲤上的研究发现,Ile添加量为16.9 g/kg时,乳酸杆菌数量升高8.4%;Ile添加量为11.9 g/kg时,大肠杆菌和嗜水气单胞菌数量分别较对照组显著降低4.7%和6.9%[3]。Karczewski等[26]发现,乳酸杆菌能够抑制人肠道内有害菌着生,且在黏附肠上皮细胞后,可促进TJs蛋白的分布与表达。因此,Ile可能通过提高乳酸菌数量,改变TJs蛋白的分布与表达,同时减少有害菌数量,降低对肠道的刺激作用保护肠道屏障功能,进而引起TJs基因的适应性下调(图 1),但这种调节机制有待进一步研究。
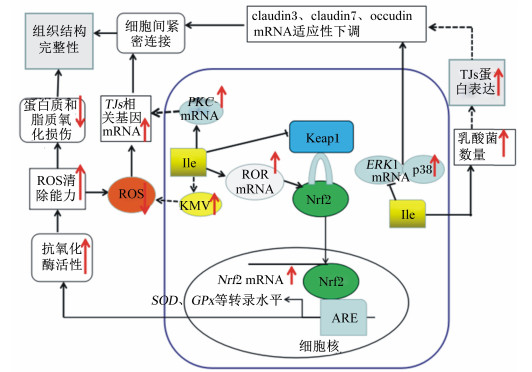
|
ROS:活性氧reactive oxygen species; PKC:蛋白激酶C protein kinase C; Ile:异亮氨酸isoleucine; KMV:α-酮-H-甲基戊酸alpha ketone-H-methyl valerate; TOR:雷帕霉素靶蛋白target of rapamycin;Keap1:Kelch样ECH相关蛋白1 Kelch-like ECH related protein 1;Nrf2:核因子E2相关因子2 nuclear factor E2-related factor 2;SOD:超氧化物歧化酶superoxide dismutase; GPx:谷胱甘肽过氧化物酶glutathione peroxidase; ARE:抗氧化反应元件antioxidant response element;ERK1:细胞外调节蛋白激酶1 extracellular regulated protein kinase 1;TJs:紧密连接tight junctions。 图 1 Ile调控鱼类鳃和肠道物理屏障功能的可能途径 Fig. 1 Possible pathways of Ile to regulate physical barrier function of gill and intestine |
鱼类非特异性免疫细胞主要有吞噬细胞(粒细胞、单核细胞、巨噬细胞)、细胞毒性细胞及树突状细胞等[27]。而目前Ile对非特异性免疫细胞的影响集中于吞噬细胞,且研究资料较少。吞噬细胞的吞噬能力与其数量和吞噬活性密切相关。鱼类头肾是白细胞的生成场所,Ile能够提高建鲤头肾指数以及血液中白细胞数量和吞噬活性[5],说明Ile能促进鱼体头肾发育,提高吞噬细胞数量和吞噬活性,增强其吞噬能力。呼吸爆发产生的活性氧可杀灭入侵的病原,反映吞噬细胞的杀菌能力。饲料中添加1.5%和2.5%的Ile显著提高了牙鲆头肾呼吸爆发活性[8],说明Ile能提升鱼体吞噬细胞的杀菌能力。目前Ile对鱼类吞噬细胞的吞噬和杀菌能力的影响仅有少量报道,有待进一步研究。
2.2 Ile对非特异性免疫因子活性的影响LZM、ACP、C3和C4是鱼类重要的非特异性免疫因子。LZM、ACP由组织分泌到血液和黏液中,直接清除病原;C3、C4是补体经典激活途径的重要分子[3, 5]。研究发现,适宜水平的Ile能够提高鱼体LZM、ACP活性与C3、C4含量(表 3),而在Ile缺乏或过量时,非特异免疫因子活性均受到了不同程度的抑制。类似地,Ile缺乏会导致小鼠血清中C3活性降低,而补充Ile提高了小鼠血清中C3的活性[28]。上述研究结果说明,适宜水平的Ile能提高鱼类非特异性免疫因子LZM、ACP活性与C3、C4含量,增强病原清除能力,促进补体系统的激活,进而提升非特异性免疫功能。关于Ile调节非特异性免疫因子活性的机制尚待研究。此外,从表 3中也可看出,血清中非特异性免疫因子活性达到最大时,肉食性鱼类对Ile的需求量较杂食性鱼类高,这与表 2中变化规律一致,可能与其自身蛋白质需求和代谢相关。
β-防御素是重要的非特异性免疫因子,具有抗菌抗病毒活性,能刺激免疫细胞迁移,促进促炎性细胞因子分泌[29]。研究发现,Ile能够特异性诱导牛肾上皮细胞中β-防御素的表达,提高猪肠上皮细胞IPEC-J2 β-防御素1、2和3的转录及其蛋白的表达[30-31]。在大鼠饮水中添加1.5%的Ile,其空肠β-防御素表达量升高了14.2倍[32]。对感病鼠类的研究发现,添加L-Ile可诱导β-防御素3和4的表达显著增加,降低细菌负荷与组织损伤[33],说明Ile能够诱导β-防御素的表达,提升机体抵抗病原入侵的能力。此外,Ren等[34]研究表明,Ile可通过沉默信息调节因子1(Sirt1)/ERK1/2/p90RSK非炎症依赖途径调节猪肠上皮细胞IPEC-J2 β-防御素基因的表达。在鱼类上的研究发现,适宜的蛋白质[12]和磷[35]水平能够显著促进草鱼头肾、脾脏和皮肤中β-防御素的表达,提升其头肾和脾脏的免疫屏障功能。但Ile能否促进鱼类β防御素表达及其调控防御素表达的机制还尚待研究。
2.3 Ile对炎症反应和抗病毒的影响鱼类非特异性免疫炎症反应主要由多种炎症细胞因子介导。TNF-α、IL-1β、IL-8是由巨噬细胞产生的重要细胞因子,能够刺激炎症反应,IL-10和TGF-β具有显著的抗炎作用[6, 36]。关于Ile对鱼类炎症反应的影响仅有零星报道。研究发现,Ile显著抑制了草鱼鳃TNF-α、IL-1β、IL-8的表达,促进了IL-10和TGF-β的表达[6];Ile显著上调了建鲤肠道和头肾TGF-β mRNA表达水平,下调了TNF-α mRNA表达水平[3, 5]。关于Ile调控鱼类炎症细胞因子表达的机制尚不完全清楚。研究发现,mTOR活性被抑制会诱导TNF-α含量增加,而Ile能够提高鱼类鳃和肠道mTOR mRNA表达水平[3, 6, 37]。此外,mTOR和其下游基因核糖体S6激酶(ribosomal protein S6 kinase,S6K1)能够刺激IL-10和TGF-β的产生[38-39]。对草鱼鳃的研究发现,适宜水平的Ile增加了mTOR和S6K1 mRNA表达水平[6]。可见,Ile能抑制鱼体促炎因子的表达,促进抗炎因子的表达,进而起到抗炎作用,而这一作用可能与mTOR和S6K1转录水平升高有关,但具体调节机制有待进一步研究。
此外,上皮细胞以及免疫细胞表面的跨膜蛋白Toll受体3(Toll-like receptor 3,TLR3)、黑色素瘤分化相关蛋白5(melanoma differentiation-associated protein 5,MDA5)和维甲酸诱导基因Ⅰ(retinoic acid inducible gene Ⅰ,RIG-Ⅰ)能识别病毒,活化干扰素调节因子3(interferon regulatory factor 3,IRF-3)和核转录因子-κB(nuclear factor-kappa B,NF-κB),进而诱导Ⅰ型-干扰素(Ⅰ-interferon,IFN-Ⅰ)和促炎因子表达,介导病毒免疫反应[40-41]。研究发现,Ile能够显著提高猪肠上皮细胞IPEC-J2和肺泡巨噬细胞3D4/31中TLR3、MDA5、RIG-Ⅰ、IRF-3、NF-κB、β-干扰素(IFN-β)和γ-干扰素(IFN-γ)mRNA丰度,增强抗病毒能力。体内试验发现,轮状病毒攻毒后,添加Ile组较未添加组血清和回肠中病毒抗体滴度分别升高了39.21%和20.18%,而回肠中TLR3、MDA5、RIG-Ⅰ、IRF-3和NF-κB mRNA丰度分别升高了113.91%、71.94%、124.33%、22.07%、134.71%[42]。上述结果表明,Ile能够增强机体对病毒的识别能力,提升免疫水平和抗病毒能力。但Ile能否提高鱼类病毒识别和抗病毒能力,还有待研究。
3 小结综上所述,Ile能够通过增强黏膜组织的ROS清除能力和细胞间紧密连接性,提高黏膜组织物理屏障功能;提高吞噬细胞的吞噬和杀菌能力,增强非特异性免疫因子活性;促进抗炎因子表达,抑制促炎因子表达,发挥抗炎作用,进而增强鱼类非特异性免疫功能。但Ile能否促进鱼类β-防御素转录和生成,能否提高鱼类病毒识别和抗病毒能力,以及Ile调控鱼类非特异性免疫细胞与免疫因子活性的具体机制,还有待进一步研究。
| [1] |
ZHU L Y, NIE L, ZHU G, et al. Advances in research of fish immune-relevant genes:a comparative overview of innate and adaptive immunity in teleosts[J]. Developmental & Comparative Immunology, 2013, 39(1/2): 39-62. |
| [2] |
AZEREDO R, SERRA C R, OLIVA-TELES A, et al. Amino acids as modulators of the European seabass, Dicentrarchus labrax, innate immune response:an in vitro approach[J]. Scientific Reports, 2017, 7(1): 18009. DOI:10.1038/s41598-017-18345-3 |
| [3] |
ZHAO J, FENG L, LIU Y, et al. Effect of dietary isoleucine on the immunity, antioxidant status, tight junctions and microflora in the intestine of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. Fish & Shellfish Immunology, 2014, 41(2): 663-673. |
| [4] |
黄忠, 周传鹏, 林黑着, 等. 饲料异亮氨酸水平对卵形鲳鲹消化酶活性和免疫指标的影响[J]. 南方水产科学, 2017, 13(1): 50-57. DOI:10.3969/j.issn.2095-0780.2017.01.007 |
| [5] |
ZHAO J, LIU Y, JIANG J, et al. Effects of dietary isoleucine on the immune response, antioxidant status and gene expression in the head kidney of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. Fish & Shellfish Immunology, 2013, 35(2): 572-580. |
| [6] |
FENG L, GAN L, JIANG W D, et al. Gill structural integrity changes in fish deficient or excessive in dietary isoleucine:towards the modulation of tight junction protein, inflammation, apoptosis and antioxidant defense via NF-κB, TOR and Nrf2 signaling pathways[J]. Fish & Shellfish Immunology, 2017, 63: 127-138. |
| [7] |
王莉苹, 姜志强, 孙梦蕾, 等. 饲料中亮氨酸和异亮氨酸交互作用对牙鲆消化酶及免疫相关酶活力的影响[J]. 大连海洋大学学报, 2017, 32(3): 287-293. |
| [8] |
RAHIMNEJAD S, LEE K J. Isoleucine effects on non-specific immune response of juvenile olive flounder (Paralichthys olivaceus)[J]. Fish & Shellfish Immunology, 2013, 34(6): 1731-1732. |
| [9] |
ZHAO J, WU P, JIANG W D, et al. Preventive and reparative effects of isoleucine against copper-induced oxidative damage in primary fish enterocytes[J]. Fish Physiology and Biochemistry, 2017, 43(4): 1021-1032. DOI:10.1007/s10695-017-0349-0 |
| [10] |
孙玉轩.吉富罗非鱼亮氨酸和异亮氨酸需求量的研究[D].硕士学位论文.重庆: 西南大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10635-1014261858.htm
|
| [11] |
王旭, 周婧, 薛晓强, 等. 牙鲆饲料中异亮氨酸与缬氨酸的交互作用对消化酶和部分免疫酶的影响[J]. 饲料工业, 2018, 39(20): 23-28. |
| [12] |
XU J, WU P, JIANG W D, et al. Optimal dietary protein level improved growth, disease resistance, intestinal immune and physical barrier function of young grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology, 2016, 55: 64-87. |
| [13] |
GAN L, JIANG W D, WU P, et al. Flesh quality loss in response to dietary isoleucine deficiency and excess in fish:a link to impaired Nrf2-dependent antioxidant defense in muscle[J]. PLoS One, 2014, 9(12): e115129. DOI:10.1371/journal.pone.0115129 |
| [14] |
HUANG H M, OU H C, CHEN H L, et al. Protective effect of α-keto-β-methyl-N-valeric acid on BV-2 microglia under hypoxia or oxidative stress[J]. Annals of the New York Academy of Sciences, 2005, 1042(1): 272-278. DOI:10.1196/annals.1338.049 |
| [15] |
HUANG H M, ZHANG H, OU H C, et al. α-keto-β-methyl-N-valeric acid diminishes reactive oxygen species and alters endoplasmic reticulum Ca2+ stores[J]. Free Radical Biology and Medicine, 2004, 37(11): 1779-1789. DOI:10.1016/j.freeradbiomed.2004.08.001 |
| [16] |
REISMAN S A, YEAGER R L, YAMAMOTO M, et al. Increased Nrf2 activation in livers from Keap1-knockdown mice increases expression of cytoprotective genes that detoxify electrophiles more than those that detoxify reactive oxygen species[J]. Toxicological Sciences, 2009, 108(1): 35-47. DOI:10.1093/toxsci/kfn267 |
| [17] |
SHAY K P, MICHELS A J, LI W G, et al. Cap-independent Nrf2 translation is part of a lipoic acid-stimulated detoxification stress response[J]. Biochimica et Biophysica Acta:Molecular Cell Research, 2012, 1823(6): 1102-1109. DOI:10.1016/j.bbamcr.2012.04.002 |
| [18] |
NIKLASSON L.Intestinal mucosal immunology of salmonids response to stress and infection and crosstalk with the physical barrier[D].Ph.D.Thesis.Geoteborg: University of Gothenburg, 2013.
|
| [19] |
GU Y T, XUE Y X, WANG Y F, et al. Role of ROS/RhoA/PI3K/PKB signaling in NS1619-mediated blood-tumor barrier permeability increase[J]. Journal of Molecular Neuroscience, 2012, 48(1): 302-312. |
| [20] |
GONZÁLEZ-MARISCAL L, TAPIA R, CHAMORRO D. Crosstalk of tight junction components with signaling pathways[J]. Biochimica et Biophysica Acta:Biomembranes, 2008, 1778(3): 729-756. DOI:10.1016/j.bbamem.2007.08.018 |
| [21] |
ZHAO J, LIU Y, JIANG J, et al. Effects of dietary isoleucine on growth, the digestion and absorption capacity and gene expression in hepatopancreas and intestine of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. Aquaculture, 2012, 368/369: 117-128. DOI:10.1016/j.aquaculture.2012.09.019 |
| [22] |
DONG X Y, AZZAM M M M, ZOU X T. Effects of dietary L-isoleucine on laying performance and immunomodulation of laying hens[J]. Poultry Science, 2016, 95(10): 2297-2305. DOI:10.3382/ps/pew163 |
| [23] |
GONZÁLEZ-MARISCAL L, DÍAZ-CORÁNGUEZ M, QUIRÍS M.Regulation of tight junctions for therapeutic advantages[M]//MARTIN T A, JIANG W G.Tight Junctions in cancer metastasis.Dordrecht: Springer, 2013: 197-246.
|
| [24] |
ZHANG K, YAO H P, WANG M H. Activation of RON differentially regulates claudin expression and localization:role of claudin-1 in RON-mediated epithelial cell motility[J]. Carcinogenesis, 2008, 29(3): 552-559. |
| [25] |
WU H L, GAO X, JIANG Z D, et al. Attenuated expression of the tight junction proteins is involved in clopidogrel-induced gastric injury through p38 MAPK activation[J]. Toxicology, 2013, 304: 41-48. DOI:10.1016/j.tox.2012.11.020 |
| [26] |
KARCZEWSKI J, TROOST F J, KONINGS I, et al. Regulation of human epithelial tight junction proteins by Lactobacillus plantarum in vivo and protective effects on the epithelial barrier[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2010, 298(6): G851-G859. DOI:10.1152/ajpgi.00327.2009 |
| [27] |
GÍMEZ G D, BALCÁZAR J L. A review on the interactions between gut microbiota and innate immunity of fish[J]. FEMS Immunology & Medical Microbiology, 2008, 52(2): 145-154. |
| [28] |
PETRO T M, BHATTACHARJEE J K. Effect of dietary essential amino acid limitations upon native levels of murine serum immunoglobulins, transferrin, and complement[J]. Infection and Immunity, 1980, 27(2): 513-518. |
| [29] |
SUAREZCARMONA M, HUBERT P, DELVENNE P, et al. Defensins:"Simple" antimicrobial peptides or broad-spectrum molecules?[J]. Cytokine & Growth Factor Reviews, 2015, 26(3): 361. |
| [30] |
FEHLBAUM P, RAO M, ZASLOFF M, et al. An essential amino acid induces epithelial β-defensin expression[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(23): 12723-12728. DOI:10.1073/pnas.220424597 |
| [31] |
MAO X B, QI S, YU B, et al. Zn2+ and L-isoleucine induce the expressions of porcine β-defensins in IPEC-J2 cells[J]. Molecular Biology Reports, 2013, 40(2): 1547-1552. DOI:10.1007/s11033-012-2200-0 |
| [32] |
任曼, 吕照勇, 史凯, 等. 异亮氨酸对大鼠空肠形态和抗菌肽表达的影响[J]. 安徽科技学院学报, 2016, 30(4): 6-10. DOI:10.3969/j.issn.1673-8772.2016.04.002 |
| [33] |
RIVAS-SANTIAGO C E, RIVAS-SANTIAGO B, LEÍN D A, et al. Induction of β-defensins by L-isoleucine as novel immunotherapy in experimental murine tuberculosis[J]. Clinical & Experimental Immunology, 2011, 164(1): 80-89. |
| [34] |
REN M, ZHANG S H, LIU X T, et al. Different lipopolysaccharide branched-chain amino acids modulate porcine intestinal endogenous β-defensin expression through the Sirt1/ERK/90RSK pathway[J]. Journal of Agricultural and Food Chemistry, 2016, 64(17): 3371-3379. DOI:10.1021/acs.jafc.6b00968 |
| [35] |
CHEN K, JIANG W D, WU P, et al. Effect of dietary phosphorus deficiency on the growth, immune function and structural integrity of head kidney, spleen and skin in young grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology, 2017, 63: 103-126. |
| [36] |
SECOMBES C J, WANG T, HONG S, et al. Cytokines and innate immunity of fish[J]. Developmental & Comparative Immunology, 2001, 25(8/9): 713-723. |
| [37] |
WEICHHART T, COSTANTINO G, POGLITSCH M, et al. The TSC-mTOR signaling pathway regulates the innate inflammatory response[J]. Immunity, 2008, 29(4): 565-577. DOI:10.1016/j.immuni.2008.08.012 |
| [38] |
RYU J M, LEE M Y, YUN S P, et al. High glucose regulates cyclin D1/E of human mesenchymal stem cells through TGF-β1 expression via Ca2+/PKC/MAPKs and PI3K/Akt/mTOR signal pathways[J]. Journal of Cellular Physiology, 2010, 224(1): 59-70. |
| [39] |
CHEEKATLA S S, AGGARWAL A, NAIK S. mTOR signaling pathway regulates the IL-12/IL-10 axis in Leishmania donovani infection[J]. Medical Microbiology and Immunology, 2012, 201(1): 37-46. DOI:10.1007/s00430-011-0202-5 |
| [40] |
BROQUET A H, HIRATA Y, MCALLISTER C S, et al. RIG-I/MDA5/MAVS are required to signal a protective IFN response in rotavirus-infected intestinal epithelium[J]. Journal of Immunology, 2011, 186(3): 1618-1626. DOI:10.4049/jimmunol.1002862 |
| [41] |
AKIRA S, TAKEDA K. Toll-like receptor signalling[J]. Nature Reviews Immunology, 2004, 4(7): 499-511. DOI:10.1038/nri1391 |
| [42] |
MAO X B, GU C S, REN M, et al. L-isoleucine administration alleviates rotavirus infection and immune response in the weaned piglet model[J]. Frontiers in Immunology, 2018, 9: 1654. DOI:10.3389/fimmu.2018.01654 |




