大豆蛋白是人类和畜禽生活中重要的食用蛋白质原料,其中β-伴大豆球蛋白(β-conglycinin)含量约占大豆蛋白含量的30%,是影响大豆蛋白营养品质的重要成分[1]。β-伴大豆球蛋白在食入体内后大部分会被利用吸收,但由于小部分具有抗原性及热稳定性,能使大鼠、犊牛、断奶仔猪等幼龄动物产生致敏作用,造成动物腹泻、生长速度迟缓,严重情况甚至可致死亡。因此,国内外许多学者对β-伴大豆球蛋白开展了系统深入地研究[2-6]。肠道中大豆致敏原抗原表位是引起动物过敏的基本物质基础,也是造成动物对大豆蛋白过敏差异的原因之一[7]。国内学者采用免疫组化将一些可显色的化学物质标记到抗体上,运用免疫学原理中抗原和抗体间的特异性结合反应,检测细胞或组织中是否存在目标抗原。目前许多研究者开展了猪肠道的相关试验,You等[8]用荧光标记的单克隆抗体检测到β-伴大豆球蛋白可与仔猪的十二指肠、空肠和回肠上皮细胞结合,推测小肠上皮细胞中可能存在与大豆β-伴大豆球蛋白相结合的受体,且理论上推断是细胞膜受体。强嘉楠[9]的试验中也初步得出,同一抗原表位与不同肠段结合蛋白存在差异,发现了β-伴大豆球蛋白在猪体内的消化降解及肠道分布规律,预测了大豆抗原蛋白对仔猪的致敏作用及相关机制,同时预测了β-伴大豆球蛋白线性表位等相关结果。
但是β-伴大豆球蛋白对大鼠的致敏原因以及抗原的吸收转运机理尚不清楚。因此,本试验就大鼠肠上皮细胞与大豆抗原β-伴大豆球蛋白结合受体的表达量及分布情况进行了分析,初步得出结合抗原蛋白的多少以及引起机体过敏的原因,为日后进一步揭示大豆抗原过敏机理,同时提高动物对大豆蛋白的吸收利用提供理论参考。
1 材料与方法 1.1 试验动物与试验设计选取12只21日龄SD雄性大鼠,随机分为2组(对照组和致敏组),每组6个重复,每个重复1只。各组分笼饲养,自由采食和饮水,鼠笼垫料每周更换1次,每天固定10:00给水给料。预饲喂3 d后进入正式试验期,试验期21 d。致敏组大鼠在第1、2、3天连续灌胃0.2 mL 50 mg/mL的β-伴大豆球蛋白,对照组大鼠灌胃等体积生理盐水;致敏组大鼠在第14天灌胃0.2 mL 50 mg/mL的β-伴大豆球蛋白进行攻击,对照组大鼠灌胃等体积生理盐水;致敏组大鼠在第21天灌胃0.2 mL 100 mg/mL的β-伴大豆球蛋白进行激发,对照组大鼠灌胃等体积生理盐水。
1.2 试验饲粮β-伴大豆球蛋白的纯化参考Zhao等[10]进行分离纯化,得到高纯度β-伴大豆球蛋白,大豆样品由吉林农业大学动物营养研究室提供。断奶大鼠饲粮由南通特洛菲饲料科技有限公司供给,型号为LAD3001G AIN93G标准饲粮,为棒状配合饲料,不含有任何豆科成分,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
在试验第21天灌胃后3 h后进行皮试,确认致敏后乙醚处死,进行心脏取血,将采集到的血液3 000 r/min离心15 min,分离血清,于-80 ℃保存。取血后,打开腹腔,迅速取出十二指肠、空肠前段、空肠中段、空肠后段、回肠各5 cm,用生理盐水冲洗后浸入4%多聚甲醛瓶中,-4 ℃保存待测。
主要抗原表位肽段选取对大鼠致敏血清的结合能力较强的2个氨基酸序列,参考强嘉楠[9]表位肽的合成,最后选取β-伴大豆球蛋白α亚基的表位区域α2(SPQLQNLR)和β-伴大豆球蛋白β亚基的表位区域β4(FFEITPEK),由北京华大蛋白公司合成纯度大于90%的短肽。
1.4 免疫组化法检测大鼠肠上皮与β-伴大豆球蛋白抗原结合受体蛋白的分布取新鲜的致敏组和对照组动物组织样品制作石蜡切片,并用梯度酒精进行固定和包埋得到组织块,然后进行切片烘烤过夜,再用梯度酒精脱蜡入水。在切片上分别滴加β-伴大豆球蛋白、α2和β4表位致敏肽段,室温20 min后滴加山羊血清封闭液,滴加大鼠抗β-伴大豆球蛋白免疫球蛋白G(IgG)抗体,4 ℃过夜将生物素标记的山羊抗大鼠IgG-辣根过氧化物酶(HRP)抗体(北京康为世纪生物科技有限公司)加入放在37 ℃下20 min,继续滴加辣根酶标记的链霉卵白素工作液,并使用二氨基联苯胺(DAB)显色试剂盒显色;接着用苏木素染液复染,再进行水洗、分化、反蓝、脱水、封片,在显微镜下观察切片选择肠上皮绒毛视野进行拍照,保存图像,并用ImagePro Plus 5.0软件对免疫组化图像进行积累光密度(IOD)值测定。
1.5 统计分析数据均用SPSS 20.0进行单因素方差分析,对照组和致敏组的数值采用t检验进行组间差异显著性检验,每个组之间的5个肠段的数值采用Duncan氏多重比较法进行差异显著性检验,以P<0.05作为差异显著性判断标准,各组内不同肠段趋势分析以P<0.05作为差异显著性判断标准。
2 结果 2.1 β-伴大豆球蛋白与大鼠小肠不同部位结合蛋白的免疫组化结果如图 1、图 2所示,对照组β-伴大豆球蛋白结合蛋白的含量呈下降趋势;致敏组β-伴大豆球蛋白结合蛋白的含量呈先下降再上升再下降再上升的倒N形趋势,在空肠前段和空肠后段出现拐点,β-伴大豆球蛋白结合蛋白的含量在回肠为最低点。对照组的空肠前段β-伴大豆球蛋白结合蛋白的含量与致敏组存在显著性差异(P < 0.05)。β-伴大豆球蛋白结合蛋白在十二指肠分布较多,回肠分布相对较少。对照组的十二指肠和空肠前段β-伴大豆球蛋白结合蛋白的含量显著高于空肠中段、空肠后段和回肠(P < 0.05),致敏组的十二指肠β-伴大豆球蛋白结合蛋白的含量显著高于空肠前段、空肠中段、空肠后段和回肠(P < 0.05)。
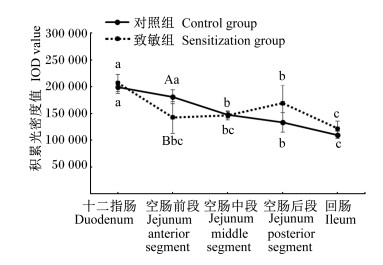
|
折线上标不同小写字母表示对照组中不同肠段间显著差异(P < 0.05),折线下标不同小写字母表示致敏组中不同肠段间显著差异(P < 0.05);不同大写字母表示同一肠段对照组与致敏组显著差异(P < 0.05)。下图同。 Values with different small letters above the broken line mean significant difference among different intestinal segments in the control group (P < 0.05), with different small letters below the broken line mean significant difference among different intestinal segments in the sensitization group (P < 0.05), and with different capital letters mean significant difference in the same intestinal segment between control group and sensitization group (P < 0.05). The same as below. 图 1 β-伴大豆球蛋白与大鼠小肠不同部位结合蛋白的免疫组化积累光密度结果 Fig. 1 Immunohistochemical integrated optical density results of β-conglycinin with binding protein in different parts of small intestine of rats |
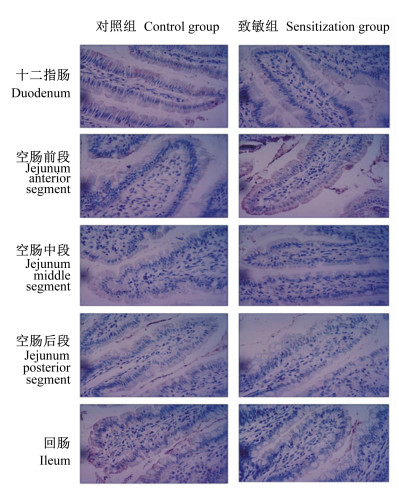
|
图 2 β-伴大豆球蛋白与大鼠小肠不同部位结合蛋白的免疫组化结果 Fig. 2 Immunohistochemical results of β-conglycinin with binding protein in different parts of small intestine of rats (40×) |
如图 3、图 4所示,不同于β-伴大豆球蛋白结合蛋白的含量趋势,对照组和致敏组α2抗原表位结合蛋白的含量同呈下降趋势,并且未出现拐点。对照组的空肠后段和回肠α2抗原表位结合蛋白的含量与致敏组存在显著性差异(P < 0.05)。α2抗原表位结合蛋白主要分布在十二指肠、空肠前段、空肠中段,空肠后段和回肠分布较少。对照组的十二指肠和空肠前段α2抗原表位结合蛋白的含量显著高于空肠中段、空肠后段和回肠(P < 0.05);致敏组的十二指肠α2抗原表位结合蛋白的含量显著高于空肠前段、空肠中段、空肠后段和回肠(P < 0.05)。
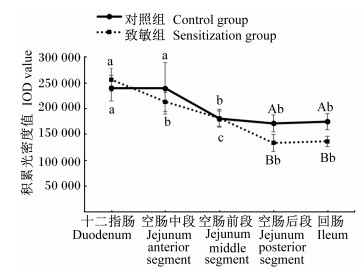
|
图 3 α2抗原表位与大鼠小肠不同部位结合蛋白的免疫组化积累光密度结果 Fig. 3 Immunohistochemical integrated optical density results of α2 antigen epitope with binding protein in different parts of small intestine of rats |
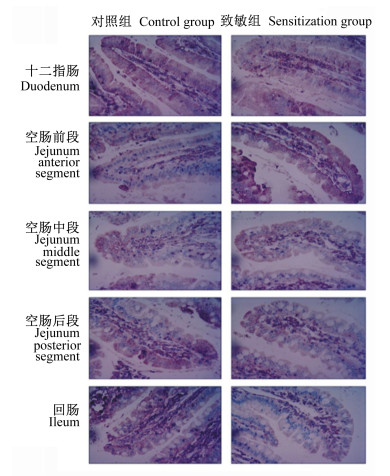
|
图 4 α2抗原表位与大鼠小肠不同部位结合蛋白的免疫组化结果 Fig. 4 Immunohistochemical results of α2 antigen epitope with binding protein in different parts of small intestine of rats (40×) |
如图 5、图 6所示,不同肠段β4抗原表位结合蛋白的含量趋势与α2相同,对照组与致敏组也呈持续下降趋势。对照组的十二指肠和空肠后段β4抗原表位结合蛋白的含量与对照组存在显著性差异(P < 0.05)。β4抗原表位结合蛋白同样大多分布在十二指肠、空肠前段、空肠中段,空肠后段及回肠分布相对较少。对照组和致敏组的十二指肠、空肠前段和空肠中段β4抗原表位结合蛋白的含量显著高于空肠后段和回肠(P < 0.05)。
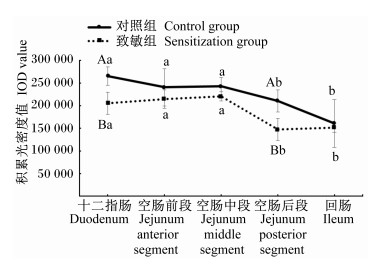
|
图 5 β4抗原表位与大鼠小肠不同部位结合蛋白的免疫组化积累光密度结果 Fig. 5 Immunohistochemical integrated optical density results of β4 antigen epitope with binding protein in different parts of small intestine of rats |
|
图 6 β4抗原表位与大鼠小肠不同部位结合蛋白的免疫组化结果 Fig. 6 Immunohistochemical results of β4 antigen epitope with binding protein in different parts of small intestine of rats (40×) |
本试验采用了免疫组化方法对β-伴大豆球蛋白抗原表位与大鼠小肠上皮结合的受体蛋白进行定位,并运用统计学分析的方法比较了大鼠小肠的十二指肠、空肠前段、空肠中段、空肠后段和回肠的差异。结果表明,对照组和致敏组均有β-伴大豆球蛋白主要抗原表位结合的受体蛋白,由此可说明大鼠小肠上皮黏膜存在着可以与β-伴大豆球蛋白及重要抗原表位结合的受体蛋白。
β-伴大豆球蛋白免疫组化结果表明,大鼠小肠上皮黏膜与β-伴大豆球蛋白结合蛋白主要分布在十二指肠,回肠分布最少。这与Zhao等[10]发现的β-伴大豆球蛋白随着仔猪消化道而免疫活性逐渐下降的趋势相似,以及鲍男[11]研究表明仔猪十二指肠的β-伴大豆球蛋白积累光密度值最高相同。结果体现在对照组的十二指肠和空肠前段β-伴大豆球蛋白结合蛋白的含量显著高于空肠中段、空肠后段和回肠。在大鼠小肠上皮黏膜细胞与β-伴大豆球蛋白结合的情况下,致敏组的十二指肠的β-伴大豆球蛋白积累光密度值高对照组,推测十二指肠中本身是存在着与β-伴大豆球蛋白相结合的受体,并在灌胃大豆粉纯品后产生了新的与β-伴大豆球蛋白相结合的受体。
2个肽段结合组结果表明,大鼠小肠上皮与α2抗原表位和β4抗原表位结合的受体蛋白主要分布在十二指肠和空肠前段,空肠中段、空肠后段、回肠分布相对较少。这与强嘉楠[9]仔猪肠上皮不同肠段与α2抗原表位结合蛋白呈Ⅴ型,空肠中段肠上皮黏膜结合的受体蛋白含量最少明显相反。由此可推测,大鼠与仔猪在对于α2抗原表位结合的受体蛋白存在差异,可能是由于大鼠在十二指肠中存在着有较强能力结合的受体蛋白,与猪等单胃动物消化道结构存在差异。在众多研究中发现,鼠具有比猪更为成熟的细胞系。研究表明,SD大鼠肠黏膜免疫屏障是是由肠道内所有的免疫细胞对肠道进行保护,其中尤为重要的是肠道肠相关淋巴组织(gut-associated lymphatic tissue, GALT),皮尔结节存在于肠黏膜上皮及固有层淋巴细胞、肠系膜淋巴结等[12]。在本试验中,大鼠在激发前进行过多次致敏攻击,猜测大鼠肠道在多次的致敏攻击下产生了口服耐受。而且幼龄大鼠的免疫机制尚未发育完全,在经过多次β-伴大豆球蛋白致敏后,推测大鼠上皮细胞逐渐对β-伴大豆球蛋白形成了一定的免疫功能,致使致敏组β-伴大豆球蛋白及主要抗原表位与小肠上皮黏膜的结合蛋白含量普遍低于对照组。
此外树突细胞分布在淋巴结中具有处理抗原的能力,Sun等[13]试验得出,灌胃β-伴大豆球蛋白可刺激小鼠肠黏膜发生变态反应,使小鼠组胺含量升高来反映出肥大细胞脱粒,同时小鼠固有层存在大量淋巴细胞浸润,刺激小肠黏膜免疫球蛋白E(IgE)的分泌量显著增加。这说明在饲喂含有豆粕类的饲粮后,大鼠小肠中十二指肠到回肠受体含量呈递减趋势,可推测在十二指肠中树突状细胞和绒毛上皮细胞分布最多,结合的受体蛋白最多,所以十二指肠是引起大鼠过敏的重要部位。Liu等[14]研究得出,大鼠在热应激后回肠的免疫球蛋白A(IgA)表达量下降,黏膜免疫功能降低。但是检测到回肠淋巴组织处的树突状细胞抗原递呈功能并未发生显著变化,但树突状细胞分泌的表达量下降影响了细胞辅助细胞的分化,使回肠的体液免疫和细胞免疫功能下降。所以可推测树突状细胞分泌的表达量减少是回肠结合受体含量减少的主要因素。
本试验通过β-伴大豆球蛋白及其主要抗原表位与大鼠小肠上皮黏膜蛋白结合进行了比较,发现了β-伴大豆球蛋白可以与大鼠小肠上皮黏膜蛋白进行结合,运用免疫组化分方法以及积累光密度值的测定,并用软件分析得出了5个肠段间的结合受体含量都呈下降趋势。根据所查阅文献猜测是SD大鼠小肠上皮细胞膜中的树突状细胞的抗原递呈功能变化导致小肠的免疫功能增加,但对β-伴大豆球蛋白与肠道上皮发生作用的抗原受体尚不清楚,有待进一步研究。
4 结论十二指肠β-伴大豆球蛋白、α2和β4抗原表位结合蛋白的含量最多,空肠后段和回肠较少。致敏组β-伴大豆球蛋白、α2和β4抗原表位结合蛋白的含量普遍低于对照组。
| [1] |
NISHINARI K, FANG Y, GUO S, et al. Soy proteins:a review on composition, aggregation and emulsification[J]. Food Hydrocolloids, 2014, 39: 301-318. DOI:10.1016/j.foodhyd.2014.01.013 |
| [2] |
FU C J, JEZ J M, KERLEY M S, et al. Identification, characterization, epitope mapping, and three-dimensional modeling of the α-subunit of β-conglycinin of soybean, a potential allergen for young pigs[J]. Journal of Agricultural and Food Chemistry, 2007, 55(10): 4014-4020. DOI:10.1021/jf070211o |
| [3] |
ZHENG S G, QIN G X, TIAN H, et al. Role of soybean β-conglycinin subunits as potential dietary allergens in piglets[J]. The Veterinary Journal, 2014, 199(3): 434-438. DOI:10.1016/j.tvjl.2013.11.020 |
| [4] |
GUO P F, PIAO X S, OU D Y, et al. Characterization of the antigenic specificity of soybean protein β-conglycinin and its effects on growth and immune function in rats[J]. Archives of Animal Nutrition, 2007, 61(3): 189-200. DOI:10.1080/17450390701318358 |
| [5] |
李宝, 李玉, 马良友, 等. 大豆抗原蛋白对断奶仔猪细胞因子及肠上皮紧密连接蛋白Claudin-1 mRNA表达的影响[J]. 中国兽医学报, 2015, 35(9): 1511-1517. |
| [6] |
宋青龙, 袁翔, 张海燕, 等. 大豆球蛋白的抗营养作用及检测技术研究进展[J]. 动物营养学报, 2017, 29(12): 4260-4265. DOI:10.3969/j.issn.1006-267x.2017.12.003 |
| [7] |
TALIERCIO E, LOVELESS T M, TURANO M J, et al. Identification of epitopes of the β subunit of soybean β-conglycinin that are antigenic in pigs, dogs, rabbits and fish[J]. Journal of the Science of Food and Agriculture, 2014, 94(11): 2289-2294. DOI:10.1002/jsfa.2014.94.issue-11 |
| [8] |
YOU J M, LI D F, QIAO S Y, et al. Development of a monoclonal antibody-based competitive ELISA for detection of β-conglycinin, an allergen from soybean[J]. Food Chemistry, 2008, 106(1): 352-360. DOI:10.1016/j.foodchem.2007.05.040 |
| [9] |
强嘉楠.大豆β-Conglycinin及其主要抗原表位与仔猪肠上皮结合蛋白的分布规律与鉴定的研究[D].硕士学位论文.长春: 吉林农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10193-1019811444.htm
|
| [10] |
ZHAO Y, QIN G X, SUN Z W, et al. Disappearance of immunoreactive glycinin and β-conglycinin in the digestive tract of piglets[J]. Archives of Animal Nutrition, 2008, 62(4): 322-330. DOI:10.1080/17450390802190318 |
| [11] |
鲍男.大豆抗原在仔猪小肠组织中分布规律的研究[D].硕士学位论文.长春: 吉林农业大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10193-2007216888.htm
|
| [12] |
马莉.IgA肾病大鼠肠黏膜免疫细胞的变化及大黄酸的调节作用[D].硕士学位论文.南昌: 南昌大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10403-1016236711.htm
|
| [13] |
SUN H, LIU X, WANG Y Z, et al. Allergen-specific immunoglobulin, histamine and T-cell responses induced by soybean glycinin and β-conglycinin in BALB/c mice of oral sensitisation[J]. Food and Agricultural Immunology, 2013, 24(4): 489-501. DOI:10.1080/09540105.2012.730501 |
| [14] |
LIU X X, LI H R, LU A, et al. Reduction of intestinal mucosal immune function in heat-stressed rats and bacterial translocation[J]. International Journal of Hyperthermia, 2012, 28(8): 756-765. DOI:10.3109/02656736.2012.729173 |




