2. 深圳市金新农科技股份有限公司, 深圳 518106;
3. 珠海市现代农业发展中心, 珠海 519000
2. Shenzhen Kingsino Technology Co., Ltd., Shenzhen 518106, China;
3. Zhuhai Modern Agricultural Development Center, Zhuhai 519000, China
断奶仔猪的应激是生产中经常遇到的问题,会造成仔猪采食量下降,生长缓慢。所以在断奶仔猪中经常会添加诱食剂。常见的诱食剂有甜味剂和酸味剂,猪偏爱的甜味剂主要有葡萄糖和蔗糖,但是糖在自然界中主要以多糖的形式存在,单糖和双糖的提取耗时耗力。所以我们需要寻找新的甜味剂。
目前低聚糖作为饲料添加剂的研究与应用日益深入与广泛。有人将低聚糖按照一定比例添加进犊牛和猪饲粮中,结果发现可以很明显地降低胃肠道疾病的发生,并且还能提高其生长性能[1]。还有研究发现功能性低聚糖能明显促进仔猪肠道乳酸菌的多样性[2]。李桂伶[3]通过研究发现半乳甘露聚糖添加到犬的饲粮中,能提高犬对营养物质的消化吸收效率。低聚异麦芽糖作为常见的低聚糖之一,主要的生产方法是以淀粉为原料,采用淀粉酶系多酶协同法转化淀粉得到,其甜度是蔗糖的40%~50%[4]。研究发现猪饲粮中添加低聚异麦芽糖能提高其平均日增重(ADG)和平均日采食量(ADFI),降低料重比(F/G)和腹泻率[5-6], 有助于仔猪肠道发育[7]。
本试验所用大米提取复合糖是以大米为原料,采用膜分离技术,通过定向限制性酶解和喷雾干燥工艺对大米进行粗提得到的各类糖复合物,其中低聚糖含量为60.8%、多糖含量为37.1%、单糖含量为2.1%,低聚糖以低聚异麦芽糖为主,单糖主要是葡萄糖。大米复合糖提取工艺如下:大米→磨浆→调浆(CaCl2、α-淀粉酶、高温酶解)→喷射液化(10级串联连续液化,真空闪蒸技术)→调酸灭酶→糖化(β-淀粉酶、真菌α-淀粉酶)→转苷(α-葡萄糖苷酶)→灭酶→过滤→脱色(活性炭)→膜分离(去除大部分单糖)→离子交换→真空浓缩→喷雾干燥。
虽然关于低聚异麦芽糖对猪生长性能的研究不少,但是在无诱食剂条件下低聚异麦芽糖的作用还未见报道。所以本试验旨在研究以低聚异麦芽糖为主、多糖为辅的大米提取复合糖在无诱食剂条件下对断奶仔猪生长性能的影响,并从肠道形态、结构和免疫功能等角度分析其作用机理,为大米提取复合糖在断奶仔猪饲粮中的应用提供更全面的数据基础。
1 材料与方法 1.1 试验设计试验选取160头(26±2)日龄、体况相近、健康状况良好的断奶仔猪,随机分为5个组,每组4个重复,公母各占1/2,分栏饲养,每个重复8头猪。A组饲喂标准饲粮,B组饲喂基础饲粮(标准饲粮中去除甜味剂、香味剂、葡萄糖、蔗糖),C组饲喂标准饲粮+3%大米提取复合糖,D组饲喂基础饲粮+3%大米提取复合糖,E组饲喂基础饲粮+5%大米提取复合糖。试验预试期5 d,正式试验期30 d。试验结束后从每个重复随机选取1头仔猪采集样品。试验过程中,自由采食、自由饮水,免疫及管理均严格按照试验猪场规程执行。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of trial diets (air-dry basis) |
试验最后3 d时,每个重复随机采集粪便,10% HCl固氮,65 ℃烘箱中烘至恒重,制成风干样品。
1.2.2 血样采集试验结束后从每个重复中随机选择1头仔猪屠宰,采集静脉血,分离血清,-20 ℃保存,用于测定血清总抗氧化能力(T-AOC)以及免疫球蛋白G(IgG)含量。
1.2.3 回肠黏膜和组织样采集采集相同位置的回肠肠段,刮取肠黏膜,加入等体积的磷酸盐缓冲液(PBS)(pH为7.4)混匀,6 000 r/min离心15 min,取上清并放入-20 ℃冰箱保存,用于测定肠道中分泌性免疫球蛋白A(SIgA)含量;取2段1 cm×1 cm回肠样品,1段用磷酸盐缓冲液(PBS)清洗后,放入10%福尔马林保存,用于制作切片,另一段置于液氮保存,用于紧密连接相关功能基因mRNA表达量的测定。
1.3 检测指标 1.3.1 生长性能指标测定试验过程中,记录采食量、增重以及腹泻仔猪数,结束后计算ADFI、ADG、F/G以及腹泻率。
1.3.2 养分表观消化率测定饲粮和粪便中养分含量依照《饲料中水分和其他挥发性物质含量的测定》(GB/T 6435—2006)、《饲料中粗蛋白测定方法》(GB/T 6432—1994)和《饲料中粗脂肪的测定》(GB/T 6433—2006)进行测定。养分表观消化率采用酸不溶灰分法测定。
1.3.3 免疫球蛋白含量测定免疫球蛋白含量采用酶联免疫吸附测定(ELISA)法进行测定。
1.3.4 肠道形态检测回肠肠道组织采用苏木精-伊红染色法制作成切片后,在显微镜下观察组织形态,并用Leica Qwin图像分析系统进行分析。
1.3.5 回肠紧密连接相关功能基因mRNA表达量测定 1.3.5.1 引物的设计和合成所用引物参照GenBank登录核酸序列,采用Oligo 7软件设计,由上海生物工程有限公司合成。引物序列见表 2。
|
|
表 2 引物序列 Table 2 Primer sequences |
按照OMEGA公司的Total RNA Kit Ⅱ R6934和M-MLV Frist Strand cDNA Synthesis Kit TQ2501试剂盒说明书进行总RNA的提取和反转录。
1.3.5.3 荧光定量PCR反应体系如表 3所示。
|
|
表 3 荧光定量PCR反应体系 Table 3 Fluorescence quantitative PCR reaction system |
荧光定量PCR程序如下:95 ℃预变性1 min;变性95 ℃,15 s;退火57~61 ℃,30 s;延伸读板72 ℃,45 s,40个循环;变性95 ℃,60 s;退火58~61 ℃,30 s;延伸读板95 ℃,30 s。
1.3.6 血清中总抗氧化能力(T-AOC)的测定严格按照南京建成生物工程研究所的T-AOC试剂盒说明书进行测定。
1.4 数据统计分析试验数据用SPSS 18.0软件统计分析,LSD法进行多重比较,结果用平均值±标准误(mean±SE)表示,结果中以0.05≤P < 0.10为差异显著性趋势, P < 0.05为差异显著性判断标准。
2 结果与分析 2.1 大米提取复合糖对断奶仔猪生长性能的影响由表 4可知,与A组相比,B组的ADG、ADFI差异均不显著(P>0.05),C组的ADG、ADFI分别提高了45.10%、35.56%(P<0.05);与B组相比,D组的ADG、ADFI和F/G差异均不显著(P>0.05),E组的ADG、ADFI分别提高了69.15%、29.60%(P<0.05),F/G降低了16.39%(P<0.05)。各组仔猪都没有腹泻的情况发生。
|
|
表 4 大米提取复合糖对断奶仔猪生长性能的影响 Table 4 Effects of rice extracting complex sugar on growth performance of weaned piglets |
由表 5可知,与A组相比,B组的粗蛋白质表观消化率降低了16.61%(P<0.05),C组的粗蛋白质表观消化率提高了5.91%(P=0.069);与B组相比,D组的养分表观消化率无显著差异(P>0.05),E组干物质、粗蛋白质和粗脂肪表观消化率分别提高了21.67%、47.27%、68.38%(P<0.05)。
|
|
表 5 大米提取复合糖对断奶仔猪养分表观消化率的影响 Table 5 Effects of rice extracting complex sugar on nutrient apparent digestibility of weaned piglets |
由表 6可知,与A组相比,B组的隐窝深度显著提高(P<0.05),绒毛高度/隐窝深度有降低的趋势(P=0.073),C组的绒毛高度和绒毛高度/隐窝深度显著提高(P<0.05);与B组相比,D组的绒毛高度、隐窝深度差异不显著(P>0.05),绒毛高度/隐窝深度有提高的趋势(P=0.053),E组的绒毛高度/隐窝深度显著提高(P<0.05)。
|
|
表 6 大米提取复合糖对断奶仔猪回肠肠道形态的影响 Table 6 Effects of rice extracting complex sugar on ileum intestinal morphology of weaned piglets |
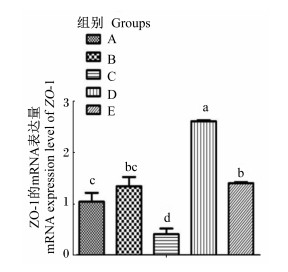
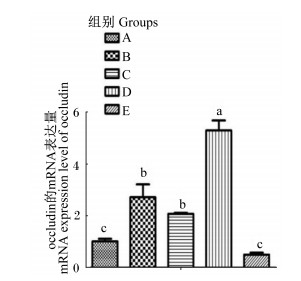
图 1、图 2显示,与A组相比,B组occludin的mRNA表达量显著提高(P<0.05),C组ZO-1的mRNA表达量显著下降(P<0.05),occludin的mRNA表达量显著提高(P<0.05);与B组相比,D组ZO-1和occludin的mRNA表达量显著提高(P<0.05),E组ZO-1的mRNA表达量有提高的趋势(P=0.075),occludin的mRNA表达量显著下降(P<0.05)。
|
数据柱标注不同字母表示差异显著(P < 0.05)。下图同。 Data column with different letter superscripts mean significant difference (P < 0.05). The same as below. 图 1 ZO-1的mRNA表达量 Fig. 1 mRNA expression level of ZO-1 |
|
图 2 occludin的mRNA表达量 Fig. 2 mRNA expression level of occludin |
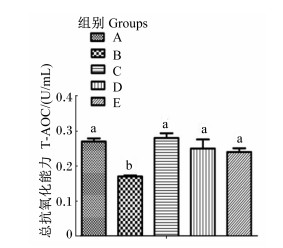
由图 3可知,与A组相比,B组的血清T-AOC显著降低(P<0.05),C组的血清T-AOC无显著差异(P>0.05);与B组相比,D组和E组的血清T-AOC显著提高(P<0.05)。
|
图 3 血清总抗氧化能力 Fig. 3 Serum total antioxidant capacity |
由表 7可知,5个组之间的回肠黏膜SIgA和血清IgG含量无显著差异(P>0.05)。
|
|
表 7 大米提取复合糖对断奶仔猪免疫球蛋白含量的影响 Table 7 Effects of rice extracting complex sugar on immunoglobulin contents of weaned piglets |
本次试验发现,标准饲粮中添加3%大米提取复合糖和基础饲粮中添加5%复合糖都能显著提高断奶仔猪的生长性能,基础饲粮中添加3%大米复合糖能提高仔猪的生长性能,但是没有显著效果,这与罗丽萍等[6]的研究结果一致,说明断奶仔猪饲粮中添加低聚异麦芽糖能够提高动物的生长性能。
3.2 大米提取复合糖对断奶仔猪养分表观消化率的影响营养物质的消化率可以直观地反映出机体消化系统的状况,间接地反映机体的生长发育情况。目前关于低聚异麦芽糖对营养物质养分消化率的研究鲜见报道。但是有研究发现,在肉鸡饲粮中添加一定比例的大豆低聚糖能不同程度地提高肉鸡的粗蛋白质消化率[8]。在断奶仔猪饲粮中添加低聚木糖能提高营养物质的消化率[9]。本试验中,5个组之间粗灰分消化率没有显著差异,这说明复合糖对仔猪矿物质等无机物的吸收利用无关。基础饲粮中添加5%大米提取复合糖能够显著提高干物质、粗蛋白质和粗脂肪消化率,这和上面提到过的生长性能的趋势基本一致,也与前人关于低聚糖的研究结果一致。添加大米提取复合糖的量高于其他组导致其对营养物质的消化利用率显著高于其他组,最终生长性能和饲粮利用率也高于其他组,说明低聚异麦芽糖能够通过提高营养物质的养分消化率来提高断奶仔猪的生长性能。
3.3 大米提取复合糖对断奶仔猪肠道健康的影响肠道绒毛高度与隐窝深度以及二者比值能够从一定程度上反映机体肠道健康状况[10]。仔猪断奶后前2天会产生断奶应激,肠道绒毛变短[11],隐窝变深[12-13]。研究发现,断奶前仔猪饲粮中添加果寡糖能够显著增加其空肠、回肠中绒毛高度/隐窝深度[14]。刘雪兰等[7]发现在仔猪饲粮中添加低聚异麦芽糖能够促进小肠绒毛生长,保证小肠组织结构的完整性。本试验中,饲喂基础饲粮增加了仔猪隐窝深度,降低了绒毛高度/隐窝深度,可能是因为供能不足引起的肠道发育不完善。添加大米提取物复合糖提高了仔猪绒毛高度和绒毛高度/隐窝深度,降低了隐窝深度,与前人的研究结果一致。推测是因为复合糖在小肠后段发酵,提高了该肠段中挥发性脂肪酸(VFA)的浓度,促进了肠上皮细胞的增殖与生长。VFA特别是丁酸,能够促进肠上皮细胞的增殖与生长,促进肠道形态的发育和完整性[15]。
完整的屏障功能是仔猪肠道健康的重要基础,良好的紧密连接结构是肠道发挥物理屏障功能的前提。仔猪断奶应激会引起肠上皮细胞间紧密连接蛋白occludin的mRNA表达量下降,导致肠道通透性增加,屏障功能降低[16]。在断奶仔猪饲粮中添加壳聚糖或壳寡糖后,可以提高小肠紧密连接蛋白的蛋白和mRNA表达量[17]。本试验中,基础饲粮中添加3%大米提取复合糖增加了紧密连接蛋白的mRNA相对表达量,添加5%大米提取复合糖反而降低了紧密连接蛋白的mRNA相对表达量,标准饲粮中添加大米提取复合糖降低了ZO-1的mRNA表达量,增加了occludin的mRNA表达量,而且发现基础饲粮组的紧密连接蛋白的mRNA表达量高于标准饲粮组,所以低剂量的低聚异麦芽糖有助于肠道物理屏障的增强。
3.4 大米提取复合糖对断奶仔猪免疫功能的影响断奶会引起仔猪氧化应激[18]。仔猪饲粮中添加低聚果糖能显著提高仔猪血清中抗氧化酶的活性,并且有效降低过氧化物代谢产物丙二醛(MDA)的含量[19],最终提高机体的抗氧化能力。白术多糖对过氧化氢(H2O2)诱导的IEC-6细胞损伤具有显著的保护作用[20]。本次试验中,标准饲粮组和添加大米提取复合糖组相比基础饲粮组血清T-AOC均显著升高,在标准饲粮的基础上添加大米提取复合糖相比其他组血清T-AOC在数值上都有提高,这与前人的结果一致。基础饲粮组血清T-AOC最低,主要是因为剔除了标准饲粮中的糖类,导致饲粮结构的不平衡。
众多学者的研究发现,植物提取多糖参与了动物机体的免疫调节,可以激活体内免疫淋巴细胞[21]、巨噬细胞[22]、自然杀伤(NK)细胞等免疫细胞[23]、促进多种细胞因子的释放[24]。饲料中添加0.2%~0.8%低聚异麦芽糖的产蛋鸡血浆中IgG和免疫球蛋白A(IgA)的含量都显著提高[25]。贺琴[26]发现酵母壁多糖能够提高断奶仔猪血清IgG含量。本次试验结果显示,5个组之间的回肠黏膜SIgA和血清IgG含量均无显著差异,趋势也不明显,这与前人的研究结果不一致,可能的原因是试验动物不同或者使用的低聚糖的种类不同。
4 结论断奶仔猪饲粮中添加大米提取复合糖可以通过提高养分消化吸收、抗氧化能力和肠道屏障等途径实现对仔猪生长性能的改善。
| [1] |
周贞兵, 夏中生. 功能性低聚糖在饲料添加剂中的应用[J]. 湖南环境生物职业技术学院学报, 2001, 7(2): 6-10. DOI:10.3969/j.issn.1671-6361.2001.02.002 |
| [2] |
侯振平, 张平, 张军, 等. 半乳甘露寡糖对断奶仔猪肠道微生物多样性的影响[J]. 中国科学院研究生院学报, 2008, 25(3): 413-418. |
| [3] |
李桂伶. 半乳甘露寡糖对犬营养消化率和肠道主要菌群的影响[J]. 饲料广角, 2011(16): 30-32. DOI:10.3969/j.issn.1002-8358.2011.16.016 |
| [4] |
李孟伟, 陈清华. 低聚异麦芽糖的生产工艺及其在仔猪生产中的应用研究[J]. 湖南饲料, 2014(6): 25-28. DOI:10.3969/j.issn.1673-7539.2014.06.014 |
| [5] |
赵静杰, 李小成, 王景儒. 低聚糖对断奶仔猪生产性能的影响[J]. 粮食与饲料工业, 2008(1): 34-35. DOI:10.3969/j.issn.1003-6202.2008.01.015 |
| [6] |
罗丽萍, 蒋振南, 覃秀华, 等. 低聚异麦芽糖对保育猪生长性能及经济效益的影响[J]. 养猪, 2013(3): 7-8. |
| [7] |
刘雪兰, 谢幼梅, 韩绍忠, 等. 异麦芽低聚糖对断奶仔猪肠道菌群及腹泻的影响[J]. 中国畜牧杂志, 2003, 39(5): 24-26. DOI:10.3969/j.issn.0258-7033.2003.05.011 |
| [8] |
张振红, 张会彩, 黄仁录, 等. 大豆低聚糖对肉鸡消化代谢率的影响[J]. 黑龙江畜牧兽医, 2013(20): 111-112. |
| [9] |
LIU J B, CAO S C, LIU J, et al. Effect of probiotics and xylo-oligosaccharide supplementation on nutrient digestibility, intestinal health and noxious gas emission in weanling pigs[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(10): 1660-1669. DOI:10.5713/ajas.17.0908 |
| [10] |
方锐, 凌宝明, 夏旻灏, 等.过氧化氢酶对断奶仔猪生长性能、肠道形态及抗氧化性能的影响[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集.武汉: 中国畜牧兽医学会动物营养学分会, 2016.
|
| [11] |
PHILLIPS S M, STEPHENSON J R, AARONSON S A. Genetic factors infuencing mouse type-C RNA virus induction by naturally occurring B cell mitogens[J]. Journal of Immunology, 1977, 118(2): 662-666. |
| [12] |
MCCRACKEN B A, SPURLOCK M E, ROOS M A, et al. Weaning anorexia may contribute to local inflammation in the piglet small intestine[J]. The Journal of Nutrition, 1999, 129(3): 613-619. DOI:10.1093/jn/129.3.613 |
| [13] |
SPREEUWENBERG M A M, VERDONK J M A J, GASKINS H R, et al. Small intestine epithelial barrier function is compromised in pigs with low feed intake at weaning[J]. The Journal of Nutrition, 2001, 131(5): 1520-1527. DOI:10.1093/jn/131.5.1520 |
| [14] |
时祺.果寡糖对断奶前仔猪胃肠道发育、消化酶活性、乳酸杆菌菌群结构及数量的影响[D].硕士学位论文.南京: 南京农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012490358.htm
|
| [15] |
SAKATA T. Stimulatory effect of short-chain fatty acids on epithelial cell proliferation in the rat intestine:a possible explanation for trophic effects of fermentable fibre, gut microbes and luminal trophic factors[J]. British Journal of Nutrition, 1987, 58(1): 95-103. DOI:10.1079/BJN19870073 |
| [16] |
韩蕊, 赵元, 潘丽, 等. 大豆球蛋白对仔猪小肠上皮细胞occludin mRNA表达的影响[J]. 畜牧兽医学报, 2013, 44(8): 1258-1262. |
| [17] |
王玉, 王丽, 郑春田. 壳聚糖在断奶仔猪生产上的应用及研究进展[J]. 中国畜牧杂志, 2016, 52(11): 78-81. |
| [18] |
YIN J, REN W K, WU X S, et al. Oxidative stress-mediated signaling pathways:a review[J]. Journal of Food Agriculture and Environment, 2013, 11(2): 132-139. |
| [19] |
冯静.低聚果糖和低聚木糖对荣昌断奶仔猪生产性能和血液理化指标的影响[D].硕士学位论文.重庆: 重庆大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10611-2010217304.htm
|
| [20] |
王一寓. 白术多糖对过氧化氢致IEC-6细胞损伤的保护作用研究[J]. 内蒙古中医药, 2018, 37(9): 98-99. DOI:10.3969/j.issn.1006-0979.2018.09.065 |
| [21] |
刘晴雪, 董晓芳, 佟建明, 等. 水溶性苜蓿多糖对肉仔鸡T、B淋巴细胞体外增殖的影响[J]. 畜牧兽医学报, 2010, 41(9): 1185-1190. |
| [22] |
KIM H S, KIM Y J, LEE H K, et al. Activation of macrophages by polysaccharide isolated from Paecilomyces cicadae through toll-like receptor 4[J]. Food and Chemical Toxicology, 2012, 50(9): 3190-3197. DOI:10.1016/j.fct.2012.05.051 |
| [23] |
李敬双, 刘英姿, 唐雨顺, 等. 苜蓿多糖对小鼠淋巴细胞增殖和NK细胞活性影响的研究[J]. 中国农学通报, 2012, 28(32): 89-93. DOI:10.3969/j.issn.1000-6850.2012.32.018 |
| [24] |
徐贤柱, 饶华, 蔡险峰, 等. 杜仲叶多糖提取及对小鼠免疫功能影响研究[J]. 时珍国医国药, 2013, 24(3): 541-542. |
| [25] |
武书庚, 高春起, 张海军, 等. 低聚异麦芽糖对产蛋鸡生产性能、盲肠微生物和免疫机能的影响[J]. 动物营养学报, 2011, 23(9): 1560-1568. |
| [26] |
贺琴.酵母壁多糖对断奶仔猪生长性能、肠道微生物和机体免疫的影响[D].硕士学位论文.南昌: 江西农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10410-1017271444.htm
|




