2. 中国农业大学动物科技学院, 动物营养学国家重点实验室, 北京 100193
2. State Key Laboratory of Animal Nutrition, College of Animal Science & Technology, China Agricultural University, Beijing 100193, China
棉籽及棉副产品中的棉酚、单宁、环丙烯脂肪酸等抗营养因子是限制其在动物养殖中大量应用的主要原因之一。棉酚是存在于棉属植物中的一种次级代谢产物,对棉花植物抵御虫害具有重要作用[1-2]。单胃动物猪[3]或鸭[4]饲喂棉籽后会出现棉酚中毒现象,而反刍动物对棉酚则具有一定的耐受性[5]。有研究认为,出现这种现象的原因可能是由于单胃动物缺乏降解有毒物质的微生物[6],而反刍动物瘤胃中存在的大量微生物可能具有降解棉酚作用,因此反刍动物对棉酚表现出一定的耐受性。
正常条件下,瘤胃液中真菌的数量一般在105~106个/mL。真菌在反刍动物瘤胃内降解纤维素的过程中发挥着重要作用。在给绵羊每千克饲粮添加0.1 g棉酚时,发现瘤胃原虫、细菌、纤维分解菌数量与对照组相比均增加,而真菌的数量降低[7]。瘤胃微生物体外试验研究结果表明,在培养液中初次添加棉酚后导致了微生物数量下降,但是长期添加棉酚时微生物会产生适应性[8]。在微生物降解棉酚的研究过程中,研究者们最初发现在霉变的棉籽饼中棉酚的含量明显降低。黑曲霉(Aspergillus niger)、曲霉(Aspergillus oryzae)、热带假丝酵母(Candida tropicalis)、酿酒酵母(Saccharomyces cerevisiae)、白地霉(Geotrichum candidum)等一些真菌可以通过发酵作用降低游离棉酚的含量[9-10]。近年来研究发现,棉酚具有抗癌[11]、抗病毒、抗微生物[12]、抗寄生虫[13-14]等方面的作用。瘤胃液中一定浓度的棉酚对瘤胃真菌种群结构会有怎样的影响?绵羊瘤胃液中的真菌种群对一定浓度的棉酚是否具有生物降解作用?阐明这些问题,对深入认识瘤胃真菌对诸如棉酚等抗营养因子的适应性(或生物降解作用)具有重要意义。
目前,国内外的研究大多数集中在棉酚对瘤胃细菌、原虫和真菌数量上的影响,有关棉酚对瘤胃真菌种群影响的研究报道还很少见。因此,本试验运用高通量测序的方法检测瘤胃液真菌区系变化,旨在研究醋酸棉酚对绵羊瘤胃液真菌多样性的影响,为今后深入探讨瘤胃真菌对诸如棉酚等抗营养因子的适应性(或生物降解作用)提供试验基础和参考依据。
1 材料与方法 1.1 试验时间与地点本试验于2017年8月5日至2017年9月21日在新疆惠康畜牧生物科技有限公司羊场进行。
1.2 试验材料醋酸棉酚购自湖北鑫源顺医药化工有限公司,纯度为98%。醋酸棉酚是由游离棉酚提纯转化而成,与游离棉酚相比其生理活性相当,性质更稳定。精料补充料购自新疆天康畜牧生物技术股份有限公司。
1.3 试验设计选取8只健康、体重为(49.13±4.70) kg、年龄(3岁)相近、安装有永久性瘤胃瘘管的哈萨克羊母羊,随机分为2组,分别为对照组和试验组,每组4只。试验绵羊在饲喂基础饲粮14 d后进入试验期。试验期对照组绵羊饲喂基础饲粮;第1~26天试验组绵羊补饲600 mg/(d·只)醋酸棉酚,第27~47天醋酸棉酚补饲量增加至1 200 mg/(d·只)。
试验前2天于晨饲前空腹称重,根据体重确定营养水平,其中精料补充料为体重的1.5%,青贮料(干物质基础)为体重的0.05%,苜蓿为体重的1%,秸秆为体重的1%。基础饲粮的配制参考《肉羊饲养标准》(NY/T 816—2004),基础饲粮组成及营养水平见表 1。醋酸棉酚添加量参考《饲料卫生标准》(GB 13078—2017)。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验期间,每天08:00和20:00按时饲喂。试验期将醋酸棉酚与50 g粉状精料补充料混合均匀提前饲喂,同时对照组饲喂50 g粉状精料补充料,待绵羊采食完毕后,将剩余精料补充料、玉米青贮、苜蓿及小麦秸秆搅拌均匀后饲喂。试验动物单笼舍饲,自由饮水,试验期内统一饲养管理。
1.5 样品采集于试验期第1、20[添加600 mg/(d·只)醋酸棉酚后第20天]、37[醋酸棉酚添加量增加至1 200 mg/(d·只)后第10天]和47天[醋酸棉酚添加量增加至1 200 mg/(d·只)后第20天]晨饲后3 h采集瘤胃液样品50 mL/只,用60目尼龙袋过滤后立即分装,放入液氮中冻存,待测。
1.6 瘤胃液微生物总DNA提取、扩增和测序瘤胃液真菌样品送至北京诺禾致源科技股份有限公司,采用十六烷基三甲基溴化铵法(hexadecyltrimethy ammonium bromide,CTAB)提取瘤胃液样品的基因组总DNA,检测纯度和浓度后,稀释至1 ng/μL备用。以稀释后的基因组DNA为模板,使用ITS1-5F(200~400 bp)进行瘤胃液真菌PCR扩增,通用引物为ITS5-1737F:5′-GGAAGTAAAAGTCGTAACAAGG-3′;ITS2-2043R:5′-GCTGCGTTCTTCATCGATGC-3′。PCR产物经2%凝胶电泳检测,使用Qiagen Gel Extraction Kit (Qiagen,德国)纯化PCR产物。使用TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库通过Qubit和PCR进行定量,构建文库合格后,使用Illumina HiSeq 2500进行上机测序。
1.7 序列分析根据Barcode和PCR扩增引物序列从原始数据中拆分出各样品数据,截去Barcode和引物序列后使用FLASH对每个样品的reads进行拼接,得到的拼接序列为原始Tags(raw Tags)数据;经过严格的过滤处理得到高质量Tags(clean Tags)数据。高质量Tags数据序列通过UCHIME Algorithm与数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到有效Tags(effective Tags)数据。
1.8 操作分类单元(operational taxonomic units,OTUs)聚类和物种注释利用Uparse软件对所有样品的全部有效Tags进行聚类,默认以97%的一致性(identity)将序列聚类成为OTUs,同时筛选出OTUs中出现频数最高的序列作为OTUs的代表序列进行物种注释,用Qiime 1.9.1软件中的Blast方法与Unit数据库进行物种注释分析,并分别在各个分类水平[界(kingdom)、门(phylum)、纲(class)、目(order)、科(family)、属(genus)、种(species)]统计各样本的群落组成。对各样品的数据进行均一化处理,以样品中数据量最少的为标准进行均一化处理,后续的多样性分析都是基于均一化处理后的数据。
1.9 绵羊瘤胃液棉酚浓度检测运用高效液相色谱仪,参照Chen等[15]方法检测试验组绵羊瘤胃液棉酚浓度。色谱条件:SHIMAZU高效液相色谱仪;色谱柱为Welch AQ-C18(4.6 mm×250 mm,5 μm)。流动相为乙腈:0.2%磷酸(体积比85 : 15),流速1 mL/min,紫外检测波长235 nm,进样量20 μL,柱温30 ℃。
1.10 数据分析瘤胃液真菌菌群显著性分析采用SPSS 19.0软件进行独立样本t检验,结果以平均值±标准差(mean±SD)表示,以P < 0.05为差异显著水平。
2 结果与分析 2.1 瘤胃液真菌样品测序深度对本试验数据进行质控后,共得到有效Tags 2 082 498条,平均每个样品65 078条,以97%的一致性聚类为4 709个OTUs。分属6个门、25个纲、74个目、123个科、152个属,其中每个分类水平上都包含1个未分类单元。
由图 1所示,在抽样的初期,随着抽样数量的增加,不断出现新的物种,曲线的斜率较大;当抽样数量大于25 000时,曲线的斜率变小,随着抽样数量的增加出现新物种的速率放缓;当抽样数量达40 000条时,曲线的斜率基本趋于平缓,继续抽样出现新物种的概率很小,说明本次测序已经覆盖了大部分的物种。
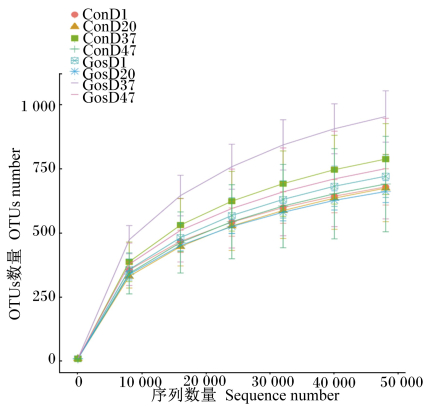
|
ConD1为第1天对照组样品,GosD1为第1天试验组样品;ConD20为第20天对照组样品,GosD20为第20天试验组样品;ConD37为第37天对照组样品,GosD37为第37天试验组样品;ConD47为第47天对照组样品,GosD47为第47天试验组样品。下图和下表同。 ConD1 was samples of control group at day 1, GosD1 was samples of experimental group at day 1; ConD20 was samples of control group at day 20, GosD20 was samples of experimental group at day 20; ConD37 was samples of control group at day 37, GosD37 was samples of experimental group at day 37; ConD47 was samples of control group at day 47, and GosD47 was samples of experimental group at day 47. The same as below. 图 1 样品物种稀释曲线 Fig. 1 Rarefaction curve of sample species |
由图 2所示,在抽取样品初期,新的物种迅速增加,随着抽样数量的增加新物种出现的概率逐渐变小,当抽样数量达到15时,样品物种累计曲线趋于平缓,再增加抽样数量新物种出现的概率较小。这说明在抽样的初期仍然有大量的真菌物种未发现,但是随着抽样数量的增加,新物种出现的概率降低,到抽样数量达到15时,出现新物种的概率越来越小,因此本试验覆盖了绵羊瘤胃液样品中的大部分真菌种群。
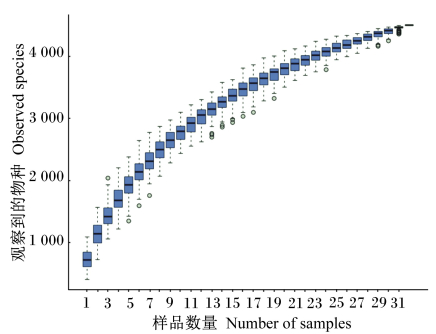
|
图 2 样品物种累积曲线 Fig. 2 Accumulation curve of sample species |
由表 2可见,试验组第1、20和47天时瘤胃液真菌的Shannon、Simpson、Chao1和ACE指数以及第37天时的Chao1和ACE指数与对照组相比差异不显著(P>0.05),但试验组第37天时瘤胃液真菌的Shannon和Simpson指数与对照组相比显著升高(P < 0.05)。
|
|
表 2 醋酸棉酚对瘤胃液真菌Alpha多样性的影响 Table 2 Effects of gossypol acetic acid on Alpha diversity of fungi in rumen fluid |
如图 3所示,第1天,试验组和对照组共享915个OTUs,2组所特有的OTUs数量分别为643和562个(图 3-A)。第20天,试验组与对照组共享788个OTUs,2组所特有的OTUs数量相同,均为668个(图 3-B)。第37天,试验组与对照组所共享1 138个OTUs,试验组特有的OTUs数量为1 063个,高于对照组所特有的OTUs数量715个(图 3-C)。第47天,试验组与对照组共享874个OTUs,2组特有的OTUs数量分别为806和793个(图 3-D)。
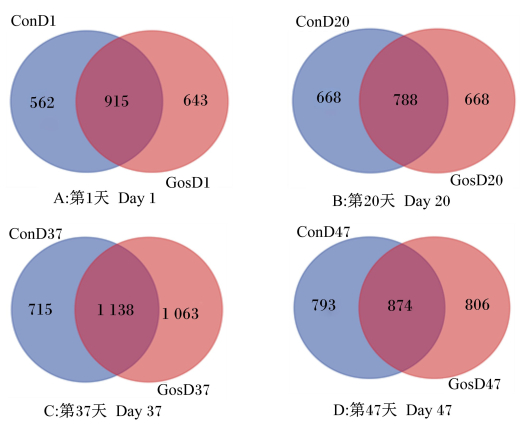
|
图 3 瘤胃液真菌Venn图 Fig. 3 Venn diagram of fungi in rumen fluid |
基于UniFrac的加权主坐标分析(PCoA)见图 4。由图可以看出,绵羊瘤胃液真菌第1主坐标(PC1)和第2主坐标(PC2)对于区分样品的贡献率分别为45.54%和11.68%,试验组与对照组瘤胃液真菌样品交叉聚集在一起,说明试验组和对照组瘤胃液真菌区系相似性较大。第20天试验组和第37天对照组中各有1个样品较分散,说明存在个体差异。
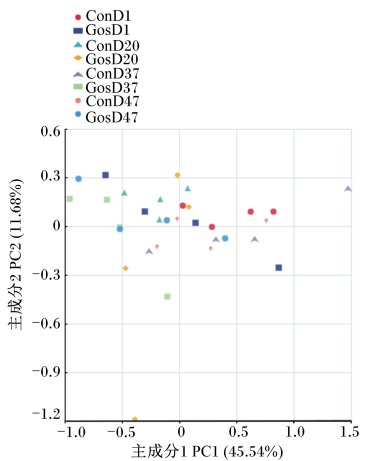
|
图 4 瘤胃液真菌区系主坐标分析图 Fig. 4 Principal coordinate analysis diagram of fungi flora in rumen fluid |
由表 3可见,瘤胃液真菌区系中假丝酵母菌属(Candida)、假散囊菌属(Pseudopithomyces)和Metschnikowia为瘤胃液真菌主要优势菌属。第1天,试验组与对照组相比瘤胃液真菌在属水平上相对丰度均差异不显著(P>0.05)。第20天,试验组绵羊真菌区系中毛霉菌属(Mucor)相对丰度显著高于对照组(P < 0.05)。第37天,试验组绵羊真菌区系中毛霉菌属(Mucor)和Phallus相对丰度显著高于对照组(P < 0.05)。第47天,试验组绵羊瘤胃液真菌区系中Metschnikowia相对丰度显著高于对照组(P < 0.05)。总体上看,醋酸棉酚对瘤胃液真菌主要优势菌属组成无影响,但在数值上第37和47天试验组主要优势菌属相对丰度大于对照组。
|
|
表 3 醋酸棉酚对瘤胃液真菌属水平上相对丰度的影响(占总真菌比例大于1%) Table 3 Effects of gossypol acetic acid on relative abundance of fungi at genus level in rumen fluid (proportion of total fungi higher than 1%) |
由表 4可见,第20天,绵羊瘤胃液棉酚浓度最低,为(1.37±0.30) μg/mL;第37天,绵羊瘤胃液棉酚浓度最高,为(3.26±0.72) μg/mL。
|
|
表 4 醋酸棉酚对不同时间瘤胃液棉酚浓度的影响 Table 4 Effects of gossypol acetic acid on gossypol concentration in rumen fluid at different time |
在本试验中,添加低浓度醋酸棉酚对绵羊瘤胃液真菌Alpha多样性无显著影响,而在由低浓度升高至高浓度时(第37天)对瘤胃液真菌的Shannon和Simpson指数有显著影响。Venn图中发现,第37天试验组瘤胃液真菌样品特有的OTUs数量增多,而添加低浓度醋酸棉酚对瘤胃液真菌特有的OTUs数量无明显影响,说明低浓度的醋酸棉酚对瘤胃液真菌多样性无影响,高浓度醋酸棉酚可能会促进某些瘤胃真菌种群的生长,随着时间的延长瘤胃真菌对高浓度的棉酚会产生一定的适应性(耐受性),长时间添加棉酚时使得瘤胃真菌重新达到动态平衡的状态。起初添加低浓度有毒物质且随后不断增加其添加量,可使瘤胃微生物对有毒物质产生适应性[6]。有研究显示,绵羊瘤胃微生物在对植物有毒物质芥子油的分解产物烯丙烯氰[16]、含羞草碱毒素[17]的耐受中发挥着重要作用。因此,绵羊瘤胃微生物在不断添加醋酸棉酚的过程中可能也会逐渐产生适应性。目前,有毒物质影响瘤胃中的哪些真菌仍不清楚,棉酚对绵羊瘤胃液中真菌结构的影响需要进一步研究。
本试验中,从属水平上看,绵羊瘤胃液主要优势真菌为假丝酵母菌属、假散囊菌属和Metschnikowia。Mao等[18]发现新丽鞭毛菌属、根囊鞭菌属和瘤胃壶菌属是雄性山羊瘤胃真菌区系的优势真菌。这与本试验结果不一致,可能是由于饲粮组成、宿主遗传背景以及采样方法等不同而引起[19]。有研究显示,瘤胃中固相和液相微生物存在很大的区别[20]。在本研究中,采集的是绵羊瘤胃液部分,可能棉酚对不同采集部位的微生物具有不同的影响。因此,在研究棉酚对瘤胃真菌影响时应慎重考虑样品采集的问题。
瘤胃液真菌相对丰度结果表明,醋酸棉酚对绵羊瘤胃液真菌主要优势菌属没有明显影响,从PCoA图也可以看出,试验组与对照组瘤胃液真菌区系相似性较大。目前对于瘤胃微生物降解棉酚的机制有2种报道;第一,棉酚能够与瘤胃中可溶性蛋白结合从而降低棉酚毒性[21];第二,瘤胃微生物能够利用棉酚作为碳源供其生长[22]。本试验中,醋酸棉酚显著提高了第20天毛霉菌属,第37天毛霉菌属和Phallus,第47天Metschnikowia的相对丰度,可能毛霉菌属、Phallus和Metschnikowia参与了棉酚的降解。有研究显示,动物在饲喂草酸盐后会提高与降解草酸盐有关细菌的相对丰度[23]。体外发酵试验发现,热带假丝酵母发酵棉籽饼粕后,棉酚的脱毒率可达94.57%[24]。本试验中,假丝酵母菌属为瘤胃液真菌主要优势菌属,这可能是棉酚没有显著改变绵羊瘤胃液真菌区系结构的原因之一。同时试验组优势菌属相对丰度的数值大于对照组,可能存在个体差异,从PCoA图中也可以看出在同一时间相同组存在个体差异,这可能与样品采集时采集管的位置和采样深浅有关。
本试验中,绵羊在摄入醋酸棉酚后,瘤胃液中醋酸棉酚的浓度为1.37~3.26 μg/mL。醋酸棉酚对瘤胃液真菌结构无显著影响也可能是由于瘤胃液中棉酚浓度未达到真菌的最小抑菌浓度。有研究显示,棉酚对毕赤酵母和新型隐球酵母抑菌浓度为25 μg/mL,而对酿酒酵母、卡尔酵母、汉逊酵母属、Zygosaccharomyces mellis、Hanseniaspora、产朊假丝酵母和黏性红圆酵母抑制效果不明显(最小抑菌浓度≥200 μg/mL),对Debaryomyces nicotianae最小抑菌浓度为100 μg/mL[25]。终浓度为100 μg/mL的(±)-棉酚、(+)-棉酚、(-)-棉酚和棉酚代谢产物gossypolone分别与黄曲霉共同培养6 h后发现,(±)-棉酚对黄曲霉的抑制率为46.9%,(+)-棉酚对黄曲霉的抑制率为30.3%,(-)-棉酚对黄曲霉的抑制率为54.2%,gossypolone对黄曲霉的抑制率最高为71.0%[26]。因此,不同的真菌对棉酚的敏感性不同。醋酸棉酚进入瘤胃后绵羊自身吸收和排泄、与瘤胃中可溶性蛋白结合、瘤胃微生物的降解等原因,使瘤胃液中醋酸棉酚浓度仍未达到最小抑菌浓度,这可能是棉酚对绵羊瘤胃液真菌种群结构无显著影响的另一原因。
4 结论低浓度醋酸棉酚对绵羊瘤胃真菌多样性无显著影响,醋酸棉酚添加量增加至1 200 mg/(d·只)时,Simpson和Shannon指数显著升高。醋酸棉酚对瘤胃液真菌主要优势菌属组成无显著影响。
| [1] |
STIPANOVIC R D, LOPEZ J D, J r, DOWD M K, et al. Effect of racemic and (+)- and (-)-gossypol on the survival and development of Helicoverpa zea larvae[J]. Journal of Chemical Ecology, 2006, 32(5): 959-968. DOI:10.1007/s10886-006-9052-9 |
| [2] |
WANG X, HOWELL C P, CHEN F, et al. Gossypol—a polyphenolic compound from cotton plant[J]. Advances in Food and Nutrition Research, 2009, 58: 215-263. DOI:10.1016/S1043-4526(09)58006-0 |
| [3] |
FOMBAD R B, BRYANT M J. Effects of cottonseed cake-based diets supplemented with blood meal, alone or with lysine, on the growth of pigs[J]. Tropical Animal Health and Production, 2004, 36(4): 385-395. DOI:10.1023/B:TROP.0000026660.09304.38 |
| [4] |
ZENG Q F, YANG G L, LIU G N, et al. Effects of dietary gossypol concentration on growth performance, blood profiles, and hepatic histopathology in meat ducks[J]. Poultry Science, 2014, 93(8): 2000-2009. DOI:10.3382/ps.2013-03841 |
| [5] |
IMAIZUMI H, DE SOUZA J, BATISTEL F, et al. Replacing soybean meal for cottonseed meal on performance of lactating dairy cows[J]. Tropical Animal Health and Production, 2016, 48(1): 139-144. DOI:10.1007/s11250-015-0933-1 |
| [6] |
SMITH G S. Toxification and detoxification of plant compounds by ruminants:an overview[J]. Journal of Range Management, 1992, 45(1): 25-30. DOI:10.2307/4002521 |
| [7] |
石彩霞, 侯彩云, 王海荣, 等. 游离棉酚对绵羊瘤胃发酵和微生物区系的影响[J]. 中国饲料, 2013(5): 17-19. |
| [8] |
ISMARTOYO I, STEWART C S, ACAMOVIC T.The effect of gossypol on the rumen microbial degradation of grass hay under consecutive batch culture (CBC)[C]//Proceedings of winter meeting of the british society of animal production.Scarborough: BSAP, 1993: 171.
|
| [9] |
KHALAF M A, MELEIGY S A. Reduction of free gossypol levels in cottonseed meal by microbial treatment[J]. International Journal of Agriculture & Biology, 2008, 10(2): 185-190. |
| [10] |
赵静.高效降解棉酚菌株的分离、鉴定及其降解机理的研究[D].硕士学位论文.新乡: 河南师范大学, 2017.
|
| [11] |
LIN J, WU Y J, YANG D J, et al. Induction of apoptosis and antitumor effects of a small molecule inhibitor of Bcl-2 and Bcl-xl, gossypolacetate, in multiple myeloma in vitro and in vivo[J]. Oncology Reports, 2013, 30(2): 731-738. |
| [12] |
YILDIRIM-AKSOY M, LIM C, DOWD M K, et al. In vitro inhibitory effect of gossypol from gossypol-acetic acid, and (+)- and (-)-isomers of gossypol on the growth of Edwardsiella ictaluri[J]. Journal of Applied Microbiology, 2004, 97(1): 87-92. DOI:10.1111/jam.2004.97.issue-1 |
| [13] |
EID J E, UENO H, WANG C C, et al. Gossypol-induced death of African trypanosomes[J]. Experimental Parasitology, 1988, 66(1): 140-142. |
| [14] |
PACHECO L B, CASTRO-GARZA J, PEREZ-EGUÍA E, et al. Growth inhibitory activity of gossypol against several trichomonas vaginalis isolates[J]. Pharmacy and Pharmacology Communications, 1996, 2(7): 333-334. |
| [15] |
CHEN C, NIE C X, LIANG J, et al. Validated method to determine (±)-gossypol in Candida tropicalis culture by high-performance liquid chromatography[J]. Acta Chromatographica, 2018, 30(4): 269-273. DOI:10.1556/1326.2018.00420 |
| [16] |
DUNCAN A J, MILNE J A. Rumen microbial degradation of allyl cyanide as a possible explanation for the tolerance of sheep to brassica-derived glucosinolates[J]. Journal of the Science of Food and Agriculture, 2010, 58(1): 15-19. |
| [17] |
JONES R J, MEGARRITY R G. Successful transfer of DHP-degrading bacteria from Hawaiian goats to Australian ruminants to overcome the toxicity of Leucaena[J]. Australian Veterinary Journal, 2010, 63(8): 259-262. |
| [18] |
MAO S Y, HUO W J, ZHU W Y. Microbiome-metabolome analysis reveals unhealthy alterations in the composition and metabolism of ruminal microbiota with increasing dietary grain in a goat model[J]. Environmental Microbiology, 2015, 18(2): 525-541. |
| [19] |
王佳堃, 和文凤. 组学技术揭秘草食动物消化道真菌组成和功能[J]. 浙江大学学报(农业与生命科学版), 2018, 44(2): 131-139. |
| [20] |
MARTÍN-ORÚUE S M, BALCELLS J, ZAKRAOUI F, et al. Quantification and chemical composition of mixed bacteria harvested from solid fractions of rumen digesta:effect of detachment procedure[J]. Animal Feed Science and Technology, 1998, 71(3/4): 269-282. |
| [21] |
REISER R, HC F U. The mechanism of gossypol detoxification by ruminant animals[J]. The Journal of Nutrition, 1962, 76(2): 215-218. DOI:10.1093/jn/76.2.215 |
| [22] |
ZHANG Y H, ZHANG Z Y, DAI L, et al. Isolation and characterization of a novel gossypol-degrading bacteria Bacillus subtilis strain rumen bacillus subtilis[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(1): 63-70. DOI:10.5713/ajas.17.0018 |
| [23] |
MILLER A W, OAKESON K F, DALE C, et al. Effect of dietary oxalate on the gut microbiota of the mammalian herbivore Neotoma albigula[J]. Applied and Environmental Microbiology, 2016, 82(9): 2669-2675. DOI:10.1128/AEM.00216-16 |
| [24] |
张文举.高效降解棉酚菌种的选育及棉籽饼粕生物发酵的研究[D].博士学位论文.杭州: 浙江大学, 2006.
|
| [25] |
MARGALITH P. Inhibitory effect of gossypol on microorganisms[J]. Applied Microbiology, 1967, 15(4): 952-953. |
| [26] |
MELLON J E, ZELAYA C A, DOWD M K. Inhibitory effects of gossypol-related compounds on growth of Aspergillus flavus[J]. Letters in Applied Microbiology, 2011, 52(4): 406-412. DOI:10.1111/lam.2011.52.issue-4 |




