2. 中国农业大学动物科技学院, 动物营养学国家重点实验室, 北京 100193
2. State Key Laboratory of Animal Nutrition, College of Animal Science & Technology, China Agricultural University, Beijing 100193, China
棉籽粕中粗蛋白质含量在20%~40%,是动物很好的蛋白质饲料来源[1],而棉籽粕中的抗营养因子棉酚限制了其在畜牧业中的应用[2]。棉酚是棉籽色素腺体中的一种黄色多酚化合物,分为游离棉酚(FG)和结合棉酚(BG)[3],游离棉酚具有毒性。禽[4-5]、猪[6]等单胃动物摄入棉酚后常出现中毒症状,但反刍动物出现中毒症状的现象很少,有研究指出这种现象可能与瘤胃微生物有关[7]。饲粮中添加100 mg/kg棉酚,绵羊瘤胃细菌、原虫数量及挥发性脂肪酸(VFA)浓度显著升高[8]。体外发酵时,添加0.1 mg/mL棉酚,瘤胃液细菌、原虫数量及氨态氮(NH3-N)浓度显著升高[9]。目前研究较多集中在棉酚对瘤胃微生物数量及代谢产物的影响方面,而对瘤胃消化过程中水解酶的研究较少。瘤胃消化代谢的前提主要是瘤胃微生物分泌的各种水解酶对摄入的蛋白质、碳水化合物、脂肪等养分的水解。因此,研究棉酚对瘤胃内蛋白酶、碳水化合物酶活性的影响,对深入了解棉酚对瘤胃消化代谢的影响具有重要意义。本试验通过添加纯度为98%的醋酸棉酚,测定瘤胃细菌、原虫数量、瘤胃水解酶活性及瘤胃代谢产物动态变化,探究游离棉酚对绵羊瘤胃微生物数量、瘤胃消化代谢,特别是对瘤胃内蛋白酶、碳水化合物酶活性的影响。
1 材料与方法 1.1 试验时间及地点本试验于2017年6月3日至2017年10月4日在新疆惠康畜牧生物科技有限公司羊场进行。
1.2 试验材料粉状精料购自新疆天康畜牧生物技术股份有限公司;醋酸棉酚购自湖北鑫源顺医药化工有限公司,纯度为98%。棉酚性质活泼,极易被氧化,游离棉酚和游离氨基酸较易形成氨衍生物结构的色素,醋酸棉酚是棉酚经过分离提纯及精制后得到的一种稳定的化合物,因此本试验选用添加纯度为98%的醋酸棉酚。
1.3 试验设计试验选用3岁左右、平均体重为(49.13± 4.70) kg的健康哈萨克母羊8只,安装永久性瘤胃瘘管后随机分为2组,分别为对照组和试验组,每组4只,试验分为2期,每期25 d。所有羊只饲喂同一营养水平粉状精料。每只羊每天粉状精料饲喂量为体重的1.50%,小麦秸秆及苜蓿为体重的1.00%,玉米青贮为体重的0.05%(干物质基础),混合饲喂,自由饮水。在此基础上,试验Ⅰ期试验组饲粮每天每只添加600 mg醋酸棉酚,试验Ⅱ期饲粮每天每只添加1 200 mg醋酸棉酚(添加量参考反刍动物饲粮中游离棉酚的安全限量[10])。试验Ⅰ期样品采集结束后,试验组饲粮每天每只继续添加600 mg醋酸棉酚2 d作为恢复期。
1.4 饲养管理试验期间所有试验羊分槽分栏饲喂,将每天每只羊的粉状精料、粗饲料及醋酸棉酚平均分为2份,于每日08:00和20:00分2次饲喂,为保证醋酸棉酚采食完全,将醋酸棉酚与50 g粉状精料混合均匀提前饲喂,同时对照组提前饲喂50 g粉状精料。待试验羊采食完毕后,将剩余粉状精料、玉米青贮、苜蓿及小麦秸秆搅拌均匀分3次投喂,自由饮水。试验期间定期做瘘管护理,清理圈舍,保持良好的试验环境。绵羊粉状精料组成及营养水平见表 1。玉米青贮、苜蓿及小麦秸秆的营养水平见表 2。
|
|
表 1 粉状精料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the powder concentrate (DM basis) |
|
|
表 2 玉米青贮、苜蓿及小麦秸秆的营养水平(干物质基础) Table 2 Nutrient levels of corn silage, alfalfa and wheat straw (DM basis) |
于试验第25、52天,分别在饲喂前(即0 h)、1.5、3.0、6.0、9.0、12.0 h采集瘤胃液,每个时间点30 mL,经60目尼龙袋过滤,其中8 mL用2 mL冻存管分装,置于-20 ℃保存,待测,剩余存于小白瓶中,置于液氮中保存,待测。瘤胃液采集过程中所有羊只每个时间点样品采集时间不超过15 min。
1.6 样品的测定方法 1.6.1 pH的测定采集瘤胃液过滤后立即用PE20K梅特勒托利多酸度计直接测定pH并记录数据。
1.6.2 NH3-N浓度的测定瘤胃液NH3-N浓度采用碱性次氯酸钠-苯酚分光光度法[11]测定。
1.6.3 VFA浓度的测定准确吸取瘤胃液样品0.6 mL于1.5 mL的离心管中,加入0.6 mL的10%三氯乙酸,混匀放置20 min后,20 000×g离心15 min,取1.0 mL上清加入0.1 mL 60 mmol/L巴豆酸,取处理后样品,采用气相色谱分析法[12]测定VFA浓度ssn。色谱条件:初始温度60 ℃,以每分钟20 ℃的速率升温至190 ℃,保持3 min,进样量0.5 μL。
1.6.4 瘤胃液细菌、原虫数量的测定绵羊瘤胃液细菌、原虫采用光学显微镜法[13]计数。
1.6.5 瘤胃液醋酸棉酚浓度的测定准确吸取300 μL瘤胃液样品置于1.5 mL离心管中,加入700 μL丙酮混合浸提,静置3 h后,4 ℃,1 2 000×g离心2 min,取上清0.45 μm滤膜过滤,采用高效液相色谱法[14]测定。色谱条件:初始柱温25 ℃,流速1.0 mL/min,紫外检测波长380 nm,进样量20 μL。
1.6.6 瘤胃液纤维素酶、蛋白酶、淀粉酶活性的测定瘤胃液水解酶活性的测定参考张龙翔等[15]的试验方法。分别以滤纸、可溶性淀粉、1%酪素为底物测定纤维素酶、淀粉酶、蛋白酶的活性。
1.7 数据处理与统计数据经Excel 2007初步处理后,采用SPSS 19.0统计软件进行配对样本t检验分析,试验结果均以平均值±标准差(mean±SD)表示。P>0.05为差异不显著,P<0.05为差异显著,P < 0.01为差异极显著。
2 结果与分析 2.1 添加醋酸棉酚对绵羊瘤胃液细菌数量的影响由表 3可知,绵羊瘤胃液细菌数量整体呈先降低后升高的变化趋势。添加醋酸棉酚对试验Ⅰ期及试验Ⅱ期瘤胃细菌数量均无显著影响(P>0.05)。
|
|
表 3 添加醋酸棉酚对绵羊瘤胃液细菌数量的影响 Table 3 Effects of adding gossypol acetate on rumen fluid bacterial population in sheep (n=4) |
由表 4可知,除饲喂前外,试验Ⅰ期各时间点试验组瘤胃原虫数量极显著低于对照组(P<0.01),分别降低了32.47%、41.04%、31.58%、36.80%、46.99%、43.66%。试验Ⅱ期添加醋酸棉酚对绵羊瘤胃原虫数量无显著影响(P>0.05)。
|
|
表 4 添加醋酸棉酚对绵羊瘤胃液原虫数量的影响 Table 4 Effects of adding gossypol acetate on rumen fluid protozoa population in sheep (n=4) |
由图 1可知,试验Ⅰ期饲喂后1.5 h瘤胃液中棉酚浓度最高,随后快速降低,之后逐渐缓慢下降。试验Ⅱ期饲喂后3.0 h瘤胃液中棉酚浓度最高,随后持续降低至饲喂前水平。
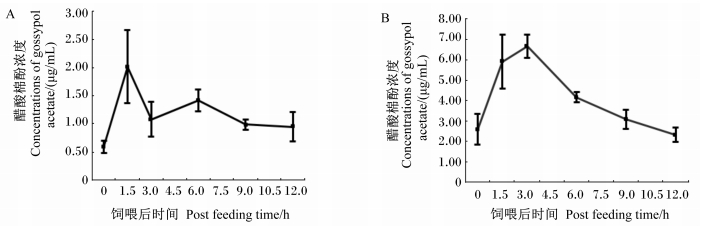
|
A:试验Ⅰ期the first period of trial; B:试验Ⅱ期the second period of trial。 图 1 添加醋酸棉酚后绵羊瘤胃液中醋酸棉酚浓度的变化 Fig. 1 Change of gossypol acetate concentration in rumen fluid of sheep after adding gossypol acetate |
由表 5可知,添加醋酸棉酚对试验Ⅰ期及试验Ⅱ期绵羊瘤胃液pH均无显著影响(P>0.05),试验组和对照组绵羊瘤胃液pH变化趋势基本相同,均在饲喂后6.0 h最低。
|
|
表 5 添加醋酸棉酚对绵羊瘤胃液pH的影响 Table 5 Effects of adding gossypol acetate on rumen fluid pH in sheep (n=4) |
从表 6可知,饲喂前(即0 h)试验组瘤胃NH3-N浓度显著高于对照组(P<0.05),试验Ⅰ期、试验Ⅱ期分别升高了31.57%、18.31%,试验组与对照组绵羊瘤胃NH3-N浓度变化趋势相同,均在饲喂后1.5 h最高。
|
|
表 6 添加醋酸棉酚对绵羊瘤胃液NH3-N浓度的影响 Table 6 Effects of adding gossypol acetate on rumen fluid NH3-N concentration in sheep (n=4) |
由表 7可知,试验Ⅰ期饲喂后12.0 h,试验组绵羊瘤胃液总挥发性脂肪酸(TVFA)、丙酸、正丁酸浓度显著低于对照组(P<0.05),分别降低了7.31%、8.85%、9.27%;饲喂后3.0、6.0、9.0 h试验组绵羊瘤胃液异戊酸浓度显著低于对照组(P<0.05),分别降低了17.30%、28.57%、10.34%;饲喂后9.0 h试验组绵羊瘤胃液丙酸、异丁酸浓度显著低于对照组(P<0.05),分别降低了8.27%、37.50%。
|
|
表 7 添加醋酸棉酚对绵羊瘤胃液VFA浓度的影响 Table 7 Effects of adding gossypol acetate on rumen fluid VFA concentrations in sheep (n=4) |
试验Ⅱ期饲喂后3.0、6.0 h,试验组异戊酸浓度显著低于对照组(P<0.05),分别降低了20.37%、25.00%,饲喂后6.0、12.0 h试验组异丁酸浓、戊酸浓度显著低于对照组(P<0.05),分别降低了26.67%、10.93%、10.81%。
2.7 添加醋酸棉酚对绵羊瘤胃液纤维素酶活性的影响由表 8可知,试验Ⅰ期,在饲喂后1.5 h绵羊瘤胃液纤维素酶活性最高后下降,在饲喂后3.0 h试验组绵羊纤维素酶活性显著高于对照组(P<0.05),升高了33.02%。试验Ⅱ期,添加醋酸棉酚后各时间点纤维素酶活性变化较小,试验组与对照组绵羊瘤胃纤维素酶活性无显著差异(P>0.05)。
|
|
表 8 添加醋酸棉酚对绵羊瘤胃液纤维素酶活性的影响 Table 8 Effects of adding gossypol acetate on rumen fluid cellulase activity in sheep (n=4) |
由表 9可知,试验Ⅰ期绵羊瘤胃液蛋白酶活性呈先升高, 在饲喂后3.0、6.0 h后降低,9.0 h升高,12.0 h降低的变化规律,在饲喂后9.0、12.0 h试验组绵羊瘤胃液蛋白酶活性极显著低于对照组(P<0.01),分别降低了51.22%、80.80%;试验Ⅱ期绵羊瘤胃液蛋白酶活性呈在饲喂后1.5、3.0 h降低,6.0、9.0 h升高,12.0 h降低的变化趋势。饲喂后6.0 h绵羊瘤胃液蛋白酶活性显著降低(P<0.05),饲喂后12.0 h极显著降低(P<0.01),分别降低了45.70%、59.49%。
|
|
表 9 添加醋酸棉酚对绵羊瘤胃液蛋白酶活性的影响 Table 9 Effects of adding gossypol acetate on rumen fluid protease activity in sheep (n=4) |
由表 10可知,试验Ⅰ期绵羊瘤胃液淀粉酶活性先降低,在饲喂后3.0 h呈上升趋势,试验Ⅱ期在饲喂后6.0 h呈上升趋势,均在饲喂后12.0 h恢复至饲喂前水平。添加醋酸棉酚对试验Ⅰ期及试验Ⅱ期绵羊瘤胃淀粉酶活性均无显著影响(P>0.05)。
|
|
表 10 添加醋酸棉酚对绵羊瘤胃液淀粉酶活性的影响 Table 10 Effects of adding gossypol acetate on rumen fluid amylase activity in sheep (n=4) |
添加醋酸棉酚对绵羊瘤胃液细菌数量无显著影响,试验Ⅰ期添加醋酸棉酚显著降低绵羊瘤胃原虫数量。体外发酵时,棉酚占培养底物量的浓度为0.1 mg/g,对瘤胃细菌数量无显著影响,而原虫数量增加[8],与本试验结果不一致。这可能是因为本试验中每只羊每天在饲粮中添加600 mg醋酸棉酚时瘤胃液中棉酚浓度为0.59~2.02 mg/mL,存在添加量及体内外试验环境的差异。试验Ⅱ期棉酚对绵羊瘤胃液原虫的数量无显著影响。这说明在本试验添加量及添加时间下,短期添加醋酸棉酚可能对瘤胃原虫的生长繁殖具有一定的抑制作用,较长时间添加醋酸棉酚对绵羊瘤胃细菌及原虫的生长繁殖无显著影响。
3.2 添加醋酸棉酚对绵羊瘤胃液pH及代谢产物的影响添加醋酸棉酚对绵羊瘤胃pH、NH3-N浓度变化趋势无显著影响。在饲喂前(即0 h)试验组绵羊瘤胃液NH3-N浓度显著高于对照组,可能是因为醋酸棉酚降低了饲喂后6.0、9.0、12.0 h瘤胃液蛋白酶的活性,在抑制作用消除后微生物对饲粮中蛋白质、内源性蛋白、非蛋白氮的降解作用增强,导致饲喂前NH3-N浓度升高[16]。试验Ⅰ期饲喂后9.0、12.0 h,绵羊瘤胃液丙酸浓度显著降低,丙酸是糖异生作用的主要前体物质[17-18],棉酚可能在饲喂后9.0、12.0 h抑制了参与绵羊瘤胃碳水化合物代谢的微生物酶活性。添加100 mg/kg饲粮游离棉酚时对绵羊瘤胃液pH、NH3-N浓度变化趋势无显著影响,饲喂后12.0 h丙酸浓度降低[9],与本试验结果相似。在饲喂后6.0、9.0、12.0 h绵羊瘤胃液戊酸、异戊酸、异丁酸浓度显著降低,瘤胃中异位酸(异戊酸、异丁酸及2-甲基丁酸)是瘤胃中蛋白质降解后支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)经氧化脱氨基或脱羧基后的产物[19-20],瘤胃中异戊酸、异丁酸浓度降低可能与瘤胃蛋白酶活性下降有关。支链脂肪酸是瘤胃纤维素分解菌的营养因子[21],在本试验条件下,在饲喂后6.0、9.0、12.0 h瘤胃纤维素酶活性呈下降趋势。
3.3 添加醋酸棉酚对绵羊瘤胃液纤维素酶、淀粉酶、蛋白酶活性的影响纤维素酶、淀粉酶由瘤胃微生物分泌,琥珀丝状杆菌、溶纤维丁酸弧菌等是分解饲料中纤维素的主要菌群,能分泌较强活性的纤维素酶[22-23];瘤胃真菌也能分泌较强活性的纤维素酶[23-24]。试验Ⅰ期,对照组绵羊的瘤胃液纤维素酶活性在饲喂后3.0 h下降,这与刘文杰等[25]研究添加赖氨酸对绵羊瘤胃消化代谢的影响中对照组纤维素酶活性的变化相似,而本试验中试验组绵羊在饲喂后3.0 h瘤胃液纤维素酶活性下降缓慢。给绵羊饲喂全棉籽后瘤胃液纤维素酶活性显著升高[26],全棉籽中不仅棉酚能够影响瘤胃微生物代谢,其较高含量的油脂降解产生的游离脂肪酸对瘤胃微生物活性及其正常的发酵活动也具有一定影响,因而,全棉籽对绵羊瘤胃纤维素酶活性的影响不完全来自于棉酚。纤维素酶、淀粉酶是碳水化合物在瘤胃消化的重要酶类。目前,尚不明确棉酚是通过直接与纤维素酶、淀粉酶结合并影响其活性,还是通过影响微生物本身的活性进而影响纤维素酶、淀粉酶的合成与分泌,对这些方面的认识需要进一步研究阐明。
添加醋酸棉酚后6.0、9.0、12.0 h绵羊瘤胃蛋白酶活性显著降低。瘤胃拟杆菌是瘤胃中最重要的蛋白分解菌[27],原虫也可以分泌较强酶活性的的蛋白酶[28],绵羊瘤胃液蛋白水解酶活性降低,可能是因为醋酸棉酚抑制了饲喂后6.0、9.0、12.0 h瘤胃液中瘤胃拟杆菌和原虫的生长,与本试验中短期添加醋酸棉酚原虫数量减少的结果相符。游离棉酚可与可溶性蛋白结合,从而降低瘤胃液中蛋白质的降解率[29]。本试验结果显示,在添加醋酸棉酚后6.0、9.0、12.0 h瘤胃液中蛋白酶活性及棉酚浓度均降低。研究表明,游离棉酚的游离羰基能够通过与酶活性部位的络合、改变活性部位的离子性质或产生空间位阻而导致酶失活[30]。对胃蛋白酶,棉酚的抑制浓度(Ki)为4.7×10-5 mol/L,即0.047 mmol/L[31]。本试验中,饲喂后6.0、9.0、12.0 h瘤胃液棉酚浓度为0.001 6~0.007 0 mmol/L,远低于抑制浓度,但却显著降低了蛋白水解酶的活性,可能是瘤胃微生物蛋白水解酶与胃蛋白酶的结构有差异,2类酶与棉酚的亲和力不同。有研究显示,瘤胃微生物蛋白酶具有以半胱氨酸、丝氨酸为活性中心的蛋白酶类特点[32]。棉酚对瘤胃微生物蛋白水解酶的影响及其可能的机制需要进一步研究。
4 结论在本试验条件下,醋酸棉酚在初期摄入后显著降低绵羊瘤胃原虫数量。醋酸棉酚通过抑制绵羊瘤胃液蛋白酶活性,降低瘤胃液中戊酸、异戊酸及异丁酸的浓度而对瘤胃内蛋白质消化代谢产生影响,这种作用主要发生在摄入醋酸棉酚6.0 h之后。醋酸棉酚对绵羊瘤胃液中的纤维素酶、淀粉酶的活性整体没有显著影响。
| [1] |
元秀晔, 谢全喜, 陈振, 等. 高效降解游离棉酚并改善棉籽粕营养品质的菌株筛选[J]. 动物营养学报, 2017, 29(9): 3258-3266. DOI:10.3969/j.issn.1006-267x.2017.09.029 |
| [2] |
金红春, 兰时乐, 胡毅, 等. 棉粕发酵前后营养成分变化研究[J]. 饲料工业, 2011, 32(13): 19-23. DOI:10.3969/j.issn.1001-991X.2011.13.006 |
| [3] |
DODOU K, ANDERSON R J, SMALL D A, et al. Investigations on gossypol:past and present developments[J]. Expert Opinion on Investigational Drugs, 2005, 14(11): 1419-1434. DOI:10.1517/13543784.14.11.1419 |
| [4] |
方琴音.饲粮不同棉籽饼用量对商品蛋鸡生产性能、蛋品质、血液生化指标的影响研究[D].硕士学位论文.雅安: 四川农业大学, 2004.
|
| [5] |
吕云峰, 王修启, 赵青余, 等. 棉酚在饲料中安全限量及畜产品中残留研究进展[J]. 中国农学通报, 2010, 26(24): 1-5. |
| [6] |
EISELE G R. A perspective on gossypol ingestion in swine[J]. Veterinary & Human Toxicology, 1986, 28(2): 118-120. |
| [7] |
ABOU-DONIA M B. Physiological effects and metabolism of gossypol[J]. Residue Reviews, 1976, 61: 125-160. |
| [8] |
石彩霞, 侯彩云, 王海荣, 等. 游离棉酚对绵羊瘤胃发酵和微生物区系的影响[J]. 中国饲料, 2013(5): 16-19. DOI:10.3969/j.issn.1004-3314.2013.05.005 |
| [9] |
候彩云.棉酚对绵羊瘤胃微生物种群及纤维物质降解的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2012.
|
| [10] |
KNUTSEN H K, BARREGÅRD L, BIGNAMI M, et al. Presence of free gossypol in whole cottonseed[J]. Efsa Journal, 2017, 15(7): e04850. |
| [11] |
屯妮萨·麦提赛伊迪.不同精粗比日粮、粗料型日粮添喂烟酰胺对绵羊瘤胃微生物代谢的影响[D].硕士学位论文.乌鲁木齐: 新疆农业大学, 2012.
|
| [12] |
邓凯平, 王锋, 马铁伟, 等. 日粮中添加不同水平紫苏籽对湖羊生长性能、瘤胃发酵及养分表观消化率的影响[J]. 草业学报, 2017, 26(5): 205-212. |
| [13] |
杨舒黎, 王加启, 胡志勇, 等. 日粮添加豆油和胡麻油对肉牛瘤胃发酵及主要微生物数量的影响[J]. 中国农业科学, 2007, 40(10): 2316-2322. DOI:10.3321/j.issn:0578-1752.2007.10.027 |
| [14] |
陈程.棉铃虫P450基因CPR-CYP6AE14/CYP9A12的异源共表达及其对棉酚降解作用研究[D].博士学位论文.石河子: 石河子大学, 2018.
|
| [15] |
张龙翔, 张庭芳, 李玲媛. 生化实验方法和技术[M]. 2版.北京: 高等教育出版社, 1997.
|
| [16] |
HRISTOV A N, ROPP J K, HUNT C W. Effect of barley and its amylopectin content on ruminal fermentation and bacterial utilization of ammonia-N in vitro[J]. Animal Feed Science and Technology, 2002, 99(1/2/3/4): 25-36. |
| [17] |
The PLOS ONE Staff. Correction:predicting in vitro rumen VFA production using CNCPS carbohydrate fractions with multiple linear models and artificial neural networks[J]. PLoS One, 2015, 10(3): e0119740. DOI:10.1371/journal.pone.0119740 |
| [18] |
SCHNEIDER I C, AMES M L, RASMUSSEN M A, et al. Fermentation of cottonseed and other feedstuffs in cattle rumen fluid[J]. Journal of Agricultural and Food Chemistry, 2002, 50(8): 2267-2273. DOI:10.1021/jf010783n |
| [19] |
FRENCH E A, BERTICS S J, ARMENTANO L E. Rumen and milk odd- and branched-chain fatty acid proportions are minimally influenced by ruminal volatile fatty acid infusions[J]. Journal of Dairy Science, 2012, 95(4): 2015-2026. |
| [20] |
孙万成, 罗毅皓, 刘祥军. 不同泌乳期牦牛乳中奇数与支链脂肪酸的分布[J]. 食品科学, 2015, 36(6): 199-201. |
| [21] |
VLAEMINCK B, FIEVEZ V, VAN LAAR H, et al. Rumen odd and branched chain fatty acids in relation to in vitro rumen volatile fatty acid productions and dietary characteristics of incubated substrates[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 88(11/12): 401-411. |
| [22] |
NSEREKO V L, MORGAVI D P, RODE L M, et al. Effects of fungal enzyme preparations on hydrolysis and subsequent degradation of alfalfa hay fiber by mixed rumen microorganisms in vitro[J]. Animal Feed Science and Technology, 2000, 88(3/4): 156-170. |
| [23] |
FESTENSTEIN G N. Cellulolytic enzymes from sheep-rumen liquor micro-organisms[J]. Biochemical Journal, 1958, 69(4): 562-567. DOI:10.1042/bj0690562 |
| [24] |
SUHARTATI F M, SURYAPRATAMA W. Increasing the in vitro enzymatic activity of cellulase and amylase from beef cattle rumen fluid supplemented with Moringa oleifera leaves and sulfur[J]. Pakistan Journal of Nutrition, 2017, 16(8): 571-576. DOI:10.3923/pjn.2017.571.576 |
| [25] |
刘文杰, 雒秋江, 钟涛, 等. 添加赖氨酸对小尾寒羊瘤胃消化代谢的影响[J]. 中国畜牧兽医, 2015, 42(10): 2658-2668. |
| [26] |
TRIPATHI M K, RAGHUVANSI K S K, MONDAL D, et al. Effect of Bt-cottonseed meal feeding on performance, fermentation, ciliates population and microbial hydrolytic enzymes in lamb[J]. African Journal of Biotechnology, 2014, 13(3): 510-522. |
| [27] |
LI F, ZHANG P Y, ZHANG G M, et al. Enhancement of corn stover hydrolysis with rumen fluid pretreatment at different solid contents:effect, structural changes and enzymes participation[J]. International Biodeterioration & Biodegradation, 2016, 119: 405-412. |
| [28] |
MORGAVI D P, BEAUCHEMIN K A, NSEREKO V L, et al. Resistance of feed enzymes to proteolytic inactivation by rumen microorganisms and gastrointestinal proteases[J]. Journal of Animal Science, 2001, 79(6): 1621-1630. DOI:10.2527/2001.7961621x |
| [29] |
REISER R, FU H C. The mechanism of gossypol detoxification by ruminant animals[J]. The Journal of Nutrition, 1962, 76(3): 215-218. |
| [30] |
CATER C M, LYMAN C M. Effect of bound gossypol in cottonseed meal on enzymic degradation[J]. Lipids, 1970, 5(9): 765-769. DOI:10.1007/BF02531390 |
| [31] |
WONG R C, NAKAGAWA Y, PERLMANN G E. Studies on the nature of the inhibition by gossypol of the transformation of pepsinogen to pepsin[J]. Journal of Biological Chemistry, 1972, 247(5): 1625-1631. |
| [32] |
FORSBERG C W, LOVELOCK L K A, KRUMHOLZ L, et al. Protease activities of rumen protozoa[J]. Applied and Environmental Microbiology, 1984, 47(1): 101-110. |




