2. 眉山职业技术学院, 眉山 620010
2. Meishan Vocational Technical College, Meishan 620010, China
动物胰岛素抵抗是指因能量代谢功能异常或氧化应激损伤等原因导致胰岛素靶器官或组织对胰岛素的敏感性降低,进而引发全身或局部的胰岛素抵抗,导致大量葡萄糖滞留于血液。而高血液葡萄糖水平会使胰岛β细胞受到损害并进一步引发胰岛素抵抗,最终阻碍机体糖原、脂肪和蛋白质合成[1]。
黄烷醇(flavanols)是广泛存在于植物中的一类黄酮化合物,具有抑菌、抗炎症、抗氧化、增强免疫等生物学功能[2]。近年来,关于黄烷醇对机体代谢综合征特别是在血糖稳态维持和胰岛素抵抗调控方面的改善作用成为新的研究热点,本文就黄烷醇对胰岛素抵抗状态下血糖稳态的调控作用及其机理作一综述,为其实际应用提供科学依据。
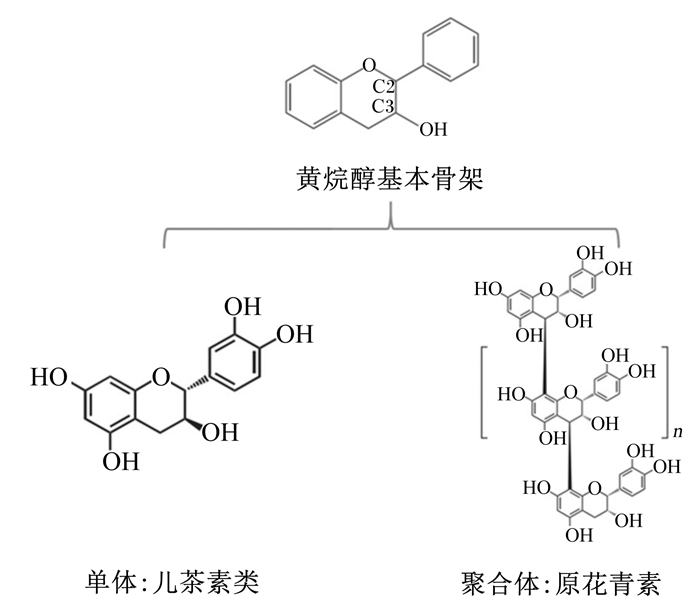
1 黄烷醇概述 1.1 黄烷醇的来源和结构黄烷醇是一类生物类黄酮物质,广泛分布于可可、银杏、山楂、茶叶、葡萄等植物中。它的基本骨架由1个羟基化的3碳含氧杂环连接2个苯环构成(图 1),以单体形式存在的统称为儿茶素类(catechins),包括儿茶素(C)、表儿茶素(EC)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)和表没食子儿茶素没食子酸酯(EGCG);以聚合体形式存在的则统称为原花青素(procyanidins)[3]。
|
图 1 黄烷醇的结构 Fig. 1 Structure of flavanols |
在胃中,寡聚黄烷醇不能被降解,而多聚黄烷醇仅能被微弱降解,因此胃液对黄烷醇的生物利用率影响不大。在小肠中,寡聚黄烷醇则大多能被直接吸收,且分子质量越小,被吸收的程度越高。Deprez等[4]利用Caco-2细胞模型对黄烷醇的渗透系数进行了测定,发现单体黄烷醇和寡聚黄烷醇具有与甘露醇相似的渗透系数,可以在Caco-2细胞中通过细胞间扩散直接进入血液。Kosińska等[5]也检测了黄烷醇从肠黏膜顶部向基底部的转移速度,发现单体黄烷醇和寡聚黄烷醇均能被肠上皮细胞快速吸收。
多聚黄烷醇则随未被小肠吸收的单体黄烷醇和寡聚黄烷醇一同进入结肠,经结肠微生物降解后被吸收进入血液循环。通常单体黄烷醇被降解为5-(3′, 4′-二羟基苯)-γ-戊内酯、5-苯基-γ-戊内酯和苯丙酸等物质,聚合黄烷醇则被降解为酚酸、苯戊内酯和其他未知物质。已有研究证明其中部分降解产物具有维持血糖稳态的功能,Fernández-Millán等[6]研究发现,3, 4-二羟基苯乙酸、2, 3-二羟基苯甲酸、3-羟基苯丙酸能提高大鼠餐后胰岛素分泌,同时保护胰岛β细胞免遭氧化应激损伤。Carrasco-Pozo等[7]研究也证实,3, 4-二羟基苯乙酸对β细胞的胰岛素分泌障碍和线粒体功能失调具有改善效果。Monagas等[8]研究表明,黄烷醇的代谢产物二羟基苯基乙酸和氢氟酸具有抗炎症功效。
2 黄烷醇对动物血糖稳态的调控作用研究者们利用胰岛素抵抗动物和肥胖动物为模型,检测了黄烷醇对动物血糖稳态的调控改善效果(表 1),研究表明,黄烷醇能降低模型动物的空腹血液葡萄糖水平并提高其葡萄糖耐量水平,原因可能与其能减少血液循环中的内毒素水平、降低机体氧化应激和炎性反应来改善代谢综合征引发的血糖不稳及其他联带效应有关。
|
|
表 1 黄烷醇对动物血糖稳态的改善效果 Table 1 Improvement effect of flavanols on blood glucose homeostasis of animals |
α-淀粉酶和α-葡萄糖苷酶是小肠中与淀粉消化相关的2种酶。黄烷醇可以延缓肠道中碳水化合物的消化和吸收,这可能是其调控处于胰岛素抵抗状态下的动物血糖稳态的最主要机制。Barrett等[14]利用Caco-2细胞模型进行碳水化合物消化酶活性测定,发现在细胞培养液中加入单体黄烷醇和寡聚黄烷醇均能有效降低细胞麦芽糖酶、蔗糖酶、异麦芽糖酶等α-葡萄糖苷酶的活性。黄烷醇能通过其苯环上的羟基与碳水化合物消化酶的非催化位点结合,使酶中的α螺旋和β折叠解构成为β转角和无规卷曲,从而引发酶的变性和失活。体外酶解试验也证实寡聚黄烷醇能抑制α-淀粉酶和α-葡萄糖苷酶的活性[14]。
淀粉在肠腔中被降解为葡萄糖后通过葡萄糖转运蛋白2(GLUT2)和钠葡萄糖共转运体1(SGLT1)进入肠上皮细胞。Hossain等[15]用黄烷醇处理爪蟾卵母细胞,发现黄烷醇能将添加葡萄糖或果糖后诱发细胞产生的SGLT1含量降低20%以上。Roopchand等[16]用黄烷醇饲喂糖尿病模型小鼠,发现黄烷醇显著降低了小鼠空肠中GLUT2的含量,其机理可能是通过非特异性的黄烷醇-蛋白质相互作用对葡萄糖转运蛋白运输活性部位产生竞争性抑制作用,其确切途径尚待探明。
3.2 通过调节胰高血糖素样肽-1(GLP-1)的活性来增加餐后胰岛素的合成GLP-1是由小肠末端和结肠的上皮L细胞分泌的一种肽类激素,可以通过刺激胰岛素、抑制升糖素、抑制胃排空和促进胰岛细胞重生的方式来降低血液葡萄糖水平[17]。二肽基肽酶-4(DPP-4)是体内广泛存在的一种跨膜糖蛋白,它的主要作用是通过切割蛋白质中倒数第2个脯氨酸或丙氨酸残基来分解体内的蛋白质[18]。目前,研发促使DPP-4失活的DPP-4抑制剂,从而延缓GLP-1的降解,已经成为治疗胰岛素抵抗的主攻方向之一。
González-Abuín等[18]研究发现,用高脂饲粮饲喂大鼠能抑制其肠道内分泌细胞的产生数量,从而降低结肠中GLP-1前体胰高血糖素原和GLP-1的基因表达,而在高脂饲粮中添加黄烷醇后,结肠中胰高血糖素原和GLP-1的基因表达均得到恢复;研究也表明黄烷醇是通过抑制DPP-4的活性来延长GLP-1的半衰期,其改善效果与DDP-4抑制剂维格列汀效果相当。体外试验也证明添加高剂量(200 mg/L)黄烷醇能将肠道中的DPP-4活性抑制至30%左右[19]。
3.3 提升胰岛β细胞存活率并促进胰岛素的分泌胰岛素抵抗常伴随着功能性β细胞团损伤,胰腺功能性β细胞团具有胰岛素分泌功能,如果β细胞团遭受损伤将严重破坏血糖稳态平衡。Fu等[20]用单体黄烷醇饲喂4周龄的Ⅰ型糖尿病非肥胖小鼠28周后,检测到其血液中抗炎症细胞因子白细胞介素-10(IL-10)的水平得到提高,小鼠的胰腺炎症状得到缓解并且胰岛β细胞数量得到提升。Fernández-Millán等[13]研究表明,用聚合黄烷醇饲喂Zucker糖尿病大鼠15周后,大鼠胰岛素抵抗指数得到降低,其机制与黄烷醇提高胰岛凋亡抑制基因β细胞淋巴瘤因子(Bcl-xL)的表达水平、降低凋亡基因β淋巴细胞瘤-2基因相关蛋白(Bax)和半胱氨酸天冬氨酸蛋白酶-3(caspase-3)的表达水平,从而阻止β细胞的凋亡有关;研究也发现黄烷醇能通过降低胰腺组织中蛋白质羰基化水平和组织硫代巴比妥酸反应物(TBARs)水平来提升机体内源抗氧化能力,从而实现对胰岛β细胞的保护作用。Furlan等[21]研究也证实了黄烷醇的抗氧化能力,单体黄烷醇处理磷脂双分子层后,采用核磁共振检测膜成分变化,结果表明,黄烷醇能抑制细胞膜中不饱和脂肪酸含量的下降,进而避免细胞膜脂遭受氧化破坏。
黄烷醇不但能通过其抗炎症、抗氧化能力提升胰岛β细胞存活率,还能促进正常状态下胰岛素的分泌水平。Huang等[22]研究发现,黄烷醇能提高胰腺细胞内的钙离子水平,激活蛋白激酶C(PKC)和胞外信号调节激酶(ERK)信号分子,从而促进胰岛素的分泌和释放。Castell-Auví等[23]研究发现,饲粮中添加黄烷醇能降低肝脏中胰岛素降解酶(Ide)的基因表达水平,表明黄烷醇能通过降低胰岛素降解酶的表达来延长胰岛素的半衰期。
3.4 促进肝脏中糖原合成并抑制糖原异生肝脏是控制血液葡萄糖水平的重要器官,它能将餐后血糖转换为肝糖原储存,从而降低餐后血液葡萄糖水平。其调节糖原生成的关键酶是葡萄糖激酶和糖原合酶,在空腹状态下调节糖原异生的主要酶是丙酮酸羧化酶、磷酸烯醇式丙酮酸羧激酶、果糖-1, 6-二磷酸酶、葡萄糖-6-磷酸酶。GLUT-2是肝脏葡萄糖转运的重要媒介,它介导葡萄糖通过易化扩散方式吸收进出肝脏,从而维持肝细胞内外的葡萄糖水平平衡[24]。黄烷醇能通过促进肝脏中GLUT-2的蛋白表达来提升肝细胞对葡萄糖的吸收速度,有利于肝糖原的合成[25]。Cordero-Herrera等[26]研究也发现,在HepG2细胞培养液中添加黄烷醇能促进细胞中糖原合酶的磷酸化进而升高糖原合酶的活性。除了促进肝糖原的合成外,黄烷醇也具有抑制肝糖异生的作用,饲喂黄烷醇能显著降低胰岛素抵抗模型小鼠肝脏中丙酮酸羧化酶和葡萄糖-6-磷酸酶的活性[27]。
3.5 降低代谢性内毒素血症和炎症,保护胰岛素信号转导途径不被破坏内毒素源自革兰氏阴性菌细胞壁外膜中的脂多糖层。如果肠屏障功能较差,在细菌溶解后内毒素可通过细胞旁扩散或活化促炎信号途径形式进入血液循环。慢性低度炎症可以破坏机体能量稳态和胰岛素信号转导,导致肥胖和代谢综合征的发生。研究表明,黄烷醇有助于减少代谢性内毒素血症的发生[28],涉及的机制包括调节肠道微生物组成和改善肠道屏障功能。
大量未被降解的黄烷醇在结肠中被肠道微生物降解生成酚酸和苯戊内酯等物质,这些降解物能充当益生素来优化肠道微生物的组成。Tzounis等[29]研究发现,单体黄烷醇与粪便样品共同发酵后,能显著提升粪便中直肠真杆菌、双歧杆菌、乳酸杆菌等有益菌的数量,并抑制球形梭菌的数量。Massot-Cladera等[30]开展了黄烷醇饲喂健康大鼠的试验,试验期6周,结果表明,黄烷醇能降低大鼠粪便中的多形拟杆菌、葡萄球菌和梭菌属的数量。Roopchand等[16]研究发现,在小鼠的高脂饲粮中添加黄烷醇能降低厚壁菌门数量/拟杆菌门数量,并显著增加盲肠和粪便中的嗜黏蛋白-艾克曼菌(A. muciniphila)菌群数量。而Everard等[31]研究证实,A. muciniphila不但具有改善胰岛素抵抗的作用,还能增加肠道黏膜屏障功能,从而阻止内毒素从肠道进入血液。
肠道微生物菌群构成与肠道屏障功能密切相关。内毒素易通过细胞旁扩散穿透屏障功能受损的肠道,进而引发机体的免疫反应并破坏正常的胰岛素信号通路。Goodrich等[32]研究发现,在健康小鼠和大鼠的饮水中加入黄烷醇能提高结肠前段紧密连接蛋白(occludin)的表达,并降低粪便中炎性细胞活化标志物——钙卫蛋白的水平。
Song等[33]在健康大鼠的标准饲粮中添加黄烷醇,也证实黄烷醇能提高小肠中闭锁连接蛋白1(ZO-1)和occludin的蛋白表达水平并降低肠黏膜通透性。Yang等[34]发现用过氧化氢(H2O2)处理小肠上皮细胞能降低occludin和ZO-1的蛋白表达水平,而添加黄烷醇能逆转H2O2对肠上皮细胞紧密连接蛋白的抑制作用。
以上研究结果表明,黄烷醇能通过优化肠道微生物的组成并提高肠道屏障功能,阻止内毒素透过肠道屏障进入血液,进而阻止后续炎性因子的激活过程,从而避免了炎性反应对胰岛素信号途径的破坏。
3.6 其他可能机理以上综述的是黄烷醇对血糖稳态调控作用的主流机理。另有部分研究表明,黄烷醇还可能通过促进肌肉和脂肪组织对外源葡萄糖的摄取效率来维持机体血糖稳态,用黄烷醇饲喂肥胖小鼠后,提升了其肌肉中与胰岛素信号通路相关的蛋白——磷酸腺苷活化蛋白激酶(AMPKα)、胰岛素受体底物-1(IRS-1)、蛋白激酶(Akt)底物AS160的磷酸化水平[35]。单体黄烷醇可改善高脂饮食小鼠受损的胰岛素信号通路,提升其脂肪组织中胰岛素受体(IR)、IRS-1、Akt、ERK1/2的磷酸化水平[36]。黄烷醇还可通过调控脂肪消化来降低高脂血症,从而降低高脂血症对血糖稳态的不利影响。在体外试验中已证实黄烷醇能有效提升脂肪酶活性,动物试验也发现其能降低餐后及空腹血浆甘油三酯水平,并增加粪脂排泄量[37]。
4 小结黄烷醇能作用于肠道、肝脏、胰脏等多个组织器官对机体血糖稳态进行调节,包括减缓肠道对碳水化合物的消化吸收速率、增加GLP-1的活性、促进胰岛β细胞分泌胰岛素、提升肝糖原合成效率以及降低机体炎症来保护胰岛素信号转导途径不被破坏。但其对机体的血糖稳态调控作用到底是黄烷醇本身还是它的肠道微生物降解产物在发挥功效尚不清楚;而关于黄烷醇如何影响肠道促胰岛素的分泌、功能发挥和降解过程也需要开展进一步的研究。
近年来,宠物营养代谢病的发生有升高趋势,其中糖尿病尤为突出,因此用黄烷醇来控制宠物血糖稳态具有较好的应用前景。目前黄烷醇在动物生产中的应用研究还较少,但根据已有的文献研究可以预测它在动物生产中会有很好的应用前景。第一,黄烷醇能激活肌肉中的IR以及胰岛素信号通路中的下游因子,促进对血液葡萄糖的吸收利用,因而有利于动物蛋白质的沉积;第二,黄烷醇的抗氧化抗炎症能力有助于提高动物的生产性能。黄烷醇作为饲料添加剂在实际生产中的应用剂量及应用形式还有待进一步的探索和研究。
| [1] |
NOMA Y, BONNER-WEIR S, LATIMER J B, et al. Translocation of glucokinase in pancreatic beta-cells during acute and chronic hyperglycemia[J]. Endocrinology, 1996, 137(4): 1485-1491. DOI:10.1210/endo.137.4.8625927 |
| [2] |
GRUNDY S M, HANSEN B, SMITH J S Jr, et al. Clinical management of metabolic syndrome:report of the American heart association/national heart, lung, and blood institute/American diabetes association conference on scientific issues related to management[J]. Circulation, 2004, 109(4): 551-556. DOI:10.1161/01.CIR.0000112379.88385.67 |
| [3] |
STRAT K M, ROWLEY Ⅳ T J, SMITHSON A T, et al. Mechanisms by which cocoa flavanols improve metabolic syndrome and related disorders[J]. The Journal of Nutritional Biochemistry, 2016, 35: 1-21. DOI:10.1016/j.jnutbio.2015.12.008 |
| [4] |
DEPREZ S, MILA I, HUNEAU J F, et al. Transport of proanthocyanidin dimer, trimer, and polymer across monolayers of human intestinal epithelial Caco-2 cells[J]. Antioxidants & Redox Signaling, 2001, 3(6): 957-967. |
| [5] |
KOSI ŃSKA A, ANDLAUER W. Cocoa polyphenols are absorbed in Caco-2 cell model of intestinal epithelium[J]. Food Chemistry, 2012, 35(3): 999-1005. |
| [6] |
FERNÁNDEZ-MILLÁN E, RAMOS S, ALVAREZ C, et al. Microbial phenolic metabolites improve glucose-stimulated insulin secretion and protect pancreatic beta cells against tert-butyl hydroperoxide-induced toxicity via ERKs and PKC pathways[J]. Food and Chemical Toxicology, 2014, 66: 245-253. DOI:10.1016/j.fct.2014.01.044 |
| [7] |
CARRASCO-POZO C, GOTTELAND M, CASTILLO R L, et al. 3, 4-dihydroxyphenylacetic acid, a microbiota-derived metabolite of quercetin, protects against pancreatic β-cells dysfunction induced by high cholesterol[J]. Experimental Cell Research, 2015, 334(2): 270-282. DOI:10.1016/j.yexcr.2015.03.021 |
| [8] |
MONAGAS M A, KHAN N, ANDRÉS-LACUEVA C, et al. Dihydroxylated phenolic acids derived from microbial metabolism reduce lipopolysaccharide-stimulated cytokine secretion by human peripheral blood mononuclear cells[J]. British Journal of Nutrition, 2009, 102(2): 201-206. DOI:10.1017/S0007114508162110 |
| [9] |
SI H W, FU Z, BABU P V A, et al. Dietary epicatechin promotes survival of obese diabetic mice and Drosophila melanogaster[J]. The Journal of Nutrition, 2011, 141(6): 1095-1100. DOI:10.3945/jn.110.134270 |
| [10] |
YAMASHITA Y, OKABE M, NATSUME M, et al. Prevention mechanisms of glucose intolerance and obesity by cacao liquor procyanidin extract in high-fat diet-fed C57BL/6 mice[J]. Archives of Biochemistry and Biophysics, 2012, 527(2): 95-104. DOI:10.1016/j.abb.2012.03.018 |
| [11] |
DORENKOTT M R, GRIFFIN L E, GOODRICH K M, et al. Oligomeric cocoa procyanidins possess enhanced bioactivity compared to monomeric and polymeric cocoa procyanidins for preventing the development of obesity, insulin resistance, and impaired glucose tolerance during high-fat feeding[J]. Journal of Agricultural and Food Chemistry, 2014, 62(10): 2216-2227. DOI:10.1021/jf500333y |
| [12] |
YAMASHITA Y, OKABE M, NATSUME M, et al. Cinnamtannin A2, a tetrameric procyanidin, increases GLP-1 and insulin secretion in mice[J]. Bioscience, Biotechnology, and Biochemistry, 2013, 77(4): 888-891. DOI:10.1271/bbb.130095 |
| [13] |
FERNÁNDEZ-MILLÁN E, CORDERO-HERRERA I, RAMOS S, et al. Cocoa-rich diet attenuates beta cell mass loss and function in young zucker diabetic fatty rats by preventing oxidative stress and beta cell apoptosis[J]. Molecular Nutrition & Food Research, 2015, 59(4): 820-824. |
| [14] |
BARRETT A, NDOU T, HUGHEY C A, et al. Inhibition of α-amylase and glucoamylase by tannins extracted from cocoa, pomegranates, cranberries, and grapes[J]. Journal of Agricultural and Food Chemistry, 2013, 61(7): 1477-1486. DOI:10.1021/jf304876g |
| [15] |
HOSSAIN S J, KATO H, AOSHIMA H, et al. Polyphenol-induced inhibition of the response of Na+/glucose cotransporter expressed in Xenopus oocytes[J]. Journal of Agricultural and Food Chemistry, 2002, 50(18): 5215-5219. DOI:10.1021/jf020252e |
| [16] |
ROOPCHAND D E, CARMODY R N, KUHN P, et al. Dietary polyphenols promote growth of the gut bacterium Akkermansia muciniphila and attenuate high-fat diet-induced metabolic syndrome[J]. Diabetes, 2015, 64(8): 2847-2858. DOI:10.2337/db14-1916 |
| [17] |
D'ALESSIO D A, KAHN S E, LEUSNER C R, et al. Glucagon-like peptide 1 enhances glucose tolerance both by stimulation of insulin release and by increasing insulin-independent glucose disposal[J]. The Journal of Clinical Investigation, 1994, 93(5): 2263-2266. DOI:10.1172/JCI117225 |
| [18] |
GONZÁLEZ-ABUÍN N, MARTÍNEZ-MICAELO N, BLAY M, et al. Grape-seed procyanidins prevent the cafeteria-diet-induced decrease of glucagon-like peptide-1 production[J]. Journal of Agricultural and Food Chemistry, 2014, 62(5): 1066-1072. DOI:10.1021/jf405239p |
| [19] |
GONZÁLEZ-ABUÍN N, MARTÍNEZ-MICAELO N, BLAY M, et al. Grape seed-derived procyanidins decrease dipeptidyl-peptidase 4 activity and expression[J]. Journal of Agricultural and Food Chemistry, 2012, 60(36): 9055-9061. DOI:10.1021/jf3010349 |
| [20] |
FU Z, YUSKAVAGE J, LIU D M. Dietary flavonol epicatechin prevents the onset of type 1 diabetes in nonobese diabetic mice[J]. Journal of Agricultural and Food Chemistry, 2013, 61(18): 4303-4309. DOI:10.1021/jf304915h |
| [21] |
FURLAN A L, JOBIN M L, PIANET I, et al. Flavanol/lipid interaction:a novel molecular perspective in the description of wine astringency & bitterness and antioxidant action[J]. Tetrahedron, 2015, 71(20): 3143-3147. DOI:10.1016/j.tet.2014.07.106 |
| [22] |
HUANG C F, CHEN Y W, YANG C Y, et al. Extract of lotus leaf (Nelumbo nucifera) and its active constituent catechin with insulin secretagogue activity[J]. Journal of Agricultural and Food Chemistry, 2011, 59(4): 1087-1094. DOI:10.1021/jf103382h |
| [23] |
CASTELL-AUVÍ A, CEDÓ L, PALLARÈS V, et al. Procyanidins modify insulinemia by affecting insulin production and degradation[J]. The Journal of Nutritional Biochemistry, 2012, 23(12): 1565-1572. DOI:10.1016/j.jnutbio.2011.10.010 |
| [24] |
KLOVER P J, MOONEY R A. Hepatocytes:critical for glucose homeostasis[J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(5): 753-758. |
| [25] |
CORDERO-HERRERA I, MARTÍN M Á, GOYA L, et al. Cocoa flavonoids attenuate high glucose-induced insulin signalling blockade and modulate glucose uptake and production in human HepG2 cells[J]. Food and Chemical Toxicology, 2014, 64: 10-19. DOI:10.1016/j.fct.2013.11.014 |
| [26] |
CORDERO-HERRERA I, MARTÍN M Á, BRAVO L, et al. Cocoa flavonoids improve insulin signalling and modulate glucose production via AKT and AMPK in HepG2 cells[J]. Molecular Nutrition & Food Research, 2013, 57(6): 974-985. |
| [27] |
HUANG P L, CHI C W, LIU T Y. Areca nut procyanidins ameliorate streptozocin-induced hyperglycemia by regulating gluconeogenesis[J]. Food and Chemical Toxicology, 2013, 55: 137-143. DOI:10.1016/j.fct.2012.12.057 |
| [28] |
GU Y, YU S, PARK J Y, et al. Dietary cocoa reduces metabolic endotoxemia and adipose tissue inflammation in high-fat fed mice[J]. The Journal of Nutritional Biochemistry, 2014, 25(4): 439-445. DOI:10.1016/j.jnutbio.2013.12.004 |
| [29] |
TZOUNIS X, VULEVIC J, KUHNLE G G, et al. Flavanol monomer-induced changes to the human faecal microflora[J]. The British Journal of Nutrition, 2008, 99(4): 782-792. DOI:10.1017/S0007114507853384 |
| [30] |
MASSOT-CLADERA M, PÉREZ-BEREZO T, FRANCH A, et al. Cocoa modulatory effect on rat faecal microbiota and colonic crosstalk[J]. Archives of Biochemistry and Biophysics, 2012, 527(2): 105-112. DOI:10.1016/j.abb.2012.05.015 |
| [31] |
EVERARD A, BELZER C, GEURTS L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(22): 9066-9071. DOI:10.1073/pnas.1219451110 |
| [32] |
GOODRICH K M, FUNDARO G, GRIFFIN L E, et al. Chronic administration of dietary grape seed extract increases colonic expression of gut tight junction protein occludin and reduces fecal calprotectin:a secondary analysis of healthy Wistar Furth rats[J]. Nutrition Research, 2012, 32(10): 787-794. DOI:10.1016/j.nutres.2012.09.004 |
| [33] |
SONG P X, ZHANG R J, WANG X X, et al. Dietary grape-seed procyanidins decreased postweaning diarrhea by modulating intestinal permeability and suppressing oxidative stress in rats[J]. Journal of Agricultural and Food Chemistry, 2011, 59(11): 6227-6232. DOI:10.1021/jf200120y |
| [34] |
YANG H X, XIAO L, YUAN Y, et al. Procyanidin B2 inhibits NLRP3 inflammasome activation in human vascular endothelial cells[J]. Biochemical pharmacology, 2014, 92(4): 599-606. DOI:10.1016/j.bcp.2014.10.001 |
| [35] |
LIU H W, WEI C C, CHEN Y J, et al. Flavanol-rich lychee fruit extract alleviates diet-induced insulin resistance via suppressing mTOR/SREBP-1 mediated lipogenesis in liver and restoring insulin signaling in skeletal muscle[J]. Molecular Nutrition & Food Research, 2016, 60(10): 2288-2296. |
| [36] |
CREMONINI E, BETTAIEB A, HAJ F G, et al. (-)-epicatechin improves insulin sensitivity in high fat diet-fed mice[J]. Archives of Biochemistry and Biophysics, 2016, 599: 13-21. DOI:10.1016/j.abb.2016.03.006 |
| [37] |
MARTÍN M A, RAMOS S, CORDERO-HERRERO I, et al. Cocoa phenolic extract protects pancreatic beta cells against oxidative stress[J]. Nutrients, 2013, 5(8): 2955-2968. DOI:10.3390/nu5082955 |




