β-葡聚糖是一种多个葡萄糖单元以不同β-糖苷键连接而成的同聚物,广泛分布于谷科植物籽实、细菌和真菌细胞壁结构当中[1]。对于其免疫调节功能的研究要追溯到1941年,由Pillemer等[2]首次发现,酵母细胞中存在具有免疫刺激的物质。并在1955年,证实酵母细胞中具有免疫刺激特性的物质来源于β-1, 3/1, 6-葡聚糖[3]。经过近几十年的探索与研究,发现β-1, 3/1, 6-葡聚糖在提高机体免疫功能、抗肿瘤、抗氧化等方面,具有明显的效果。而随着近年来我国畜牧行业“限抗”和“禁抗”进程的不断推进,寻找安全有效的替抗产品的需求也越发强烈。并且,我国β-1, 3/1, 6-葡聚糖资源丰富,但有效利用率低,每年仅啤酒生产后的酵母废泥就有5万t左右,却未能达到有效利用,直接排放还会造成环境污染[4]。此外,酵母可通过发酵大规模高效生产,保证安全和充足的原料供应。因此,探明β-1, 3/1, 6-葡聚糖的生理功能及畜牧生产中的应用效果,以此作为高效利用β-葡聚糖资源和替抗产品开发的纽带,具有很强的现实意义。
1 β-葡聚糖的结构和相关性质β-葡聚糖由多个D-葡萄糖单体聚合而成[5]。不同来源的β-葡聚糖的结构和功能也有一定差别,谷物类植物来源的β-葡聚糖主要以β-1, 3和β-1, 4糖苷键连接,其他微生物来源的β-葡聚糖主要以β-1, 3和β-1, 6糖苷键连接为主[6]。图 1中所示是微生物源β-葡聚糖的连接结构。同时,β-葡聚糖还有3种空间结构式:三螺旋、单螺旋和不规则螺旋,这3种结构是可以在不同的条件下相互转化[7]。此外,根据生理特性可将β-葡聚糖分为可溶性和不可溶性β-葡聚糖。研究表明,不可溶性的β-葡聚糖具有激活免疫相关信号通路,刺激细胞和体液免疫的功能[8];可溶性β-葡聚糖通过延迟胃排空来减缓葡萄糖吸收和增加总转运时间,但不具有免疫激活特性[9]。
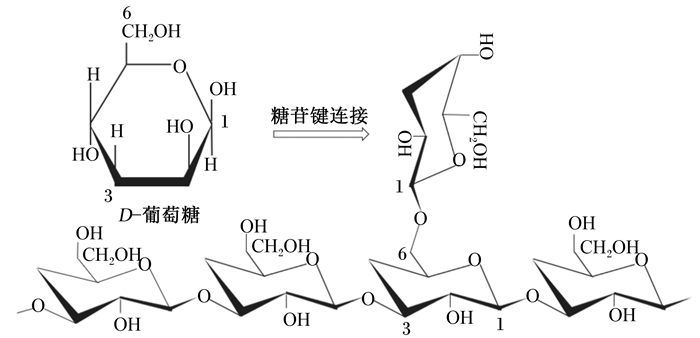
|
图 1 β-1, 3/1, 6-葡聚糖结构 Fig. 1 The structure of β-1, 3/1, 6-glucan |
针对β-1, 3/1, 6-葡聚糖的生理功能研究在国际范围内虽然已经开展多年,但近年由于树突状细胞(DC)相关C型凝集素-1(Dectin-1)作为DC上新的β-葡聚糖受体被发现,加之许多研究发现,β-葡聚糖能够刺激小鼠DC高表达簇分化抗原CD40、CD80、CD86和主要组织相容性复合体Ⅱ(MHC Ⅱ)等共刺激因子[10-12]。Kock等[13]更是在研究β-葡聚糖对人外周血单核细胞来源DC的影响时,得到相似结果。这表明β-葡聚糖在动物机体DC成熟过程中的重要作用。而就DC本身功能而言,其主要作为机体专职的抗原提呈细胞,通过参与抗原识别、加工和提呈,连接天然免疫和适应性免疫,是免疫反应的始动者和免疫应答的重要调节因子的角色。因此,β-葡聚糖可能通过诱导吞噬细胞成熟,激活相关免疫反应来调节机体免疫能力的作用日益受到关注。
外源性物质摄入或进入血液产生免疫调节效应主要通过固有免疫和适应性免疫2个过程。固有免疫反应激活适应性免疫过程离不开吞噬细胞的识别和吞噬,外源物质中的病原体相关分子模式物质(pathogen-associated molecular patterns, PAMPs),与吞噬细胞膜结构上的模式识别受体(pattern recognition receptor,PRR)识别并结合,产生吞噬过程,激活相关信号通路,进而分泌多种细胞因子和趋化因子,激活体内适应性免疫反应过程。β-葡聚糖本身就是一种PAMPs,根据研究结果显示,其在发挥免疫调控作用的过程中主要是通过Dectin-1受体、Toll样受体(Toll-like receptor,TLR)和补体3型受体(CR3)这3类PRR的作用。
2.1 β-1, 3/1, 6-葡聚糖通过Dectin-1受体的免疫调节过程Dectin-1受体是C型凝集素受体(C-type lectin like receptors,CTLRs)家族中的一种受体,Dectin-1受体通过其自身跨膜的短杆连接1个凝集素样结构域,2个单体Dectin-1受体与细胞膜外的β-葡聚糖特异性识别后,其2个单体尾部的酪氨酸的免疫活化基序,相互产生作用,诱导细胞膜中Src激酶使基序中的酪氨酸发生磷酸化,进而招募脾脏酪氨酸激酶(spleen tyrosine kinase,Syk),与磷酸化后的尾部基序结合,启动相关依赖Syk的下游信号通路[14]。其中一条是通过胞内磷酸化的磷脂酶Cγ(phospholipase Cγ,PLCγ)的作用下,将原本结合于膜上的磷脂酰肌醇三磷酸(PIP3)转化为基于膜结构的二酰基甘油(DAG)和可溶性的肌醇三磷酸,这一过程的发生可刺激蛋白激酶C(protein kinase C,PKC)的活化[15]。同时,可溶性肌醇三磷酸刺激内质网释放钙离子(Ca2+)作为第二信使,增强PKC的活化效果。活化后的PKC可以促进下游CAR09与Bcl10和Malt1 3个信号蛋白形成三聚体[16],而后作用于核转录因子-κB(nuclear factor kappa B,NF-κB)信号通路中经典的NF-κB抑制蛋白(IκB)激酶(IKK)三聚体,最终使得原本细胞内NF-κB和IκB形成的抑制态结合,经其作用后使IκB磷酸化,解除IκB抑制效果,NF-κB进入细胞核中,促进相关免疫因子的表达和分泌。另一条依赖Syk的路径是直接通过Syk诱导刺激NF-κB诱导激酶的活化,进而影响IKK三聚体,但是不通过NF-κB的调节,而是将胞内的RelB-P100二聚体通过IKK作用,转化为可进入细胞核内的RelB-P52,最终影响基因表达。值得补充的是,在Syk诱导产生的调节路径中,PKC还具有刺激细胞外调节蛋白激酶(extracellular signal-regulated kinase,ERK)的作用,此过程可以产生大量活性氧,提高吞噬细胞杀伤能力,也可作用于NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体,最终释放白细胞介素(IL)-1β免疫因子[17-18]。也有研究发现,当内质网(ER)释放Ca2+信号后,也可刺激钙调神经磷酸酶(calcineurin)将活化T细胞核因子(nuclear factor of activated T cells,NFAT)去磷酸化,使其可以进入细胞核内产生作用,可促进树突状细胞IL-2、IL-10等细胞因子的表达[19]。
除了以上依赖Syk的调节途径,还存在与Dectin-1受体下游的非酪氨酸活化(DED)基序相关的另一部分激活过程,通过激活膜上Ras-Raf-1相关通路,经过一系列变化最终使磷酸化和乙酰化的P50-P52二聚体,易位进入细胞核内,这条路径中的具体调节过程还有待进一步证实,但有研究表明,最终的形成的二聚体,对于上文提到的RelB-P52调节过程具有一定的调节效果,具有抑制其结合DNA的效应[20]。同时,并有利于辅助性T1型细胞分化所需的Raf-1依赖性IL-12 p70的产生,以及参与辅助性T17极化细胞因子的IL-1β、IL-23、IL-6的分泌过程[21]。
2.2 β-1, 3/1, 6-葡聚糖对其他受体的免疫调节过程除了主要由Dectin-1受体关联的信号通路,β-1, 3/1, 6-葡聚糖还可以与TLR2/6结合,通过髓样分化因子88(MyD88)的作用,最终使IκB与NF-κB的抑制结合在IL-1受体相关激酶(IRAK)1、IRAK4和肿瘤坏死因子受体相关因子6(TRAF6)的三聚体作用下解除,进而影响相关炎性因子的表达。也有研究表明,在β-1, 3/1, 6-葡聚糖在调节Dectin-1和TLR2/6的信号通路时,不仅可以单独激活其过程,还可以产生协同的效果,促进树突状细胞中IL-2、IL-6、IL-1β等细胞因子的表达以及巨噬细胞中IL-23、TNF-α、IL-12等细胞因子的表达[22]。综上,β-1, 3/1, 6-葡聚糖通过Dectin-1受体相关信号通路进行免疫调节的内容,其相关调节网络汇总如图 2所示。
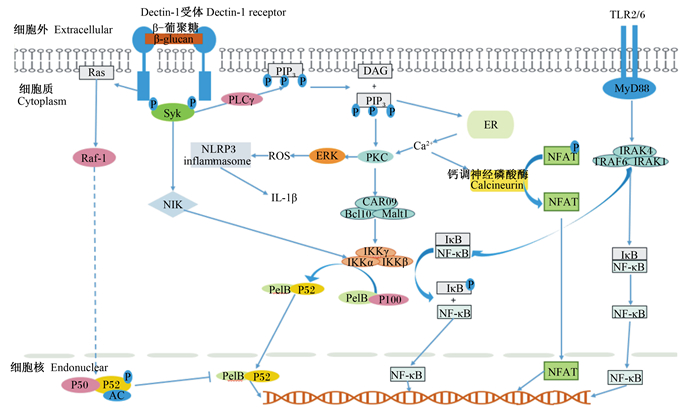
|
Syk:脾脏酪氨酸激酶spleen tyrosine kinase;PLCγ:磷脂酶Cγ phospholipase Cγ;PIP3:磷脂酰肌醇三磷酸phosphatidyl inositol triphosphate;DAG:二酰基甘油diacylglycerol;PKC:蛋白激酶C protein kinase C;ERK:细胞外调节蛋白激酶extracellular signal-regulated kinase;ROS:活性氧reactive oxygen species;NLRP3 inflammasome:NOD样受体热蛋白结构域相关蛋白3炎性小体NOD-like receptor pyrin domain-containing-3 inflammasome;IL-1β:白细胞介素-1β interleukin-1β;ER:内质网endoplasmic reticulum;NFAT:活化T细胞核因子nuclear factor of activated T cells;TLR:Toll样受体Toll-like receptor;MyD88:髓样分化因子88 myeloid differentiation factor 88;IRAK:白细胞介素-1受体相关激酶interleukin-1 receptor-associated kinase;TRAF6:肿瘤坏死因子受体相关因子6 tumor necrosis factor receptor-associated factor 6;IκB:核因子-κB抑制蛋白nuclear factor-κB inhibitor protein;NF-κB:核因子-κB nuclear factor-κB;NIK:核因子-κB诱导激酶NF-κB-inducing kinase;IKK:核因子-κB抑制蛋白激酶nuclear factor-κB inhibitor protein kinase。 图 2 Dectin-1受体相关免疫调节信号通路网络 Fig. 2 Signaling pathway network of Dectin-1 receptor-associated immune regulatory |
此外,β-1, 3/1, 6-葡聚糖还可以与巨噬细胞、中性粒细胞、DC等细胞上的CR3结合。CR3激活的重要生理功能是产生CR3依赖性细胞毒性,是吞噬细胞杀死和清除微生物的关键。CR3是由1条α-链(CD11b)和1条β-链(CD18)交织而成,α-链上具有结合iCb3的结合位点,β-链上具有识别β-1, 3/1, 6-葡聚糖的结合位点[23]。当机体内存在具有β-1, 3/1, 6-葡聚糖结构的微生物时,其β-1, 3/1, 6-葡聚糖结构被CR3上β-链的结合位点识别并结合,进而导致补体活化,补体3(C3)裂解为C3a和C3b,C3b进一步转化为iC3b,包裹调理微生物,调理后的iC3b一端与α-链的Ⅰ-结构域识别并结合,形成双重结合,最终启动细胞毒性过程,完成杀伤。这个过程中必须2个位点同时激活才能产生,因此机体内不具有β-1, 3/1, 6-葡聚糖的分子,即使经过iC3b的调理,也无法触发细胞毒性过程;从另一个角度,外源添加β-1, 3/1, 6-葡聚糖可以进入机体结合CR3,同时结合经过iC3b调理的有害细胞或物质,触发细胞毒性过程,增强免疫细胞杀伤能力,提高机体免疫能力。
3 β-1, 3/1, 6-葡聚糖在畜牧生产中的应用随着β-1, 3/1, 6-葡聚糖生理功能的研究发展,其免疫调控功能逐渐受到畜牧行业专家和学者的广泛关注。也有大量研究表明,在不同动物中应用β-1, 3/1, 6-葡聚糖可以不同程度地调节机体免疫因子水平和免疫细胞数量,总体提高机体整体免疫功能(表 1)。接下来总结来自不同种类动物的β-1, 3/1, 6-葡聚糖应用研究进展及其可能机制。
|
|
表 1 β-1, 3/1, 6-葡聚糖调节动物机体免疫功能效果 Table 1 Moderating effects of β-1, 3/1, 6-glucan on immune function of animals |
β-1, 3/1, 6-葡聚糖在家禽中的应用研究主要集中在作为免疫调节剂对肉鸡抵御病害、缓解疾病或病毒感染带来的生长抑制和机体损伤[32-33]。Levine等[24]研究发现,在使用艾美球虫对肉鸡进行攻毒后发现,补充β-1, 3/1, 6-葡聚糖可显著提高饲料转化率,显著降低肠道损伤评分,并提高肠道中巨噬细胞数量和其他免疫因子的表达。也有研究表明,β-1, 3/1, 6-葡聚糖产品可以显著降低艾美球虫感染后的十二指肠和空肠的病变程度,并提高肠道中IL-18等细胞因子的表达量,减少一氧化氮合酶(iNOS)和干扰素-γ(IFN-γ)的表达量[25]。因此,β-1, 3/1, 6-葡聚糖可能通过提高机体免疫水平,抵御球虫感染以及缓解球虫感染对于家禽肠道的损伤,最终提高饲料转化率,降低感染带来的生长抑制。此外,β-1, 3/1, 6-葡聚糖还可通过特异性提高肠道和血清中免疫球蛋白A(IgA)和免疫球蛋白G(IgG)含量,有效缓解沙门氏菌感染带来的生长抑制以及降低其盲肠定植和损伤内脏器官的水平[26]。在Shao等[27]的研究中,补充β-1, 3/1, 6-葡聚糖不仅显著增加沙门氏菌感染后肉鸡的绒毛高度、绒毛高度/隐窝深度值以及杯状细胞数量,还增加了空肠中分泌型免疫球蛋白A(sIgA)表达细胞数和sIgA含量,提高机体免疫水平,缓解肠道损伤。这说明补充β-1, 3/1, 6-葡聚糖可以提高机体整体免疫功能,对于寄生虫和细菌等感染病原都有显著的免疫效果。根据Horst等[34]的研究表明,在接种新城疫病毒、禽传染性支气管炎病毒、传染性法氏囊病毒疫苗后,补充添加β-1, 3/1, 6-葡聚糖可显著提高抗体滴度水平,并且提高疫苗整体免疫效果。综合以上的研究结果和β-1, 3/1, 6-葡聚糖已知的免疫调控机理进行推测,外源添加β-1, 3/1, 6-葡聚糖可以通过激活机体先天免疫和适应性免疫系统,提高机体免疫水平,抵抗病原的感染,同时增加肠道等受损部位的免疫因子表达,缓解感染后机体的损伤,保障机体健康和生产水平。
此外,还有大量研究关注β-1, 3/1, 6-葡聚糖对家禽生产性能的影响。研究表明,肉仔鸡饲粮中添加150 mg/kg的β-1, 3/1, 6-葡聚糖可以显著提高其21日龄阶段日增重,对料重比和死淘率也有降低的效果[35]。同时,Cho等[36]的报道也显示,添加0.1%水平的β-1, 3/1, 6-葡聚糖可以提高1~35日龄阶段仔鸡的体增重。据Rajapakse等[37]的研究发现,β-1, 3/1, 6-葡聚糖作为良好的免疫调节剂,可提高肉鸡机体IL-1的分泌,诱导巨噬细胞吞噬增强,同时提高肠上皮白细胞中T淋巴细胞的百分比。同时,研究证明,IL-1主要由单核巨噬细胞产生,在免疫应答过程中,IL-1的增加可通过诱导辅助性T细胞增生,促进IL-2的产生和IL-2受体的表达,在免疫应答和组织修复中起作用[38]。可以推测β-1, 3/1, 6-葡聚糖通过调节机体免疫因子的表达和分泌,提高机体消化道组织的修复能力,缓解应激或疾病造成的损伤,进而达到提高生产性能的效果。然而,也有其他学者认为,β-1, 3/1, 6-葡聚糖对于肉鸡的促生长作用并不显著[39-40]。因此,β-1, 3/1, 6-葡聚糖在促进家禽生产性能提高方面的效果还存在争议,这也可能与试验动物品种和其生产状态不同有关,亦或是由于β-1, 3/1, 6-葡聚糖来源和添加量的差异带来的变化。
3.2 β-1, 3/1, 6-葡聚糖在家畜生产中的应用研究表明,β-1, 3/1, 6-葡聚糖具有提高猪生产性能的功能[41-43]。刘金艳等[28]报道,饲粮添加400 mg/kg的β-1, 3/1, 6-葡聚糖,与对照组和100 mg/kg抗生素组对比,可显著提高断奶仔猪平均日增重、平均日采食量,显著降低料重比;同时,添加β-1, 3/1, 6-葡聚糖显著改善了回肠的肠道形态。安尚泽等[44]也得到类似的结果。有研究表明,由于机体内部没有特异性的分解β-葡聚糖的酶存在,因此,部分未被吸收的营养物质在后肠进行微生物发酵,形成短链脂肪酸,为肠道快速吸收供能,这促进了肠上皮细胞的生长和分化,保障了肠道形态和功能的完整性[45]。同时根据Wu等[46]的报道,添加β-1, 3/1, 6-葡聚糖还可以降低脂多糖(LPS)应激后的炎症反应,可以推测,β-1, 3/1, 6-葡聚糖可能通过缓解应激的炎症反应,保护肠道形态结构,维持良好的消化吸收水平,实现生产性能的提高。综上所述,β-1, 3/1, 6-葡聚糖提高仔猪生产性能的机制可能是通过能量供给和缓解应激损伤多种途径保障动物机体内肠道的形态和功能,提高仔猪消化吸收能力来实现的。同时,潘树德等[47]的研究显示,添加不同水平β-1, 3/1, 6-葡聚糖都可有效抑制仔猪大肠中大肠杆菌的增殖,对双歧杆菌和乳酸杆菌的浓度也有不同程度的影响。这说明β-1, 3/1, 6-葡聚糖也可能通过调节肠道组织免疫功能,有效抑制有害菌定植,提高有益菌的数量,通过保证机体健康的微生态环境,达到提高生产性能的效果。此外,有研究表明,在犊牛饲粮中添加β-1, 3/1, 6-葡聚糖也有类似的提高生产性能的效果[48-49],这可能由于犊牛瘤胃消化未成形阶段,其消化特点与其他单胃动物相近,因而表现出类似的效应。
3.3 β-1, 3/1, 6-葡聚糖在水产养殖中的应用β-1, 3/1, 6-葡聚糖具有改善水产动物免疫能力和生产性能[50]。研究表明,添加β-1, 3/1, 6-葡聚糖可以提高水产动物体内溶菌酶的活性[29],同时激活补体[51],提高免疫相关细胞的数量[30],最终提高水产动物的抗病能力[31]。溶菌酶是体内主要针对溶解致病菌中黏多糖的酶,是机体内免疫外界病源的重要手段。免疫相关细胞的数目提高和溶菌酶活性增强,都是机体先天免疫激活的重要标志,这可能与添加β-1, 3/1, 6-葡聚糖后,激活了机体内吞噬细胞的吞噬作用,并且激活了相关免疫信号通路有关。机体整体免疫水平的提高,先天免疫和适应性免疫的激活,也是其抗病能力提高的重要原因。然而,也有研究表明,连续投喂β-1, 3/1, 6-葡聚糖会给鱼体带来一定负面影响[52]。Sealey等[53]和Whittington等[54]认为,β-1, 3/1, 6-葡聚糖的长期添加,会造成机体对病菌过度免疫反应,造成免疫衰竭,亦或出现对于抗原的竞争性抑制,影响机体免疫功能。同时,长期保持较高的免疫活性水平,可能也会增加机体能量的损耗,影响生产性能,但是关于潜在的免疫抑制效果还需要进一步的研究和验证。
研究表明,幼年波斯鲟鱼饲料中分别添加0.1%、0.2%和0.3%的β-1, 3/1, 6-葡聚糖,与对照组相比,显著提高了鲟鱼的体增重、生长速率和饲料转化率[55]。此外,饲喂0.2%水平的β-葡聚糖鲟鱼的体增重和生长速率显着高于其他组。在其他种类水产动物中也有相同效果[56-58]。据Guzmán-Villanueva等[59]报道,在LPS应激状态下,使用β-1, 3/1, 6-葡聚糖可以提高鱼体内超氧化物歧化酶、过氧化氢酶、氨肽酶、胰蛋白酶等抗氧化酶及消化酶的活性。因而,β-1, 3/1, 6-葡聚糖可能通过提高抗氧化酶活性来清除应激产生的过量活性氧,从而保护机体器官和组织免受损伤,保障更多的能量供给生长,提高生产性能。此外,β-1, 3/1, 6-葡聚糖可能刺激水产动物消化道中消化酶的产生和提高消化酶的活性,进而有效提高营养物质利用率,提高动物生产性能[60]。
4 小结我国存在大量的β-1, 3/1, 6-葡聚糖资源,充分的研究和合理的利用,有助于在新的替抗形势下,开发出有效的饲料添加剂产品,同时对与资源的合理配置和环境的保护也有重要的意义。然而,现阶段仍然存在一些有待进一步解决的问题:1)虽然已有研究显示β-1, 3/1, 6-葡聚糖在生产中的应用效果,但针对不同生长阶段和不同生产需要条件下的添加量还需要进一步的研究和总结;2)β-1, 3/1, 6-葡聚糖对于刺激机体免疫水平的分子机制需要进一步的探索,最终使免疫促进效果更加安全有效。
| [1] |
BALDASSANO S, ACCARDI G, VASTO S. Beta-glucans and cancer:the influence of inflammation and gut peptide[J]. European Journal of Medicinal Chemistry, 2017, 142: 486-492. DOI:10.1016/j.ejmech.2017.09.013 |
| [2] |
PILLEMER L, ECKER E E. Anticomplementary factor in fresh yeast[J]. Journal of Biological Chemistry, 1941, 137(1): 139-142. |
| [3] |
PILLEMER L, SCHOENBERG M D, BLUM L, et al. Properdin system and immunity.Ⅱ.Interaction of the properdin system with polysaccharides[J]. Science, 1955, 122(3169): 545-549. DOI:10.1126/science.122.3169.545 |
| [4] |
王志宏, 邢沈阳, 张桂荣. 啤酒废酵母中RNA和β-(1, 3)-D-葡聚糖的综合提取[J]. 东北师大学报(自然科学版), 2012, 44(2): 95-98. |
| [5] |
VANNUCCI L, KRIZAN J, SIMA P, et al. Immunostimulatory properties and antitumor activities of glucans[J]. International Journal of Oncology, 2013, 43(2): 357-364. DOI:10.3892/ijo.2013.1974 |
| [6] |
AKRAMIENĖ D, KONDROTAS A, DIDŽIAPETRIENĖ J, et al. Effects of β-glucans on the immune system[J]. Medicina, 2007, 43(8): 597. DOI:10.3390/medicina43080076 |
| [7] |
ZEKOVIĆ D B, KWIATKOWSKI S, VRVIĆM M, et al. Natural and modified (1→3)-β-D-glucans in health promotion and disease alleviation[J]. Critical Reviews in Biotechnology, 2005, 25(4): 205-230. DOI:10.1080/07388550500376166 |
| [8] |
HUANG H B, OSTROFF G R, LEE C K, et al. Relative contributions of Dectin-1 and complement to immune responses to particulate β-glucans[J]. The Journal of Immunology, 2012, 189(1): 312-317. DOI:10.4049/jimmunol.1200603 |
| [9] |
CUMMINGS J H, STEPHEN A M. Carbohydrate terminology and classification[J]. European Journal of Clinical Nutrition, 2007, 61(Suppl.1): S5-S18. |
| [10] |
YOSHITOMI H, SAKAGUCHI N, KOBAYASHI K, et al. A role for fungal β-glucans and their receptor Dectin-1 in the induction of autoi-mmune arthritis in genetically susceptible mice[J]. Journal of Experimental Medicine, 2005, 201(6): 949-960. DOI:10.1084/jem.20041758 |
| [11] |
SAIJO S, FUJIKADO N, FURUTA T, et al. Dectin-1 is required for host defense against Pneumocystis carinii but not against Candida albicans[J]. Nature Immunology, 2007, 8(1): 39-46. |
| [12] |
XU S L, HUO J X, LEE K G, et al. Phospholipase Cγ2 is critical for Dectin-1-mediated Ca2+ flux and cytokine production in dendritic cells[J]. Journal of Biological Chemistry, 2009, 284(11): 7038-7046. DOI:10.1074/jbc.M806650200 |
| [13] |
KOCK G, BRINGMANN A, HELD S A E, et al. Regulation of Dectin-1-mediated dendritic cell activation by peroxisome proliferator-activated receptor-gamma ligand troglitazone[J]. Blood, 2011, 117(13): 3569-3574. DOI:10.1182/blood-2010-08-302224 |
| [14] |
PLATO A, WILLMENT J A, BROWN G D. C-type lectin-like receptors of the Dectin-1 cluster:ligands and signaling pathways[J]. International Reviews of Immunology, 2013, 32(2): 134-156. DOI:10.3109/08830185.2013.777065 |
| [15] |
LOWELL C A. Src-family and syk kinases in activating and inhibitory pathways in innate immune cells:signaling cross talk[J]. Cold Spring Harbor Perspectives in Biology, 2011, 3(3): a002352. |
| [16] |
RAWLINGS D J, SOMMER K, MORENO-GARCÍA M E. The CARMA1 signalosome links the signalling machinery of adaptive and innate immunity in lymphocytes[J]. Nature Reviews Immunology, 2006, 6(11): 799-812. DOI:10.1038/nri1944 |
| [17] |
GROSS O, POECK H, BSCHEIDER M, et al. Syk kinase signalling couples to the Nlrp3 inflammasome for anti-fungal host defence[J]. Nature, 2009, 459(7245): 433-436. DOI:10.1038/nature07965 |
| [18] |
GRINGHUIS S I, KAPTEIN T M, WEVERS B A, et al. Dectin-1 is an extracellular pathogen sensor for the induction and processing of IL-1β via a noncanonical caspase-8 inflammasome[J]. Nature Immunology, 2012, 13(3): 246-254. DOI:10.1038/ni.2222 |
| [19] |
FRIC J, ZELANTE T, WONG A Y W, et al. NFAT control of innate immunity[J]. Blood, 2012, 120(7): 1380-1389. DOI:10.1182/blood-2012-02-404475 |
| [20] |
GEIJTENBEEK T B, GRINGHUIS S I. Signalling through C-type lectin receptors:shaping immune responses[J]. Nature Reviews Immunology, 2009, 9(7): 465-479. DOI:10.1038/nri2569 |
| [21] |
SANCHO D, SOUSA C R E. Signaling by myeloid C-type lectin receptors in immunity and homeostasis[J]. Annual Review of Immunology, 2012, 30(1): 491-529. DOI:10.1146/annurev-immunol-031210-101352 |
| [22] |
NOVAK M, VETVICKA V. β-glucans, history, and the present:immunomodulatory aspects and mechanisms of action[J]. Journal of Immunotoxicology, 2008, 5(1): 47-57. DOI:10.1080/15476910802019045 |
| [23] |
ZHANG M, KIM J A, HUANG A Y C. Optimizing tumor microenvironment for cancer immunotherapy:β-glucan-based nanoparticles[J]. Frontiers in Immunology, 2018, 9: 341. DOI:10.3389/fimmu.2018.00341 |
| [24] |
LEVINE R, HORST G, TONDA R, et al. Evaluation of the effects of feeding dried algae containing beta-1, 3-glucan on broilers challenged with Eimeria[J]. Poultry Science, 2018, 97(10): 3494-3500. DOI:10.3382/ps/pey227 |
| [25] |
COX C M, SUMNERS L H, KIM S, et al. Immune responses to dietary β-glucan in broiler chicks during an Eimeria challenge[J]. Poultry Science, 2010, 89(12): 2597-2607. DOI:10.3382/ps.2010-00987 |
| [26] |
SHAO Y J, WANG Z, TIAN X Y, et al. Yeast β-D-glucans induced antimicrobial peptide expressions against Salmonella infection in broiler chickens[J]. International Journal of Biological Macromolecules, 2016, 85: 573-584. DOI:10.1016/j.ijbiomac.2016.01.031 |
| [27] |
SHAO Y J, GUO Y M, WANG Z. β-1, 3/1, 6-glucan alleviated intestinal mucosal barrier impairment of broiler chickens challenged with Salmonella enterica serovar Typhimurium[J]. Poultry Science, 2013, 92(7): 1764-1773. DOI:10.3382/ps.2013-03029 |
| [28] |
刘金艳, 王瑶, 毛俊霞, 等. 日粮添加β-葡聚糖对仔猪生长性能、肠道发育与免疫功能的影响[J]. 中国兽医学报, 2017, 37(11): 2197-2205. |
| [29] |
NGUYEN N D, VAN DANG P, LE A Q, et al. Effect of oligochitosan and oligo-β-glucan supplementation on growth, innate immunity, and disease resistance of striped catfish (Pangasianodon hypophthalmus)[J]. Biotechnology and Applied Biochemistry, 2016, 64(4): 564-571. |
| [30] |
KÜHLWEIN H, MERRIFIELD D L, RAWLING M D, et al. Effects of dietary β-(1, 3)(1, 6)-D-glucan supplementation on growth performance, intestinal morphology and haemato-immunological profile of mirror carp (Cyprinus carpio L.)[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(2): 279-289. DOI:10.1111/jpn.12078 |
| [31] |
RODRÍGUEZ I, CHAMORRO R, NOVOA B, et al. β-glucan administration enhances disease resistance and some innate immune responses in zebrafish (Danio rerio)[J]. Fish & Shellfish Immunology, 2009, 27(2): 369-373. |
| [32] |
OTT C P, OMARA I I, PERSIA M E, et al. The impact of β-glucans on performance and response of broiler chickens during a coccidiosis challenge[J]. Poultry Science, 2018, 97(8): 2713-2721. DOI:10.3382/ps/pey148 |
| [33] |
TIAN X Y, SHAO Y J, WANG Z, et al. Effects of dietary yeast β-glucans supplementation on growth performance, gut morphology, intestinal Clostridium perfringens population and immune response of broiler chickens challenged with necrotic enteritis[J]. Animal Feed Science and Technology, 2016, 215: 144-155. DOI:10.1016/j.anifeedsci.2016.03.009 |
| [34] |
HORST G, LEVINE R, CHICK R, et al. Effects of beta-1, 3-glucan (AletaTM) on vaccination response in broiler chickens[J]. Poultry Science, 2019, 98(4): 1643-1647. DOI:10.3382/ps/pey523 |
| [35] |
曲昆鹏, 张倩, 杨家昶, 等. β-葡聚糖对肉仔鸡生长性能、免疫功能和肠道微环境的影响[J]. 动物营养学报, 2016, 28(7): 2235-2242. DOI:10.3969/j.issn.1006-267x.2016.07.030 |
| [36] |
CHO J H, ZHANG Z F, KIM I H. Effects of single or combined dietary supplementation of β-glucan and kefir on growth performance, blood characteristics and meat quality in broilers[J]. British Poultry Science, 2013, 54(2): 216-221. DOI:10.1080/00071668.2013.777691 |
| [37] |
RAJAPAKSE J R P V, BUDDHIKA M D P, NAGATAKI M, et al. Effect of sophy β-glucan on immunity and growth performance in broiler chicken[J]. Journal of Veterinary Medical Science, 2010, 72(12): 1629-1632. DOI:10.1292/jvms.10-0029 |
| [38] |
宣兆艳, 卢英强, 刘东辉, 等. IL-1及VEGF在大鼠皮肤切创愈合过程中的免疫组织化学表达[J]. 吉林大学学报(医学版), 2007, 33(3): 460-463. |
| [39] |
MORALES-LÓPEZ R, AUCLAIR E, GARCÍA F, et al. Use of yeast cell walls; β-1, 3/1, 6-glucans; and mannoproteins in broiler chicken diets[J]. Poultry Science, 2009, 88(3): 601-607. DOI:10.3382/ps.2008-00298 |
| [40] |
COX C M, STUARD L H, KIM S, et al. Performance and immune responses to dietary β-glucan in broiler chicks[J]. Poultry Science, 2010, 89(9): 1924-1933. DOI:10.3382/ps.2010-00865 |
| [41] |
HISS S, SAUERWEIN H. Influence of dietary β-glucan on growth performance, lymphocyte proliferation, specific immune response and haptoglobin plasma concentrations in pigs[J]. Journal of Animal Physiology and Animal Nutrition, 2003, 87(1/2): 2-11. |
| [42] |
LEI X J, YUN H M, YANG Y, et al. Growth performance, nutrient digestibility, and selected fecal microbiota are improved by β-glucan supplementation in weaner pigs[J]. Annals of Animal Science, 2018, 18(3): 769-779. DOI:10.2478/aoas-2018-0024 |
| [43] |
WANG Z, GUO Y M, YUAN J M, et al. Effect of dietary β-1, 3/1, 6-glucan supplementation on growth performance, immune response and plasma prostaglandin E2, growth hormone and ghrelin in weanling piglets[J]. Asian-Australasian Journal of Animal Sciences, 2008, 21(5): 707-714. DOI:10.5713/ajas.2008.70559 |
| [44] |
安尚泽, 汪岩, 王雷, 等. β-葡聚糖对仔猪生长性能和肠道黏膜形态的影响[J]. 延边大学农学学报, 2012, 34(1): 79-82. DOI:10.3969/j.issn.1004-7999.2012.01.019 |
| [45] |
周梦怡, 高延东, 张建法. β-葡聚糖在胃肠道方面的生理学功能[J]. 食品工业科技, 2013, 34(18): 366-369, 374. |
| [46] |
WU C, XU Q, WANG R, et al. Effects of dietary β-glucan supplementation on growth performance and immunological and metabolic parameters of weaned pigs administered with Escherichia coli lipopolysaccharide[J]. Food & Function, 2018, 9(6): 3338-3343. |
| [47] |
潘树德, 李学俭, 边连全, 等. 酵母β-葡聚糖对断奶仔猪肠道菌群的影响[J]. 饲料工业, 2012, 33(12): 21-23. DOI:10.3969/j.issn.1001-991X.2012.12.007 |
| [48] |
周怿.酵母β-葡聚糖对早期断奶犊牛生长性能及胃肠道发育的影响[D].博士学位论文.北京: 中国农业科学院, 2010. http://cdmd.cnki.com.cn/Article/CDMD-82101-2010171083.htm
|
| [49] |
周怿, 刁其玉, 屠焰, 等. 酵母β-葡聚糖和抗生素对早期断奶犊牛生长性能和肠道菌群的影响[J]. 畜牧兽医学报, 2010, 41(6): 685-691. |
| [50] |
陈靖雯, 郭道远, 赵冰, 等. 饲料β-葡聚糖和灭活乳酸菌的添加对泥鳅幼鱼生长性能、肠脂肪酸组成及免疫性能的影响[J]. 水生生物学报, 2019, 43(1): 52-59. |
| [51] |
PAULSEN S M, LUNDE H, ENGSTAD R E, et al. In vivo effects of β-glucan and LPS on regulation of lysozyme activity and mRNA expression in Atlantic salmon (Salmo salar L.)[J]. Fish & Shellfish Immunology, 2003, 14(1): 39-54. |
| [52] |
WELKER T L, LIM C, YILDIRIM-AKSOY M, et al. Immune response and resistance to stress and Edwardsiella ictaluri challenge in channel catfish, Ictalurus punctatus, fed diets containing commercial whole-cell yeast or yeast subcomponents[J]. Journal of the World Aquaculture Society, 2010, 38(1): 24-35. |
| [53] |
SEALEY W M, BARROWS F T, HANG A, et al. Evaluation of the ability of barley genotypes containing different amounts of β-glucan to alter growth and disease resistance of rainbow trout Oncorhynchus mykiss[J]. Animal Feed Science and Technology, 2008, 141(1/2): 115-128. |
| [54] |
WHITTINGTON R, LIM C, KLESIUS P H. Effect of dietary β-glucan levels on the growth response and efficacy of Streptococcus iniae vaccine in Nile tilapia, Oreochromis niloticus[J]. Aquaculture, 2005, 248(1/2/3/4): 217-225. |
| [55] |
ARAMLI M S, KAMANGAR B, NAZARI R M. Effects of dietary β-glucan on the growth and innate immune response of juvenile Persian sturgeon, Acipenser persicus[J]. Fish & Shellfish Immunology, 2015, 47(1): 606-610. |
| [56] |
DO HUU H, SANG H M, THUY N T T. Dietary β-glucan improved growth performance, Vibrio counts, haematological parameters and stress resistance of pompano fish, Trachinotus ovatus Linnaeus, 1758[J]. Fish & Shellfish Immunology, 2016, 54: 402-410. |
| [57] |
BAI N, ZHANG W B, MAI K S, et al. Effects of discontinuous administration of β-glucan and glycyrrhizin on the growth and immunity of white shrimp Litopenaeus vannamei[J]. Aquaculture, 2010, 306(1/2/3/4): 218-224. |
| [58] |
SANG H M, FOTEDAR R. Effects of dietary β-1, 3-glucan on the growth, survival, physiological and immune response of marron, Cherax tenuimanus (Smith, 1912)[J]. Fish & Shellfish Immunology, 2010, 28(5/6): 957-960. |
| [59] |
GUZMÁN-VILLANUEVA L T, ASCENCIO-VALLE F, MACÍAS-RODRÍGUEZ M E, et al. Effects of dietary β-1, 3/1, 6-glucan on the antioxidant and digestive enzyme activities of Pacific red snapper (Lutjanus peru) after exposure to lipopolysaccharides[J]. Fish Physiology and Biochemistry, 2014, 40(3): 827-837. |
| [60] |
JUNG-SCHROERS V, ADAMEK M, JUNG A, et al. Feeding of β-1, 3/1, 6-glucan increases the diversity of the intestinal microflora of carp (Cyprinus carpio)[J]. Aquaculture Nutrition, 2016, 22(5): 1026-1039. DOI:10.1111/anu.12320 |




