2. 中国热带农业科学院热带作物品种资源研究所, 海口 571101
2. Institute of Tropical Crop Resources, Chinese Academy of Tropical Agriculture, Haikou 571101, China
随着社会经济水平和人们生活品质的提高,人们更加重视畜产品尤其是肉制品的质量。膳食脂肪的摄入量与人类健康息息相关,动物体内脂肪过度沉积或沉积过少均会影响肉的风味和人类健康,甚至还会影响饲养成本和环境保护。近年来,分子水平的研究越来越多地运用到动物营养代谢试验中。目前,能量水平对动物脂肪代谢的研究主要集中于基因定位和表达量等方面[1-2],不同能量水平对动物体内脂肪沉积及相关基因的表达量的影响不同。因此,本文将从动物的脂肪沉积和脂肪相关代谢酶基因表达量等方面,综述近年来不同能量水平对动物脂肪代谢方面的研究进展,为改变能量水平从而达到调控动物脂肪代谢的科学研究提供参考。
1 脂肪代谢途径简述动物体内存积脂肪以贮存能量。动物能量摄入过多,则主要以甘油三酯(triglyceride,TG)的形式贮存在体内;能量摄入过少,则分解体内的TG为机体提供能量, 即动物脂肪代谢分为合成代谢和分解代谢。组织中乙酰辅酶A作为原料,在乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)催化下合成丙二酸单酰辅酶A。之后丙二酸单酰辅酶A在脂肪酸合成酶(fatty acid synthetase,FAS)的催化下合成长链脂肪酸。脂肪细胞利用脂蛋白脂酶(lipoprotein lipase,LPL)将极低密度脂蛋白(very low density lipoproteins,VDLD)携带并运送的TG水解,生成的脂肪酸酯化形成TG,TG水解过程释放能量供机体利用,以维持生命活动。而动物吸收的多余的脂肪酸则合成TG,以储存能量。即ACC是脂肪合成的限速酶,FAS是脂肪酸合成的关键酶,LPL是脂肪转运的关键酶。此外,激素敏感脂肪酶(hormone-sensitive lipase,HSL)可催化TG分解为甘油和脂肪酸为机体供能,或重新合成TG,即HSL是脂肪分解的限速酶(图 1)。
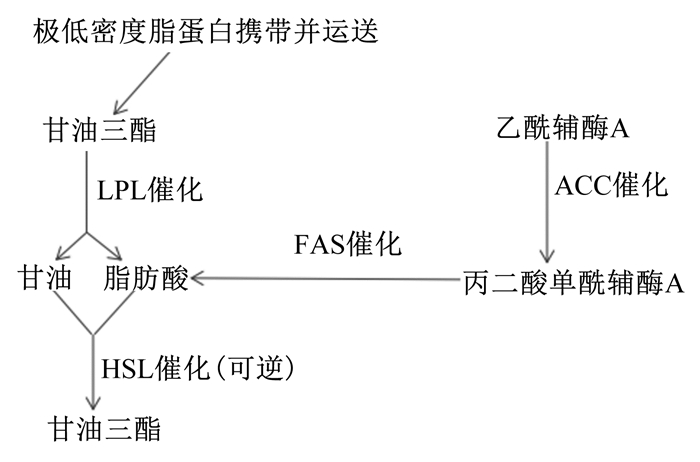
|
LPL:脂蛋白脂酶lipoprotein lipase;FAS:脂肪酸合成酶fatty acid synthetase;ACC:乙酰辅酶A羧化酶acetyl-CoA carboxylase;HSL:激素敏感脂肪酶hormone-sensitive lipase。 图 1 脂肪代谢途径 Fig. 1 Fat metabolism pathway |
ACC是长链脂肪酸从头合成的限速酶,催化乙酰辅酶A生成丙二酸单酰辅酶A,其活性的高低可影响肝脏和肌肉组织中的脂肪代谢[3]。Kinnuen等[4]对貉进行饥饿处理,结果发现,ACC基因的表达受到显著抑制。有学者对鱼进行饥饿处理,也得到了同样的结果[5]。这表明,由饥饿导致的低能量水平抑制了ACC基因的表达。有学者在培养的肝细胞中添加紫苏子油增加能量供应,发现肝细胞中ACC基因的表达量降低[6]。出现这种结果猜测是因为添加的油脂中的部分脂肪酸降低了ACC基因的表达和活性,从而调控脂肪代谢。研究表明,多不饱和脂肪酸可抑制ACC基因的表达,显著降低脂肪组织中ACC基因的表达量[7]。Maury等[8]在断奶仔鼠饲粮中加入肠道α-葡萄糖苷酶阻断剂,减少采食后肠道内葡萄糖的吸收,结果降低ACC基因的表达量。有国外研究表明,给断奶后仔鼠饲喂低能量水平饲粮,可抑制ACC基因的表达量和活性的提高[9]。由此可见,动物被供应低能量水平饲粮时,可抑制ACC基因的表达和活性。
2.2 FAS动物体内FAS的存在量直接受FAS基因的表达量的影响,FAS的活性对动物机体脂肪含量的改变有重要作用,FAS基因的表达量升高,则会显著增加TG在体内的存积而导致肥胖。有学者饲喂不同能量水平的饲粮,发现高能量水平饲粮对小鼠体内FAS基因的表达量有促进作用[10]。有学者对育肥猪饲喂高能量水平饲粮,结果表明,高能量水平显著提高了试验组肌肉中FAS基因的表达量,并增加了其体内脂肪的沉积[11]。李正娟[12]采用qPCR方法,研究滩羊在不同能量水平饲粮下背最长肌中FAS基因的表达量,结果表明,FAS基因的表达量随着饲粮能量水平的升高而增加。对家禽饲喂高能量水平饲粮的试验表明,高能量水平饲粮组的家禽肝脏中FAS的合成率和基因的表达量相对较高,并且禁食后再采食高能量水平饲粮组的家禽肝脏中FAS基因的表达量迅速增加,其基因的表达量最高升至对照组的10倍[13]。还有学者发现,高能量水平饲粮也可影响小尾寒羊的FAS基因的表达量,即高能量水平饲粮组显著高于低能量水平饲粮组[14]。这些研究表明,高能量水平饲粮很可能在转录水平上调了FAS基因的表达。
2.3 LPLLPL大量存在于心肌、肾脏、脑、骨骼肌、脂肪组织等的毛细血管内皮中,肾上腺和脂肪组织中含量最高。LPL可将VLDL携带并运送的TG水解,LPL的缺失和活性较低可引起机体严重的脂肪代谢障碍[15-16]。有研究表明,LPL的功能位点中可能存在6个功能位点与脂肪代谢相关[17]。有学者进行高能量水平饲粮对猪脂肪代谢影响的研究发现,LPL基因的表达量随能量水平升高而升高,体重也随之增加[18]。郑珂珂等[19]发现,高脂肪水平可诱导鱼肝脏中LPL基因的表达,较高脂肪水平(15.4%和18.9%)饲喂组肝脏中LPL基因的表达量最高。李庆海等[20]饲喂24头90日龄的猪不同能量水平的饲粮,发现高能量水平饲粮可提高LPL基因的表达量和活性。有学者在肉鸡饲粮中添加共轭亚油酸提高能量水平,研究能量水平对脂类代谢的影响,发现当添加量为1.2%时,LPL活性达到最高,而超出此添加量后,LPL活性开始降低[21]。高能量水平饲粮可上调动物机体皮下脂肪和肾周脂肪组织中LPL基因的表达,但基因的表达与转录机制的调控、时空性均有关联,作用机理需继续深入研究。
2.4 HSLHSL主要存在于脂肪组织、肾上腺、巨噬细胞、胎盘、卵巢细胞,心肌和骨骼肌中含量较少[22]。大量研究表明,脂肪代谢重要候选基因也包括HSL基因[23]。HSL基因的表达量对脂肪细胞内TG的沉积具有显著的抑制作用[24]。Zhang等[25]报道称,高能量水平饲粮可降低绵羊皮下脂肪、背最长肌、肱二头肌等组织中HSL基因的表达量,且HSL基因在不同组织中的表达具有特异性,皮下脂肪组织中HSL基因的表达量极显著高于背最长肌、肱二头肌和心脏组织中。有学者对泌乳中期的奶牛饲喂不同比例紫花苜蓿和大麦干草的饲粮,发现当紫花苜蓿和大麦干草的比例为63:36的低能量水平饲粮时,HSL的活性增加了7倍[26]。Stich等[27]给8对双胞胎动物饲喂低能量水平饲粮,结果表明,低能量水平饲粮组HSL活性和基因的表达量增加,并导致机体脂肪合成量降低;随着饲粮能量水平的升高,HSL基因的表达量呈降低趋势。刘作华等[11]提取猪前体脂肪细胞进行体外培养,并提供不同能量水平,研究能量水平对HSL基因表达的直接作用,结果表明,随着能量水平的增加,前体脂肪细胞中HSL基因的表达量显著升高,而在相同能量水平下,随着培养时间的延长,HSL基因的表达量有下降趋势。体内和体外试验验出现不同的结果,可能是由于HSL基因的也受机体分泌的其他物质的影响,如激素、调节因子等。
3 激素对脂肪代谢酶基因的调控 3.1 ACCACC主要通过共价和变构修饰对脂肪代谢进行调控,其变构激活剂为柠檬酸盐,共价修饰表现为可逆性磷酸化。有国外学者向大鼠体内注射胰岛素,结果发现大鼠体内ACC基因的表达量和活性均升高[28]。胰岛素可通过脱磷酸化和聚合作用激活ACC的活性,而胰高血糖素和肾上腺素则通过磷酸化和解聚作用抑制ACC的活性[29]。ACC可能参与了降低采食量的调控作用,下丘脑中丙二酰单酰辅酶A有促进进食的重要作用,进食后胰岛素和血糖水平激活ACC,消耗掉底物丙二酰单酰辅酶A,从而调控采食行为[30]。有学者在猪体内注射生长激素,结果发现试验组ACC基因的表达量显著高于对照组[31]。研究发现,在大鼠脂肪组织中,瘦素浓度的升高可降低ACC的活性[32]。激素对ACC活性的调节关系网复杂,调控机理有待进一步研究。
3.2 FAS机体内FAS的活性和基因表达受多种激素的调控。FAS活性的高低主要是由FAS基因的表达量的高低决定。在体外脂肪细胞培养基中加入10 ng/mL的胰岛素,FAS基因的表达量在培养48 h后提高了7倍[33]。另有研究表明,胰岛素可显著提高肾小管上皮和鹅肝脏中FAS活性和基因的表达量[34-35]。胰岛素与FAS基因启动子5′端胰岛素应答元件结合,从而激活FAS基因的转录。相反,胰高血糖素则降低FAS基因的表达量[16]。大量试验表明,生长激素可降低FAS的活性,并具有显著的性别效应,试验中同时向年龄体重相当的公猪和母猪组织中注射相同剂量的生长激素,发现公猪FAS活性降低程度(110%)显著低于母猪(231%)[36-37]。多个学者研究发现,猪重组生长激素可显著降低肝脏和脂肪组织中FAS基因的表达量和活性,并发现大鼠肝脏组织中FAS基因的表达量下降了55%[36, 38]。此外, 糖皮质激素也会影响组织中FAS基因的表达量[16]。
3.3 LPLLPL是动物机体内TG降解为甘油和游离脂肪酸反应的限速酶,参与并调控各种脂质代谢,以供组织氧化供能和贮存。LPL基因的表达存在组织特异性,并且不同种类的激素也影响LPL活性和基因的表达量。LPL在白色和棕色脂肪组织、骨骼肌和心肌组织中的表达和代谢作用存在差异。近期研究发现,LPL在哺乳动物胎盘组织细胞中有分泌,妊娠期糖尿病患者的胎盘和机体中LPL活性较高[39]。而哺乳期动物乳腺组织中LPL活性显著增加,脂肪组织中则显著下降。有学者检测怀孕小鼠体内LPL活性,结果表明,随着妊娠期的增加,脂肪和肝脏组织中LPL活性和基因的表达量显著下降,胎盘和乳腺组织中LPL活性和基因的表达量则显著增加[40]。有研究证实,高糖和高胰岛素水平可提高LPL活性和基因的表达量[41]。而妊娠期中,雌激素分泌下降,因此雌激素可能会抑制LPL活性和基因的表达量[42-43]。激素对LPL调控网络中可能存在负反馈等复杂机制的作用,完整的机理目前尚不可知。
3.4 HSL动物体内存在有活性和无活性2种的HSL,其中无活性HSL需要ATP磷酸化后才具有活性,而有活性HSL去磷酸化而失去活性。HSL活性的控制为复杂的级联反应,肾上腺素、去甲肾上腺素和胰高血糖素为快速酯解型激素,作用于脂肪细胞膜外的特异性受体,激活腺苷酸环化酶,ATP磷酸后恢复活性。而糖皮质激素、甲状腺素对环化腺苷酸作用较为缓慢。胰岛素具有抗酯解效应,可降低HSL基因的表达量和活性。有试验对大黄鱼饥饿胁迫进行研究,发现HSL基因的表达量在21 d后显著上升,对应肝脏和肌肉组织中脂肪含量下降[44];另外有学者用罗非鱼进行饥饿胁迫试验,也出现了同样的结果[45-46]。
4 脂肪代谢酶基因的表达量与脂肪沉积的相关性分析脂肪代谢酶基因的表达量决定了动物体脂肪的沉积。有报道称,ACC抑制剂(芳氧苯氧丙酸酯类、芳氧苯基环己二酮类等)能抑制小鼠体重的增加,减少小鼠肥胖程度,降低血液中TG和胆固醇含量[47]。研究发现,FAS基因的表达量的提高可显著增加酮体内TG的沉积量而导致肥胖[48]。FAS基因的表达量与猪酮体脂肪率之间呈显著正相关,猪脂肪沉积量增加时,其体内FAS基因的表达量也逐步提高[49]。在鹅肥肝生产过程中,随着填饲鹅体重的增加,其肝脏中FAS基因的表达量也相应提高,FAS基因的表达量和活性决定了肥鹅肝的品质[50]。鸡体内LPL基因的表达量与腹部脂肪率、皮脂率呈显著正相关,猪背最长肌肌间脂肪、体重也与LPL基因的表达量呈正相关关系[18, 51]。大量研究表明,HSL基因的表达量与动物体脂肪率、脂肪沉积呈显著负相关[12, 52]。
5 小结脂肪代谢受饲粮能量水平、环境、温度等外部环境的影响,动物机体内部的脂肪代谢具有复杂的调控网络,脂肪代谢酶基因的表达量高并不意味着对应的酶活性也高。因此,研究动物机体脂肪代谢网络及影响因素具有重要的意义。随着基因组学和生物信息学的深入发展和广泛应用,未来将更多地从分子方面揭示脂肪代谢及其调控机制。
| [1] |
初晓娜, 胡迎利, 汪以真. 肥胖基因研究进展[J]. 中国兽药杂志, 2004, 38(7): 25-28. DOI:10.3969/j.issn.1002-1280.2004.07.009 |
| [2] |
戴汉川, 龙良启. 鸭肥胖基因的分子克隆、序列分析及原核表达[J]. 畜牧兽医学报, 2005, 36(7): 641-644. DOI:10.3321/j.issn:0366-6964.2005.07.001 |
| [3] |
SONE H, KAMIYAMA S, HIGUCHI M, et al. Biotin augments acetyl COA carboxylase 2 gene expression in the hypothalamus, leading to the suppression of food intake in mice[J]. Biochemical and Biophysical Research Communication, 2016, 476(3): 134-139. DOI:10.1016/j.bbrc.2016.04.152 |
| [4] |
KINNUEN S, MÄNNTTÄRI S, HERZIG K H, et al. Effects of wintertime fasting and seasonal adaptation on AMPK and ACC in hypothalamus, adipose tissue and liver of the raccoon dog (Nyctereutes procyonoides)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2016, 192: 44-51. |
| [5] |
钱宝英, 黄红丽, 李娟, 等. 饥饿胁迫对大黄鱼激素敏感性脂肪酶和乙酰辅酶A羧化酶mRNA表达及酶活性的影响[J]. 海洋学报, 2018, 40(12): 31-39. DOI:10.3969/j.issn.0253-4193.2018.12.004 |
| [6] |
IRITANI N, KOMIYA M, FUKUDA H, et al. Lipogenic enzyme gene expression is quickly suppressed in rats by a small amount of exogenous polyunsaturated fatty acids[J]. Journal of Nutriyion, 1998, 128(6): 967-972. |
| [7] |
CLARKE S D. Regulation of fatty acid synthase gene expression:an approach for reducing fat accumulation[J]. Journal of Animal Science, 1993, 71(7): 1957-1965. DOI:10.2527/1993.7171957x |
| [8] |
MAURY J, ISSAD T, PERDEREAU D, et al. Effect of acarbose on glucose homeostasis, lipogenesis and lipogenic enzyme gene expression in adipose tissue of weaned rats[J]. Diabetologia, 1993, 36(6): 503-509. DOI:10.1007/BF02743265 |
| [9] |
FOUFELLE F, GOUHOT B, PÉGORIER J P, et al. Glucose stimulation of lipogenic enzyme gene expression in cultured white adipose tissue:a role for glucose 6-phosphate[J]. The Journal of Biology Chemistry, 1992, 267(29): 20543-20546. |
| [10] |
SMITH S, WITKOWSKI A, JOSHI A K. Structural and functional organization of the animal fatty acid synthase[J]. Progress in Lipid Research, 2003, 42(4): 289-317. DOI:10.1016/S0163-7827(02)00067-X |
| [11] |
刘作华, 杨飞云, 孔路军, 等. 日粮能量水平对生长育肥猪肌内脂肪含量以及脂肪酸合成酶和激素敏感脂酶mRNA表达的影响[J]. 畜牧兽医学报, 2007, 38(9): 934-941. DOI:10.3321/j.issn:0366-6964.2007.09.009 |
| [12] |
李正娟.日粮能量水平对滩羊肌内两种脂肪酶基因表达的影响[D].硕士学位论文.银川: 宁夏大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10749-1013377351.htm
|
| [13] |
雷明刚, 吴珍芳, 邓吕彦, 等. 猪品种间HSL基因外显子I PCR-RFLP的研究[J]. 华中农业大学学报, 2001, 20(1): 7-10. |
| [14] |
张英杰, 李宗波, 刘月琴, 等.不同能量水平饲粮对绵羊脂肪酸合成酶(FAS)基因表达的影响[C]//中国畜牧兽医学会养羊学分会全国养羊生产与学术研讨会议论文集.银川: 《中国草食动物科学》杂志社, 2010.
|
| [15] |
杨龙江, 戴瑞彤, 陈斌. 猪肌肉组织的性能及其脂肪的影响[J]. 肉类研究, 2000(2): 17-19. DOI:10.3969/j.issn.1001-8123.2000.02.007 |
| [16] |
颜新春, 汪以真, 许梓荣. 动物脂肪酸合成酶(FAS)基因表达的调控[J]. 动物营养学报, 2002, 2(14): 1-4, 8. |
| [17] |
WINO K L, KIRCHGESSNER T G, LUSIS A J, et al. Human lipoprotein lipsae complementary DNA sequence[J]. Science, 1987, 235(4796): 1638-1641. DOI:10.1126/science.3823907 |
| [18] |
廉红霞, 卢德勋, 高民. 饲粮营养水平对猪血液生化指标、背最长肌IMF含量及LPL mRNA表达量的影响[J]. 中国饲料, 2008(5): 12-15, 20. DOI:10.3969/j.issn.1004-3314.2008.05.004 |
| [19] |
郑珂珂, 朱晓鸣, 韩冬, 等. 饲料脂肪水平对瓦氏黄颡鱼生长及脂蛋白脂酶基因表达的影响[J]. 水生生物学报, 2010, 34(4): 815-821. |
| [20] |
李庆海, 范京辉, 楼立峰, 等. 日粮能量水平对长白猪体质量、脂蛋白酯酶活性及其基因表达的影响[J]. 中国兽医学报, 2015, 35(8): 1366-1370. |
| [21] |
郗艳菊.共轭亚油酸对肉鸡肌肉品质、脂类代谢和免疫机能影响的研究[D].硕士学位论文.保定: 河北农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-11920-2009131763.htm
|
| [22] |
FRAYN K N, COPPACK S W, FIELDING B A, et al. Coordinated regulation of hormone-sensitive lipase and lipoprotein lipase in human adipose tissue in vivo:implications for the control of fat storage and fat mobilization[J]. Advance in Enzyme Regulation, 1995, 35: 163-178. DOI:10.1016/0065-2571(94)00011-Q |
| [23] |
HOLST L S, LANGIN D, MULDER H, et al. Molecular cloning, genomic organization, and expression of a testicular isoform of hormone-sensitive lipase[J]. Genomics, 1996, 35(3): 441-447. DOI:10.1006/geno.1996.0383 |
| [24] |
KRAEMER F B, TAVANGAR K, HOFFMAN A R. Developmental regulation of hormone-sensitive lipase mRNA in the rat:changes in steroidogenic tissues[J]. Journal of Lipid Resume, 1991, 32(8): 1303-1310. |
| [25] |
ZHANG Y J, LIU Y Q, CHENG S Y, et al. Effects of dietary energy level on the expression of the HSL gene in different tissues of sheep[J]. Journal of Integrative Agriculture, 2012, 11(7): 1167-1172. DOI:10.1016/S2095-3119(12)60111-7 |
| [26] |
WINZELL M S, SVENSSON H, PETER A, et al. The expression of hormone-sensitive lipase in clonal β-cells and rat islets is induced by long-term exposure to high glucose[J]. Diabetes, 2001, 50(10): 2225-2230. DOI:10.2337/diabetes.50.10.2225 |
| [27] |
STICH V, HARANT I, DE GLISEZINSKI I, et al. Adipose tissue lipolysis and hormone-sensitive lipase expression during very-low-calorie diet in obese female identical twins[J]. Journal of Clinical Endocrinology and Metabolism, 1997, 82(3): 739-744. |
| [28] |
COUSIN B, CASTEILLA L, DANL C, et al. Adipose tissues from various anatomical sites are characterized by different patterns of gene expression and regulation[J]. Biochemical Journal, 1993, 292(3): 873-876. DOI:10.1042/bj2920873 |
| [29] |
MABROUK G M, HELMY I M, THAMPY K G, et al. Acute hormonal control of acetyl-CoA carboxylase.The roles of insulin, glucagon, and epinephrine[J]. The Journal of Biological Chemistry, 1990, 265(11): 6330-6338. |
| [30] |
李宏亮, 萧建中, 杨文英. 乙酰辅酶A羧化酶作为糖尿病治疗新靶点研究进展[J]. 中华医学杂志, 2006, 86(36): 2586-2588. DOI:10.3760/j:issn:0376-2491.2006.36.019 |
| [31] |
LIU C Y, GRANT A L, KIM K H, et al. Porcine somatotropin decreases acetyl-CoA carboxylase gene expression in porcine adipose tissue[J]. Domestic Animal Endocrinology, 1994, 11(1): 125-132. DOI:10.1016/0739-7240(94)90040-X |
| [32] |
FLICK P K, CHEN J L, VAGELOS P R. Effect of dietary linoleate on synthesis and degradation of fatty acid synthetase from rat liver[J]. Journal of Biological Chemistry, 1997, 252(12): 4242-4249. |
| [33] |
YIN D Z, CLARKE S D, PETERS J L, et al. Somatotropin-dependent decrease in fatty acid synthase mRNA abundance in 3T3-F442A adipocytes is the result of a decrease in both gene transcription and mRNA stability[J]. Biochemical Journal, 1998, 331(3): 815-820. |
| [34] |
郝军, 刘青娟, 郑书深, 等. 不同浓度胰岛素对人肾小管上皮细胞SREBP1、FAS表达及脂质形成的影响[J]. 中国病理杂志, 2010, 26(7): 1275-1279. |
| [35] |
韩春春, 王继文, 符自英, 等. 葡萄糖和胰岛素对鹅肝细胞脂肪酸合成酶活性及转录表达的影响[J]. 农业生物技术学报, 2009, 17(4): 634-637. DOI:10.3969/j.issn.1674-7968.2009.04.016 |
| [36] |
DONKIN S S, CHIU P Y, YIN D, et al. Porcine somatotropin differentially down-regulates expression of the GLUT4 and fatty acid synthase genes in pig adipose tissue[J]. The Journal of Nutrition, 1996, 126(6): 2568-2577. |
| [37] |
熊文中, 杨凤, 周安国. 猪重组生长激素对不同杂交肥育猪脂肪代谢调控的研究[J]. 畜牧兽医学报, 2001, 32(1): 1-4. DOI:10.3321/j.issn:0366-6964.2001.01.001 |
| [38] |
MILDNER A M, CLARKE S D. Porcine fatty acid synthase:cloning of a complementary DNA, tissue distribution of its mRNA and suppression of expression by somatotropin and dietary protein[J]. The Journal of Nutrition, 1991, 121(6): 900-907. DOI:10.1093/jn/121.6.900 |
| [39] |
王丽, 邱瑞霞, 温穗文, 等. 子痫前期孕妇血清脂蛋白酯酶与血脂相关性研究[J]. 齐齐哈尔医学院学报, 2013, 34(2): 157-159. DOI:10.3969/j.issn.1002-1256.2013.02.001 |
| [40] |
HERRERA E, LASUNCIÓN M A, GOMEZ-CORONADO D, et al. Role of lipoprotein lipase activity on lipoprotein metabolism and the fate of circulating triglycerides in pregnancy[J]. American Journal of Obstetrics and Gynecology, 1988, 158: 1575-1583. DOI:10.1016/0002-9378(88)90193-7 |
| [41] |
CARVER T D, ANDERSON S M, ALDORETTA P W, et al. Effect of low-level basal plus marked "pulsatile" hyperglycemia on insulin secretion in fetal sheep[J]. American Journal of Physiology, 1996, 271: E865-E871. |
| [42] |
HERRERA E. Implications of dietary fatty acids during pregnancy on placental, fetal and postnatal development-a review[J]. Placenta, 2002, 23(Suppl.A): S9-S19. |
| [43] |
MAGNUSSON-OLSSON A L, LAGER S, JACOBSSON B, et al. Effect of maternal triglycerides and free fatty acids on placental LPL in cultured primary trophoblast cells and in a case of maternal LPL deficiency[J]. American Journal of Physiology:Endocrinology and Metabolism, 2007, 293(1): E24-E30. DOI:10.1152/ajpendo.00571.2006 |
| [44] |
HERRERA E, ORTEGA H, ALVINO G, et al. Relationship between plasma fatty acid profile and antioxidant vitamins during normal pregnancy[J]. European Journal of Clinical Nutrition, 2004, 58(9): 1231-1238. DOI:10.1038/sj.ejcn.1601954 |
| [45] |
HAN C H, WEN X B, ZHENG Q M, et al. Effect of starvation on activities and mRNA expression of lipoprotein lipase and hormone-sensitive lipase in tilapia (Oreochromis niloticus×O. areus)[J]. Fish Physiology and Biochemistry, 2011, 37(1): 113-122. |
| [46] |
TIAN J, WEN H, ZENG L B, et al. Changes in the activities and mRNA expression levels of lipoprotein lipase (LPL), hormone-sensitive lipase (HSL) and fatty acid synthetase (FAS) of Nile tilapia (Oreochromis niloticus) during fasting and re-feeding[J]. Aquaculture, 2013, 400/401: 29-35. DOI:10.1016/j.aquaculture.2013.01.032 |
| [47] |
TONG L. Acetyl-coenzyme a carboxylase:crucial metabolic enzyme and attractive target for drug discovery[J]. Cellular and Molecular Life Science, 2005, 62(16): 1784-1803. DOI:10.1007/s00018-005-5121-4 |
| [48] |
SEMENKOVICH C F. Regulation of fatty acid syntheses (FAS)[J]. Progress in Lipid Research, 1997, 36(1): 43-53. DOI:10.1016/S0163-7827(97)00003-9 |
| [49] |
单体中, 汪以真, 刘建新, 等. 不同日龄猪腹脂酸合成酶(FAS)基因表达规律的研究[J]. 畜牧兽医学报, 2006, 37(7): 662-666. DOI:10.3321/j.issn:0366-6964.2006.07.007 |
| [50] |
彭祥伟, 范守城, 邢豫川, 等. 鹅肥肝的生产及其FAS活性测定[J]. 中国家禽, 2005, 9(1): 48-51. |
| [51] |
刘蒙, 宋代军, 齐珂珂, 等. 日粮代谢能水平对北京油鸡脂肪沉积和LPL基因表达的影响[J]. 中国畜牧兽医, 2009, 36(5): 9-13. |
| [52] |
陈利荣.猪激素敏感脂肪酶(HSL)基因PCR-RFLP多态性及其与生产性能的相关研究[D].硕士学位论文.晋中: 山西农业大学, 2005. http://cdmd.cnki.com.cn/article/cdmd-10113-2005114426.htm
|




