2. 山东隆科特酶制剂有限公司, 沂水 276400
2. Shandong Lonct Enzymes Co., Ltd., Yishui 276400, China
植物性饲料原料中果胶质成分是一种常见的抗营养因子,进入畜禽消化道后易提高食糜黏度,降低动物对饲粮营养物质的消化、吸收,直接影响畜禽对于植物性原料的利用效果。果胶酶做为一种非常重要的酶制剂,目前在诸多领域中都得以广泛应用[1]。果胶酶常用于果蔬汁澄清[2]、食品加工废水预处理与植物油提取等[3-4]。此外,果胶酶用于饲料加工业中以达到破坏植物细胞壁结构、降低食糜黏度、提高动物对于植物性原料的消化吸收效率等效果,从而实现提高动物生产性能、降低养殖成本、保护自然环境等目标。在此基础上,对果胶及果胶酶性质进行分析,阐述果胶酶在畜禽机体内发挥生物活性的作用机理,有助于新型酶制剂的开发,同时促进酶制剂行业的发展。本文主要从果胶酶的酶学特性及其在畜禽生产中应用效果等方面进行综述,拓展饲用果胶酶在畜牧生产中的科学应用方法,并对其在动物营养研究中的前景进行展望。
1 果胶与果胶酶在植物性原料中,果胶是组成植物细胞壁的主要成分之一,是一种夹杂于高等植物初生细胞壁和细胞间隙的一组多糖,是一类具有相似特性的多聚糖与寡糖的混合物,但结构差异显著[5]。果胶分子结构会因为植物种类及组织部位的不同而产生较大差异,结构区可大致分为同型半乳糖醛酸聚糖(HGA)、鼠李半乳糖醛酸聚糖Ⅰ(RG-Ⅰ)、鼠李半乳糖醛酸聚糖Ⅱ(RG-Ⅱ)3部分,其中均半乳糖醛酸构成果胶光滑区,而各种中性糖构成须状区[6-8]。果胶分子主链为直链高分子化合物,绝大部分羧基形成甲基酯,不具有甲基酯则称为果胶酸,通过α-(1, 4)糖苷键将D-吡喃半乳糖醛酸连接构成主链,侧链为不同种类的中性糖,包括L-阿拉伯糖、L-鼠李糖、D-半乳糖、D-山梨糖等[9]。果胶不具有水溶性,在植物组织中与纤维素、半纤维素、木质素、蛋白质等物质结合,表现出各部位组织的固有形态。
果胶酶是分解果胶质的一类酶的总称,根据不同的分类方法对果胶酶会有不同的划分。美国果胶酶术语制定委员会按照不同酶所作用的底物不同将果胶酶分为3类,分别为:果胶酯酶(pectinesterase, PE)、果胶酶和原果胶酶。但此种分类方法并不能突出不同酶在酶解果胶过程中的作用。所以,也可按照对底物作用方式的不同对果胶酶进行分类,可分为聚半乳糖醛酸酶(polygalacturonase, PG)、果胶酸裂解酶(pectate lyases, PL)、果胶酯酶[6]。不同酶作用于果胶和果胶酸分子,无定型的断开果胶分子中的α-(1, 4)半乳糖苷键,使之分解为寡聚糖和半乳糖醛酸。其中聚半乳糖醛酸酶可细分为无规则切断半乳糖醛酸分子内部α-(1, 4)糖苷键的内聚半乳糖醛酸酶和逐个切断半乳糖醛酸分子非还原末端α-(1, 4)糖苷键的外聚半乳糖醛酸酶;果胶酸裂解酶可细分为无规则切断甲基半乳糖醛酸基内部α-(1, 4)糖苷键的内聚甲基半乳糖醛酸酶和逐个切断甲基半乳糖醛酸基非还原末端α-(1, 4)糖苷键的外聚甲基半乳糖醛酸酶;果胶解酯酶用以催化水解半乳糖醛酸的甲酯[10-11]。果胶酶的作用方式见图 1。
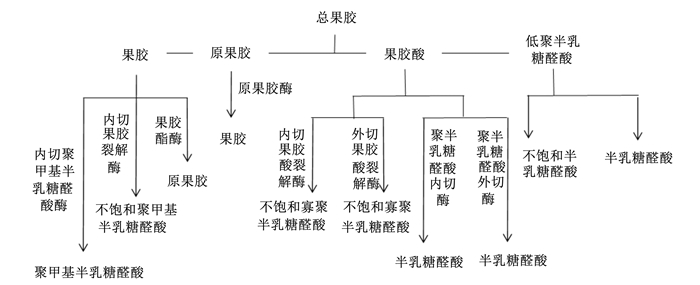
|
图 1 果胶酶的作用方式 Fig. 1 Mode of action of pectinase[10] |
果胶酶大多来源于微生物[12]。多数霉菌及部分细菌、酵母菌均具有产生果胶酶的能力,市场上常见的果胶酶多为霉菌产果胶酶,其中,黑曲霉(Aspergillusniger)在生产中的应用最为广泛[13]。黑曲霉是国际公认的安全菌株,因为其代谢物安全可直接用于食品工业加工过程,且其产果胶酶酶系较全,产酶效率高。除黑曲霉外,其他常用于生产果胶酶的菌种见表 1。
|
|
表 1 常用于生产果胶酶的菌种 Table 1 Commonly bacteria used in production of pectinase |
果胶酶的酶学特性研究一般采用层析、电泳等方法。国内外研究学者对此已进行过广泛的研究,并对果胶酶的相对分子质量、动力学性质及其影响因素进行了归纳总结。果胶酶活性的测定方法有很多[10]:黏度法、脱胶作用时间法、滴定法、α-氰基乙酰胺比色法、二硝基水杨酸(DNS)比色法等。不同测定方法各有其特点与优势,可根据不同分析条件选择合适的测定方法。
果胶酶多以单体形式存在,但也有个别多聚体。果胶酶的pH稳定范围是3.0~6.0,最适pH为3.5~5.5。最适温度为45~50 ℃,60 ℃保温条件时,酶活性下降速度快[26]。汤鸣强[11]就黑曲霉SL2-111菌株产果胶酶酶学特性进行了研究,结果表明,果胶酯酶分子质量为48.8 ku,最适pH为5.8,最适温度为60 ℃;半乳糖醛酸酶分子质量为71.5 ku,最适pH为3.0,最适温度为65 ℃。卢晓华[27]对囊酵母V25所产果胶酶酶学特性进行研究后得到如下结果,囊酵母V25所产果胶酶在55~70 ℃的温度内可以保持较高活性,60 ℃时酶活性最高;pH在3.0~6.0之间时可保持较高酶活,最适pH为5.0,适用于酸性环境;铜离子(Cu2+)、钠离子(Na+)在低浓度(1 mmol/L)下即可显著提高酶活性,Cu2+、锌离子(Zn2+)、锰离子(Mn2+)、钾离子(K+)在高浓度(10 mmol/L)下促进酶活性效果明显,钯离子(Ba2+)、铁离子(Fe2+)、钴离子(Co2+)、铝离子(Al3+)、铅离子(Pb2+)在高浓度(10 mmol/L)下会显著降低酶活性,汞离子(Hg2+)通过氧化巯基作用[28]在低浓度(1 mmol/L)下即会显著抑制酶活性。
目前,在果胶酶分子生物学研究领域已取得了重大的进展,对于多种属微生物进行果胶酶基因克隆并测序,对基因结构、功能、调控等方面开展了深入的探讨。目前克隆的微生物多为黑曲霉和欧文氏菌,克隆基因多为多聚半乳糖醛酸酶基因和果胶裂解酶基因[29]。有研究报道称,半乳糖醛酸酶一般包含360~390个残基组成的前体蛋白,且存在17~40个残基组成的N端信号肽;有部分果胶酸裂解酶的前体蛋白残基数少于250个,一般为370~380个残基;果胶酯酶的前体蛋白残基数为331个[30]。
3 果胶酶在畜禽生产中的应用 3.1 解除抗营养因子抑制,改善动物生产性能果胶是植物细胞壁的重要组成成分,常规植物源饲料原料、蔬菜、水果中,果胶含量随植物生长表现出先增高再降低的趋势[31-32]。果胶是一种常见的抗营养因子[33],随饲料进入畜禽消化道后,在消化液的作用下易产生黏性溶液,提高肠道内食糜黏度,降低消化效率,造成饲料浪费,引起动物生产性能下降。Kocher等[34]发现果胶质能显著提高肉鸡肌胃及肠道内食糜黏度,影响胃肠内物质的排空,从而更易产生饱腹感并降低采食量。Patel等[35]研究发现,果胶酶可以改善肉鸡由于果胶过量摄入造成的生长抑制,提高了雏鸡生长速度并降低其肝脏脂肪含量和血清胆固醇含量。在饲粮中添加适比例果胶酶可分解非淀粉多糖(NSP),使肠道内食糜黏度下降,以提高营养物质消化率并提升生产性能。雷廷等[36]研究表明,将果胶酶添加至饼粕类饲料(豆粕、棉籽粕、菜籽粕)中饲喂1日龄肉公鸡,除菜籽粕外,其他几种饼粕类饲料添加果胶酶后,肉鸡的代谢能及氨基酸消化率均表现出增加趋势,同时降低了各类饼粕饲料中抗营养因子毒性。
3.2 补充内源酶缺乏,改善肠道功能畜禽消化道内存在淀粉酶、蛋白酶、脂肪酶等机体能够自身合成的酶类,以上统称为内源性酶。由于动物体细胞与植物细胞结构的特异性,加之动物机体内源消化酶组成及数量均有限,导致动物不能完全消化吸收饲粮中的营养物质,造成不必要的资源浪费。Cowan等[37]研究表明,饲粮添加果胶酶(500 mg/kg)饲喂14日龄肉鸡,发现肉鸡在能量利用率及氨基酸消化率方面均有不同程度提升,并且当饲喂赖氨酸和蛋氨酸缺乏的饲粮时,添加果胶酶可以补偿氨基酸缺乏所带来的影响。王宝维等[38]通过外源添加0.249%果胶酶饲喂肉鸡,并于28、49日龄屠宰,发现不同生长阶段外源果胶酶均能显著提高肉鸡十二指肠和胰腺淀粉酶、脂肪酶、胰蛋白酶以及空肠脂肪酶和胃蛋白酶活性。果胶酶能显著提高小肠绒毛高度,以改善肉鸡肠道结构形态[39]。许毅[40]研究表明,玉米-豆粕型饲粮中适量添加果胶酶(0.025%),可显著提高生长前期肉鸡生产性能,提高粗蛋白质、粗纤维等营养物质的消化利用率,随果胶酶添加量的上升,动物机体内源消化酶活性表现出先升高后降低的总体趋势。
3.3 破坏植物细胞壁结构,提高饲料转化利用效率水溶性果胶在消化道中存在,会大幅增加肠道内食糜黏度。致使营养物质不能与消化酶良好接触,阻碍了动物对营养物质的吸收利用。果胶酶可破坏植物细胞壁中的果胶,与纤维素酶、半纤维素酶、木质素酶等协同作用对细胞壁破坏效果优于单一使用果胶酶,使得细胞内的营养物质更加完全的释放出来。
羽扇豆是一种良好的蛋白质及能量饲料来源,但由于其含有大量复杂细胞壁结构,饲料配方中配比一般不得高于10%。Ali等[41]通过在产蛋鸡含20%羽扇豆饲粮中添加0.6 g/kg果胶酶后发现,蛋鸡饲粮消化率、产蛋量均显著提高,同时提高蛋壳厚度。Tahir等[42]报道,果胶酶和纤维素酶或半纤维素酶搭配均可以显著提高肉鸡回肠末端对于粗蛋白质、有机物质的消化率,并提高玉米-豆粕型饲粮表观代谢能。
Dehghani等[43]通过在玉米秸秆、苜蓿青贮饲料制作过程中外源添加果胶酶(500 mg/kg),均可以降低中性洗涤纤维(NDF)含量与pH,提高乳酸及葡萄糖含量,以提高青贮饲料质量,提高奶牛对于该类饲料的消化吸收效率。草食动物由于特殊的消化器官构造,其饲粮主体多为秸秆、干草等高纤维原料。添加果胶酶或纤维素复合酶有助于提高草食动物对纤维素分解产物的充分消化吸收。
3.4 与其他酶配伍使用,提高酶制剂作用效果非淀粉多糖是植物性原料,尤其是杂粕原料中非常常见的抗营养因子,总量在碳水化合物中可达10%~30%。不易被动物消化,产生的黏性物质阻碍消化酶与底物接触,从而降低营养素向肠黏膜的扩散速度,降低蛋白质、脂肪等营养物质的消化利用率。添加外源性酶制剂可以控制并解除NSP的抑制作用。果胶酶与纤维素酶、半纤维素酶、木聚糖酶配伍使用,可以达到良好的使用效果。目前对于含有果胶酶的复合酶制剂研究较多。
Khalil等[44]研究表明,果胶酶可打破细胞壁结构,提高饲料营养价值。将果胶酶和木聚糖酶协同作用降解植物性饲料中的非淀粉多糖,效果优于单独使用果胶酶或木聚糖酶。Meng等[45]研究发现,肉鸡玉米型饲粮添加复合酶制剂(果胶酶1 000 U/kg、木聚糖酶1 000 U/kg、葡聚糖酶400 U/kg、纤维素酶120 U/kg、甘露聚糖酶280 U/kg、半乳糖酶180 U/kg)可显著降低料重比,提高动物非淀粉多糖消化率并促进肉鸡回肠淀粉的消化吸收。以上结果均与复合酶制剂对细胞壁的降解有关。高粱中由于抗营养因子单宁水平较高,存在毒性和胃黏膜刺激性,单宁与蛋白质、矿物质等形成化合物会降低高粱的营养价值[46-47]。Flores等[48]使用高粱饲喂生长育肥猪的试验中发现,添加0.3 kg/t多酶复合物(果胶酶、β-葡聚糖酶、半纤维素酶)可提高猪对于钙、磷及能量的利用效率,为更好地利用高粱这一原料提供可行思路。
4 小结目前,果胶酶作为一种良好的饲用酶制剂在畜禽养殖过程中已得到广泛的应用,且与其他酶制剂复配后可表现出协同效应。果胶酶通过破坏植物细胞壁中果胶结构使植物源饲料原料中营养成分得以充分释放,利于动物进一步消化吸收。同时由于动物机体不能分泌果胶酶等一系列非淀粉多糖酶,外源添加果胶酶可以补充机体内源酶的不足且促进其他内源酶的分泌,改善动物消化及肠道功能。但饲用酶制剂的研究热点仍然是蛋白酶、脂肪酶等消化酶,非淀粉多糖酶的研究多集中在纤维素酶、木聚糖酶等,且对于果胶酶在畜禽饲粮中的应用效果及作用机制研究尚少。除此之外,由于行业内缺乏相关的国家或行业标准,使得国内不同生产厂家的果胶酶产品酶活性差异较大,检测标准也存在差异。随着果胶及果胶酶研究的不断深化,果胶酶发酵菌种的选育、发酵工艺及果胶酶作用机理与高效利用技术将逐步成为研究热点。
| [1] |
PEDROLLI D B, MONTEIRO A C, GOMES E, et al. Pectin and pectinases:production, characterization and industrialapplication of microbial pectinolytic enzymes[J]. The Open Biotechnology Journal, 2009, 3: 9-18. DOI:10.2174/1874070700903010009 |
| [2] |
KASHYAP D R, VOHRA P K, CHOPRA S, et al. Applications of pectinases in the commercial sector:a review[J]. Bioresource Technology, 2001, 77(3): 215-227. DOI:10.1016/S0960-8524(00)00118-8 |
| [3] |
JUGEN. Plant protein inhibitors of cell wall degrading enzymes[J]. Trends in Plant Science, 2006, 11(7): 359-367. DOI:10.1016/j.tplants.2006.05.006 |
| [4] |
HOONDAL G S, TIWARI R P, TEWARI R, et al. Microbial alkaline pectinases and their industrial applications:a review[J]. Applied Microbiology and Biotechnology, 2002, 59(4/5): 409-418. |
| [5] |
WILLATS W G T, MCCARTNEYL, MACKIEW, et al. Pectin:cell biology and prospects for functional analysis[J]. Plant Molecular Biology, 2001, 47(1/2): 9-27. DOI:10.1023/A:1010662911148 |
| [6] |
BELARBIA. Advancesin pectin and pectinase research[J]. Plant Science, 2003, 165(5): 1169. DOI:10.1016/S0168-9452(03)00281-4 |
| [7] |
WILLATS W G T, KNOX J P, MIKKELSEN J D. Pectin:new insights into an old polymer are starting to gel[J]. Trends in Food Science & Technology, 2006, 17(3): 97-104. |
| [8] |
HARHOLTJ, SUTTANGKAKUL A, VIBE SCHELLER H. Biosynthesis of pectin[J]. Plant Physiology, 2010, 153(2): 384-395. |
| [9] |
MOHNEND. Pectin structure and biosynthesis[J]. Current Opinion in Plant Biology, 2008, 11(3): 266-277. DOI:10.1016/j.pbi.2008.03.006 |
| [10] |
胡慧磊.产聚半乳糖醛酸酶菌株的筛选、发酵条件及酶学性质的研究[D].硕士学位论文.武汉: 华中农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10504-1010010040.htm
|
| [11] |
汤鸣强.黑曲霉产果胶酶的分离纯化和酶学特性研究[D].硕士学位论文.福州: 福建师范大学, 2004. http://cdmd.cnki.com.cn/article/cdmd-10394-2004095147.htm
|
| [12] |
DALVI P, ANTHAPPAN P, DARADE N, et al. Amylase and pectinase from single source for combined desizing and scouring[J]. Colourage, 2007, 53(8): 49-50, 53-61. |
| [13] |
NAIDU G S N, PANDA T. Production of pectolytic enzymes—a review[J]. Bioprocess Engineering, 1998, 19(5): 355-361. DOI:10.1007/PL00009023 |
| [14] |
SOLÍS S, FLORES M E. Improvement of pectinase production by interspecific hybrids of Aspergillus strains[J]. Letters in Applied Microbiology, 1997, 24(2): 77-81. DOI:10.1046/j.1472-765X.1997.00352.x |
| [15] |
CHITRADON L, MAHAKHAN P, POONPAIROJ P, et al. Production of pectinases from Rhizopus sp.in solid substrates[J]. Progress in Biotechnology, 1996, 14: 853-860. |
| [16] |
PURNACHANDRAREDDY M, SARITHA K V. Bio-catalysis of mango industrial waste by newly isolated Fusarium sp.(PSTF1) for pectinase production[J]. 3 Biotech, 2015, 5(6): 893-900. |
| [17] |
CAVALITTO S F, HOURS R A, MIGNONE C F. Quantification of protopectinase, anendopolygalacturonase with pectin-releasing activity from Geotrichumklebahnii[J]. Biotechnology Techniques, 1999, 13(6): 385-390. DOI:10.1023/A:1008917912296 |
| [18] |
NASSER W, CONDEMINE G, PLANTIER R, et al. Inducing properties of analogs of 2-keto-3-deoxygluconate on the expression of pectinase genes of Erwiniachrysanthemi[J]. FEMS Microbiology Letters, 1991, 81(1): 73-78. DOI:10.1111/j.1574-6968.1991.tb04715.x |
| [19] |
AHLAWAT S, DHIMAN S S, BATTAN B, et al. Pectinase production by Bacillussubtilis and its potential application in biopreparation of cotton and micropoly fabric[J]. Process Biochemistry, 2009, 44(5): 521-526. DOI:10.1016/j.procbio.2009.01.003 |
| [20] |
TAMARU Y, DOI R H. Pectatelyase A, an enzymatic subunit of the Clostridium cellulovoranscellulosome[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(7): 4125-4129. DOI:10.1073/pnas.071045598 |
| [21] |
KLUSKENS L D, VAN ALEBEEK G J W M, WALTHER J, et al. Characterization and mode of action of an exopolygalacturonase from the hyperthermophilic bacterium Thermotogamaritima[J]. FEBS Journal, 2005, 272(21): 5464-5473. DOI:10.1111/j.1742-4658.2005.04935.x |
| [22] |
SAKAI T, OKUSHIMA M, SAWADA M. Some properties of endo-polygalacturonase from Trichosporonpenicillatum SNO-3[J]. Agricultural and Biological Chemistry, 1982, 46(9): 2223-2231. |
| [23] |
POONDLA V, BANDIKARI R, SUBRAMANYAM R, et al. Low temperature active pectinases production by Saccharomyces cerevisiaeisolate and their characterization[J]. Biocatalysisand Agricultural Biotechnology, 2015, 4(1): 70-76. DOI:10.1016/j.bcab.2014.09.008 |
| [24] |
MARÍA G M, MENDOZA L M, FARÍAS ME, et al. Isolation and selection of yeasts from wine grape ecosystem secreting cold-active pectinolytic activity[J]. International Journal of Food Microbiology, 2011, 147(2): 144-148. |
| [25] |
HARSA S, ZAROR C A, PYLE D L. Adsorption of Kluyveromycesmarxianus pectinase on CM-Sephadex gels[J]. Enzyme and Microbial Technology, 1993, 15(11): 906-915. DOI:10.1016/0141-0229(93)90165-X |
| [26] |
薛茂云, 杨爱萍, 郑萍, 等. 果胶酶酶学性质研究[J]. 中国调味品, 2016, 41(3): 74-76. DOI:10.3969/j.issn.1000-9973.2016.03.017 |
| [27] |
卢晓华.果胶酶产生菌的筛选鉴定、产酶条件优化及酶学性质研究[D].硕士学位论文.武汉: 湖北工业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10500-1016721252.htm
|
| [28] |
MANDAL A, KAR S, DAS MOHAPATRA P K, et al. Purification and characterization of an endoxylanase from the culture broth of Bacilluscereus BSA1[J]. Applied Biochemistry and Microbiology, 2011, 47(3): 277-282. |
| [29] |
GAINVORS A, NEDJAOUM N, GOGNIES S, et al. Purification and characterization of acidic endo-polygalacturonase encoded by the PGL1-1 gene from Saccharomycescerevisiae[J]. FEMS Microbiology Letters, 2000, 183(1): 131-135. DOI:10.1111/j.1574-6968.2000.tb08946.x |
| [30] |
PARENICOVÁ L, BENEN J A, KESTER H C, et al. pgaA and pgaB encode two constitutively expressed endopolygalacturonases of Aspergillusniger[J]. The Biochemical Journal, 2000, 345: 637-644. DOI:10.1042/bj3450637 |
| [31] |
BAILONI L, BONSEMBIANTE M, SCHIAVON S, et al. Estimation of the content of pectins in feeds:fractional extraction and quantitative determination[J]. Veterinary Research Communications, 2003, 27(1): 249-251. |
| [32] |
SILACCI M W, MORRISON J C. Changes in pectin content of cabernet sauvignon grape berries during maturation[J]. American Journal of Enology and Viticulture, 1990, 41(2): 111-115. |
| [33] |
ADAM C L, WILLIAMS P A, GARDEN K E, et al. Dose-dependent effects of a soluble dietary fibre (pectin) on food intake, adiposity, gut hypertrophy and gut satiety hormone secretion in rats[J]. PLoS One, 2015, 10(1): e0115438. DOI:10.1371/journal.pone.0115438 |
| [34] |
KOCHER A, CHOCT M, PORTER M D, et al. Effects of feed enzymes on nutritive value of soyabean meal fed to broilers[J]. British Poultry Science, 2002, 43(1): 54-63. DOI:10.1080/00071660120109890 |
| [35] |
PATEL M B, MCGINNIS J, PUBOLS M H. Effect of dietary cereal grain, citruspenctin, and guar gum on liver fat in laying hens and young chicks[J]. Poultry Science, 1981, 60(3): 631-636. DOI:10.3382/ps.0600631 |
| [36] |
雷廷, 呙于明, 王耀辉, 等. 饼粕类饲料原料中添加果胶酶对肉鸡回肠氨基酸消化率和代谢能的影响[J]. 动物营养学报, 2014, 26(2): 453-465. DOI:10.3969/j.issn.1006-267x.2014.02.022 |
| [37] |
COWAN W D, PETTERSSONI D R, RASMUSSEN P B.The influence of multi-component pectinase enzymes on energy and amino acid availability in vegetable proteins[C]//Proceedings of the Australian poultry science symposium.Sydney: University of Sydney, 1999: 85-88
|
| [38] |
王宝维, 姜晓霞, 孙鹏, 等. 鹅源草酸青霉产果胶酶对肉鸡消化生理影响的研究[J]. 动物营养学报, 2010, 22(2): 358-364. DOI:10.3969/j.issn.1006-267x.2010.02.018 |
| [39] |
RITZ C W, HULET R M, SELF B B, et al. Growth and intestinal morphology of male turkeys as influenced by dietary supplementation of amylase and xylanase[J]. Poultry Science, 1995, 74(8): 1329-1334. DOI:10.3382/ps.0741329 |
| [40] |
许毅.果胶酶对肉鸡玉米豆粕型日粮养分利用率的影响[D].硕士学位论文.南京: 南京农业大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10307-2004086436.htm
|
| [41] |
ALI A, WILLIAMS I H, MARTIN G B, et al.The optimal dose of pectinase in lupin-based diets for laying hens[C]//Proceedings of the 18th Australian poultry science symposium.Sydney: Poultry Research Foundation, 2006: 218-221.
|
| [42] |
TAHIR M, SALEH F, OHTSUKA A, et al. Pectinase plays an important role in stimulating digestibility of a corn-soybean meal diet in broilers[J]. The Journal of Poultry Science, 2006, 43(4): 323-329. DOI:10.2141/jpsa.43.323 |
| [43] |
DEHGHANI M R, WEISBJERG M R, HVELPLUND T, et al. Effect of enzyme addition to forage at ensiling on silage chemical composition and NDF degradation characteristics[J]. Livestock Science, 2012, 150(1/2/3): 51-58. |
| [44] |
KHALIL M, ALI A, MALECKI IA, et al.Improving the nutritive value of lupin using a combination of pectinase and xylanase[C]//Proceedings of Australian poultry science symposium.Sydney: Poultry Research Foundation, 2014: 50-53.
|
| [45] |
MENG X, SLOMINSKI B A. Nutritive values of corn, soybeanmeal, canolameal, and peas for broiler chickens as affected by a multicarbohydrase preparation of cell wall degrading enzymes[J]. Poultry Science, 2005, 84(8): 1242-1251. DOI:10.1093/ps/84.8.1242 |
| [46] |
SCHONS P F, RIES E F, BATTESTIN V, et al. Effect of enzymatic treatment on tannins and phytate in sorghum (Sorghum bicolor) and its nutritional study in rats[J]. International Journal of Food Science & Technology, 2011, 46(6): 1253-1258. |
| [47] |
IDRIS W H, ABDELRAHAMAN S M, ELMAKI H B, et al. Effect of malt pretreatment on phytate and tannin level of two sorghum (Sorghum bicolor) cultivars[J]. International Journal of Food Science & Technology, 2006, 41(10): 1229-1233. |
| [48] |
FLORES A I S, LANDÍN GM, ROSALES S G, et al. Effect of fibrolytic enzymes and phytase on nutrient digestibility in sorghum-canola based feeds for growing pigs[J]. Técnica Pecuariaen México, 2009, 47(1): 1-14. |




