2. 临沂大学农林科学学院, 临沂 276000
2. College of Agriculture and Forestry Science, Linyi University, Linyi 276000, China
沂蒙黑山羊是山东省肉皮绒兼用地方优良品种,具有耐粗饲、适应性好、抗病力强、板皮优等特性的同时还具有生长速度缓慢、母羊空怀期长等缺点[1],而代乳粉能够减少母羊空怀时间和缩短羔羊生产周期,提高繁殖效率,降低培育成本[2],改善沂蒙黑山羊生长性能,并且在优良后备种羊的培育、母羊一胎多产和体弱母羊增加羔羊的成活率等方面具有重大意义[3-4]。已有研究表明,瘤胃微生物区系定植受到断奶日龄、饲粮以及补饲时间[5-6]等影响。瘤胃功能尚未完善的羔羊早期断奶和早期补饲等措施可引起营养物质的摄入发生改变,影响瘤胃微生物区系和瘤胃组织的发育[7-8],促进大量外来微生物在瘤胃中定植。而作为早期断奶羔羊主要饲粮的羔羊代乳粉,能够极大地促进羔羊的生长发育[9-10]。但是代乳粉促进早期断奶羔羊生长发育,是否与瘤胃微生物区系变化有相关,尚未见相关研究报道。因此,本试验采用高通量测序技术旨在揭示早期饲喂代乳粉对沂蒙黑山羊羔羊瘤胃区系变化规律及其分析与生长发育的相关性问题,为羔羊饲喂代乳粉进行早期断奶培育提供理论依据。
1 材料与方法 1.1 试验设计采用单因子试验设计,选用双胎沂蒙黑山羊羔羊36只[初生体重为(1.84±0.06) kg],随机分为2组,每组6个重复,每个重复3只。对照组(B组)羔羊随母羊哺乳至75日龄,试验组(R组)羔羊于8日龄开始逐渐断奶,并训练进食代乳粉,过渡至10日龄完全饲喂代乳粉。所有羔羊在试验第15天起补饲开食料直至第75天试验结束。2组羊只分别于10、15、25、45和75日龄称重,并随机各取3只进行屠宰,收集瘤胃内容物样品。屠宰前停食、停水16 h。
1.2 试验饲粮中国农业科学院饲料研究所提供本试验所需的代乳粉(主要参照发明专利ZL201210365927.6[11])和开食料。代乳粉和开食料组成及营养水平分别见表 1、表 2。
|
|
表 1 代乳粉组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the milk replacer (DM basis) |
|
|
表 2 开食料组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of the starter (DM basis) |
采用常规分析法[12]测定代乳粉和开食料中相关的养分含量。
1.4 饲养管理将试验羔羊打上耳号,同时按照免疫程序进行免疫,在通风良好、光线良好的半开放式暖棚里进行饲养。参照王海超等[13]方法,哺喂羔羊均于13日龄开始训练采食相同的开食料,15日龄开始饲喂开食料,自由采食和饮水。
1.5 样品的采集与处理屠宰时采用颈静脉放血,屠宰后,打开腹腔,立即结扎胃贲门及幽门,将羔羊胃取出,采取瘤胃内容物,-80 ℃保存备用。
1.6 羔羊胃肠道细菌基因组DNA提取采用DNA提取试剂盒(Qiagen公司,德国)对沂蒙黑山羊瘤胃内容物DNA进行提取。
1.6.1 DNA浓度、纯度及片段完整性测定采用RS-232型核酸蛋白测定仪(伯乐SmartSpec Plus,美国)测定DNA溶液纯度与浓度,用1%琼脂糖凝胶进行电泳,电压为100 V,电泳时间为40 min,对提取的DNA片段完整性进行检测。
1.6.2 16S rRNA PCR扩增使用细菌16S V4+V5 rDNA通用引物扩增16S rRNA V4+V5可变区。引物序列(5′—3′)为515F:GTGCCAGCMGCCGCGGTAA;907R:CCGTCAATTCCTTTGAGTTT。采用New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR,确保扩增效率和准确性。
PCR产物使用2%的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用Qiagen公司胶回收试剂盒回收产物。纯化PCR产物,使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,送至诺禾致源公司使用MiSeq PE300进行16S rRNA高通量测序。
1.7 16S rRNA高通量测序及数据分析基于IIIumina MiSeq PE300 (Illumina,美国)测序平台得到的raw reads,首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤。序列过滤后,将那些具有高度相似性(97%)的序列归为一个操作分类单位(OTU),运用Blast比对程序在RDP(Ribosomal Database Project)数据库进行物种分类学分析。根据以上分类学信息,估算出样品稀释性曲线[14]、Ace指数、Chao1指数及Shannon指数、Simpson指数。
采用SAS 8.0统计软件进行单因素方差分析(one-way ANOVA),以Duncan氏法进行多重比较,P < 0.05为差异显著,P < 0.01为差异极显著。数据以平均值±标准差(mean±SD)表示,n=3。
2 结果与分析 2.1 代乳粉对沂蒙黑山羊羔羊生长性能的影响从表 3可见,15日龄补喂开食料后B组日均干物质采食量在不同日龄段均低于R组,但差异不显著(P>0.05)。
|
|
表 3 代乳粉对沂蒙黑山羊羔羊不同日龄阶段日均干物质采食量的影响 Table 3 Effects of milk replacer on average daily DM intake of Yimeng black lambs at different days of age |
|
|
表 4 代乳粉对沂蒙黑山羊羔羊体重的影响 Table 4 Effects of milk replacer on body weight of Yimeng black lambs |
|
|
表 5 代乳粉对沂蒙黑山羊羔羊日增重的影响S Table 5 Effects of milk replacer on average daily gain of Yimeng black lambs |
从表 4可见,1、10日龄时,B、R组间体重差异不显著(P>0.05),而15日龄时B组体重大于R组,差异极显著(P < 0.01);随着日龄增长,R组生长较快,到45日龄时已超过B组(P>0.05),且在75日龄时显著高于B组(P < 0.05)。
从表 5可见,羔羊日增重在1~10日龄时,R组低于B组(P>0.05),11~15日龄时,R组极显著低于B组(P < 0.01);而26~45日龄、46~75日龄时,R组高于B组,且差异显著(P < 0.05)。
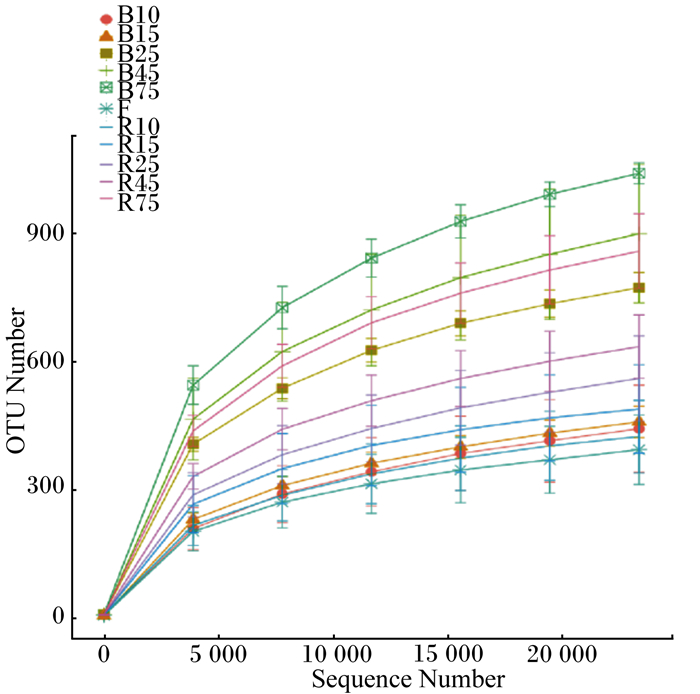
2.2 代乳粉对沂蒙黑山羊羔羊瘤胃内容物细菌菌群结构的影响 2.2.1 OTU聚类分析经过16S rDNA V4+V5区的Illumina Miseq双端测序,反映97%相似度下样品取样深度的稀释曲线见图 1,当抽取测序数据量在15 000以上时,曲线变得愈趋平缓,说明测序深度和数据量足够。B组和R组各样品稀释曲线趋向平坦,说明测序数据量渐进合理,更多的数据量只会产生少量新的物种(OTU)。B组75日龄的物种多样性最高。
|
B10、B15、B25、B45、B75分别代表B组10、15、25、45、75日龄样本;R10、R15、R25、R45、R75分别代表R组10、15、25、45、75日龄样本。下图同。 B10, B15, B25, B45 and B75 mean the samples in group B at 10, 15, 25, 45 and 75 days of age; R10, R15, R25, R45 and R75 mean the samples in group R at 10, 15, 25, 45 and 75 days of age. The same as below. 图 1 B组、R组不同饲喂天数样品稀释曲线 Fig. 1 Dilution curve of different feeding days in groups B and R |
从表 6可见,Ace指数在25日龄时,R组显著低于B组(P < 0.05),R组Chao1指数在不同日龄段均低于B组,但差异不显著(P>0.05),而Shannon指数及Simpson指数在25日龄后均低于B组,但差异不显著(P>0.05)。
|
|
表 6 B组和R组样品在97%一致性阈值下多样性指数分析 Table 6 Analysis of diversity indexes of samples in groups B and R at 97% coherence threshold |
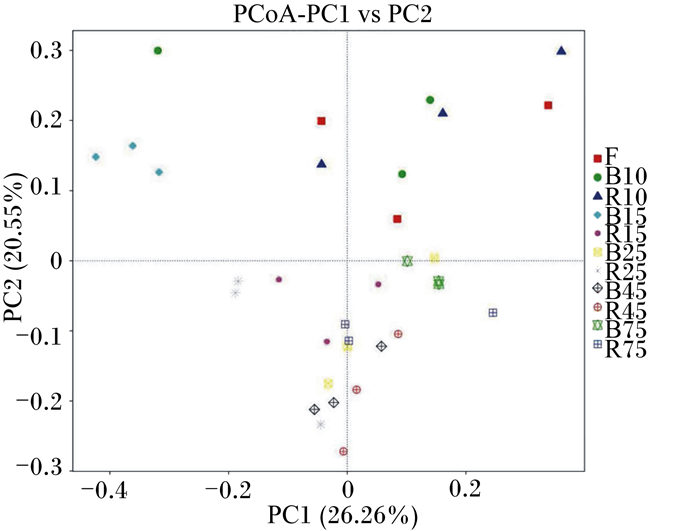
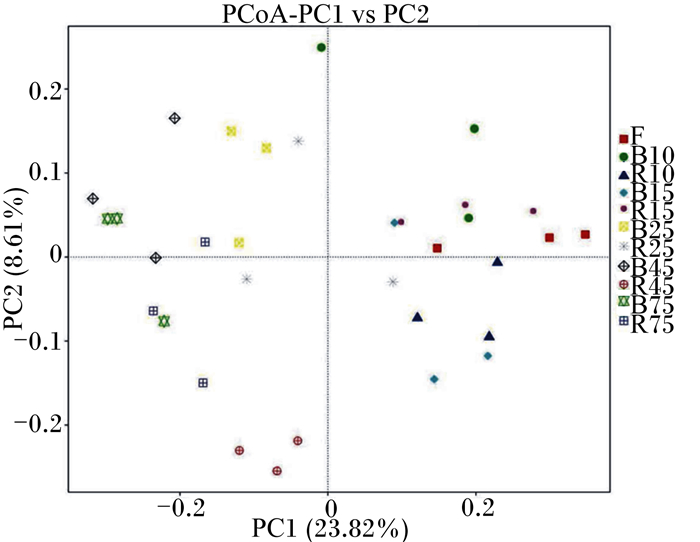
Beta多样性是对不同样品的微生物菌落构成进行比较分析,是物种组成沿环境梯度或在菌落间的变化率。由基于UniFrac的加权主坐标分析图(图 2、图 3)可知,基于UniFrac的加权(Weighted Unifrac)和非加权(Unweighted Unifrac)的主坐标分析其第一主成分和第二主成分的贡献率分别为26.26%和20.55%、23.82%和8.61%,并且试验初期R组与B组显著区分,B组、R组在10和15日龄时各样品比较分散,而B组、R组在45和75日龄时2组样品分布在同一区域。这种现象说明随着日龄的增加瘤胃菌落的差异越来越小。
|
图 2 基于Weighted Unifrac距离PCoA分析 Fig. 2 Analysis of PCoA based on Weighted Unifrac distance |
|
图 3 基于Unweighted Unifrac距离PCoA分析 Fig. 3 Analysis of PCoA based on Unweighted Unifrac distance |
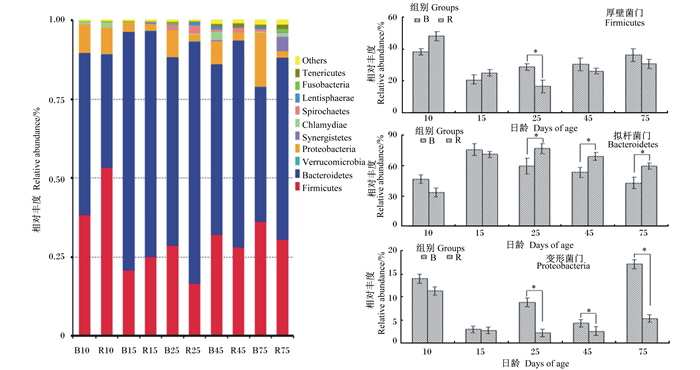
在门水平上,相对丰度排名前10的物种见图 4。厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)在瘤胃中相对丰度较高,并且细菌数量总和占各组样品中细菌总数的90%以上。其中,R组厚壁菌门相对丰度在10、15日龄时高于B组(P>0.05),而25、45、75日龄时低于B组,且25日龄时差异显著(P < 0.05);拟杆菌门相对丰度在10、15日龄时低于B组,25、45、75日龄时均显著高于B组(P < 0.05);变形菌门相对丰度在10、15日龄时,R组低于B组,但差异不显著(P>0.05),到25、45、75日龄时组间差异显著(P<0.05)。
|
数据柱标注*表示组间差异显著(P < 0.05)。Data bars with * mean significant difference between groups (P < 0.05). Others:其他;Tenericutes:柔膜菌门;Fusobacteria:梭杆菌门;Lentisphaerae:黏胶球形菌门;Spirochaetes:螺旋体门;Chlamydiae:衣原体门;Synergistetes:互养菌门;Proteobacteria:变形杆菌门;Verrucomicrobia:疣微菌门;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门。 图 4 不同日龄B组和R组沂蒙黑山羊羔羊门水平上瘤胃细菌组成分析 Fig. 4 Composition analysis of rumen bacteria of Yimeng black lambs at different days of age in groups B and R at phylum level |
在属水平上,瘤胃内菌群相对丰度排名前10的物种见图 5。普雷沃菌属(Prevotella)、拟杆菌属(Bacteroides)、拟普雷沃菌属(Alloprevotella)、乳杆菌属(Lactobacillus)、巨球型菌属(Megasphaera)和大肠埃希菌-志贺菌属(Escherichla-shigella)为瘤胃中相对丰度大于1%的菌属,其中普雷沃菌属约占11%。由图 6可见,R组瘤胃中普雷沃菌属相对丰度在15日龄后均高于B组,且在75日龄时差异显著(P < 0.05);拟杆菌属相对丰度在10、15日龄时低于B组,到25日龄后高于B组(P>0.05);拟普雷沃菌属相对丰度在15日龄时显著低于B组(P < 0.05),而25日龄后均高于B组(P>0.05);大肠埃希菌-志贺菌属相对丰度在15~25日龄间呈现下降趋势,到25日龄后低于B组(P>0.05)。

|
Other:其他;Porphyromonas:卟啉单胞菌属;Quinella:奎因氏菌属;Escherichia-Shigella:大肠埃希菌-志贺菌属;Veillonella:韦荣氏球菌属;Lactobacillus:乳杆菌属;Prevotella:普雷沃菌属;Akkermansia:阿克曼菌属;Bacteroides:拟杆菌属;Megasphaera:巨球型菌属;Alloprevotella:拟普雷沃菌属。 图 5 不同日龄B组和R组沂蒙黑山羊羔羊属水平上瘤胃细菌组成分析 Fig. 5 Composition analysis of rumen bacteria of Yimeng black lambs at different days of age in groups B and R at genus level |

|
Alloprevotella:拟普雷沃菌属;Akkermansia:阿克曼菌属;Veillonella:韦荣氏球菌属;Ruminococcaceae_UCG-00:5疣微菌科UCG-005;Succiniclasticum:琥珀酸菌属;Anaerovibrio:厌氧弧菌属;Ruminococcaceae_NK4A214_group:瘤胃球菌科NK4A214;Moryella:毛螺旋菌属; Ruminococcus:瘤胃球菌属;Prevotellaceae_UCG-004:普雷沃菌属_UCG-004;Lachnospiraceae_NK3A20_group毛螺菌科_NK3A20_group; Alistipe:另枝菌属;Anaerotruncus:厌氧棍状菌属。 图 6 不同日龄B组和R组沂蒙黑山羊羔羊瘤胃细菌差异显著的菌群 Fig. 6 Bacterial flora with significant differences in rumen of Yimeng black lambs at different ages of age in groups B and R |
另外,从图 7可见,在10、15日龄时R组瘤胃中琥珀酸菌属(Succiniclasticum)、瘤胃杆菌属(Ruminococcus)相对丰度低于B组,而25日龄后呈升高的趋势,其中琥珀酸菌属、瘤胃杆菌属分别在25、45日龄时显著高于R组(P < 0.05);与此相反,密螺旋体菌属(Treponema-2)相对丰度在25日龄后明显下降,到45日龄后低于B组,而韦荣氏球菌属(Veillonella)相对丰度15日龄时显著高于B组,而到25日龄后低于B组(P>0.05)。从以上菌属差异性分析中看出,R组有益菌相对丰度在15~25日龄间发生变化,而条件致病菌相对丰度在25~45日龄间发生变化。
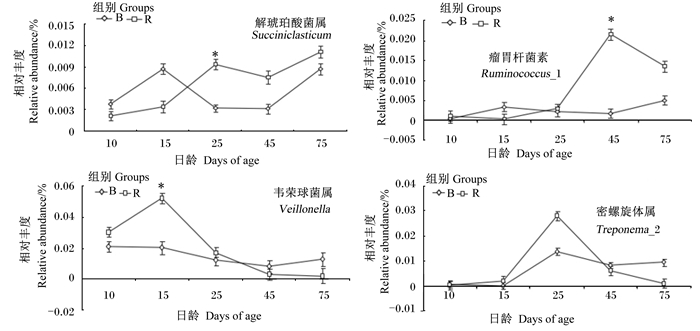
|
折线数据点标注*表示组间差异显著(P < 0.05)。 Broken line data point with * mean significant difference between groups (P < 0.05). 图 7 不同日龄段有益菌和条件致病菌变化趋势分析 Fig. 7 Analysis of variation tendency of beneficial bacteria and opportunistic pathogen at different days of age |
由物种丰度聚类图 8可知,B组、R组共同拥有35种菌,被聚为4类;B组10、15日龄(6种)和25、45、75日龄(6种)时菌属首先聚到一起,再与R组10、15日龄(11种)聚在一起,最后与R组25、45、75日龄(11种)相聚。从中可以看出,2组饲喂开食料前后物种丰度聚类明显分开,R组物种多样性与B组比较更为丰富。
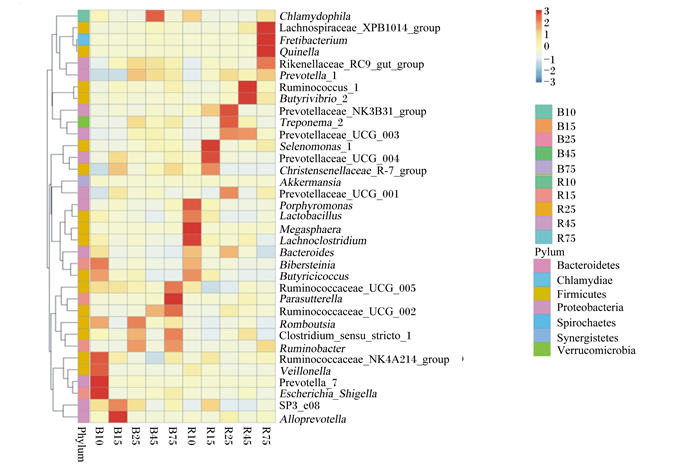
|
Chlamydophila:嗜衣体属;Lachnospiraceae_XPB1014_group:毛螺菌科XPB1014群;Quinella:奎因氏菌属;Rikenellaceae_RC9_gut group:理研菌科RC9肠道群;Prevotella_1:普雷沃菌属_1;Ruminococcus_1:瘤胃球菌属;Butyrivibrio_2:丁酸弧菌属;Prevotellaceae_NK3B31_group:普雷沃氏菌科_NK3B31群;Treponema_2:密螺旋体属;Prevotellaceae_UCG-003:普雷沃氏菌科_UCG-003;Selenomonas_1:月形单胞菌属;Prevotellaceae_UCG-004:普雷沃氏菌科_UCG-004;Christensenellaceae_R-7_group:克里斯滕森氏菌属;Akkermansia:阿克曼菌属;Prevotellaceae_UCG-001:普雷沃氏菌科_UCG-001;Porphyromonas:卟啉单胞菌属;Lactobacillus:乳杆菌属;Megasphaera:巨球型菌属;Bacteroides:拟杆菌属;Ruminococcaceae_UCG-005:疣微菌科UCG-005; Ruminococcaceae_UCG-002:疣微菌科UCG-002;Clostridium_sensu_stricto_1:梭菌属_sensu_stricto_1; Ruminobacter:瘤胃杆菌属;Ruminococcaceae_NK4A214_group:瘤胃球菌科NK4A214;Veillonella:韦荣氏球菌属;Prevotella_7:普雷沃菌属_7;Escherichia-Shigella:大肠埃希菌-志贺菌属;Alloprevotella:拟普雷沃菌属;Bacteroidetes:拟杆菌门;Chlamydiae:衣原体门; Firmicutes:厚壁菌门; Proteobacteria:变形菌门; Spirochaetes:螺旋体门; Synergistetes:互养菌门; Verrucomicrobia疣微菌门。 图 8 不同日龄B组和R组沂蒙黑山羊羔羊瘤胃物种丰度聚类图 Fig. 8 Heat map of rumen species abundance of Yimeng black lamb sat different days of age in groups B and R |
研究表明,对羔羊实行早期断奶,饲喂营养合理的代乳粉,能显著提高羔羊的日增重,促进羔羊的生长发育,其效果受代乳粉成分组成、饲喂方式、断奶日龄、羔羊健康状态等多方面影响[15-16]。本试验中发现11~15日龄时R组羔羊的日增重极显著低于B组,而在45日龄后R组羔羊体增重显著高于B组。这与王海超等[13]、Napolitano等[17]和Sevi等[18]的研究结果相一致。其主要原因是羔羊断奶过早,应激较大,并且羔羊对代乳粉有一个胃肠道内环境逐渐适应的过程,影响R组羔羊的生长。另外,25日龄后母乳中活性物质含量显著下降导致羊乳的营养成分已不能满足羔羊生长需要,从而影响其生长发育[19],相反优质代乳粉可以给羔羊提供全面的营养物质,弥补母乳营养成分的不足[9]。
3.2 代乳粉对沂蒙黑山羊羔羊瘤胃菌落结构的影响动物胃肠道菌群组成受到多种因素影响,如宿主年龄、营养、遗传等,同时受到生存环境、应激等因素的影响[20]。Jami等[21]研究发现,荷斯坦牛从1日龄到2岁瘤胃细菌OTU数量与Shannon指数逐渐增加。本试验通过多样性分析得出R组和B组微生物多样性指标均有随日龄的增长而升高的趋势,其中R组瘤胃细菌的OTU数量、Ace指数、Chao1指数低于B组,而Shannon指数、Simpson指数在10、15日龄时高于B组,15日龄时,R组Alpha和Beta多样性产生显著的分化,而随着日龄的增长逐渐差异缩小,这与Rer等[22]的研究结果一致。随着日龄的增长,羔羊瘤胃内的微生物区系逐渐趋于稳定状态,达到一种动态的平衡,说明随母乳和代乳粉植入的微生物对瘤胃内微生物结构的影响已逐渐变小。这可能由于试验开始前期2组间营养水平不同、而后期开食料组成相同所致。
3.3 代乳粉对沂蒙黑山羊羔羊瘤胃微生物菌群物种相对丰度的影响动物肠道微生物可促进宿主的个体发育进程,并且养分代谢过程需要微生物的参与。如拟杆菌门参与碳水化合物的代谢过程,厚壁菌门参与能量的吸收过程,当菌群失调,厚壁菌门增加而拟杆菌门减少时引起代谢紊乱,发育受到限制[23]。从本试验结果中可见,R组和B组瘤胃内主要菌群为厚壁菌门、拟杆菌门和变形菌门,但是R组在25日龄时瘤胃内优势菌群由厚壁菌门变为拟杆菌门。这一结果说明代乳粉哺喂后,逐步改变了羔羊瘤胃菌群结构。此结果与Kittelmann等[24]研究基本一致,但与韩旭峰等[25]报道80~100日龄陕北白绒山羊瘤胃优势菌群为厚壁菌门和互养菌门的结果不同,表明羊瘤胃内的优势菌群可能受品种、年龄及饲养环境的影响[26-27]。本研究结果显示,R组乳酸杆菌属相对丰度在45日龄后逐渐升高;琥珀酸菌属、瘤胃杆菌属等在25日龄后相对丰度高于B组。相反,韦荣氏球菌属(Veillonella)相对丰度在25日龄后明显下降。有报道证实,动物胃肠道中厚壁菌门促进宿主吸收或储存能量,而厚壁菌门中乳酸杆菌属(Lactobacillus)、琥珀酸菌属(Succiniclasticum)、瘤胃杆菌属(Ruminococcus)是瘤胃内主要的纤维降解菌,有助于饲粮中纤维素的降解,促进动物的生长[28]。
拟杆菌门是哺乳动物胃肠道内主要优势菌群,参与碳水化合物降解、多糖物质代谢、胆汁酸和类固醇等养分代谢,维持肠道正常的生理功能和微生态平衡,对动物生长和健康有重要作用[29-30]。本研究结果显示,R组在25日龄时拟杆菌门相对丰度超过B组,并且拟杆菌门中的普雷沃菌属、拟普雷沃菌属和拟杆菌属,特别的是普雷沃菌属相对丰度高达16.70%,这与其他反刍动物, 如奶牛[31]、肉牛[32]和绵羊[33]上的研究结果一致。由于代乳粉中糖、氨基酸和小肽等营养成分可以促进瘤胃内普雷沃菌属的生长[31],因此哺喂代乳粉的羔羊瘤胃中普雷沃菌属成为优势菌群,它能够降解和利用碳水化合物或蛋白质[34-35],有助于纤维素、半纤维素等多糖的分解消化,使得其转化为能量的水平提高,促进宿主生长发育[36]。从本试验结果中可以看出,R组在25日龄后生长速度快于B组,导致此结果的原因是否与上述有益菌属或条件致病菌属变化影响宿主营养物质的分解、吸收等有关还需要进一步验证。
变形菌门是革兰氏阴性细菌,是细菌中最大的一门,包括很多病原菌,如大肠杆菌、沙门氏菌、弧菌、螺杆菌等种类[37-38]。本试验结果显示,R组在25日龄后变形菌门相对丰度逐渐下降,其中变形菌门中大肠埃希菌-志贺菌属相对丰度在25、75日龄时较B组分别下降57.89%、94.80%。这表明哺喂代乳粉对羔羊养分的稳定性和安全性方面优于母乳,因为母乳在母羊饲养环境、营养水平等条件下存在营养水平变化、细菌感染等隐患,导致羔羊瘤胃菌群结构发生变化[39-40]。
综上所述,哺喂代乳粉从35日龄开始对体重、日增重影响较为明显,而此时瘤胃中优势菌群变化明显,并且普雷沃菌属逐渐增加,特别在15~25日龄间有益菌相对丰度明显增加,相反在25~45日龄间条件致病菌相对丰度明显降低,这些菌群结构的变化有助于相关营养物质的降解和吸收[34-35],影响宿主生长发育。
4 结论① R组羔羊在45日龄获得与B组羔羊一样的增重效果,且随着日龄增加R组呈现优于B组羔羊的趋势。
② R组与B组羔羊在45日龄前其瘤胃微生物结构差异明显,到75日龄时其差异逐渐减小。
③ R组羔羊在25日龄后瘤胃微生物区系的变化明显,其中拟杆菌门成为优势菌群,并且普雷沃菌属等有益菌相对丰度逐步增加,从而改善羔羊瘤胃微生物区系结构,有助于促进羔羊的生长。
| [1] |
杨燕, 吕慎金, 陈炳宇. 沂蒙黑山羊种质资源现状及保护开发对策[J]. 家畜生态学报, 2014, 35(6): 81-84. DOI:10.3969/j.issn.1673-1182.2014.06.016 |
| [2] |
岳喜新, 刁其玉, 屠焰, 等.羔羊代乳粉营养特点及饲喂效果[C]//中国畜牧兽医学会养羊学分会全国养羊生产与学术研讨会议论文集.银川: 中国畜牧兽医学会养羊学分会, 2010.
|
| [3] |
HUNGATE R E.The rumen and its microbes[M].[s.l.]: Elsevier, 2013.
|
| [4] |
PRAJAPATI V S, PUROHIT H J, RAJE D V, et al. The effect of a high-roughage diet on the metabolism of aromatic compounds by rumen microbes:ametagenomic study using Mehsani buffalo (Bubalusbubalis)[J]. Applied Microbiology and Biotechnology, 2016, 100(3): 1319-1331. DOI:10.1007/s00253-015-7239-0 |
| [5] |
淡瑞芳, 张海涛, 龙瑞军, 等. 瘤胃微生物生态研究方法评述[J]. 草业科学, 2007, 24(7): 77-82. DOI:10.3969/j.issn.1001-0629.2007.07.018 |
| [6] |
DE FILIPPO C, CAVALIERI D, DI PAOLA M, et al. Impact of diet in shaping gut microbiota revealed by acomparative study in children from Europe and rural Africa[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(33): 14691-14696. DOI:10.1073/pnas.1005963107 |
| [7] |
陈昊, 刘婷, 吴建平, 等. 牛至精油对新生犊牛生长发育和血液免疫的影响[J]. 草业科学, 2017, 34(10): 2141-2148. DOI:10.11829/j.issn.1001-0629.2016-0559 |
| [8] |
罗惦, 柴林荣, 常生华, 等. 我国青藏高原地区牦牛草地放牧系统管理及优化[J]. 草业科学, 2017, 34(4): 881-891. |
| [9] |
岳喜新, 刁其玉, 马春晖, 等. 早期断奶羔羊代乳粉饲喂水平对营养物质消化代谢及血清生化指标的影响[J]. 中国农业科学, 2011, 44(21): 4464-4473. |
| [10] |
柴建民, 刁其玉, 屠焰, 等. 早期断奶时间对湖羊羔羊组织器官发育、屠宰性能和肉品质的影响[J]. 动物营养学报, 2014, 26(7): 1838-1847. DOI:10.3969/j.issn.1006-267x.2014.07.016 |
| [11] |
屠焰, 刁其玉, 岳喜新.一种0~3月龄羔羊的代乳品及其制备方法: 中国, CN201210365927[P].2013-01-30.
|
| [12] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007.
|
| [13] |
王海超, 张乃锋, 柴建民, 等. 人工哺育代乳粉对湖羊双胎羔羊生长发育、营养物质消化和血清学指标的影响[J]. 动物营养学报, 2015, 27(2): 436-447. DOI:10.3969/j.issn.1006-267x.2015.02.014 |
| [14] |
YILMAZ P, PARFREY L W, YARZA P, et al. The SILVA and "All-species Living Tree Project (LTP)" taxonomic frameworks[J]. Nucleic Acids Research, 2014, 42(D1). |
| [15] |
王利红, 张伟, 曹少先, 等. 湖羊羔羊早期断乳(7日龄)后代乳粉饲喂效果研究[J]. 安徽农业大学学报, 2017, 44(2): 224-228. |
| [16] |
江喜春, 夏伦志, 张乃锋, 等. 代乳粉能量水平对早期断奶湖羊羔羊生长性能和物质代谢的影响[J]. 中国畜牧杂志, 2015, 51(7): 50-53. DOI:10.3969/j.issn.0258-7033.2015.07.012 |
| [17] |
NAPOLITANO F, CIFUNI G F, PACELLI C, et al. Effect of artificial rearing on lamb welfare and meat quality[J]. Meat Science, 2002, 60(3): 307-315. DOI:10.1016/S0309-1740(01)00140-1 |
| [18] |
SEVI A, CAROPRESE M, ANNICCHIARICO G, et al. The effect of a gradual separation from the mother on later behavioral, immune and endocrine alterations in artificially reared lambs[J]. Applied Animal Behaviour Science, 2003, 83(1): 41-53. DOI:10.1016/S0168-1591(03)00088-1 |
| [19] |
郭敏增, 郑成江, 宋桂敏, 等. 代乳粉对早期断奶羔羊生长及健康状况的影响[J]. 天津农业科学, 2011, 17(3): 50-53. DOI:10.3969/j.issn.1006-6500.2011.03.015 |
| [20] |
LAITINEN K, MOKKALA K, KALLIOMAKI M.Impact of early nutrition on intestinal microbiome: effects on immunity and long-term health[M]//SAAVEDRA J M, DATTILO A M.Early nutrition and long-term health.Duxford: Elsevier, 2017: 203-228.
|
| [21] |
JAMI E, ISRAEL A, KOTSER A, et al. Exploring the bovine rumen bacterial community from birth to adulthood[J]. The ISME Journal, 2013, 7(6): 1069-1079. DOI:10.1038/ismej.2013.2 |
| [22] |
REY M, ENJALBERT F, COMBES S, et al. Establishment of ruminal bacterial community in dairy calves from birth to weaning is sequential[J]. Journal of Applied Microbiology, 2014, 116(2): 245-257. DOI:10.1111/jam.12405 |
| [23] |
GROVER M. Role of gut pathogens in development of irritable bowel syndrome[J]. The Indian Journal of Medical Research, 2014, 139(1): 11-18. |
| [24] |
KITTELMANN S, SEEDORF H, WALTERS W A, et al. Simultaneous amplicon sequencing to explore co-occurrence patterns of bacterial, archaeal and eukaryotic microorganisms in rumen microbial communities[J]. PLoS One, 2013, 8(2): e47879. DOI:10.1371/journal.pone.0047879 |
| [25] |
韩旭峰, 王小龙, 杨雨鑫, 等.日龄、日粮精粗比对陕北白绒山羊瘤胃微生物区系影响的研究[C]//遗传多样性: 前沿与挑战--中国的遗传学研究(2013-2015)--2015中国遗传学会大会论文摘要汇编.昆明: 中国遗传学会, 2015.
|
| [26] |
HUO W J, ZHU W Y, MAO S Y. Impact of subacute ruminal acidosis on the diversity of liquid and solid-associated bacteria in the rumen of goats[J]. World Journal of Microbiology and Biotechnology, 2014, 30(2): 669-680. DOI:10.1007/s11274-013-1489-8 |
| [27] |
JAMI E, MIZRAHI I. Composition and similarity of bovine rumen microbiota across individual animals[J]. PLoS One, 2012, 7(3): e33306. DOI:10.1371/journal.pone.0033306 |
| [28] |
KOMAROFF A L. The microbiome and risk for obesity and diabetes[J]. JAMA, 2017, 317(4): 355-356. DOI:10.1001/jama.2016.20099 |
| [29] |
SINGH P, BENJAK A, SCHUENEMANN V J, et al. Insight into the evolution and origin of leprosy bacilli from the genome sequence of Mycobacterium lepromatosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(14): 4459-4464. DOI:10.1073/pnas.1421504112 |
| [30] |
SEARS C L. A dynamic partnership:celebrating our gut flora[J]. Anaerobe, 2005, 11(5): 247-251. DOI:10.1016/j.anaerobe.2005.05.001 |
| [31] |
STEVENSON D M, WEIMER P J. Dominance of Prevotella and low abundance of classical ruminal bacterial species in the bovine rumen revealed by relative quantification real-time PCR[J]. Applied Microbiology and Biotechnology, 2009, 83(5): 987-988. DOI:10.1007/s00253-009-2033-5 |
| [32] |
BEKELE A Z, KOIKE S, KOBAYASHI Y. Genetic diversity and diet specificity of ruminal Prevotella revealed by 16S rRNA gene-based analysis[J]. FEMS Microbiology Letters, 2010, 305(1): 49-57. DOI:10.1111/j.1574-6968.2010.01911.x |
| [33] |
DE OLIVEIRA M N V, JEWELL K A, FREITAS F S, et al. Characterizing the microbiota across the gastrointe stinal tract of a Brazilian Neloresteer[J]. Veterinary Microbiology, 2013, 164(3/4): 307-314. |
| [34] |
曾燕, 简平, 倪学勤, 等. Illumina MiSeq测序平台测定蒙古羊瘤胃液相和固相菌群多样性[J]. 动物营养学报, 2015, 27(10): 3256-3262. DOI:10.3969/j.issn.1006-267x.2015.10.034 |
| [35] |
周祥.日粮不同NDF水平对杂交水牛瘤胃细菌群落结构与瘤胃主要功能细菌的影响[D].硕士学位论文.武汉: 华中农业大学, 2015.
|
| [36] |
DURSO L, WELLS J E, KIM M S.Diversity of microbiomes in beef cattle[M]//NELSON K.Encyclopedia of metagenomics.New York, NY: Springer, 2014.
|
| [37] |
LIU C, LI X H, CHEN Y X, et al. Age-related response of rumen microbiota to mineral salt and effects of their interactions on enteric methane emissions in cattle[J]. Microbial Ecology, 2017, 73(3): 590-601. DOI:10.1007/s00248-016-0888-4 |
| [38] |
SHIN N R, WHON T W, BAE J W. Proteobacteria:microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503. DOI:10.1016/j.tibtech.2015.06.011 |
| [39] |
刘欣欣, 李发弟, 乐祥鹏. 羊奶成分和奶中主要蛋白的研究进展[J]. 中国畜牧杂志, 2016, 52(9): 87-91. DOI:10.3969/j.issn.0258-7033.2016.09.021 |
| [40] |
TORAL P G, CHILLIARD Y, ROUEL J, et al. Comparison of the nutritional regulation of milk fat secretion and composition in cows and goats[J]. Journal of Dairy Science, 2015, 98(10): 7277-7297. DOI:10.3168/jds.2015-9649 |




