苏氨酸(threonine,Thr)是动物体内的一种必需氨基酸,也是以谷物为基础的猪饲粮的第二或者第三限制性氨基酸[1]。近些年,诸多研究表明,饲粮中适宜的苏氨酸水平能维持猪最佳的生长性能、免疫功能和肠道屏障功能;而饲粮中苏氨酸缺乏或者过量会影响猪的生长性能、骨骼肌蛋白质合成、免疫功能和肠道屏障功能[2-5]。本团队前期的研究表明,饲粮中添加适量的苏氨酸(使真可消化苏氨酸水平达到0.89%)可以缓解猪伪狂犬病毒弱毒苗诱导的免疫应激对猪生长性能、肠道健康和免疫功能的负面影响[6-7]。
黏液蛋白是肠道屏障功能(尤其是非特异性屏障机制)的重要组成部分[8]。已有的研究表明,在肠道黏液蛋白的蛋白核心中苏氨酸含量可以达到28%~35%,这表明苏氨酸是肠道黏液蛋白主要的组成基质[9]。此外,饲粮中补充适量的苏氨酸可以刺激仔猪肠道中黏液蛋白mRNA的表达[3]。而关于功能性氨基酸(如亮氨酸、精氨酸、蛋氨酸等)的研究表明,蛋白激酶B(protein kinase B, Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路是其调节蛋白质合成的重要机制[10-14]。然而,目前对于适量的苏氨酸促进黏液蛋白合成是否通过了Akt/mTOR信号通路的调节尚未见报道。因此,本试验的目的在于考察饲粮中补充适量的苏氨酸对Akt/mTOR信号通路的影响,以期进一步完善苏氨酸调节黏液蛋白合成的可能机制,这将为猪饲粮中适宜苏氨酸的探讨和应用推广提供试验支撑。
1 材料与方法 1.1 试验材料L-苏氨酸(饲料级):购于长春大成公司,纯度98.5%。
L-丙氨酸(食品级):购于淮北新旗氨基酸有限公司,纯度98.5%。
1.2 试验动物与设计试验选取10头平均体重为(6.15±0.29) kg、健康的21日龄断奶“杜×长×大”仔猪,全部采用代谢笼饲养。试验第1天空腹称重后,根据体重相近原则,将所有仔猪随机分为2组(每组5个重复,每个重复1头猪),分别饲喂真可消化苏氨酸水平为0.74%(基础饲粮,对照组)和0.89%的饲粮(在基础饲粮基础上补充苏氨酸的试验饲粮,苏氨酸组),试验期为21 d。
1.3 试验饲粮试验所用玉米-豆粕型基础饲粮参照NRC(1998)5~10 kg阶段仔猪营养需要配制,其中L-丙氨酸为等氮处理所设。基础饲粮组成及营养水平见表 1。试验饲粮以L-苏氨酸替代基础饲粮中L-丙氨酸配制而成。经计算,基础饲粮和试验饲粮中可消化苏氨酸水平分别为0.74%和0.89%。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验在四川农业大学动物营养研究所教学科研基地代谢室进行。正式试验前预饲2 d,使仔猪适应粉状饲粮和饲养环境。猪舍温度控制在27~30 ℃,相对湿度不高于80%,每天饲喂4次(08:00、12:00、16:00和20:00),以每次采食后料槽有少量余料为度。所有仔猪自由饮水,试验期间消毒、清扫按常规程序进行,并保持猪舍通风、清洁。
1.5 样品采集于试验第22天早上进行空腹称重,将所有试验猪颈静脉放血、处死。打开腹腔,迅速分离空肠和回肠,并用冰生理盐水冲洗,通过载玻片刮取空肠和回肠黏膜,液氮速冻后存于-80 ℃。
1.6 测定指标和方法 1.6.1 生长性能试验期间每天结料,记录每头猪每天饲喂量,所有试验仔猪在试验第1和22天早上称重,用于计算平均日增重(average daily gain,ADG)、平均日采食量(average daily feed intake,ADFI)和料重比(feed/gain,F/G)。
1.6.2 空肠和回肠黏膜黏液蛋白含量的检测称取约1 g肠道黏膜组织,按重量体积比1 : 9的比例加入预冷的生理盐水,置于冰上匀浆后,匀浆液于冷冻离心机中以5 000×g离心10 min,取上清液用于指标检测。具体操作参考Mao等[15]的方法进行。
仔猪空肠和回肠黏膜中黏液蛋白1和2含量采用武汉华美生物工程有限公司生产的酶联免疫吸附测定(ELISA)试剂盒测定,操作按照试剂盒说明书进行。仔猪空肠和回肠黏膜中蛋白质含量采用南京建成生物工程研究所生产的试剂盒检测,操作按照试剂盒说明书进行。
1.6.3 空肠和回肠黏膜中黏液蛋白基因表达的检测空肠和回肠黏膜中黏液蛋白1和2基因的表达采用实时荧光定量PCR技术测定,以β-肌动蛋白为参比基因,所需引物见表 2,由宝生物工程(大连)有限公司合成。具体操作参考Mao等[16]的方法进行。
|
|
表 2 实时荧光定量PCR所使用的引物序列 Table 2 Primer sequences used for real-time qPCR |
空肠和回肠黏膜中Akt、mTOR、核糖体40S小亚基S6蛋白激酶(ribosomal protein S6 kinase,p70S6K)和真核起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E-binding protein 1,4E-BP1)磷酸化水平及β-肌动蛋白含量
空肠和回肠黏膜中Akt、mTOR、p70S6K和4E-BP1磷酸化水平及β-肌动蛋白含量采用Western Blotting技术测定,试验中涉及到的磷酸化Akt、mTOR、p70S6K和4E-BP1的抗体均购自于美国Cell Signaling公司,β-肌动蛋白的抗体购自于美国Santa Cruz公司。具体操作参考Mao等[17]的方法进行。
1.7 数据处理与分析试验数据采用Excel 2007进行初步整理,所有测定结果以每头仔猪为统计单位,采用SAS 8.1软件进行t检验,数据以“平均值±标准误”表示。以P < 0.05为差异显著性判定标准。
2 结果 2.1 饲粮补充苏氨酸对断奶仔猪生长性能的影响由表 3可知,饲粮补充苏氨酸(饲粮中真可消化苏氨酸水平为0.89%)对断奶仔猪的ADG和ADFI无显著影响(P>0.05),但显著降低了F/G(P < 0.05)。
|
|
表 3 饲粮补充苏氨酸对断奶仔猪生长性能的影响 Table 3 Effects of threonine supplementation on growth performance of weaned piglets |
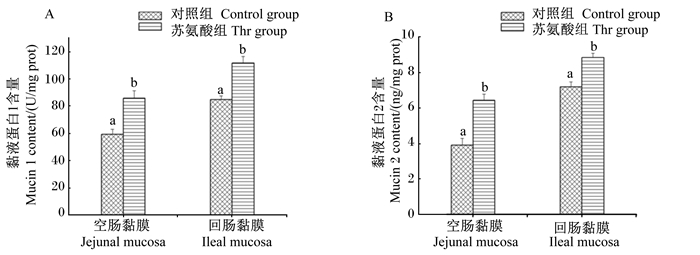
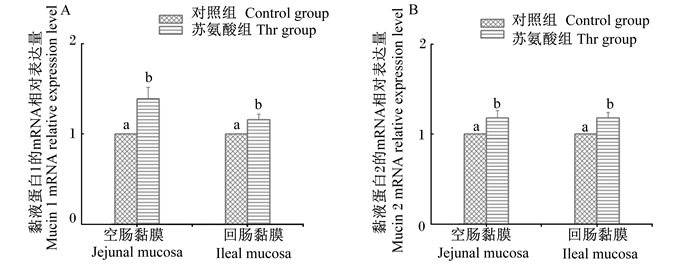
由图 1和图 2可知,与饲喂基础饲粮(真可消化苏氨酸水平为0.74%)的对照组仔猪相比,饲喂补充苏氨酸饲粮(真可消化苏氨酸水平为0.89%)的仔猪空肠和回肠中黏液蛋白1和2含量均显著提高(P < 0.05),且黏液蛋白1和2的mRNA相对表达量也显著提高(P < 0.05)。
|
数据柱标注不同字母表示差异显著(P < 0.05)。下图同。 Date columns with different letters mean significant difference (P < 0.05). The same as below. 图 1 饲粮补充苏氨酸对断奶仔猪空肠和回肠黏膜中黏液蛋白1(A)和黏液蛋白2(B)含量的影响 Fig. 1 Effects of threonine supplementation on mucin 1 (A) and mucin 2 (B) contents in jejunal and ileal mucosa of weaned piglets |
|
图 2 饲粮补充苏氨酸对断奶仔猪空肠和回肠黏膜中黏液蛋白1(A)和黏液蛋白2(B)mRNA相对表达量的影响 Fig. 2 Effects of threonine supplementation on mRNA relative expression levels of mucin 1 (A) and mucin 2 (B) in jejunal and ileal mucosa of weaned piglets |
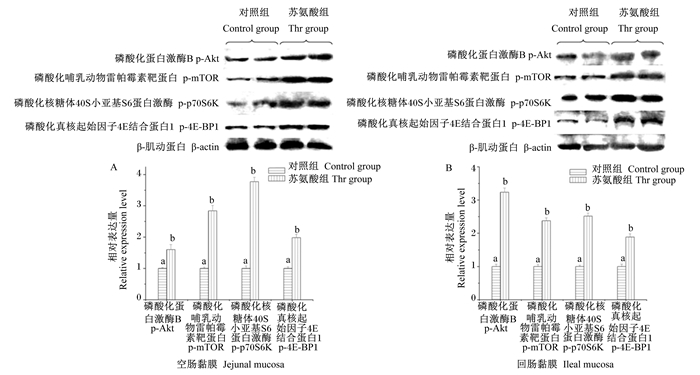
由图 3可知,与饲喂基础饲粮(真可消化苏氨酸水平为0.74%)的对照组仔猪相比,饲喂补充苏氨酸饲粮(真可消化苏氨酸水平为0.89%)的仔猪空肠和回肠中Akt、mTOR、p70S6K和4E-BP1磷酸化水平均显著提高(P < 0.05)。
|
图 3 饲粮补充苏氨酸对断奶仔猪空肠(A)和回肠黏膜(B)中Akt、mTOR、p70S6K和4E-BP1磷酸化水平的影响 Fig. 3 Effects of threonine supplementation on phosphorylation levels of Akt, mTOR, p70S6K and 4E-BP1 in jejunal (A) and ileal mucosa (B) of weaned piglets |
苏氨酸是以谷物为基础的猪饲粮中第二或者第三限制性氨基酸[1]。据相关的研究表明,当饲粮中回肠真可消化苏氨酸水平低于0.74%[NRC(1998)5~10 kg猪饲粮中苏氨酸的推荐含量]时,断奶仔猪的生长性能将显著降低;而将饲粮中回肠真可消化苏氨酸水平从0.74%提高到1.11%,断奶仔猪的ADG和ADFI未受到显著影响[2-5]。因此,本研究以真可消化苏氨酸水平为0.74%配制了基础饲粮。且本研究的基础饲粮也是参照NCR(1998)中5~10 kg猪营养需要配制;其中,饲粮中真可消化苏氨酸和真可消化赖氨酸水平(计算值)分别为0.74%和1.19%(二者比值为0.62 : 1.00),而饲粮中苏氨酸和赖氨酸含量的测定值分别为0.85%和1.36%(二者比值为0.63 : 1.00),均满足了需要量。此外,本研究的结果表明,饲粮中真可消化苏氨酸水平从0.74%提高到0.89%未显著影响断奶仔猪的ADG和ADFI,但显著降低了仔猪的F/G,这与前人在正常和应激条件下的研究结果[2-7]一致。对动物生长性能的维持或提高很大程度上依赖于肠道屏障功能的改善,且相关的研究已表明饲粮中真可消化苏氨酸水平为0.89%(即为基础饲粮中苏氨酸需要量的125%)时可以改善肠道屏障功能[3],因此,本研究亦选择了真可消化苏氨酸水平0.89%进行苏氨酸组饲粮的配制。
黏液蛋白是肠道屏障功能(尤其是非特异性屏障机制)的重要组成部分[8]。作为一种功能性氨基酸,苏氨酸是肠道黏液蛋白主要的组成基质,肠道黏液蛋白的蛋白核心中苏氨酸含量可以达到28%~35%[9],而食物中苏氨酸首过代谢有40%~60%(特殊情况下可达80%)发生在门静脉回流内脏组织[18]。这些也可以在一定程度上解释前人的研究结果,即饲粮中适宜水平的苏氨酸能提高肠道黏膜中黏液蛋白的含量。而本研究也得到了类似的结果——饲粮中真可消化苏氨酸水平为0.89%时改善了仔猪空肠和回肠黏膜中黏液蛋白1和2的生成。
在探讨适宜饲粮苏氨酸水平提高肠道黏膜中黏液蛋白含量的机制中,以断奶仔猪为研究对象的研究表明,苏氨酸可以刺激肠道黏膜中黏液蛋白(如黏液蛋白1和2)mRNA的表达[3],与本研究的结果一致。这说明,饲粮中适宜水平的苏氨酸将提高肠道黏膜中黏液蛋白基因的转录,进而提高黏液蛋白的合成。
Akt/mTOR信号通路是细胞内调节蛋白质合成的重要信号通路。活化的Akt将提高mTOR磷酸化水平(即活性状态),而磷酸化的mTOR将诱导其下游的2个重要的效应物(p70S6K和4E-BP1)磷酸化而随之被激活,进而促进mRNA的翻译,最终刺激蛋白质的合成[19]。近些年大量的研究表明,诸多功能性氨基酸(如亮氨酸、精氨酸、蛋氨酸等)均可通过这一信号通路调节机体和细胞的特异性蛋白和/或总蛋白的合成[10-14]。本研究也检测了空肠和回肠黏膜中Akt/mTOR信号通路的关键蛋白的活化情况,结果发现,饲粮中补充苏氨酸(真可消化苏氨酸水平达到0.89%)也可提高空肠和回肠黏膜中Akt、mTOR、p70S6K和4E-BP1的磷酸化水平,即激活了Akt/mTOR信号通路。那么,苏氨酸调节黏液蛋白合成可能也与这一信号通路有关。
4 结论饲粮中补充苏氨酸(真可消化苏氨酸水平达到0.89%)可在一定程度上提高断奶仔猪的生长性能,并促进断奶仔猪空肠和回肠黏膜中黏液蛋白1和2的合成,而除了提供合成基质和刺激转录水平外,这一作用还可能与空肠和回肠黏膜中Akt/mTOR信号通路的激活有关。
| [1] |
LEWIS A J.Amino acids in swine nutrition[M]//LEWIS A J, SOUTHERN L L.Swine nutrition.2nd ed.Boca Raton, FL: CRC Press, 2001: 131-150.
|
| [2] |
LI D F, XIAO C T, QIAO S Y, et al. Effects of dietary threonine on performance, plasma parameters and immune function of growing pigs[J]. Animal Feed Science and Technology, 1999, 78(1/2/3/4): 179-188. |
| [3] |
WANG W W, ZENG X F, MAO X B, et al. Optimal dietary true ileal digestible threonine for supporting the mucosal barrier in small intestine of weanling pigs[J]. The Journal of Nutrition, 2010, 140(5): 981-986. DOI:10.3945/jn.109.118497 |
| [4] |
WANG X, QIAO S Y, LIU M, et al. Effects of graded levels of true ileal digestible threonine on performance, serum parameters and immune function of 10-25 kg pigs[J]. Animal Feed Science and Technology, 2006, 129(3/4): 264-278. |
| [5] |
WANG X, QIAO S Y, YIN Y L, et al. A deficiency or excess of dietary threonine reduces protein synthesis in jejunum and skeletal muscle of young pigs[J]. The Journal of Nutrition, 2007, 137(6): 1442-1446. DOI:10.1093/jn/137.6.1442 |
| [6] |
MAO X B, LAI X, YU B, et al. Effects of dietary threonine supplementation on immune challenge induced by swine Pseudorabies live vaccine in weaned pigs[J]. Archives of Animal Nutrition, 2014, 68(1): 1-15. DOI:10.1080/1745039X.2013.869988 |
| [7] |
赖翔.饲粮添加苏氨酸对PRV诱导的免疫应激仔猪生长性能和免疫功能的影响[D].硕士学位论文.雅安: 四川农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10626-1013157277.htm
|
| [8] |
MAO X B, ZENG X F, QIAO S Y, et al. Specific roles of threonine in intestinal mucosal integrity and barrier function[J]. Frontiers in Bioscience:Elite Edition, 2011, 3: 1192-1200. |
| [9] |
DEKKER J, ROSSEN J W A, BÜLLER H A, et al. The MUC family:an obituary[J]. Trends in Biochemical Sciences, 2002, 27(3): 126-131. DOI:10.1016/S0968-0004(01)02052-7 |
| [10] |
ZHANG Y L, WANG P, LIN S, et al. mTORC1 signaling-associated protein synthesis in porcine mammary glands was regulated by the local available methionine depending on methionine sources[J]. Amino Acids, 2018, 50(1): 105-115. |
| [11] |
ZENG X F, MAO X B, HUANG Z M, et al. Arginine enhances embryo implantation in rats through PI3K/PKB/mTOR/NO signaling pathway during early pregnancy[J]. Reproduction, 2013, 145(1): 1-7. DOI:10.1530/REP-12-0254 |
| [12] |
MAO X B, ZENG X F, WANG J J, et al. Leucine promotes leptin receptor expression in mouse C2C12 myotubes through the mTOR pathway[J]. Molecular Biology Reports, 2011, 38(5): 3201-3206. DOI:10.1007/s11033-010-9992-6 |
| [13] |
MAO X B, ZENG X F, HUANG Z M, et al. Leptin and leucine synergistically regulate protein metabolism in C2C12 myotubes and mouse skeletal muscles[J]. British Journal of Nutrition, 2013, 110(2): 256-264. DOI:10.1017/S0007114512004849 |
| [14] |
MAO X B, HU H Y, TANG J, et al. Leucine increases mucin 2 and occludin production in LS174T cells partially via PI3K-Akt-mTOR pathway[J]. Animal Nutrition, 2016, 2(3): 218-224. DOI:10.1016/j.aninu.2016.05.004 |
| [15] |
MAO X B, LIU M H, TANG J, et al. Dietary leucine supplementation improves the mucin production in the jejunal mucosa of the weaned pigs challenged by porcine rotavirus[J]. PLoS One, 2015, 10(9): e0137380. DOI:10.1371/journal.pone.0137380 |
| [16] |
MAO X B, GU C S, HU H Y, et al. Dietary Lactobacillus rhamnosus GG supplementation improves the mucosal barrier function in the intestine of weaned piglets challenged by porcine rotavirus[J]. PLoS One, 2016, 11(1): e0146312. DOI:10.1371/journal.pone.0146312 |
| [17] |
MAO X B, XIAO X J, CHEN D W, et al. Dietary apple pectic oligosaccharide improves gut barrier function of rotavirus-challenged weaned pigs by increasing antioxidant capacity of enterocytes[J]. Oncotarget, 2017, 8(54): 92420-92430. |
| [18] |
SCHAART M W, SCHIERBEEK H, VAN DER SCHOOR S R D, et al. Threonine utilization is high in the intestine of piglets[J]. The Journal of Nutrition, 2005, 135(4): 765-770. DOI:10.1093/jn/135.4.765 |
| [19] |
KIM E, GORAKSHA-HICKS P, LI L, et al. Regulation of TORC1 by Rag GTPases in nutrient response[J]. Nature Cell Biology, 2008, 10(8): 935-945. DOI:10.1038/ncb1753 |



