2. 中国农业科学院北京畜牧兽医研究所, 北京 100193
2. Institute of Animal Science and Veterinary, Chinese Academy of Agricultural Science, Beijing 100193, China
乳蛋白是评定牛奶质量的一项重要指标,是牛奶中的主要营养物质之一[1]。其中,乳蛋白以酪蛋白为主,而酪蛋白则以β-酪蛋白为主,占牛奶中酪蛋白总量的48%[2]。有研究表明,奶牛乳腺上皮细胞(BMECs)是乳腺合成乳蛋白的主要细胞[3],乳腺中90%的蛋白是通过BMECs摄取和利用前体物(氨基酸或小肽)从头合成[4]。而β-酪蛋白的表达量常被用作BMECs分化程度及乳蛋白合成能力的标志[2]。同时,BMECs作为病原菌穿过乳导管进入乳腺后首先接触的细胞,病原微生物能够破坏其细胞形态结构、诱导宿主细胞凋亡,并以此影响疾病的发生与发展[5]。Filep等[6]研究表明,当奶牛乳腺炎致病菌感染乳腺组织后,分泌上皮细胞发生空泡化,随着成纤维细胞的增殖,气孔变厚,基底膜脱落。研究表明,哺乳动物雷帕霉素靶蛋白(mTOR)和酪氨酸激酶/信号转导及转录激活因子(JAK/STAT)信号通路在促进蛋白质和脂质合成和细胞增殖中具有重要调节作用[7]。mTOR通过核糖体6激酶(S6K)和真核翻译起始因子4E结合蛋白1/真核起始因子4E(4E-BP1/EIF4E)的磷酸化调节蛋白质翻译,活化或磷酸化S6K磷酸化核糖体蛋白S6(RPS6)以刺激翻译[8]。信号转导及转录激活因子5(STAT5)在调节乳蛋白基因启动子方面起着至关重要的作用[9]。此外,STAT5也被认为是牛奶乳蛋白合成的候选基因[10]。
无乳链球菌(GBS)为一种革兰氏阳性球菌,是引起奶牛亚临床型乳腺炎的主要致病菌之一。GBS在牛场中的流行率很高,有研究表明,调查的800个牧场中,其感染率高达90.16%,且通常是慢性和亚临床型乳腺炎[11]。奶牛患轻度和中度范围的GBS性乳腺炎会使乳汁体细胞增加[12]。Pecka-kiełb等[13]的研究表明,感染了GBS乳区的乳汁和未感染的乳区乳汁相比,酪蛋白发生降解。GBS感染奶牛也会导致牛奶质量和产量降低[12]。因此,深入研究GBS对BMECs乳蛋白合成的影响机制具有重要的理论与实际意义。但是,目前关于此方面的研究尚不清楚。鉴于此,本试验以GBS诱导BMECs损伤为模型,主要从细胞活性、形态、凋亡及JAK/STAT和mTOR信号通路方面,研究GBS对乳蛋白合成的影响机制,为进一步探讨GBS对BMECs内乳蛋白合成的影响机理提供理论基础。
1 材料与方法 1.1 试验材料BMECs来自于东北农业大学动物生物化学与分子生物学实验室的惠赠;GBS为标准菌株(CVCC3940),购自于中国兽药监察所。
1.2 试验方法 1.2.1 BMECs培养BMECs用含10%胎牛血清(FBS)的DMEM/F-12培养液(含100 U/mL青霉素和100 U/mL链霉素)于37 ℃、5% CO2细胞培养箱中培养。后续试验组培养液中不添加抗生素,用含4% FBS的DMEM/F-12培养液培养细胞。
1.2.2 GBS的培养GBS用脑心浸液肉汤(BHI,OXOID,美国)于37 ℃恒温培养箱中培养24 h后,取1 mL菌液用无菌磷酸盐缓冲液(PBS)进行10倍倍比稀释,各稀释度分别取200 μL在加有琼脂的BHI固体培养基上进行涂板,于37 ℃恒温培养箱中过夜培养,计算菌落形成单位(colony forming unit,CFU)。将GBS菌液用不加双抗的细胞培养液按接种量进行稀释,现制备现用。
1.2.3 细胞活性检测将BMECs以200 μL/孔接种于96孔板,待96孔板BMECs达到90%及以上融合,BMECs每孔数量为1×105个/孔时,吸出培养液,用D-Hank’s缓冲液(Gibco,Grand Island,美国)清洗2次,分别加入不同浓度的GBS[感染复数(MOI)分别为100、50、10],于37 ℃、5%CO2细胞培养箱中培养1、2、4、6、8、12、18、24 h。每个时间点设立6个重复以及6个空白对照。然后,按照乳酸脱氢酶(LDH)试剂盒(碧云天,上海)说明书加入60 μL工作液,室温避光孵育30 min后用酶标仪(Thermo, 美国)在490 nm处测定吸光度。
1.2.4 细胞形态检测将BMECs悬液均匀地接种于置有10 mm×10 mm盖玻片的BMECs培养皿中,于37 ℃、5% CO2细胞培养箱中培养;待BMECs达到90%及以上融合时,吸出培养液,用D-Hank’s缓冲液清洗2次,以MOI=50的比例每孔加入已制备好的GBS悬液,于细胞培养箱中培养2、4、6、8 h。每个时间点设立3个重复以及3个空白对照。到达处理时间点,将黏附在盖玻片上的BMECs用预冷PBS洗3次,每孔加入2 mL 2.5%戊二醛,4 ℃固定2 h后吸出戊二醛,分别用30%、50%、70%、80%、90%和100%酒精脱水,每次脱水15 min,然后用叔丁醇置换酒精3次,每次10 min,接着用叔丁醇浸没样品,放入4 ℃冰箱中冷冻,待叔丁醇凝固后转移到真空干燥机中;真空干燥后,将BMECs爬片粘于样品台,用喷金仪(JEOL JFC-1600,日本)喷金,喷金后用扫描电镜(JEOL JSM-6700F,日本)观察BMECs形态。
1.2.5 细胞凋亡检测培养BMECs,当BMECs达到90%及以上融合时,加入GBS(MOI=50)后在37 ℃、5% CO2细胞培养箱中培养1、2、4、6、8、10、12、24 h。每个时间点设立3个重复以及3个空白对照。然后,用不含乙二胺四乙酸(EDTA)的胰酶消化BMECs后收集到离心管内,1 000 r/min离心5 min,沉淀BMECs。小心吸除上清,加入1 mL 4 ℃预冷的PBS,重悬BMECs,再次离心沉淀BMECs,小心吸除上清。按照Annexin V-FITC/PI凋亡检测试剂盒(北京友谊中联生物科技有限公司)说明书用去离子水按1 : 10稀释结合缓冲液,加入250 μL结合缓冲液重新悬浮BMECs,调节其浓度为1×106个/mL;取100 μL的BMECs悬液于5 mL流式管中,加入5 μL Annexin V-FITC和10 μL PI溶液;混匀后于室温避光孵育15 min;在反应管中加400 μL PBS,1 h内用流式BMECs仪(NovoCyte 451160621590)检测,用软件(NovoExpress 1.2.4)进行结果分析。
1.2.6 乳蛋白合成相关基因的mRNA表达量培养BMECs,当BMECs达到90%及以上融合时,加入GBS(MOI=50)分别在37 ℃、5% CO2细胞培养箱中培养1、2、4、6、8 h后按照Total RNA Kit Ⅰ(OMEGA,中国)试剂盒进行RNA的提取。提取出来的总RNA用Denovix超微量紫外可见分光光度计(DS-11,美国)进行浓度和纯度检测,然后采用cDNA合成试剂盒(TaKaRa,日本)合成cDNA,反应条件为37 ℃,15 min(反转录反应),85 ℃,5 s(反转录酶的失活反应)。反转录-聚合酶链式反应(RT-PCR)条件为95 ℃预变性30 s,1个循环;95 ℃延伸5 s,60 ℃退火30 s,40个循环。基因的引物序列见表 1,由生工生物工程(上海)股份有限公司合成。
|
|
表 1 基因的引物序列 Table 1 Primer sequences of genes |
培养BMECs,当BMECs达到90%及以上融合时,加入GBS(MOI=50)分别在37 ℃、5% CO2细胞培养箱中培养1、2、4、6、8 h。每个时间点设立3个重复以及3个空白对照。弃去培养液,PBS洗3遍,以细胞数量1×107个/mL加入1 mL细胞裂解液提取细胞蛋白,BCA法测定蛋白浓度。配制十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE),蛋白样品上样量为15 μg/孔,90 V恒压下进行电泳至分离胶,然后在120 V恒压下电泳至溴酚蓝刚跑出分离胶底部停止电泳。电泳完毕后,用湿转法转膜,转膜完成后用丽春红染色试剂对膜进行染色,观察转膜效果,然后对膜进行封闭和抗体孵育,将膜进行曝光后直接扫描,用软件Image J转变条带为TIFF格式,用Total Lab Quant V11.5(Newcastle upon Tyne,英国)读取条带的积分光密度(IOD)值。
1.3 数据分析和处理试验数据用Excel 2016进行整理,应用统计软件SAS 9.4进行单因素方差分析(one-way ANOVA)分析,P<0.05代表差异显著,P<0.01代表差异极显著。
2 结果与分析 2.1 GBS对BMECs活性的影响如图 1所示,不同浓度(MOI=100、50、10)GBS处理BMECs后,与对照组相比,MOI=100处理中,感染1 h时,LDH释放量极显著高于对照组(P<0.01);感染8 h时,LDH释放量几乎达到最大释放量,极显著高于对照组(P<0.01),细胞基本全部死亡。MOI=50处理中,与对照组相比,感染1、2 h时,LDH释放量显著上升(P<0.05);感染4 h及以上时,LDH释放量极显著上升(P<0.01)。MOI=10处理中,与对照组相比,感染1、2、4、6 h时,LDH释放量虽然有所上升,但差异不显著(P>0.05);感染8 h时,LDH释放量显著上升(P<0.05);感染12、18、24 h时,LDH释放量极显著上升(P<0.01)。研究结果表明,GBS对BMECs的毒性作用具有明显的时间、剂量依赖性,即随着时间的延长、细菌浓度的升高,这种毒性作用越强。
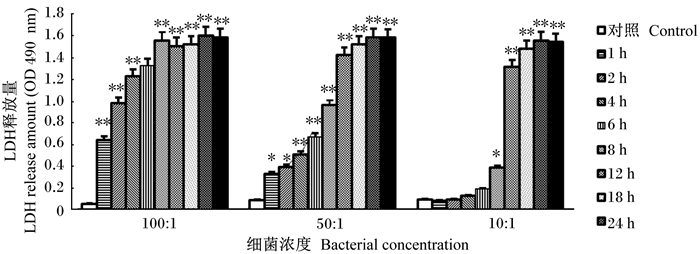
|
与对照组比较,“*”表示差异显著(P<0.05);“* *”表示差异极显著(P<0.01)。下图同。 "*" mean significant difference (P < 0.05); "* *" mean significant difference (P < 0.01) as compared with the control group. The same as below. 图 1 LDH释放量 Fig. 1 LDH release amount |
如图 2所示,未感染正常细胞的形态完整,充分伸展,贴壁性良好;GBS感染细胞2 h时,细胞边沿附着少量GBS,细胞膜发生轻微的破裂;感染4 h时,细胞表面附着大量GBS,贴壁性变差,细胞边沿严重破裂;感染6 h时,细胞大量脱落,发生断裂;感染8 h时,细胞发生严重的变形和断裂。
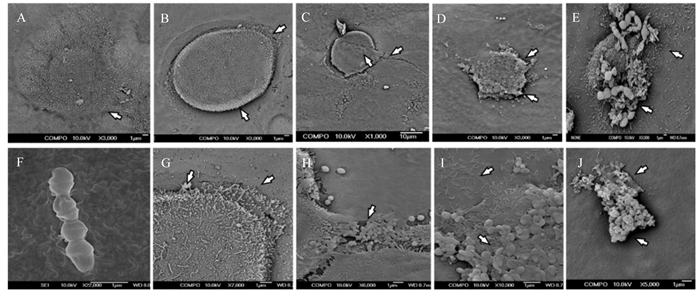
|
A:未感染正常细胞;F:无乳链球菌;B和G:感染2 h的细胞;C和H:感染4 h的细胞;D和I:感染6 h的细胞;E和J:感染8 h的细胞。 A: uninfected normal cells; F: GBS; B and G: cells infected for 2 h; C and H: cells infected for 4 h; D and I: cells infected for 6 h; E and J: cells infected for 8 h. 图 2 GBS感染后BMECs形态观察 Fig. 2 Morphological observation of BMECs after infection by GBS |
应用流式细胞术(AnnexinV/PI双染法)定量检测GBS对BMECs凋亡的影响。其中,活细胞不被染料着色(AnnexinV-/PI-),早期凋亡细胞能被着色,但不能被PI着色,晚期凋亡细胞或坏死细胞可以被2种染料着色(AnnexinV+/PI-)。GBS感染细胞1、2、4、6、8、10、12、18、24 h后,BMECs的早期凋亡、晚期凋亡或坏死的细胞大致占比如图 3所示,可以得出随着感染时间的延长,正常细胞的占比下降,处于早期和晚期凋亡的细胞占比上升。
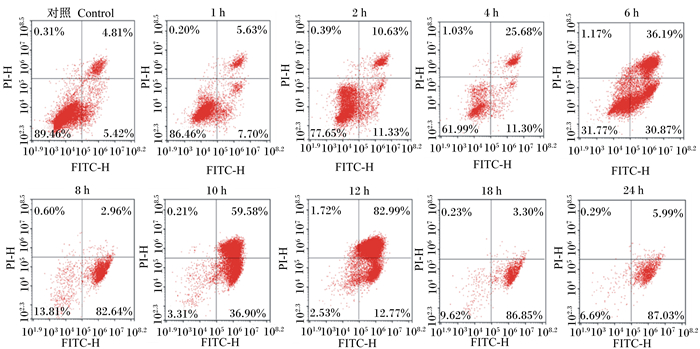
|
图 3 Annexin V-FITC和PI双染分析BMECs的凋亡流式图 Fig. 3 Flow chart of Annexin V-FITC and PI double staining for apoptosis of BMECs |
BMECs的凋亡率如图 4所示,与对照组相比,GBS感染细胞1 h时,细胞并没有出现明显的凋亡(P>0.05);而感染2 h时,便有11.33%的细胞处于早期凋亡阶段,与对照组相比,凋亡率显著上升(P<0.05),处于晚期凋亡的细胞则极显著上升(P<0.01);4 h亦如此。而随着感染时间的延长,6和8 h处于早期凋亡的细胞凋亡率与对照组相比极显著上升(P<0.01),而感染6 h时,处于晚期凋亡/坏死阶段的细胞凋亡率极显著高于对照组(P<0.01);感染8、18、24 h时,处于晚期凋亡阶段的细胞凋亡率没有显著差异(P>0.05),但是处于早期凋亡阶段的细胞凋亡率极显著高于对照组(P<0.01)。由此可见,GBS诱导BMECs的凋亡和坏死呈时间依赖性,而且凋亡和坏死的程度随着感染时间的延长而加剧。

|
图 4 Annexin V-FITC和PI双染分析BMECs的凋亡率 Fig. 4 Apoptosis rate of BMECs analyzed by Annexin V-FITC and PI double staining |
分别提取GBS感染不同时间的BMECs总RNA,以β-肌动蛋白做内参基因,进行RT-PCR检测,分别检测了β-酪蛋白、酪氨酸激酶2(JAK2)、信号转导及转录激活因子5a(STAT5a)、mTOR、丝氨酸/苏氨酸蛋白激酶1(AKT1)、真核翻译起始因子4E结合蛋白1(EIF4E-BP1)、核糖体蛋白S6(sRPS6)、催乳素受体(PRLR)、est结构域转录因子5(ELF5)mRNA的表达量。
如图 5所示,在GBS感染BMECs的过程中,β-酪蛋白的mRNA表达量呈下降趋势,与对照组比较,从感染2 h开始,β-酪蛋白的mRNA表达量极显著下降(P<0.01)且随着感染时间的延长,表达量越低。
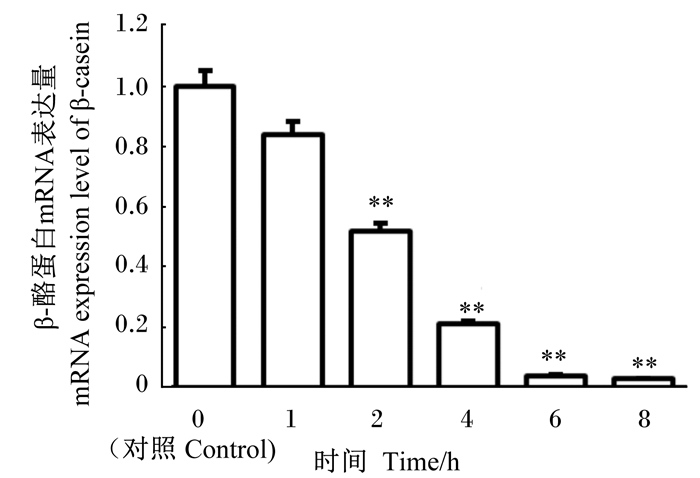
|
图 5 β-酪蛋白的mRNA表达量 Fig. 5 mRNA expression level of β-casein |
如图 6所示,基因JAK2、STAT5a的mRNA表达量均呈下降趋势。JAK2的mRNA表达量与对照组相比,感染1 h时显著下降(P<0.05),在感染8 h时,则呈极显著下降(P<0.01)。与对照组比较,STAT5a的mRNA表达量从感染2 h开始,呈显著下降(P<0.05);感染6与8 h时,与对照组比较,则呈极显著下降(P<0.01)。
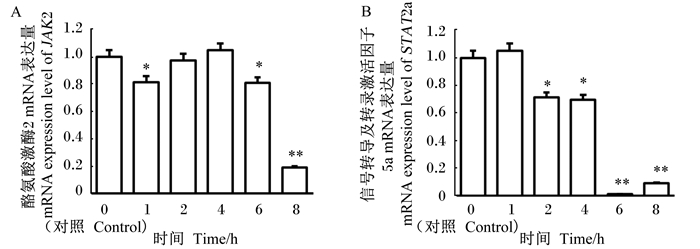
|
图 6 酪氨酸激酶2(A)和信号转导及转录激活因子5a(B)的mRNA表达量 Fig. 6 mRNA expression levels of tyrosine kinase 2 (A) and signal transducers and activators of transcription 5a (B) |
如图 7所示,AKT的mRNA表达量与对照组比较,随着感染时间的延长,呈下降的趋势,在感染1 h时,AKT的mRNA表达量呈极显著下降(P<0.01),在感染6 h时,其mRNA的表达量几乎为零,极显著低于对照组(P<0.01)。与对照组比较,mTOR的mRNA表达量在感染1 h时,没有显著差异(P>0.05),但在感染2 h时,其mRNA表达量显著低于对照组(P<0.05),随着感染时间的延长,在感染4、6、8 h时,其mRNA表达量极显著低于对照组(P<0.01)。
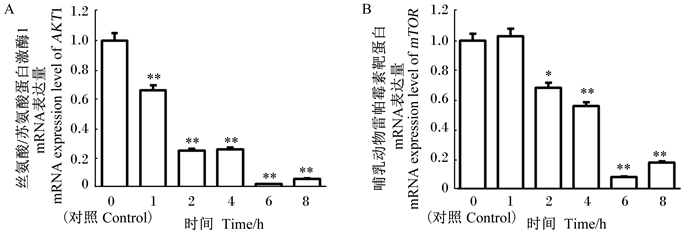
|
图 7 丝氨酸/苏氨酸蛋白激酶1(A)和哺乳动物雷帕霉素靶蛋白(B)的mRNA表达量 Fig. 7 mRNA expression levels of serine-threonine protein kinase 1 (A) and mammalian target of rapamycin (B) |
如图 8所示,负调控乳蛋白合成EIF4E-BP1的mRNA表达量与对照组比较,随着感染时间的延长,呈上升趋势,从感染4 h开始,EIF4E-BP1的mRNA表达量呈极显著上升(P<0.01)。与对照组比较,处于mTOR信号通路下游的sRPS6的mRNA表达量在感染1和2 h时,与对照组比较,没有显著差异(P>0.05);但在感染4和6 h时,其mRNA表达量显著低于对照组(P<0.05),而感染8 h时,其mRNA表达量极显著低于对照组(P<0.01)。
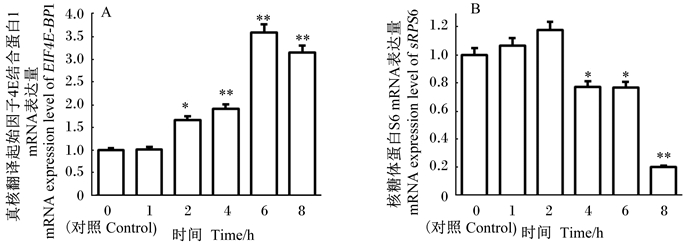
|
图 8 真核翻译起始因子4E结合蛋白1(A)和核糖体蛋白S6(B)的mRNA表达量 Fig. 8 mRNA expression levels of EIF4E-binding protein 4E-BP1 (A) and ribosomal protein S6 (B) |
如图 9所示,对乳蛋白合成起重要作用的PRLR和ELF5的mRNA表达量与对照组比较,呈下降趋势,从感染1 h开始,PRLR的mRNA表达量呈极显著下降(P<0.01)。与对照组比较,ELF5的mRNA表达量在感染2 h,与对照组比较,没有显著差异(P>0.05);但在感染4、6和8 h时,其mRNA表达量极显著低于对照组(P<0.01)。
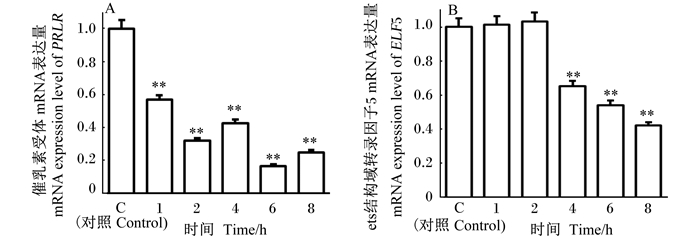
|
图 9 催乳素受体(A)和ets结构域转录因子5(B)的mRNA表达量 Fig. 9 mRNA expression levels of porcine prolactin receptor (A) and ets domain transcription factor (B) |
通过Western blot在翻译水平上检测了GBS感染后BMECs中乳蛋白合成相关蛋白的表达。如图 10所示,与对照组比较,GBS感染BMECs后,β-酪蛋白的蛋白表达量呈先上升再下降的趋势。与对照组比较,在感染1 h时,β-酪蛋白的蛋白表达量显著上升(P<0.05);在感染2 h时,其蛋白表达量有下降的趋势,但是差异不显著(P>0.05);在感染4、6、8 h时,其蛋白表达量极显著低于对照组(P<0.01),且在感染8 h时,GBS完全抑制了β-酪蛋白的蛋白表达。
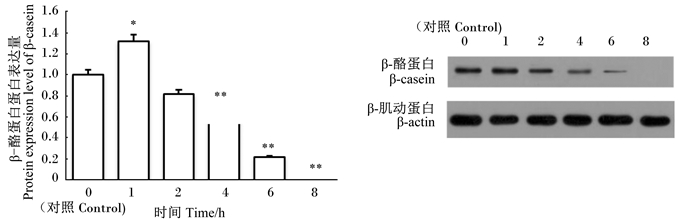
|
图 10 β-酪蛋白的蛋白表达量及Western blot谱图 Fig. 10 Protein expression level of β-casein and Western blot spectrogram |
如图 11所示,与对照组比较,STAT5a蛋白表达量整体呈下降趋势。与对照组比较,在感染2 h时,STAT5a蛋白表达量没有显著变化(P>0.05);而在感染4、6和8 h时,其蛋白表达量极显著低于对照组(P<0.01),而且在感染8 h时,其蛋白表达量完全受到抑制,表达量为零。p-STAT5a在感染1和4 h时,蛋白表达量显著低于对照组(P<0.05),感染2 h时差异不显著(P>0.05);随着感染时间的延长,感染6和8 h时,其蛋白表达量显著低于对照组(P<0.01),且在感染8 h时,GBS完全抑制了STAT5a、p-STAT5a的蛋白表达。
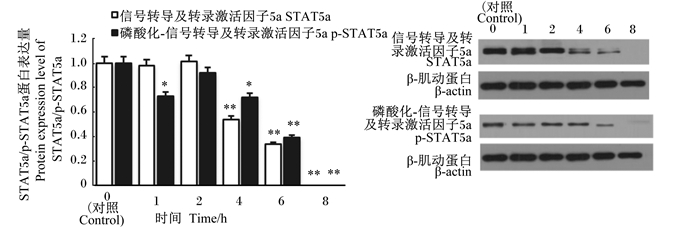
|
图 11 STAT5a/p-STAT5a蛋白表达量及Western blot谱图 Fig. 11 Protein expression level of STAT5a/p-STAT5a and Western blot spectrogram |
如图 12所示,与对照组比较,mTOR和p-mTOR二者的蛋白表达量在感染1和2 h时,没有显著差异(P>0.05);在感染4、6和8 h时,均极显著低于对照组(P<0.01),而且,在感染8 h时,二者的蛋白量均不表达,完全受到了GBS的抑制。
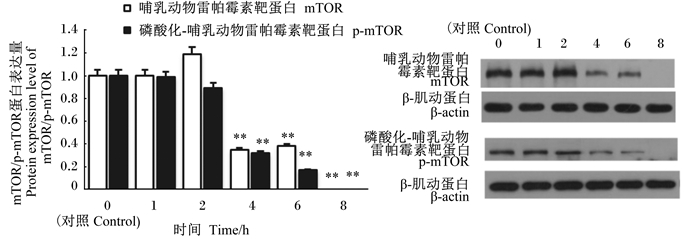
|
图 12 mTOR/p-mTOR蛋白表达量及Western blot谱图 Fig. 12 Protein expression level of mTOR/p-mTOR and Western blot spectrogram |
如图 13所示,与对照组比较,AKT蛋白表达量在感染6和8 h极显著降低(P<0.01),且在感染8 h时,其蛋白完全不表达。p-AKT的蛋白表达量在感染4、6和8 h时,其蛋白表达量极显著低于对照组(P<0.01);并且感染6和8 h时,其蛋白不表达,完全受到了GBS的抑制。
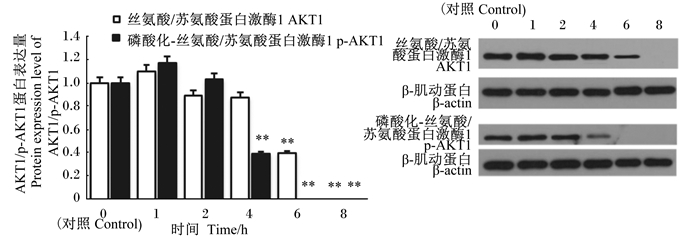
|
图 13 AKT1/p-AKT1蛋白表达量及Western blot谱图 Fig. 13 Protein expression level of AKT1/p-AKT1 and Western blot spectrogram |
当奶牛患乳腺炎时,乳腺上皮细胞的紧密连接、完整性发生改变,细胞通透性增加,甚至大量脱落,使大量的血液成分及体细胞涌入乳汁中,造成更加严重的乳腺组织损伤[14-15]。乳腺组织的结构和功能密切相关,在乳腺腺泡水平上,乳的产生取决于奶牛分娩后BMECs的生化功能、结构的分化以及细胞的增殖等因素[16]。而炎症发生时,不但影响腺泡的发育、降低腺泡细胞的分化功能,还可显著降低BMECs合成乳成分的变化以及产奶量下降[16]。因此,本试验从GBS对BMECs的活性、形态、凋亡以及相关基因表达的影响来探索其对BMECs乳蛋白合成的影响。
3.1 GBS对BMECs活性和形态的影响LDH是大部分活细胞都能合成的一种酶,一般存在于细胞胞浆中。当细胞受到损伤时,就会释放出LDH,从而使得细胞培养液中LDH的活性上升,因此,LDH活性的测定是目前测定细胞损伤程度最常用的方法之一。有研究表明,金黄色葡萄球菌、GBS和乳房链球菌对BMECs有很强的黏附能力和侵袭能力[12, 17-18]。正因为GBS对BMECs极强的黏附力和侵袭能力,使得细胞很快受损,且在短时间内释放大量的LDH。本试验通过测定LDH活性来检测GBS对BMECs的毒性强弱。从结果中我们可以看出,GBS对BNECs的损伤呈现一个急速上升的特征,而MOI=50 : 1处理中的LDH释放量相较于MOI=100 : 1和MOI=10 : 1处理是一个较平缓的上升过程,MOI=50 : 1的处理效果更好。MOI=50,在GBS感染BMECs 1、2 h后,LDH释放量显著上升;感染4、6、8、12、18 h后,LDH释放量极显著上升,这个结果表明GBS感染细胞短时间内便引起细胞膜的破裂,胞内LDH的释放,导致整个细胞崩解。细胞的形态结构影响其功能,当病原菌使细胞的形态结构发生变化,导致细胞受损时就会影响其正常的生理功能,降低其防御能力,病原体进一步侵入乳腺内部造成进一步的感染[19]。有研究表明,诺卡氏菌、内毒素能引起BMECs损伤[20-21],但是关于GBS对BMECs形态影响的研究未见报道。本试验通过扫描电镜检测GBS对BMECs形态的影响,发现GBS在短时间内便黏附于细胞表面,且随着感染时间的延长,细胞发生皱缩、变形,细胞表面微绒毛脱落,细胞从边缘折叠发展为细胞膜破裂,细胞断裂。同时,这也验证了GBS感染细胞后,细胞培养液中的LDH活性上升是由于细胞受到严重损伤,细胞破裂死亡造成的。
3.2 GBS对BMECs凋亡的影响据报道,多种细菌可以诱导细胞发生凋亡,改变细胞内环境,从而利于自身在细胞内的稳定存在[22-23]。本试验经过Annexin V-FITC和PI双染检测细胞凋亡情况,结果显示,GBS感染2 h即可使BMECs发生早期凋亡,且随着感染时间的延长,凋亡率上升。Kling等[24]在小鼠肺间质细胞上的研究结果也表明了GBS可以诱导细胞发生凋亡。Da Costa等[25]的研究表明,GBS感染会诱导人呼吸上皮细胞(A549)的细胞凋亡。GBS感染BMECs会引起细胞膜受损,细胞形态发生变化,从而使细胞胞浆内的大量LDH释放到胞外。GBS可以促进细胞发生凋亡,而引起凋亡发生的原因可能归咎于其基因编码的多种毒力因子和产生的毒素。这些毒力因子不仅能增强细菌侵袭上皮细胞的能力、协助细菌进入宿主细胞,还可损伤入侵的上皮细胞,从而严重危害乳腺组织[26-27]。
3.3 GBS对BMECs乳蛋白合成的影响各种奶牛乳腺炎致病菌导致乳成分改变,牛奶质量下降,乳蛋白受到破坏[28-29]。乳蛋白含量是影响牛奶品质的主要指标之一,其包括乳清蛋白和酪蛋白2大类,而酪蛋白是乳腺上皮细胞产生的磷酸化蛋白,酪蛋白的合成与分泌常被作为乳腺上皮细胞分泌能力的标志[30]。有研究表明,当奶牛患乳腺炎时,酪蛋白很容易被细菌酶降解。奶牛乳腺炎致病菌可导致牛奶中酪蛋白降解,从而显著降低酪蛋白含量,而不凝固的乳清蛋白增加[31-32]。有研究表明感染了GBS的奶牛,其牛奶中的酪蛋白也发生了降解[33-34]。本研究用GBS体外感染BMECs,研究发现β-酪蛋白在转录水平和和蛋白水平都发生了显著的下调,说明GBS感染抑制BMECs β-酪蛋白的合成。研究表明当奶牛患乳腺炎时,蛋白质溶解酶的活性升高,乳蛋白被分解为多肽[35]。
研究表明,JAK-STAT信号通路在转录水平上影响乳蛋白的合成。其中,JAK2使STAT5a磷酸化而被激活[36]。激活的STAT5a可调控酪蛋白等乳蛋白基因的表达,促进乳腺泌乳,当STAT5a基因完全缺失时,乳腺无法分化,乳蛋白基因也无法正常表达,乳腺泌乳功能完全丧失[37]。ELF5是STAT5a下游的效应蛋白,能增强STAT5a启动子活性,调节乳腺上皮细胞的分化促进泌乳[38]。催乳素(PRL)与催乳素受体(PRLR)结合之后,PRLR介导JAK2-STAT5信号通路,形成PRLR-JAK2-STAT5信号转导通路[39]。目前,关于乳腺炎致病菌是如何影响乳蛋白合成的研究有限[40]。因此,本研究用RT-PCR检测了BMECs JAK2-STAT5信号通路中的JAK2、STAT5a、ELF5、PRLR的mRNA表达量,并用Western blot检测了STAT5a及p-STAT5a的蛋白表达情况。结果表明,GBS对BMECs中JAK2、STAT5a、ELF5、PRLR的mRNA表达具有抑制作用,导致其mRNA的表达量显著下降。此外,在蛋白水平上,STAT5a及p-STAT5a的蛋白表达显著下降,并在感染8 h时二者蛋白表达完全被抑制。这表明了GBS能够抑制BMECs的JAK2-STAT5信号通路中的关键基因的转录和翻译,进而抑制BMECs乳蛋白的合成。有研究发现,从患亚临床乳腺炎的奶牛乳汁中分离鉴定出GBS,通过把奶样在37 ℃条件下进行模拟奶牛乳腺孵育。结果表明,奶样中的蛋白发生了降解,特别是β-酪蛋白[40]。而目前未有在BMECs层面研究GBS影响乳蛋白合成的分子机制的相关报道。
关于BMECs乳蛋白的合成,除了转录水平上的JAK2-STAT5外,AKT-mTOR被认为是蛋白水平上合成乳蛋白的重要信号转导途径。其中,活化的AKT基因使mTOR、S6K1及EIF4E-BP1磷酸化。AKT能促进乳腺蛋白质的合成和糖代谢以及抑制细胞的凋亡;mTOR在调节乳腺上皮细胞的生长、代谢等方面具有重要作用[41]。本研究用RT-PCR检测了BMECs的mTOR信号通路中的AKT1、mTOR、sRPS6、EIF4E-BP1的mRNA表达量,并用Western blot检测了AKT1、p-AKT1及mTOR、p-mTOR的蛋白表达量。结果表明,GBS感染BMECs致使细胞中正调控乳蛋白合成基因AKT1、mTOR、sRPS6的mRNA表达发生了显著的下调,而负调控基因EIF4E-BP1的mRNA表达显著上调。而且,在蛋白水平上,AKT1、p-AKT1及mTOR、p-mTOR发生了显著的下调,感染8 h时其蛋白表达完全受到抑制。这说明了GBS可以影响mTOR信号通路中与乳蛋白合成相关的关键基因的表达,进而抑制BMECs乳蛋白的合成。关于GBS影响BMECs乳蛋白合成相关因子的研究鲜有报道。
4 结论① GBS能够损伤BMECs的形态结构,促进细胞凋亡,降低细胞活力,从而影响细胞的正常生理功能。
② GBS能够抑制BMECs乳蛋白的合成,主要通过抑制JAK/STAT、mTOR信号通路发挥作用。
| [1] |
嵇庆刚. 牛奶中乳蛋白含量的影响因素及提高措施[J]. 现代畜牧科技, 2016(11): 31. |
| [2] |
欧阳五庆, 钱菊汾. 山羊乳腺上皮细胞培养体系的建立[J]. 西北农林科技大学学报(自然科学版), 2003, 31(3): 30-34. DOI:10.3321/j.issn:1671-9387.2003.03.007 |
| [3] |
GAO H N, HAN H U, ZHENG N, et al. Leucine and histidine independently regulate milk protein synthesis in bovine mammary epithelial cells via mTOR signaling pathway[J]. Journal of Zhejiang University-SciEnce B, 2015, 16(6): 560-572. DOI:10.1631/jzus.B1400337 |
| [4] |
孟春雨, 黄鑫, 刘丽杰, 等. 牛乳腺上皮细胞SNAT2对氨基酸调节乳合成的影响[J]. 中国畜牧兽医, 2018, 45(8): 2119-2127. |
| [5] |
卢金霞.苦参碱干预金黄色葡萄球菌对奶牛乳腺上皮细胞粘附作用的研究[D].硕士学位论文.银川: 宁夏大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10749-1017258888.htm
|
| [6] |
FILEP R, AKERS R M. Casein secretion and cytological differentiation in mammary tissue from bulls of high or low genetic merit[J]. Journal of Dairy Science, 2000, 83(10): 2261-2268. DOI:10.3168/jds.S0022-0302(00)75110-1 |
| [7] |
TIAN Q, WANG H R, WANG M Z, et al. Lactogenic hormones regulate mammary protein synthesis in bovine mammary epithelial cells via the mTOR and JAK-STAT signal pathways[J]. Animal Production Science, 2015, 56(11): 1803-1809. |
| [8] |
DAI W T, WHITE R R, LIU J X, et al. Seryl-tRNA synthetase-mediated essential amino acids regulate β-casein synthesis via cell proliferation and mammalian target of rapamycin (mTOR) signaling pathway in bovine mammary epithelial cells[J]. Journal of Dairy Science, 2018, 101(11): 10456-10468. DOI:10.3168/jds.2018-14568 |
| [9] |
ZHANG M C, ZHAO S G, WANG S S, et al. D-glucose and amino acid deficiency inhibits casein synthesis through JAK2/STAT5 and AMPK/mTOR signaling pathways in mammary epithelial cells of dairy cows[J]. Journal of Dairy Science, 2018, 101(2): 1737-1746. DOI:10.3168/jds.2017-12926 |
| [10] |
LI M, ZHAO D, MA G, et al. Upregulation of ATBF1 by progesterone-PR signaling and its functional implication in mammary epithelial cells[J]. Biochemical and Biophysical Research Communications, 2013, 430(1): 358-363. DOI:10.1016/j.bbrc.2012.11.009 |
| [11] |
BI Y L, WANG Y J, QIN Y, et al. Prevalence of bovine mastitis pathogens in bulk tank milk in China[J]. PLoS One, 2016, 11(5): e0155621. DOI:10.1371/journal.pone.0155621 |
| [12] |
JØRGENSEN H J, NORDSTOGA A B, SVILAND S, et al. Streptococcus agalactiae in the environment of bovine dairy herds-rewriting the textbooks?[J]. Veterinary Microbiology, 2016, 184: 64-72. DOI:10.1016/j.vetmic.2015.12.014 |
| [13] |
PECKA-KIEŁB E, VASIL M, ZACHWIEJA A, et al. An effect of mammary gland infection caused by Streptococcus uberis on composition and physicochemical changes of cows' milk[J]. Polish Journal of Veterinary Sciences, 2016, 19(1): 49-55. DOI:10.1515/pjvs-2016-0007 |
| [14] |
MOUSSAOUI F, MICHELUTTI I, LE ROUX Y, et al. Mechanisms involved in milk endogenous proteolysis induced by a lipopolysaccharide experimental mastitis[J]. Journal of Dairy Science, 2002, 85(10): 2562-2570. DOI:10.3168/jds.S0022-0302(02)74339-7 |
| [15] |
ZHAO X, LACASSE P. Mammary tissue damage during bovine mastitis:causes and control[J]. Journal of Animal Science, 2008, 86(13 Suppl): 57-65. |
| [16] |
AKERS R M, NICKERSON S C. Mastitis and its impact on structure and function in the ruminant mammary gland[J]. Journal of Mammary Gland Biology and Neoplasia, 2011, 16(4): 275-289. DOI:10.1007/s10911-011-9231-3 |
| [17] |
CHEN X Y, DEGO O K, ALMEIDA R A, et al. Deletion of sua gene reduces the ability of Streptococcus uberis to adhere to and internalize into bovine mammary epithelial cells[J]. Veterinary Microbiology, 2011, 147(3/4): 426-434. |
| [18] |
BOUCHARD D S, RAULT L, BERKOVA N, et al. Inhibition of Staphylococcus aureus invasion into bovine mammary epithelial cells by contact with live Lactobacillus casei[J]. Applied and Environmental Microbiology, 2013, 79(3): 877-885. DOI:10.1128/AEM.03323-12 |
| [19] |
RAINARD P, RIOLLET C. Innate immunity of the bovine mammary gland[J]. Veterinary Research, 2006, 37(3): 369-400. DOI:10.1051/vetres:2006007 |
| [20] |
CHEN W, LIU Y X, ZHANG L M, et al. Nocardia cyriacigeogica from bovine mastitis induced in vitro apoptosis of bovine mammary epithelial cells via activation of mitochondrial-caspase pathway[J]. Frontiers in Cellular and Infection Microbiology, 2017, 7: 194. DOI:10.3389/fcimb.2017.00194 |
| [21] |
刘明江, 宋世秀, 蒋小玉, 等.咖啡酸抗LPS诱导的奶牛乳腺上皮细胞炎性损伤的调节机制[C]//中国畜牧兽医学会2013年学术年会论文集.北京: 中国畜牧兽医学会, 2013.
|
| [22] |
CHEN W, LIU Y X, ZHANG L M, et al. Nocardia cyriacigeogica from bovine mastitis induced in vitro apoptosis of bovine mammary epithelial cells via activation of mitochondrial-caspase pathway[J]. Frontiers in Cellular and Infection Microbiology, 2017, 7: 194. DOI:10.3389/fcimb.2017.00194 |
| [23] |
SHAHID M, GAO J, ZHOU Y N, et al. Prototheca zopfii isolated from bovine mastitis induced oxidative stress and apoptosis in bovine mammary epithelial cells[J]. Oncotarget, 2017, 8(19): 31938-31947. |
| [24] |
KLING D E, TSVANG I, MURPHY M P, et al. Group B Streptococcus induces a caspase-dependent apoptosis in fetal rat lung interstitium[J]. Microbial Pathogenesis, 2013, 61/62: 1-10. DOI:10.1016/j.micpath.2013.04.008 |
| [25] |
DA COSTA A F E, MORAES J A, DE OLIVEIRA J S S, et al. Reactive oxygen species involved in apoptosis induction of human respiratory epithelial (A549) cells by Streptococcus agalactiae[J]. Microbiology, 2016, 162(1): 94-99. DOI:10.1099/mic.0.000202 |
| [26] |
EMANEINI M, KHORAMIAN B, JABALAMELI F, et al. Comparison of virulence factors and capsular types of Streptococcus agalactiae isolated from human and bovine infections[J]. Microbial Pathogenesis, 2016, 91: 1-4. DOI:10.1016/j.micpath.2015.11.016 |
| [27] |
JAIN B, TEWARI A, BHANDARI B B, et al. Antibiotic resistance and virulence genes in Streptococcus agalactiae isolated from cases of bovine subclinical mastitis[J]. Veterinarski Arhiv, 2012, 82(5): 423-432. |
| [28] |
FLEMINGER G, RAGONES H, MERIN U, et al. Low molecular mass peptides generated by hydrolysis of casein impair rennet coagulation of milk[J]. International Dairy Journal, 2013, 30(2): 74-78. DOI:10.1016/j.idairyj.2012.11.013 |
| [29] |
GONÇALVES J L, KAMPHUIS C, MARTINS C M M R, et al. Bovine subclinical mastitis reduces milk yield and economic return[J]. Livestock Science, 2018, 210: 25-32. DOI:10.1016/j.livsci.2018.01.016 |
| [30] |
FREEMAN M E, KANYICSKA B, LERANT A, et al. Prolactin:structure, function, and regulation of secretion[J]. Physiological Reviews, 2000, 80(4): 1523-1631. DOI:10.1152/physrev.2000.80.4.1523 |
| [31] |
ABDEL-NASER E M, HUSSIEN M F, EL-KHABAZ K A S. Some bacteriological studies on sub clinical mastitis in cattle and its relation to changes in the milk protein electrophoretic pattern[J]. Assiut Veterinary Medical Journal, 2010, 56(127): 58-74. |
| [32] |
KESTER H J, SORTER D E, HOGAN J S. Activity and milk compositional changes following experimentally induced Streptococcus uberis bovine mastitis[J]. Journal of Dairy Science, 2015, 98(2): 999-1004. DOI:10.3168/jds.2014-8576 |
| [33] |
MURPHY S C, CRANKER K, SENYK G F, et al. Influence of bovine mastitis on lipolysis and proteolysis in milk[J]. Journal of Dairy Science, 1989, 72(3): 620-626. DOI:10.3168/jds.S0022-0302(89)79152-9 |
| [34] |
SAEMAN A I, VERDI R J, GALTON D M, et al. Effect of mastitis on proteolytic activity in bovine milk[J]. Journal of Dairy Science, 1988, 71(2): 505-512. DOI:10.3168/jds.S0022-0302(88)79581-8 |
| [35] |
FARRELL H M, Jr., MALIN E L, BROWN E M, et al. Review of the chemistry of αS2 -casein and the generation of a homologous molecular model to explain its properties[J]. Journal of Dairy Science, 2009, 92(4): 1338-1353. DOI:10.3168/jds.2008-1711 |
| [36] |
SCHINDLER C, LEVY D E, DECKER T. JAK-STAT signaling:from interferons to cytokines[J]. Journal of Biological Chemistry, 2007, 282(28): 20059-20063. DOI:10.1074/jbc.R700016200 |
| [37] |
COCOLAKIS E, DAI M O, DREVET L, et al. Smad signaling antagonizes STAT5-mediated gene transcription and mammary epithelial cell differentiation[J]. Journal of Biological Chemistry, 2008, 283(3): 1293-1307. DOI:10.1074/jbc.M707492200 |
| [38] |
HARRIS J, STANFORD P M, SUTHERLAND K, et al. Socs2 and Elf5 mediate prolactin-induced mammary gland development[J]. Molecular Endocrinology, 2006, 20(5): 1177-1187. DOI:10.1210/me.2005-0473 |
| [39] |
HELTEMES-HARRIS L M, FARRAR M A. Constitutively active STAT5 constructs[J]. Methods in Molecular Biology, 2013, 967: 225-232. |
| [40] |
ÅKERSTEDT M, WREDLE E, LAM V, et al. Protein degradation in bovine milk caused by Streptococcus agalactiae[J]. Journal of Dairy Research, 2012, 79(3): 297-303. DOI:10.1017/S0022029912000301 |
| [41] |
REILING J H, SABATINI D M. Stress and mTORture signaling[J]. Oncogene, 2006, 25(48): 6373-6383. DOI:10.1038/sj.onc.1209889 |




