动物体肠道中生活着大量的微生物,其数量和基因数甚至超过宿主细胞数[1-2],并与宿主有着紧密的联系,具有重要的营养、免疫、抗肿瘤和抗衰老等作用。肠道微生态的紊乱会给机体带来极大的伤害。粪菌移植技术是在宿主肠道内引入特定的肠道微生物区系,近年来已被用于治疗肠道感染或者定向改变宿主的生长发育等方面。然而,粪菌移植技术当前面临着几个重要的障碍,其一是粪便菌群的供体筛选流程复杂,成本高[3];其二是粪便菌群悬液不能够长期保存,无法一次采样后多次利用[4]。因此,获得健康、充足且标准化的菌源对于粪菌移植技术的应用以及肠道微生物研究具有重要的意义。
体外发酵培养可以利用体外发酵体系大量、标准化地模拟制备肠道微生物组,是解决上述问题的有力手段。体外培养的微生物组产品不仅可以用于粪菌移植、保证移植所用菌群的品质和标准,还可以提高优秀供体的利用率。同时,体外发酵制备的微生物组还可以用来评价各种饲料原料和药物对肠道微生物的影响[5]。
营养供给直接决定了能够在体外生长增殖的细菌的种类和数量。由于肠道微生物种类的多样性和代谢通路的复杂性,相比单一微生物培养,微生物组整体培养过程中存在的微生物间的互作以及相互依存关系[6],使得培养基的设计成为最具挑战性的技术难点。食品发酵素培养基(VL培养基)常被用于微生物的培养,其以葡萄糖作为主要碳水化合物来源,主要成分为酵母浸粉、牛肉浸粉和胰蛋白示,其中胰蛋白示含量最高。因此,VL培养基是一种高蛋白质、低糖的培养基,相对的更适合鸡肠道微生物组的体外培养,用于猪结肠微生物组体外培养制备时模拟效果不佳[7]。本研究以生长猪结肠食糜的营养组成为参考,并向VL培养基中添加植物源性物质,如糖蜜、玉米浆和动物肠道分泌的黏蛋白,优化VL培养基,以期在体外培养出与生长猪结肠有较高相似度的微生物组,为猪肠道微生物的体外研究和应用提供高效、可靠的实用工具。
1 材料与方法 1.1 生长猪结肠食糜采集、VL培养基配制本试验在国家饲料工程技术研究中心/农业部饲料工业中心动物试验基地(河北省丰宁满族自治县)进行。选取体重为45 kg的杜×长×大健康去势公猪6头、母猪6头,群体饲养。试验饲粮参照NY/T 65—2004《猪饲养标准》配制,采用玉米-豆粕型饲粮。整个试验期间保持圈舍干净卫生,猪只自由采食和饮水。试验猪屠宰前先空腹8 h、再自由采食12 h,保证肠道充满食糜,每头猪在屠宰后迅速打开腹腔采集结肠食糜于-80 ℃保存。以蒸馏水为溶剂,将VL培养基按照表 1配方配制好,等待检测。
|
|
表 1 VL、VLMOL、VLCSL、VLM和ZH培养基的配方与营养组成 Table 1 Formulas and nutritional composition of VL, VLMOL, VLCSL, VLM and ZH culture mediums |
以VL培养基为基础,分别添加糖蜜、玉米浆干粉与消化道分泌的黏蛋白及上述3种物质的组合物形成新的培养基,依次命名为VLMOL、VLCSL、VLM和ZH培养基。新培养基的粗蛋白质和可溶性糖含量均与生长猪结肠食糜相近。VLMOL、VLCSL、VLM与ZH的配方与营养组成如表 1所示。
1.3 体外连续发酵培养 1.3.1 发酵培养基制备与发酵系统准备本试验在济南森康三峰生物工程有限公司(济南)进行,采用容积500 mL、发酵体积330 mL的连续发酵设备进行发酵,发酵系统如图 1所示。称取330 mL培养基对应的底物于发酵罐中,加水至300 mL;按照表 1配方配制6 L培养基于补料瓶中。将无菌盐酸溶液与氢氧化钠溶液连入发酵系统中调pH为6.4。整个系统于121 ℃灭菌25 min,灭菌后立即通入无菌氮气。保持整个过程无外界杂菌污染,维持厌氧环境。参数设定:发酵罐中pH 6.4±0.1、温度(37.0±0.1) ℃、搅拌速度120 r/min,通氮气气泡速度每秒1~2个。
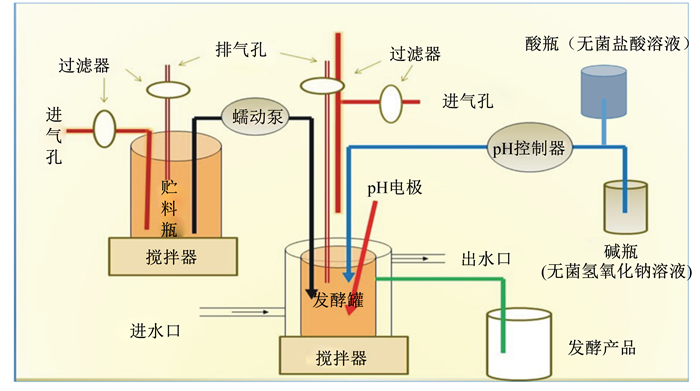
|
图 1 单向连续发酵系统示意图 Fig. 1 Schematic diagram of one-way continuous fermentation system |
选取健康的生长期去势公猪1头(无消化系统疾病且近3个月来未经过抗生素处理),体重50.12 kg,颈部放血处死后,迅速结扎分离结肠肠段,置于厌氧工作站中迅速收集结肠食糜,一部分于-80 ℃保存用于检测,另一部分用无菌磷酸盐缓冲液(pH 7.4)溶解并稀释10倍(质量体积比),4层无菌纱布过滤后制备为接种液后混匀。将30 mL接种液接种到体外单项连续发酵系统,闷罐培养16 h后开启进出料,置换率0.042 h-1(即每24 h的累积进料、出料量与发酵罐中液体体积一致,为330 mL)[8]。待发酵系统中菌群结构与数量稳定后,在发酵后第9天采集发酵液样品,-80 ℃冻存待检。
1.4 测定指标及测定方法 1.4.1 结肠食糜和VL培养基中养分含量测定干物质、粗蛋白质含量和总能水平的检测分别采用GB/T 6435—2014、GB/T6432—1994和ISO9831 : 1998中方法,可溶性糖含量的检测采用蒽酮比色法[9]。
1.4.2 结肠食糜和发酵液中微生物组成检测参照Zhao等[10]所述,利用16S rRNA方法检测不同培养基所得发酵液以及结肠食糜的微生物组成。
1.4.3 结肠食糜和发酵液中短链脂肪酸浓度检测称取0.5 g样品于10 mL聚丙烯离心管中,加入8 mL去离子水,超声30 min后8 000 r/min离心10 min,取上清液稀释10倍,用0.22 μm滤膜过滤后上机检测。25 μL样品溶液经ICS-3000离子色谱仪(戴安,美国)电导检测。多种有机酸经AS11分析柱(250 mm×4 mm)及AG11保护柱分离,流动相洗脱条件:氢氧化钾梯度洗脱,0~5 min,0.8~1.5 mmol/L;5~10 min,1.5~2.5 mmol/L;10~15 min,2.5 mmol/L,流速为1 mL/min。
1.5 数据统计与分析数据统计采用SAS 9.2软件进行,所有样本数据均进行Shapiro-Wilk正态分布检验和Brown-Forsythe方差同质性检验。数据采用单因素方差分析,若有显著差异,则用Student-Newman-Keuls多重比较进行检验。
菌群相似性分析:在考虑细菌丰度的情况下,利用SPSS 9.2统计学软件计算各组间Pearson距离远近相关系数。
2 结果与分析 2.1 生长猪结肠食糜与VL培养基营养组成比较如表 2所示,干物质基础下,结肠食糜的粗蛋白质与可溶性糖含量显著低于VL培养基(P < 0.05),总能水平显著高于VL培养基(P < 0.05)。在原始状态下,结肠食糜的粗蛋白质、可溶性糖含量与总能水平显著高于VL培养基(P < 0.05)。
|
|
表 2 结肠食糜与VL培养基的营养组成 Table 2 Nutritional composition of colonic digesta and VL culture medium (n=12) |
|
|
表 4 VLMOL、VLCSL、VLM和ZH培养基所得发酵液与结肠食糜中的短链脂肪酸浓度 Table 4 Concentrations of short chain fatty acids in colonic digesta and fermentation broths produced by VLMOL, VLCSL, VLM and ZH culture mediums (n=3) |
如表 3所示,在属水平上,用于本次试验接种的结肠食糜微生物组主要包括拟杆菌属、普氏菌属和乳杆菌属等,不同培养基所得发酵液的微生物组主要包括拟杆菌属、梭状芽孢杆菌、普氏菌属和氨基酸球菌属等。VLMOL、VLM和ZH培养基均对拟杆菌属有较强的富集作用,其发酵液中拟杆菌属丰度分别为45.39%、42.99%和32.66%,远高于结肠食糜的5.95%,而VLMOL培养基是唯一对拟杆菌属没有富集作用的培养基,其发酵液中拟杆菌属丰度(0.71%)低于结肠食糜(5.95%),但该培养基对氨基酸球菌属和布劳特氏菌属有富集作用,其发酵液中氨基酸球菌属(9.39% vs.<0.01%)和布劳特氏菌属丰度(7.63% vs. 0.21%)均高于结肠食糜。VLMOL和VLCSL培养基对普氏菌属有较好的富集作用,其发酵液中普氏菌属丰度分别为25.35%和26.64%,但仍低于结肠食糜(61.99%)。VLMOL、VLCSL和VLM培养基所得发酵液中颤杆菌克属的丰度与结肠食糜接近。
|
|
表 3 VLMOL、VLCSL、VLM和ZH培养基所得发酵液与结肠食糜中主要细菌在属水平上的丰度分布 Table 3 Abundance distribution of main bacteria in colonic digesta and fermentation broths produced by VLMOL, VLCSL, VLM and ZH culture mediums at genus level (n=3) |
|
|
表 5 VLMOL、VLCSL、VLM和ZH培养基所得发酵液与结肠食糜中微生物组菌群alpha多样性指数 Table 5 Alpha diversity indices of microbiota in colonic digesta and fermentation broths produced by VLMOL, VLCSL, VLM and ZH culture mediums (n=3) |
|
|
表 6 模拟微生物组与结肠微生物组菌群结构的相似度 Table 6 Microbiota structural similarity between simulated microbiome and colonic microbiome (n=3) |
如表 4所示,在短链脂肪酸总量上,VLMOL培养基所得发酵液与结肠食糜(21.75 mmol/L vs. 26.03 mmol/L)相近(P>0.05),VLCSL、VLM和ZH培养基所得发酵液与结肠食糜相比有较大幅度上升(43.95、39.05和42.68 mmol/L vs. 26.03 mmol/L)(P < 0.05),4种培养基所得发酵液和结肠食糜中的短链脂肪酸均以乙酸、丙酸和丁酸为主。与结肠食糜相比,4种培养基体外发酵大大提高了丁酸的浓度(7.84、9.32、3.36和9.20 mmol/L vs. 1.48 mmol/L),乙酸浓度总体比较稳定(8.17、20.33、21.00和20.83 mmol/L vs.17.00 mmol/L),丙酸浓度波动较大(2.16、8.38、5.95和8.65 mmol/L vs. 5.95 mmol/L);除甲酸外,4种培养基体外发酵所产生的非主要短链脂肪酸(异丁酸、戊酸和异戊酸)的浓度均显著高于结肠食糜(P < 0.05)。
2.4 不同培养基所得发酵液与结肠食糜中微生物组菌群alpha多样性指数与相似度的比较如表 5所示,VLMOL培养基所得发酵液中微生物组菌群Shannon指数与结肠食糜最为接近(4.8 vs. 5.7),VLCSL、VLM和ZH培养基所得发酵液中微生物组菌群Shannon指数与结肠食糜相比较低(3.8、4.5、3.8 vs. 5.7)。同样,VLMOL培养基所得发酵液中微生物组菌群Chao1指数与结肠食糜最为接近(165.0 vs. 227.7),VLCSL、VLM和ZH培养基所得发酵液中微生物组菌群Chao1指数与结肠食糜相比较低(136.6、159.7、150.6 vs. 227.7)。
如表 6所示,利用Pearson距离远近相关系数计算得到VLMOL、VLCSL、VLM与ZH培养基所得模拟微生物组与结肠微生物组菌群结构相似度分别为68.5%、52.3%、10.7%和5.0%。
3 讨论体外连续培养系统是体外培养微生物组的有力工具。单相连续发酵系统具有较高的稳定性,不同培养批次间微生物菌群结构的相似度可保持在90%以上[11],并且已经在部分食物原料和抗生素等药物对人体肠道微生物组的影响研究方面进行了应用,并取得了相应进展。也有研究人员通过对连续发酵培养的微生物组进行菌群移植,研究了不同肠道微生物与受体鸡的相互作用[8]。
与其他3种培养基相比,添加糖蜜的VLMOL培养基可以大幅度提高体外模拟培养的效果,其中的重要原因是糖蜜营养组分相对比较复杂,可满足多种微生物的生长需要。体内试验同样证实了这一发现,如李长青等[12]研究发现,放牧饲养肉羊的瘤胃微生物主要以拟杆菌门与厚壁菌门为主,但在采食含有丰富糖蜜的舔砖一段时间后,肉羊瘤胃微生物的多样性显著升高,普氏菌属大量增殖,这与本研究结果相一致。体外发酵过程中,结肠食糜微生物组中的部分微生物没有在培养基中有效地增殖,可能的原因包括:第一,体内外生理环境的巨大差异,使得部分菌属在体外无法培养;体外培养即便满足特定菌群生长的营养成分,但可能缺乏促特定菌群生长的必需营养素。第二,结肠食糜在处理接种过程中部分厌氧菌可能因为处理时间太长而失去活性,无法进行体外增殖[11]。
玉米浆作为一种常用的培养基成分,广泛的应用于细菌培养[13]。与结肠食糜微生物组相比,添加玉米浆的VLCSL培养基所得发酵液中拟杆菌属与普雷沃氏菌属明显富集。玉米浆在微生物培养与发酵工艺中更多的是作为氮源应用,本试验中玉米浆作为碳源存在使得培养基的营养状态略有失衡;同时,玉米浆虽然是植物源性物质,但其前身物质玉米被猪采食后,只有少部分物质例如难以消化的纤维等进入到后段肠道中被发酵代谢[14]。因此,玉米采食后进入到后肠的营养物质与玉米浆存在巨大的差异,从而使得体外培养的微生物组与结肠食糜微生物组产生了较大的差异。
黏蛋白是动物肠道分泌的重要内源性物质,可被后肠微生物降解利用,对于机体肠道健康具有重要的意义。Carlstedt-Duke等[15]在正常大鼠的盲肠浆膜中分离出一种可以分解利用肠壁黏液层的菌株,此菌株转染无菌大鼠后,受体大鼠的肠壁黏液层的黏蛋白被分解。向含有此菌株的菌素培养基中加入分离纯化后的黏蛋白,黏蛋白可被大量水解。肠道黏膜层与肠道黏膜微生物之间的互作是一个动态平衡的过程,黏膜微生物不断地降解利用肠道黏膜中的黏液及黏蛋白,同时黏液层也不断地补充更新[16]。因此,黏蛋白可被用做结肠微生物组的培养基组分。本试验中,添加黏蛋白培养基所得模拟微生物组与结肠微生物组相似度较低,仅有10.7%;拟杆菌属是添加黏蛋白和玉米浆的培养基共同丰度最高的菌属。添加黏蛋白的培养基对于结肠食糜微生物中丰度很高的普氏菌属的富集作用很弱,但是对于结肠食糜微生物中丰度较少的梭状芽胞杆菌的富集作用明显优于其他3种培养基。此外,单胃动物后段肠道中只有很少的蛋白质,且相当一部分是非蛋白氮,蛋白质的含量和组成变动幅度较大[17],可能造成后段肠道中蛋白质发酵相关微生物的数量较少,而使得添加黏蛋白的培养基结肠微生物培养效果较差。
ZH培养基的培养效果不仅没有如预期那样优于VLMOL和VLCSL培养基,反而比这2种培养基的培养效果还要差,表明不同底物的组合与配比对结肠微生物组的体外模拟效果具有极其重要的影响,其程度甚至可能高于培养基中某种底物添加带来的影响。
体外模拟结肠发酵的过程中,只能够模拟微生物分解利用营养物质,但是却无法模拟动物肠道对于营养物质的吸收利用过程,使得产生的代谢物质不断积累。因此,在本试验中VLCSL、VLM和ZH培养基发酵产生的短链脂肪酸总量高于结肠食糜是符合预期的。丁酸是后段肠道发酵产生的主要短链脂肪酸之一,可以直接作为肠道上皮细胞的能量来源被机体充分的吸收利用[18],而体外发酵过程中丁酸不能被吸收利用,因此4种培养基发酵液中的丁酸浓度均远高于结肠食糜。底物化学结构的复杂程度与发酵的速度呈负相关[19],糖蜜成分与结构相对比较复杂、发酵速度较慢,发酵液中短链脂肪酸的总量偏低,甚至低于结肠食糜。
4 结论干物质基础下生长猪结肠食糜中粗蛋白质与可溶性糖含量均低于常用于微生物培养的VL培养基,原始状态下生长猪结肠食糜的粗蛋白质、可溶性糖含量与总能水平均高于VL培养基。调整VL培养基的营养组成并添加糖蜜,经过体外连续发酵可以培养出与生长猪结肠菌群结构相似度较好的微生物组,所得模拟微生物组与生长猪结肠微生物组的相似度达到68.5%,且产短链脂肪酸的发酵性能基本保持一致。调整VL培养基的营养组成并添加玉米浆或黏蛋白不能够提升生长猪结肠微生物组体外培养效果,糖蜜、玉米浆与黏蛋白组合添加时微生物组体外培养效果最差。
| [1] |
BÄCKHED F, LEY R E, SONNENBURG J L, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307(5717): 1915-1920. DOI:10.1126/science.1104816 |
| [2] |
QIN J J, LI R Q, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65. DOI:10.1038/nature08821 |
| [3] |
BAKKEN J S, BORODY T, BRANDT L J, et al. Treating Clostridium difficile infection with fecal microbiota transplantation[J]. Clinical Gastroenterology and Hepatology, 2011, 9(12): 1044-1049. DOI:10.1016/j.cgh.2011.08.014 |
| [4] |
GOUGH E, SHAIKH H, MANGES A R. Systematic review of intestinal microbiota transplantation (fecal bacteriotherapy) for recurrent Clostridium difficile infection[J]. Clinical Infectious Diseases, 2011, 53(10): 994-1002. DOI:10.1093/cid/cir632 |
| [5] |
陈波, 王宇, 雷芳, 等. 肠道微生物体外模型研究进展[J]. 中国微生态学杂志, 2012, 24(8): 766-768. |
| [6] |
YIN Y S, LEI F, ZHU L Y, et al. Exposure of different bacterial inocula to newborn chicken affects gut microbiota development and ileum gene expression[J]. The ISME Journal, 2010, 4(3): 367-376. DOI:10.1038/ismej.2009.128 |
| [7] |
SHEHATA A A, WIELAND S, ALDIN A A, et al. The effect of glyphosate on potential pathogens and beneficial members of poultry microbiota in vitro[J]. Current Microbiology, 2013, 66(4): 350-358. DOI:10.1007/s00284-012-0277-2 |
| [8] |
LEI F, YIN Y S, WANG Y Z, et al. Higher-level production of volatile fatty acids in vitro by chicken gut microbiotas than by human gut microbiotas as determined by functional analyses[J]. Applied and Environmental Microbiology, 2012, 78(16): 5763-5772. DOI:10.1128/AEM.00327-12 |
| [9] |
丁雪梅, 张晓君, 赵云, 等. 蒽酮比色法测定可溶性糖含量的试验方法改进[J]. 黑龙江畜牧兽医, 2016(12): 230-233. |
| [10] |
ZHAO J B, LIU P, WU Y, et al. Dietary fiber increases butyrate-producing bacteria and improves the growth performance of weaned piglets[J]. Journal of Agricultural and Food Chemistry, 2018, 66(30): 7995-8004. DOI:10.1021/acs.jafc.8b02545 |
| [11] |
范彬, 尹业师, 孙刚, 等. 不同碳水化合物对正常人肠道菌群体外模拟效果的比较[J]. 中华内科杂志, 2016, 55(5): 381-385. DOI:10.3760/cma.j.issn.0578-1426.2016.05.010 |
| [12] |
李长青, 金海, 薛树媛. 采用PCR-DGGE技术对放牧羊补饲糖蜜尿素舔砖后细菌种群结构的分析[J]. 黑龙江畜牧兽医, 2015(10): 112-115. |
| [13] |
COSTA A F S, ALMEIDA F C G, VINHAS G M, et al. Production of bacterial cellulose by Gluconacetobacter hansenii using corn steep liquor as nutrient sources[J]. Frontiers in Microbiology, 2017, 8: 2027. DOI:10.3389/fmicb.2017.02027 |
| [14] |
KNUDSEN K E B, JENSEN B B, HANSEN I. Digestion of polysaccharides and other major components in the small and large intestine of pigs fed on diets consisting of oat fractions rich in β-D-glucan[J]. British Journal of Nutrition, 1993, 70(2): 537-556. DOI:10.1079/BJN19930147 |
| [15] |
CARLSTEDT-DUKE B, MIDTVEDT T, NORD C E, et al. Isolation and characterization of a mucin-degrading strain of Peptostreptococcus from rat intestinal tract[J]. Acta Pathologica, Microbiologica, et immunologica Scandinavica-Section B:Microbiology, 1986, 94(1/2/3/4/5/6): 293-300. |
| [16] |
ROKHSEFAT S, LIN A F, COMELLI E M. Mucin-microbiota interaction during postnatal maturation of the intestinal ecosystem:clinical implications[J]. Digestive Diseases and Sciences, 2016, 61(6): 1473-1486. DOI:10.1007/s10620-016-4032-6 |
| [17] |
SIMON O. Protein digestion and absorption measured by re-entrant cannula in the pig[J]. Nutrition Reviews, 1979, 37(5): 149-150. |
| [18] |
KACZMAREK S A, BARRI A, HEJDYSZ M, et al. Effect of different doses of coated butyric acid on growth performance and energy utilization in broilers[J]. Poultry Science, 2016, 95(4): 851-859. DOI:10.3382/ps/pev382 |
| [19] |
BOSCH G, WRIGGLESWORTH D J, CONE J W, et al. Effects of preservation conditions of canine feces on in vitro gas production kinetics and fermentation end products[J]. Journal of Animal Science, 2013, 91(1): 259-267. DOI:10.2527/jas.2012-5262 |




