雌马酚(equol,Eq)是大豆异黄酮最终代谢产物之一,在动物机体内由大豆异黄酮经特定的肠道细菌分解产生,但并非所有动物机体都可产生雌马酚[1]。雌马酚在机体内的稳定性优于前体物质大豆苷元,这也是雌马酚的生物活性高于其他异黄酮类物质的原因。由于在呋喃环上缺少双键,雌马酚分为2种类型,即S型雌马酚(S-Eq)和R型雌马酚(R-Eq),其中天然形成的雌马酚都为S型雌马酚,而人工合成的雌马酚则为2种构型雌马酚的混合物[2]。S型雌马酚与雌激素受体的结合力优于R型雌马酚及其他的异黄酮类代谢产物,约是大豆苷元的4倍[3],具有弱雌激素效应,可有效地预防更年期和乳腺癌等疾病[4]。雌马酚也可通过与双氢睾酮结合来抑制雄激素效应,降低机体内雄激素水平[5]。雌马酚还具有与细胞功能相关的其他性质,作为一种多酚,它与其他异黄酮类物质一样都具有提供氢电子和清除自由基的能力。与其他异黄酮类物质相比,雌马酚可以更好地抑制Fe2+、Fe3+引起的脂质过氧化应激,降低心血管疾病发生的风险[6]。目前有关雌马酚的研究主要集中在其前体物质,而将雌马酚直接作为添加剂补喂的报道鲜见报道。反刍动物的消化系统较为复杂,将雌马酚作为一种添加剂给反刍动物补喂后如何代谢并会产生怎样的生物学效应是未知的。因此,本试验以母绵羊为研究对象,通过补喂不同水平的雌马酚来观测其对绵羊生长性能、血浆中雌马酚含量与生殖激素水平以及抗氧化能力的影响,为今后雌马酚在反刍动物生产中的应用提供参考依据。
1 材料与方法 1.1 试验时间与试验地点试验时间:2018年6月17日至2018年6月30日;试验地点:新疆昌吉大西渠镇惠康羊场。
1.2 试验动物的选择与分组试验选取年龄为2岁、平均体重为(36.73±2.42) kg的健康、体况相近的哈萨克母羊20只,随机分为4组,分别为对照组、试验Ⅰ组、试验Ⅱ组、试验Ⅲ组,每组5只羊。各组试验羊在相同的饲养条件下饲养,在此基础上,试验Ⅰ组、试验Ⅱ组、试验Ⅲ组在每日08:00饲喂时,每只分别补喂10、25、50 mg雌马酚,进行为期14 d的饲养试验。雌马酚以片剂形式补喂,雌马酚片制备方法如下:试验Ⅰ组,将2%的雌马酚(购自Sigma公司,纯度为99.99%)与85%麦芽糊精、4%聚乙二醇6000、4%硬脂酸镁、2%明胶、2%食用色素充分混匀后,加入1%水,压制成0.50 g的片剂,每片雌马酚含量为10 mg;试验Ⅱ组,将5%的雌马酚与82%麦芽糊精、4%聚乙二醇6000、4%硬脂酸镁、2%明胶、2%食用色素充分混匀后,加入1%水,压制成0.50 g的片剂,每片雌马酚含量为25 mg;试验Ⅲ组,将10%的雌马酚与77%麦芽糊精、4%聚乙二醇6000、4%硬脂酸镁、2%明胶、2%食用色素充分混匀后,加入1%水,压制成0.50 g的片剂,每片雌马酚含量为50 mg。补喂方法:将试验羊保定后,从羊嘴角将药片塞入,轻轻用手控制母羊嘴部,确保其咀嚼并吞咽药片后将其放开。
1.3 饲养管理所有试验羊饲喂同一全价颗粒型基础饲粮(购自新疆日发新西域牧业有限公司),在试验期间每日08:00投喂2.5 kg,自由采食及饮水,次日08:00收集剩料,称重记录。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
在试验期间每日08:00收集剩料,称重记录并计算平均日采食量。试验开始前1天与试验第14天的20:00断料断水,次日的08:00称试验羊体重,记录并计算平均日增重。在试验第14天静脉采集血液,以08:00为开始(0 h),采集时间点为补喂后0、0.5、1.0、2.0、3.0、4.0、6.0、8.0、10.0、12.0 h。将采集的血液置于肝素钠管内,3 500 r/min离心15 min,将制备好的血浆分装至1.5 mL离心管中,立即放入-20 ℃冰箱中冷冻保存。在采集血样的过程中保证每次采集不超过10 min。
0 h的血浆样品除用于测定血浆中雌马酚含量外,还用于测定血浆生殖激素水平和抗氧化指标。
1.5 指标测定 1.5.1 血浆中雌马酚含量的测定使用高效液相色谱仪紫外检测法(LC-20AB高效液相色谱仪,岛津国际贸易有限公司)测定血浆中雌马酚含量。
1) 色谱条件。色谱柱:Ulimate AQ-C18, (4.6 mm×250 mm,5 μm;Welch Materials公司);检测波长:250 nm;柱温:30 ℃;流速:0.8 mL/min;洗脱方式:一元洗脱;进样量:20 μL。
2) 流动相配制。分别量取乙腈、甲醇、水,按30 : 20 : 50(体积比)的比例混合,用0.45 μm滤膜抽滤,使用超声波脱气30 min (1 L)。
3) 血浆处理。吸取500 μL血浆至10 mL离心管中,加入3 mL 0.1 mol/L pH=5.0的乙酸钠缓冲液,混匀后加入80 μL β-葡萄糖醛酶/硫酸酶,漩涡混匀1 min,在37 ℃水浴中酶解14 h。取出已酶解好的样品,冲水冷却,加入正已烷:乙酸乙酯为1 : 1(体积比)的萃取液5 mL,漩涡混匀1 min,4 ℃、4 000 r/min离心20 min,吸取离心后的萃取液至5 mL离心管中。将离心管放至氮吹仪上,氮气吹干,加入200 μL甲醇溶解,漩涡混匀1 min,0.45 μm微孔过滤,4 ℃保存待测。
1.5.2 血浆中生殖激素水平的测定将血浆样品送至北京华英生物技术研究所使用酶联免疫吸附测定法(华卫德朗DR-200S酶标分析仪,无锡华卫德朗仪器有限公司)测定生殖激素水平。
1.5.3 血浆中抗氧化指标的测定将血浆样品送至北京华英生物技术研究所使用比色法(A6半自动生化仪,北京松上技术有限公司)测定抗氧化指标。
1.6 数据处理与分析试验数据采用Excel 2003进行初步整理,使用SPSS 22.0软件中的单因素方差分析(one-way ANOVA)进行差异显著性检验,并使用Duncan氏法进行组间多重比较,差异显著性水平为P < 0.05,极显著水平为P < 0.01。
2 结果与分析 2.1 补喂不同水平雌马酚对母绵羊生长性能的影响由表 2可知,试验Ⅲ组绵羊的平均日采食量显著高于试验Ⅰ组(P < 0.05),同时,试验Ⅱ组、试验Ⅲ组的平均日采食量较对照组分别提高了6.48%和10.07%(P>0.05);试验Ⅲ组的平均日增重极显著高于对照组(P < 0.01),试验Ⅰ组、试验Ⅱ组的平均日增重较对照组分别提高了35.64%和52.25%(P>0.05);试验Ⅲ组的料重比显著低于对照组(P < 0.05),试验Ⅰ组、试验Ⅱ组的料重比较对照组分别降低了32.41%、30.00%(P>0.05)。根据上述结果可知,在本试验条件下,每日每只母绵羊补喂50 mg雌马酚时显著提高了生长性能。
|
|
表 2 补喂不同水平雌马酚对母绵羊生长性能的影响(干物质基础) Table 2 Effects of supplemented with different levels of equol on growth performance of female sheep (DM basis) |
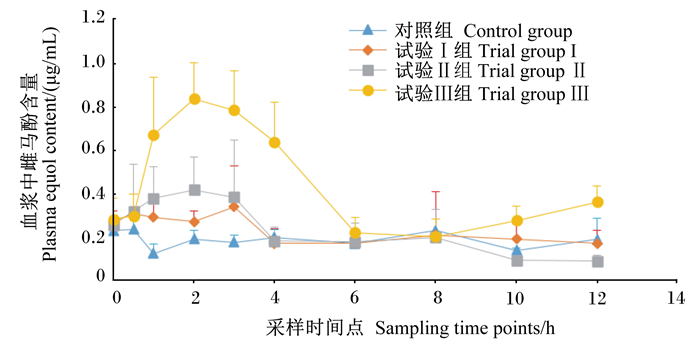
由表 3可知,在1.0~4.0 h、10.0~12.0 h即09:00—12:00与16:00—20:00这2个时间段内,试验Ⅲ组血浆中雌马酚含量均高于其他3个组,其中,试验Ⅲ组与对照组相比,在此时间段内差异均达到极显著水平(P < 0.01);试验Ⅲ组与试验Ⅰ组相比,在1.0~4.0 h、12.0 h时差异均达到极显著水平(P < 0.01),在10.0 h时差异达到显著水平(P < 0.05);试验Ⅲ组与试验Ⅱ组相比,在2.0~4.0 h及10.0~12.0 h时差异均达到极显著水平(P < 0.01),在1.0 h时差异达到显著水平(P < 0.05)。此外,在1.0 h时,试验Ⅱ组血浆中雌马酚含量极显著高于对照组(P < 0.01);在2.0 h时,试验Ⅰ组血浆中雌马酚含量显著高于对照组(P < 0.05);在10.0 h时,试验Ⅱ组血浆中雌马酚含量极显著低于试验Ⅰ组(P < 0.01)。血浆中雌马酚含量的动态变化以图 1来表示。在08:00补喂后,血浆中雌马酚含量呈先上升后下降趋势,在2.0~3.0 h时达到峰值,随后试验Ⅰ组、试验Ⅱ组在6.0~8.0 h再次升高,试验Ⅲ组在8.0~12.0 h再次升高。
|
|
表 3 补喂不同水平雌马酚对母绵羊血浆中雌马酚含量的影响 Table 3 Effects of supplemented with different levels of equol on plasma equol content of female sheep |
|
图 1 血浆中雌马酚含量的动态变化 Fig. 1 Dynamic change of plasma equol content |
由表 4可知,试验Ⅰ组血浆中雌酮(E1)水平极显著高于试验Ⅱ组(P < 0.01);试验Ⅰ组血浆中雌二醇(E2)水平显著高于试验Ⅱ组、试验Ⅲ组(P < 0.05);试验Ⅰ组血浆中睾酮(T)水平极显著高于对照组(P < 0.01),显著高于试验Ⅲ组(P < 0.05);试验Ⅱ组血浆中T水平显著高于对照组(P < 0.05);试验Ⅰ组、试验Ⅱ组血浆中双氢睾酮(DHT)水平显著高于对照组与试验Ⅲ组(P < 0.05)。
|
|
表 4 补喂不同水平的雌马酚对绵羊血浆中生殖激素水平的影响 Table 4 Effects of supplemented with different levels of equol on plasma reproductive hormone levels of female sheep |
由表 5可知,试验Ⅱ组血浆总抗氧化能力(T-AOC)极显著高于对照组、试验Ⅰ组(P < 0.01),且试验Ⅲ组的血浆T-AOC显著高于试验Ⅰ组(P < 0.05);试验Ⅱ组血浆过氧化氢酶(CAT)活性显著高于对照组、试验Ⅰ组(P < 0.05);试验Ⅱ组、Ⅲ组血浆超氧化物歧化酶(SOD)活性显著高于对照组、试验Ⅰ组(P < 0.05);试验Ⅱ组、试验Ⅲ组的血浆谷胱甘肽过氧化物酶(GSH-Px)活性显著高于对照组(P < 0.05),极显著高于试验Ⅰ组(P < 0.01);试验Ⅱ组、试验Ⅲ组血浆丙二醛(MDA)含量极显著低于试验Ⅰ组(P < 0.01)。血浆T-AOC与CAT、SOD、GSH-Px活性均以试验Ⅱ组最高,MDA含量以试验Ⅱ组最低。
|
|
表 5 补喂不同水平雌马酚对母绵羊血浆中抗氧化指标的影响 Table 5 Effects of supplemented with different levels of equol on plasma antioxidant indices of female sheep |
雌马酚作为一类具有雌激素作用的植物类异黄酮雌激素,与雌激素受体相结合并表现出雌激素作用,它能与下丘脑、垂体等受体不同程度地结合,从而影响动物内分泌系统的性轴与生长轴,进而影响机体的生长性能[7]。林厦菁等[8]的试验证实,给文昌鸡补喂15 mg/kg大豆异黄酮可以显著提高采食量。周玲玲等[9]研究得出,8%高活性大豆异黄酮发酵豆粕替代普通豆粕能够提高断奶仔猪平均日采食量和平均日增重。在本试验条件下,每只母绵羊每日补喂50 mg雌马酚可以显著提高生长性能,与上述补喂雌马酚前体物质的试验结果一致。但每只母绵羊每日补喂10 mg雌马酚使平均日采食量下降,这可能与该补饲剂量的雌马酚可以增加母绵羊血浆中的雌激素水平有关。前人研究显示,雌激素对动物的采食量有抑制的作用,Jöehle等[10]和Forbes[11]通过不同的试验证实雌激素降低了动物的采食量,这可能是导致每只每日补喂10 mg雌马酚的母绵羊平均日采食量下降的原因。
3.2 补喂不同水平雌马酚对母绵羊血浆中雌马酚含量的影响雌马酚是大豆异黄酮的代谢终产物之一,在肠道细胞内,大部分的雌马酚会通过葡萄糖磷酸化反应转变成葡萄糖苷和硫酸盐的化合物形式[12],使之结构更加稳定,且不会发生进一步代谢。通过志愿者摄入雌马酚的试验表明,人工合成雌马酚组与S型雌马酚组和R型雌马酚组相比较,被吸收入血液的速度较慢,血液中雌马酚含量相对较低,但半衰期无变化[13]。通过体外肠道细胞试验发现,细胞以被动扩散的方式吸收雌马酚,在S型雌马酚和R型雌马酚之间存在着竞争性抑制的关系[14]。此外,在研究“产雌马酚者”和“不产雌马酚者”对雌马酚代谢影响的试验中发现,二者对于雌马酚的代谢无显著差别,同时,机体对于雌马酚的吸收有明显的剂量依存关系[15]。Walsh等[16]使用肠道细胞Caco-2转运雌马酚的试验结果表明,1 h内20%游离形态的雌马酚被吸收进入细胞内,大部分的雌马酚进入细胞后转化成葡萄糖苷形式的雌马酚和硫酸盐形式的雌马酚,然后溢出细胞。在体内,游离的雌马酚会被运送到周围组织,被进一步吸收、代谢,最终通过尿液或胆汁排出体外。
本试验结果显示,补喂不同剂量的雌马酚导致血浆中雌马酚含量在2.0~3.0 h时达到顶峰,这是由于雌马酚在小肠中被快速吸收所致,但又因动物机体间的吸收差异,使组间达到顶峰时间点不一致,相关体内[17]和体外[16]雌马酚代谢试验结果与本试验结果一致。由于肠肝循环或大肠额外吸收导致试验Ⅰ组和试验Ⅱ组血浆中雌马酚含量在6.0~8.0 h、试验Ⅲ组在10.0~12.0 h时出现的第2峰,与其他异黄酮类物质代谢试验结果[18]一致;同时,试验Ⅲ组血浆中雌马酚含量比另外3组高,与补喂雌马酚的剂量有一定的关系。
3.3 补喂不同水平雌马酚对母绵羊血浆中生殖激素水平的影响生殖激素水平影响到绵羊的生殖周期,雌马酚作为一种植物雌激素,可与雌激素受体竞争性结合[19],也可与DHT直接结合[20],从而影响性激素在体内的水平,进而影响到绵羊整体的生殖激素水平。哺乳动物的雌激素主要在卵泡中合成。雌激素在排卵前由卵泡内膜分泌,而排卵后则由黄体细胞产生。雄激素是类固醇激素,包括T和DHT[21]。E2是卵泡激素中最重要的激素,它的激素样最强,E3活性最低。E2的活性是E3的600倍,是E1的6倍,后两者可以看作是E2的代谢产物,3种激素可以在体内相互转化。雄激素和雌激素都是由胆固醇衍生而成的(中间经过孕酮),可以相互转变,T经5α-转化酶反应后生产DHT[22]。在本试验中,试验Ⅰ组在0 h(即补喂雌马酚后24 h)时血浆中3种雌激素水平高于其余3组,反映了长时间补喂适当剂量的雌马酚可以有效地提高机体雌激素水平,增强雌激素调节机制,这与吴彬等[23]用雌马酚在去卵巢大鼠上及李琮等[24]用雌马酚前体物质在奶牛上的试验结果相似。吴彬等[23]给去卵巢大鼠补喂高、低剂量(0.50、0.25 kg/d)的雌马酚8周后证实,雌马酚可以显著提高去卵巢大鼠血清中雌激素水平。李琮等[24]补喂每日给每头奶牛补喂2.5 g的大豆苷元使奶牛血浆及乳中E2水平均显著增加。雌马酚与雌激素受体结合的特性,让其能够调控机体内源性激素水平,使雌激素及雄激素水平升高或降低[25]。
3.4 补喂不同水平雌马酚对母绵羊抗氧化能力的影响在夏季时,绵羊因热应激引起机体消耗大量的能量和氧气,产生了过量的自由基[26]。当机体内自由基产生过多或抗氧化机制出现紊乱时,自由基开始攻击机体,发生氧化应激,破坏细胞膜的完整性[27],进而影响动物健康水平与生产性能。所以,提高动物机体清除体内自由基的能力和抗氧化酶活性显得尤为重要。雌马酚是有效的自由基清除剂,在体内和体外均具有高抗氧化能力[28]。本实验室在前期试验中,通过在奶牛饲粮中补喂雌马酚前体物质证明雌马酚前体物质可以提高奶牛血浆中抗氧化酶的活性并降低脂质过氧化有害物的含量[29]。在体外测定的异黄酮类植物雌激素抑制血清脂质过氧化试验中,雌马酚具有最强的抗氧化能力[30]。雌马酚不仅可降低因Fe2+、Fe3+催化的脂质过氧化速度[6],还可有效改善Cu2+催化的脂质过氧化[31]。在小鼠上的试验发现,短期补喂雌马酚可以显著提高血清中SOD和CAT活性[32],有利于细胞免疫功能、抗氧化功能的发挥[20]。补喂不同剂量的雌马酚均可以降低因脂多糖(LPS)刺激鸡巨噬细胞而产生的MDA的含量[33]。同时,100 nmol/L雌马酚可以缓解双氧水引起的MDA含量的升高,并显著提高了SOD的活性[34]。本试验结果显示每日给每只母绵羊补喂25 mg雌马酚后血浆T-AOC及CAT、SOD、GSH-Px活性均高于对照组及其他雌马酚补喂剂量组,同时血浆MDA含量低于这些组,与上述试验结果一致。上述结果说明,每日给每只母绵羊补喂25 mg雌马酚可以显著提高绵羊机体的抗氧化能力,效果优于每日给每只母绵羊补喂10、50 mg雌马酚。抗氧化是一个复杂而多变的过程,需要通过多种调控共同作用来完成抗氧化过程。综合本试验结果和前人试验结果可知,雌马酚可通过不同的调节机制提高机体内清除自由基的能力,抑制氧化应激产生的有害物质,并且可能存在剂量依存关系。
4 结论由此得出,在本试验条件下,每日给每只母绵羊补喂50 mg雌马酚可以显著提高绵羊的生长性能;补喂雌马酚后2.0~3.0 h,母绵羊血浆中雌马酚含量达到峰值,并且随着补喂剂量的提高,血浆中高含量雌马酚的跨峰时间(即维持血浆高含量雌马酚的持续时间)也延长。每日给每只母绵羊补喂10和25 mg雌马酚可显著提高血浆中T和DHT水平。每日给每只母绵羊补喂25 mg雌马酚可提高显著机体抗氧化能力,效果优于补喂10、50 mg时。
| [1] |
郑庆虎, 周辉, 陈祯祥, 等. 雌马酚的生物学作用及其在医学领域的研究进展[J]. 中国皮肤性病学杂志, 2018(1): 105-109. |
| [2] |
SETCHELL K D R, BROWN N M, LYDEKING-OLSEN E. The clinical importance of the metabolite equol-a clue to the effectiveness of soy and its isoflavones[J]. The Journal of Nutrition, 2002, 132(12): 3577-3584. DOI:10.1093/jn/132.12.3577 |
| [3] |
SHUTT D A, COX R I. Steroid and phyto-oestrogen binding to sheep uterine receptors in vitro[J]. Journal of Endocrinology, 1972, 52(2): 299-310. DOI:10.1677/joe.0.0520299 |
| [4] |
SETCHELL K D R, CLERICI C, LEPHART E D, et al. S-equol, a potent ligand for estrogen receptor β, is the exclusive enantiomeric form of the soy isoflavone metabolite produced by human intestinal bacterial flora[J]. The American Journal of Clinical Nutrition, 2005, 81(5): 1072-1079. DOI:10.1093/ajcn/81.5.1072 |
| [5] |
LEGETTE L L, MARTIN B R, SHAHNAZARI M, et al. Supplemental dietary racemic equol has modest benefits to bone but has mild uterotropic activity in ovariectomized rats[J]. The Journal of Nutrition, 2009, 139(10): 1908-1913. DOI:10.3945/jn.109.108225 |
| [6] |
ARORA A, NAIR M G, STRASBURG G M. Antioxidant activities of isoflavones and their biological metabolites in a liposomal system[J]. Archives of Biochemistry and Biophysics, 1998, 356(2): 133-141. DOI:10.1006/abbi.1998.0783 |
| [7] |
马得莹, 单安山, 杜娟. 大豆黄酮对动物生产性能、免疫功能与抗氧化作用的影响[J]. 东北农业大学学报, 2004, 35(4): 505-508. DOI:10.3969/j.issn.1005-9369.2004.04.027 |
| [8] |
林厦菁, 蒋守群, 林哲敏, 等. 大豆异黄酮和抗生素对文昌鸡生长性能、肉品质和血浆抗氧化指标的影响[J]. 华南农业大学学报, 2018, 39(1): 1-6. |
| [9] |
周玲玲, 徐建雄. 高活性大豆异黄酮发酵豆粕对断奶仔猪生长性能、抗氧化能力、肝功能指标的影响[J]. 饲料工业, 2017, 38(20): 34-38. |
| [10] |
JÖEHLE W, LAMOND D R. Control of reproductive functions in domestic animals[M]. London: Martinus Niihoff, 1980: 28N49.
|
| [11] |
FORBES J M.The effects of sex hormones, pregnancy and lactation on digestion, metabolism and voluntary food intake[M]//MILLIGAN L P, GROVUM W L, DOBSON A.Control of digestion and metabolism in ruminants.New Jersey: Prentice-Hall, 1986.
|
| [12] |
李海亮, 邓颖, 王欣, 等. 肠道微生物代谢产物——S-雌马酚与人类健康关系研究进展[J]. 中国微生态学杂志, 2018, 30(3): 362-367. |
| [13] |
SETCHELL K D R, ZHAO X H, JHA P, et al. The pharmacokinetic behavior of the soy isoflavone metabolite S-(-)equol and its diastereoisomer R-(+)equol in healthy adults determined by using stable-isotope-labeled tracers[J]. The American Journal of Clinical Nutrition, 2009, 90(4): 1029-1037. DOI:10.3945/ajcn.2009.27981 |
| [14] |
王洋, 张玉梅. 雌马酚人体代谢的研究进展[J]. 卫生研究, 2010, 39(6): 787-789. |
| [15] |
CHOI E J. Evaluation of equol function on anti-or prooxidant status in vivo[J]. Journal of Food Science, 2009, 74(4): 64-71. |
| [16] |
WALSH K R, FAILLA M L. Transport and metabolism of equol by Caco-2 human intestinal cells[J]. Journal of Agricultural and Food Chemistry, 2009, 57(18): 8297-8302. DOI:10.1021/jf9011906 |
| [17] |
SETCHELL K D R, ZHAO X H, SHOAF S E, et al. The pharmacokinetics of S-(-)equol administered as SE5-OH tablets to healthy postmenopausal women[J]. The Journal of Nutrition, 2009, 139(11): 2037-2043. DOI:10.3945/jn.109.110874 |
| [18] |
SFAKIANOS J, COWARD L, KIRK M, et al. Intestinal uptake and biliary excretion of the isoflavone genistein in rats[J]. The Journal of Nutrition, 1997, 127(7): 1260-1268. DOI:10.1093/jn/127.7.1260 |
| [19] |
MORITO K, HIROSE T, KINJO J, et al. Interaction of phytoestrogens with estrogen receptors α and β[J]. Biological and Pharmaceutical Bulletin, 2001, 24(4): 351-356. DOI:10.1248/bpb.24.351 |
| [20] |
LUND T D, MUNSON D J, HALDY M E, et al. Equol is a novel anti-androgen that inhibits prostate growth and hormone feedback[J]. Biology of Reproduction, 2004, 70(4): 1188-1195. DOI:10.1095/biolreprod.103.023713 |
| [21] |
张晓娜, 杨镒峰, 常彤, 等. 雌激素、雄激素在卵泡发育中的作用及应用[J]. 特产研究, 2017, 39(3): 50-54. |
| [22] |
王镜岩. 生物化学(上册)[M]. 3版. 北京: 高等教育出版社, 2002: 556-583.
|
| [23] |
吴彬, 张勇, 陈明亮, 等. 雌马酚对去卵巢后大鼠骨质疏松症的影响[J]. 第三军医大学学报, 2015, 37(3): 256-260. |
| [24] |
李琮, 陈俊宏, 刘亚伟, 等. 大豆黄酮、芒柄花素及其组合对奶牛产奶性能、血浆和乳中激素含量的影响[J]. 动物营养学报, 2017, 29(1): 309-316. DOI:10.3969/j.issn.1006-267x.2017.01.035 |
| [25] |
ADLERCREUTZ H, FOTSIS T, BANNWART C, et al. Determination of urinary lignans and phytoestrogen metabolites, potential antiestrogens and anticarcinogens, in urine of women on various habitual diets[J]. Journal of Steroid Biochemistry, 1986, 25(5): 791-797. DOI:10.1016/0022-4731(86)90310-9 |
| [26] |
BELL A W. Regulation of organic nutrient metabolism during transition from late pregnancy to early lactation[J]. Journal of Animal Science, 1995, 73(9): 2804-2819. DOI:10.2527/1995.7392804x |
| [27] |
DIBNER J J, KITCHELL M L, ATWELL C A, et al. The effect of dietary ingredients and age on the microscopic structure of the gastrointestinal tract in poultry[J]. The Journal of Applied Poultry Research, 1996(5): 70-77. |
| [28] |
KŁADNA A, BERCZYŃSKI P, KRUK I, et al. Studies on the antioxidant properties of some phytoestrogens[J]. Luminescence, 2016, 31(6): 1201-1206. DOI:10.1002/bio.3091 |
| [29] |
李琮, 臧长江, 刘亚伟, 等. 添喂两种植物雌激素对奶牛乳成分、血液生化指标和抗氧化性能的影响[J]. 中国畜牧兽医, 2017(6): 126-130. |
| [30] |
HODGSON J M, CROFT K D, PUDDEY I B, et al. Soybean isoflavonoids and their metabolic products inhibit in vitro lipoprotein oxidation in serum[J]. The Journal of Nutritional Biochemistry, 1996, 7(12): 664-669. DOI:10.1016/S0955-2863(96)00133-7 |
| [31] |
MITCHELL J H, GARDNER P T, MCPHAIL D B, et al. Antioxidant efficacy of phytoestrogens in chemical and biological model systems[J]. Archives of Biochemistry and Biophysics, 1998, 360(1): 142-148. DOI:10.1006/abbi.1998.0951 |
| [32] |
CHOI E J. evaluation of equol function on anti-or prooxidant status in vivo[J]. Journal of Food Science, 2009, 74(2): H65-H71. DOI:10.1111/j.1750-3841.2008.01039.x |
| [33] |
苟钟勇, 蒋守群, 郑春田, 等.雌马酚对鸡巨噬细胞抗氧化保护和免疫调控作用的研究[C]//全国动物生理生化第七届全国代表大会暨第十三次学术交流会论文集.沈阳: 中国畜牧兽医学会, 2014: 193.
|
| [34] |
林厦菁, 蒋守群.雌马酚对鸡小肠上皮细胞氧化应激模型的影响[C]//全国动物生理生化第七届全国代表大会暨第十三次学术交流会论文集.沈阳: 中国畜牧兽医学会, 2014: 184-185.
|




