肠道菌群是存在肠道内微环境中与机体互利共生的微生物。正常的肠道菌群能协助机体吸收营养、调节代谢、维护胃肠道内环境相对稳定[1],肠道微生态的平衡亦是脾脏发挥生理作用的重要因素[2]。然而,当机体患脾气虚证时则会导致肠道内菌群失调。近年研究已证实肠道菌群与脾气虚证的发生发展紧密相关[3-4],脾气虚时机体胃肠功能异常,脏器间平衡遭到破坏,进而导致肠道微生态平衡被打破,而肠道菌群的失调又影响机体对营养物质的吸收,降低机体的免疫力,加重脾气虚症状[5]。基于肠道菌群对脾气虚证的重要作用,临床上常采用益生菌等微生态制剂治疗脾气虚证。益生菌制剂可促进机体对营养物质的消化吸收、增强免疫功能,具有替代抗生素的临床治疗潜质[6]。临床研究发现,复合益生菌具有生物拮抗作用,可有效修复并优化肠道防御屏障,提高营养物质利用率[7]。相关研究证实,益生菌亦可以提高人类健康肠道中菌群的多样性[8]。罗云坚等[9]认为脾气虚证与腹泻型肠易激综合征(IBS-D)患者之间存在相似性,两者有共同的基因表达谱改变。Hod等[10]用复合益生菌治疗IBS-D患者8周后,可改善其肠道有益菌群定植。
基于同源益生菌适用性更优原则[11-13],本试验从犬粪便中获得芽孢杆菌和乳杆菌,经检测后制成犬源复合益生菌,探讨其对脾气虚犬盲肠菌群多样性的影响及调节作用,为犬源益生菌的临床应用提供试验依据。
1 材料与方法 1.1 试验材料 1.1.1 犬源复合益生菌犬源复合益生菌的制备:采集健康比格犬新鲜粪便,通过分离筛选培养后进行16S rRNA鉴定,得到鲁氏芽孢杆菌PP9、蜡样芽孢杆菌VP11、鼠李糖乳杆菌SWP05及嗜酸乳杆菌DMBCT6菌株,通过耐酸耐胆盐、生化试验及药敏试验[14-15]等检验合格后制备犬源复合益生菌,其中芽孢杆菌活菌数为6×107 CFU/g,乳杆菌活菌数为1×108 CFU/g。
1.1.2 番泻叶番泻叶水煎液的制备:参照文献[16],准确称取5 kg干燥番泻叶(购自合肥立方大药房),筛选去除杂质,清洗后装入纱布袋连同清洗上清液投入TD-100小型浓缩机组提取罐中,加10 L蒸馏水,65 ℃提取1 h,重复以上步骤3次,合并滤液,65 ℃浓缩成5 L的水煎液,冷却后4 ℃保存。
1.2 试验动物分组与脾气虚模型建立试验用比格犬由安徽农业大学动物医院提供。选取24只1岁左右的比格犬,体重(10.75±0.25) kg,适应性饲养观察7 d,完成常规免疫与驱虫,确定为健康犬后方用于试验。
将24只比格犬随机分为4组,分别为对照组、脾气虚组、自然恢复组和益生菌治疗组每组6只。饲养试验在安徽农业大学动物医院动物房进行,每组的6只犬安排在相邻2个犬舍,犬舍面积12 m2左右,共占用8个犬舍。消毒、卫生防疫和日常管理按照正规宠物医院标准方法进行。
试验开始后,对照组犬饲喂基础饲粮(基础饲粮组成及营养水平见表 1);脾气虚组、自然恢复组和益生菌治疗组犬在饲喂基础饲粮的同时每天按照10 mL/kg BW的剂量灌喂番泻叶水煎液,持续灌喂7 d,制造脾气虚模型。在灌喂番泻叶水煎液7 d后,造模犬均表现出大便溏泄、食少纳呆、消瘦、体重减轻、神态萎靡和毛色无光泽等症状,可判定试验犬出现中医脾气虚证候,造模成功。在试验第7天,随机选择4只脾气虚组试验犬安乐死后进行剖检。造模结束后,对照组、自然恢复组继续饲喂基础饲粮7 d,益生菌治疗组在饲喂基础饲粮的基础上每天按照1×109 CFU/只的剂量灌服犬源复合益生菌7 d。试验期间观察各组犬的体征变化。分别于试验第0(分组后,给药前)、7和14天称量犬的体重,同时使用含乙二胺四乙酸二钠(EDTA-Na2)抗凝剂的采血管从犬前腔静脉采血1 mL用于部分血常规指标检测。在试验第14天后,从对照组、自然恢复组和益生菌治疗组各随机取4只试验犬安乐死后进行剖检。
|
|
表 1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as-fed basis) |
试验犬处死后,迅速取出盲肠内容物于2 mL灭菌冻存管中,放入液氮速冻,随后于-80 ℃冰箱中保存,用于高通量测序。
从每个冻存管样品中分别称取0.2 g盲肠内容物,使用Power Soil DNA Isolation Kit提取细菌总DNA,用DNA纯化试剂盒纯化,再用Nanodrop检测纯化后的DNA浓度和总量。PCR预扩增方法筛选合格样本,设计引物对(正向引物:5′-ACTCCTACGGGAGGCAGCA-3′;反向引物:5′-GGACTACHVGGGTWTCTAAT-3′)与衔接子序列和条形码序列组合扩增细菌16S rRNA基因的V3~V4区域。PCR的反应体系:扩增在50 μL的总体积中进行,包含10 μL Buffer,0.2 μL Q5 High-Fidelity DNA Polymerase,10 μL High GC Enhancer,1 μL dNTP,各1 μL引物和60 ng总DNA,ddH2O补足50 μL。反应条件:95 ℃下初始变性300 s,随后95 ℃ 60 s,50 ℃复性60 s,72 ℃ 60 s,最终72 ℃延伸,进行15个循环,持续7 min。通过QubitTM dsDNA HS试剂定量所有PCR产物并且合并在一起。使用Illumina HiSeq 2500平台(2×250对末端)对纯化的合并样本进行细菌rRNA基因的高通量测序分析。总DNA提取、PCR扩增和测序由北京范德生物有限公司协助完成。
1.4 数据分析HiSeq测序得到的原始图像数据档经CASAVA碱基识别分析转化为Raw Reads,去除两端Barcode和Primer序列,使用FLASH软件将Read1和Read2的overlap拼接为Raw Tags,使用Qiime进行质控,截断含5个以上连续N或低质量碱基的序列,进一步过滤连续高质量碱基长度小于序列长度75%的Tags,从而获得Clean Tags,采用UCHIME算法检定并去除Clean Tags中的嵌合体,获得Effective Tags,质控合格的Effective Tags用于后续生物信息分析。
数据处理与分析采用SPSS 21.0统计软件的单因素方差分析(one-way ANOVA)和最小显著差数(LSD)法进行,试验数据表示为平均值±标准差(mean±SD),分别以P < 0.05和P < 0.01作为差异显著和极显著的判断标准。
2 结果与分析 2.1 犬源复合益生菌对脾气虚犬体征、体重和部分血常规指标的影响饲养试验期间,对照组试验犬食欲正常,体重基本不变,精神状态良好,毛色有光泽。与对照组相比,脾气虚组试验犬在第1天出现食欲下降、喜卧不动、眼神黯淡等特征,第7天出现平均体温略降低、粪便溏泄、精神倦怠和眯眼等明显的脾气虚症状,该组试验犬于第7天已经剖检,因此第14天无相关试验数据。益生菌治疗组试验犬经7 d的犬源复合益生菌治疗后,粪便正常且精神和食欲状态明显改善。自然恢复组试验犬食欲和精神状态有好转,但较益生菌治疗组恢复缓慢,部分试验犬仍有精神倦怠、腹泻等脾气虚症状,试验结束后也未完全恢复至对照组和益生菌治疗组试验犬状态。
由表 2可知,第0天,4个组试验犬的体重与血常规中白细胞数、红细胞数和血红蛋白含量差异均不显著(P>0.05)。第7天,脾气虚组、自然恢复组和益生菌治疗组试验犬的体重与血常规中白细胞数、红细胞数和血红蛋白含量均极显著低于对照组(P < 0.01)。第14天,益生菌治疗组与对照组试验犬的体重与血常规中白细胞数、红细胞数和血红蛋白含量相比无显著差异(P>0.05),自然恢复组上述指标仍显著低于对照组(P < 0.05)。
|
|
表 2 犬源复合益生菌对脾气虚犬体质量和部分血常规指标的影响 Table 2 Effects of canine-derived compound probiotics on body weight and partial blood routine indexes in splenic qi asthenia canines |
对照组、脾气虚组、自然恢复组和益生菌治疗组共采集盲肠内容物样本16个。
采用Illumina高通量测序获得样本原始序列数据后进行数据过滤、拼接、质控,平均每个样本得到65 096条高质量序列,平均长度为465 nt。本试验Q30大于93.83%,说明测序数据可信度高。为研究盲肠菌群组成及多样性信息,使用Usearch方法进行OTU聚类,将相似性达到97%的序列聚类成一个OTU,得到所有16个盲肠内容物样本的OTU数为982,由图 1可知,对照组、脾气虚组、自然恢复组和益生菌治疗组4组共有的OTU数为87,对照组独有的OTU数为36,脾气虚组独有的OTU数为7,自然恢复组独有的OTU数为16,益生菌治疗组独有的OTU数为38。对照组OTU总数为287,与脾气虚组共有的OTU数为148,说明健康犬患脾气虚证后,肠道细菌物种会随之发生改变。益生菌治疗组OTU总数为291,与对照组共有OTU数为188,说明复合益生菌制剂可提高脾气虚犬肠道细菌物种多样性,但与对照组犬肠道细菌物种略有差异,推测可能与复合益生菌制剂有优化肠道菌群分布的功能相关。
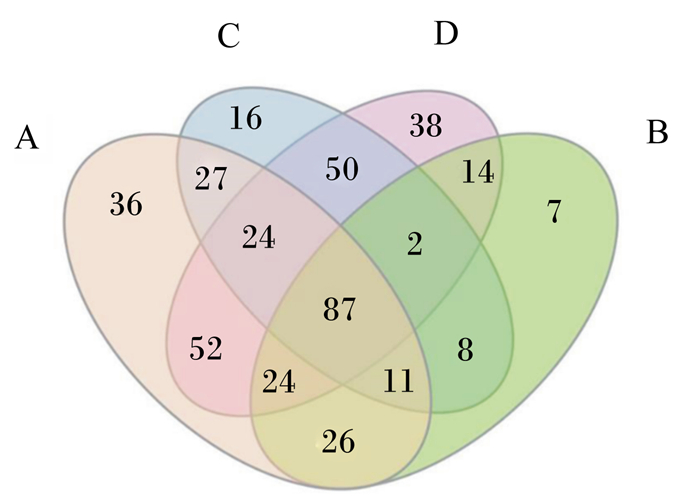
|
A:对照组;B:脾气虚组;C:自然恢复组;D:益生菌治疗组。下图同。 A: control group; B: splenic qi asthenia group; C: natural recovery group; D: probiotics treatment group. The same as below. 图 1 OTU韦恩图 Fig. 1 Venn diagram of OTU |
物种累积箱曲线可用来比较不同测序数据量样本中物种的丰富度,也可以用来说明该样本的测序数据量是否合理。图 2中,随着样本测序数据量的增加,曲线趋向于平坦,说明本试验样品测序数据量合理,可用于试验分析。
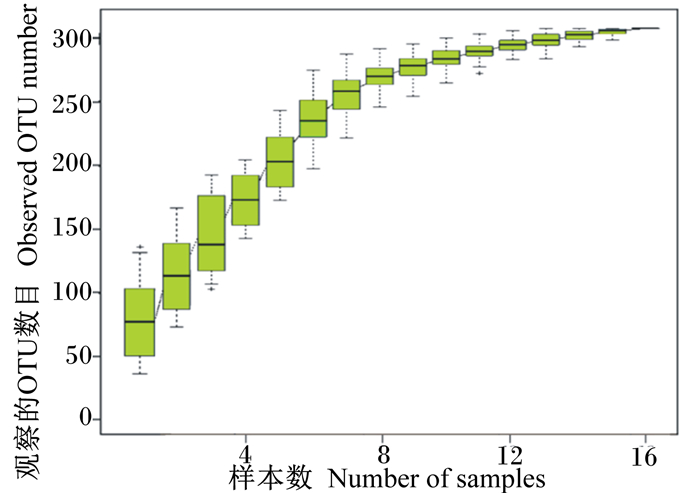
|
图 2 物种累积曲线 Fig. 2 Accumulation curves of species |
利用α多样性指数可对单个样本的物种多样性进行分析,包括ACE指数、Chao1指数、Shannon指数以及Simpson指数等,前面3个指数越大,最后1个指数越小,说明样本中物种越丰富。本试验中每个样本的覆盖度(Goods-coverage)都在0.996以上,表明样本的测序深度和广度都达到要求。对照组与益生菌治疗组的ACE指数、Chao1指数、Shannon指数均高于脾气虚组与自然恢复组,同时益生菌治疗组高于对照组,自然恢复组高于脾气虚组;对照组与益生菌治疗组的Simpson指数均低于脾气虚组与自然恢复组,且益生菌治疗组低于对照组,自然恢复组低于脾气虚组。这说明益生菌治疗组的盲肠菌群丰度及多样性最高,脾气虚组盲肠菌群丰度及多样性最低。
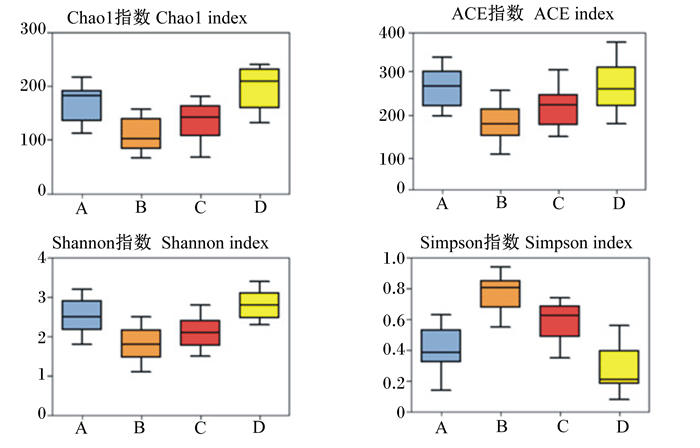
|
图 3 α多样性 Fig. 3 α diversity |
主坐标分析(PCoA)是一种研究数据相似性或差异性的可视化方法,图 4为基于Unweighted Unifrac距离的PCoA,横坐标表示一个主成分,纵坐标表示另一个主成分,主坐标1(PC1)为第1主成分,表示主成分对样品差异的贡献值为38.78%,主坐标2(PC2)为第2主成分,贡献值为16.36%。如图 4所示,4个组的16个样本较明显分开,组内样本聚集在一起,说明组内菌群组成相似,组间菌群组成存在明显差异,即同一组中的试验犬盲肠菌群组成相似,不同组间试验犬盲肠菌群组成存在较明显的组间差异。
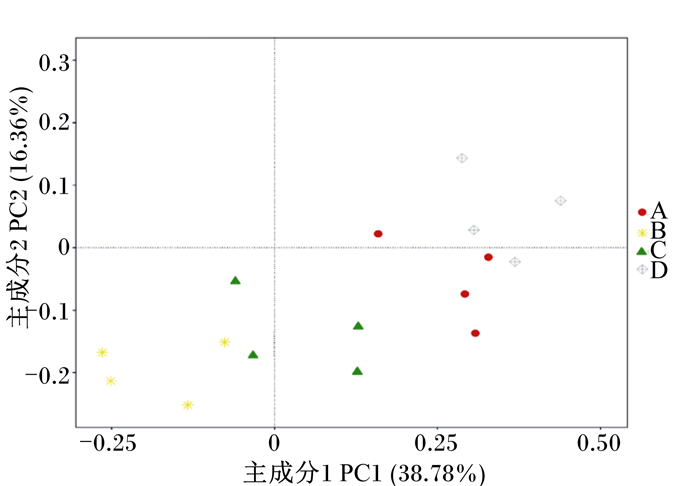
|
图中每个点表示1个样本,同一组的样本使用同一种颜色和形状表示。 Each point represents a sample in the figure, and the samples of the same group are represented by the same color and shape. 图 4 基于Unweighted Unifrac距离的主坐标分析 Fig. 4 PCoA based on Unweighted Unifrac distance |
根据OTU分类分析结果,在门水平上,犬盲肠菌群主要分布于9个菌门,占比较大的前4个菌门为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)以及变形菌门(Proteobacteria),其所占比例之和占盲肠菌群的92%以上。
由表 3可知,4组试验犬盲肠菌群中厚壁菌门的相对丰度无显著差异(P>0.05)。与对照组相比,脾气虚组和自然恢复组拟杆菌门的相对丰度显著降低(P < 0.05),梭杆菌门和变形菌门的相对丰度均显著升高(P < 0.05);益生菌治疗组拟杆菌门的相对丰度显著升高(P < 0.05),梭杆菌门和变形菌门的相对丰度无显著变化(P>0.05)。与脾气虚组相比,自然恢复组拟杆菌门的相对丰度显著升高(P < 0.05),梭杆菌门和变形菌门的相对丰度均无显著变化(P>0.05);益生菌治疗组拟杆菌门的相对丰度极显著升高(P < 0.01),梭杆菌门的相对丰度极显著降低(P < 0.01),变形菌门的相对丰度显著升高(P < 0.05)。与自然恢复组相比,益生菌治疗组拟杆菌门的相对丰度显著升高(P < 0.05),梭杆菌门和变形菌门的相对丰度均显著降低(P < 0.05)。
|
|
表 3 门水平上的优势菌群分布 Table 3 Distribution of dominant microflora at phylum level |
基于OTU分类分析结果,在纲水平上,犬盲肠菌群主要分布于10个菌纲,占比较大的前7个菌纲为拟杆菌纲(Bacteroidia)、梭杆菌纲(Fusobacteria)、芽孢杆菌纲(Bacilli)、梭菌纲(Clostridia)、β-变形菌纲(Betaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)和放线菌纲(Actinobacteria)。其中,芽孢杆菌纲和梭菌纲属于厚壁菌门,拟杆菌纲属于拟杆菌门,梭杆菌纲属于梭杆菌门,放线菌纲属于放线菌门,β-变形菌纲和γ-变形菌纲属于变形菌门。
由表 4可知,4组试验犬盲肠菌群中梭杆菌纲、梭菌纲、β-变形菌纲和放线菌纲的相对丰度均无显著差异(P>0.05)。与对照组相比,脾气虚组中拟杆菌纲的相对丰度显著降低(P < 0.05),芽孢杆菌纲的相对丰度极显著降低(P < 0.01),γ-变形菌纲的相对丰度极显著升高(P < 0.01);自然恢复组拟杆菌纲的相对丰度显著降低(P < 0.05),芽孢杆菌纲的相对丰度极显著降低(P < 0.01),γ-变形菌纲的相对丰度显著升高(P < 0.05);益生菌治疗组芽孢杆菌纲和拟杆菌纲的相对丰度显著升高(P < 0.05),γ-变形菌纲的相对丰度无显著变化(P>0.05)。与脾气虚组相比,自然恢复组拟杆菌纲的相对丰度显著升高(P < 0.05),芽孢杆菌纲的相对丰度无显著变化(P>0.05),γ-变形菌纲的相对丰度显著降低(P < 0.05);益生菌治疗组芽孢杆菌纲和拟杆菌纲的相对丰度极显著升高(P < 0.01),γ-变形菌纲的相对丰度极显著降低(P < 0.01)。与自然恢复组相比,益生菌治疗组拟杆菌纲的相对丰度极显著升高(P < 0.01),芽孢杆菌纲的相对丰度显著升高(P < 0.05),γ-变形菌纲的相对丰度极显著降低(P < 0.01)。
|
|
表 4 纲水平上的优势菌群分布 Table 4 Distribution of dominant microflora at class level |
根据OTU分类分析结果,在目水平上,犬盲肠菌群主要分布于15个菌目,占比较大的前9个菌目为拟杆菌目(Bacteroidales)、梭杆菌目(Fusobacteriales)、乳杆菌目(Lactobacillales)、芽孢杆菌目(Bacillales)、梭菌目(Clostridiales)、伯克霍尔德氏菌目(Burkholderiales)、肠杆菌目(Enterobacteriales)、丹毒丝菌目(Erysipelotrichales)和双歧杆菌目(Bifidobacteriales)。其中,乳杆菌目、芽孢杆菌目、梭菌目和丹毒丝菌目属于厚壁菌门,拟杆菌目属于拟杆菌门,梭杆菌目属于梭杆菌门,肠杆菌目和伯克霍尔德式菌目属于变形菌门,双歧杆菌目属于放线菌门。
由表 5得出,4组试验犬盲肠菌群中梭杆菌目、芽孢杆菌目、梭菌目、伯克霍尔德氏菌目、丹毒丝菌目、双歧杆菌目和肠杆菌目的相对丰度均无显著差异(P>0.05)。与对照组相比,脾气虚组乳杆菌目的相对丰度极显著降低(P < 0.01),拟杆菌目的相对丰度显著降低(P < 0.05),肠杆菌目的相对丰度显著升高(P < 0.05);自然恢复组乳杆菌目的相对丰度极显著降低(P < 0.01),拟杆菌目的相对丰度显著降低(P < 0.05),肠杆菌目的相对丰度显著升高(P < 0.05);益生菌治疗组乳杆菌目和肠杆菌目的相对丰度均无显著变化(P>0.05),拟杆菌目的比例显著升高(P < 0.05)。与脾气虚组相比,自然恢复组乳杆菌目和拟杆菌目的相对丰度均无显著变化(P>0.05),肠杆菌目的相对丰度极显著降低(P < 0.01);益生菌治疗组乳杆菌目的相对丰度极显著升高(P < 0.01),拟杆菌目的相对丰度显著升高(P < 0.05),肠杆菌目的相对丰度极显著降低(P < 0.01)。与自然恢复组相比,益生菌治疗组乳杆菌目和肠杆菌目的相对丰度均无显著变化(P>0.05),拟杆菌目的相对丰度显著升高(P < 0.05)。
|
|
表 5 目水平上的优势菌群分布 Table 5 Distribution of dominant microflora at order level |
根据OTU分类分析结果,在科水平上,犬盲肠菌群主要分布于19个菌科,占比较大的前10个菌科为产碱杆菌科(Alcaligenaceae)、拟杆菌科(Bacteroidaceae)、梭菌科(Clostridiaceeae)、梭杆菌科(Fusobacteriaceae)、乳杆菌科(Lactobacillaceae)、消化球菌科(Peptostreptococcaceae)、双歧杆菌科(Bifidobacteriaceae)、疣微菌科(Ruminococcaceae)、毛螺旋菌科(Lachnospiraceae)和螺旋体科(Spirochaetaceae)。其中,梭菌科、乳杆菌科、消化球菌科和毛螺旋菌科属于厚壁菌门,拟杆菌科属于拟杆菌门,梭杆菌科属于梭杆菌门,产碱杆菌科属于变形菌门,双歧杆菌科属于放线菌门,疣微菌科属于疣微菌门,螺旋体科属于螺旋体门。
由表 6可知,4组试验犬盲肠菌群中产碱杆菌科、梭菌科、梭杆菌科、乳杆菌科、消化球菌科、双歧杆菌科、疣微菌科和毛螺旋菌科的相对丰度均无显著差异(P>0.05)。与对照组相比,脾气虚组和自然恢复组拟杆菌科的相对丰度显著降低(P < 0.05),螺旋体科的相对丰度显著升高(P < 0.05);益生菌治疗组拟杆菌科的相对丰度显著升高(P < 0.05)、螺旋体科的相对丰度无显著变化(P>0.05)。与脾气虚组相比,自然恢复组拟杆菌科的相对丰度显著升高(P < 0.05),螺旋体科的相对丰度显著降低(P < 0.05);益生菌治疗组拟杆菌科的比例极显著升高(P < 0.01),螺旋体科的相对丰度显著降低(P < 0.05)。与自然恢复组相比,益生菌治疗组拟杆菌科的相对丰度显著升高(P < 0.05),螺旋体科的相对丰度显著降低(P < 0.05)。
|
|
表 6 科水平上的优势菌群分布 Table 6 Distribution of dominant microflora at family level |
根据OTU分类分析结果,在属水平上,犬盲肠菌群主要分布于23个菌属,占比较大的前11个菌属为乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、梭菌属(Clostridium)、丹毒丝菌属(Erysipelothrix)、拟杆菌属(Bacteroides)、梭杆菌属(Fusobacterium)、伯克霍尔德氏菌属(Burkholderia)、消化球菌属(Peptostreptococcus)、副萨特氏菌属(Parasutterella)、普氏菌属(Prevotella)和苏黎世杆菌属(Turicibacter)。其中,乳杆菌属、苏黎世杆菌属、芽孢杆菌属、梭菌属、丹毒丝菌属和消化球菌属属于厚壁菌门,拟杆菌属和普氏菌属属于拟杆菌门,梭杆菌属属于梭杆菌门,副萨特氏菌属和伯克霍尔德式菌属属于变形菌门。
由表 7可知,4组试验犬盲肠菌群中乳杆菌属、丹毒丝菌属、拟杆菌属、梭杆菌属、伯克霍尔德氏菌属、消化球菌属、副萨特氏菌属、普氏菌属和苏黎世杆菌属的相对丰度均无显著差异(P>0.05)。与对照组相比,脾气虚组芽孢杆菌属的相对丰度显著降低(P < 0.05),梭菌属的相对丰度显著升高(P < 0.05);自然恢复组芽孢杆菌属的相对丰度显著降低(P < 0.05),梭菌属的相对丰度显著升高(P < 0.05);益生菌治疗组芽孢杆菌属的相对丰度显著升高(P < 0.05),梭菌属的相对丰度无显著差异(P>0.05)。与脾气虚组相比,自然恢复组芽孢杆菌属和梭菌属的相对丰度均无显著变化(P>0.05);益生菌治疗组芽孢杆菌属的相对丰度极显著升高(P < 0.01),梭菌属的相对丰度极显著降低(P < 0.01)。与自然恢复组相比,益生菌治疗组芽孢杆菌属的相对丰度极显著升高(P < 0.01),梭菌属的相对丰度显著降低(P < 0.05)。
|
|
表 7 属水平上的优势菌群分布 Table 7 Distribution of dominant microflora at genus level |
肠道菌群紊乱与脾气虚证发展密切相关[3]。临床常用微生态制剂调节脾气虚动物的胃肠微生态环境[17]。16S rRNA高通量测序分析被广泛用于微生物多样性及定性分析,可综合反映群落生态中物种丰富度和均匀度[18]。脾气虚动物肠道菌群多样性呈现下降趋势。本试验结果中发现脾气虚组试验犬盲肠菌群的Chao1指数、ACE指数和Shannon指数均低于对照组,脾气虚犬经犬源复合益生菌治疗后,上述指数显著高于对照组,说明脾气虚犬盲肠菌群多样性低于对照组,经益生菌治疗后盲肠菌群多样性高于对照组。
肠道内的菌群形成了错综复杂的微生态系统,直肠和盲肠食糜中含菌量高达109~1010 CFU/g[19]。Suchodolski等[20]对6只健康犬盲肠内容物基因测序,与SILVA基因库比对(相似性98%)后发现,4大优势菌门为厚壁菌门、梭杆菌门、拟杆菌门和变形菌门,盲肠菌群中梭杆菌门和拟杆菌门各占1/3。Middelbos等[21]利用454高通量测序技术检测犬肠道菌群,结果显示优势菌门为厚壁菌门、梭杆菌门和拟杆菌门。本试验中,犬盲肠菌群中优势菌门为厚壁菌门、拟杆菌门、梭杆菌门和变形菌门,对照组、脾气虚组、自然恢复组和益生菌治疗组四大菌门之和分别占盲肠菌群的87.84%、94.53%、96.37%和94.93%,说明未被检测率较低。本研究发现不同分类等级中,益生菌治疗组拟杆菌门、纲、目、科以及芽孢杆菌纲、属的相对丰度均显著高于对照组和脾气虚组,且脾气虚组显著低于对照组。拟杆菌是肠道厌氧菌群中的优势菌,有学者发现拟杆菌能帮助宿主分解多糖、提高营养利用率、加快肠黏膜修复、促进免疫系统发育及维持肠道微生态平衡[22]。芽孢杆菌能够产生多种脂肽类抗菌物质,抑制病原菌生长和繁殖[23]。此外,对照组和益生菌治疗组乳杆菌目的相对丰度均显著高于脾气虚组。乳杆菌提供机体部分所需维生素、必需氨基酸和酶类,维持酸性环境,通过黏附抗性和竞争定植,进而抑制并清除肠道病原菌等有害物质[24]。
变形菌是常见的条件致病菌,可以引起患者消化道及泌尿道感染[25]。梭菌属中的丁酸梭菌可改善肠道菌群分布,提高免疫功能;艰难梭菌、产气荚膜梭菌和破伤风梭菌等的存在有损宿主健康[26]。宿主体内微生态失调时,梭杆菌可能造成肠道癌症[25]。螺旋体的致病机制尚不明确,钩端螺旋体的致病性可能与其产生的溶血素、细胞毒因子及内毒素样物质有关;梅毒螺旋体的致病性则与其表面夹膜样物质的黏附作用及自身分泌的黏多糖酶的作用有关[27]。本试验结果显示,脾气虚组梭杆菌门、γ-变形菌纲、肠杆菌目、螺旋体科和梭菌属的相对丰度均高于对照组,而益生菌治疗组则低于对照组,表明犬源复合益生菌不仅能帮助脾气虚犬盲肠菌群多样性恢复到对照组水平,并且可使盲肠中有益菌占比优于正常犬。从本试验中这些菌群组成比例的改变来看,脾气虚犬经犬源复合益生菌治疗后取得了良好效果,其盲肠菌群多样性优于正常犬。本试验使用番泻叶法成功造出犬脾气虚模型,对深入探讨犬源复合益生菌对脾气虚证患者肠道内源微生物群作用机制及临床应用有参考意义。
4 结论综上所述,犬源复合益生菌不仅能够使番泻叶诱导的脾气虚犬盲肠菌群多样性恢复至正常犬水平,而且还能提高盲肠菌群中有益菌拟杆菌、芽孢杆菌的占比,对脾气虚犬盲肠菌群结构有良好的调节作用。
| [1] |
KAJANDER K, HATAKKA K, POUSSA T, et al. A probiotic mixture alleviates symptoms in irritable bowel syndrome patients:a controlled 6-month intervention[J]. Alimentary Pharmacology and Therapeutics, 2005, 22(5): 387-394. DOI:10.1111/j.1365-2036.2005.02579.x |
| [2] |
冯文林, 伍海涛. 从肠道菌群探讨多种疾病从脾论治的机理[J]. 吉林中医药, 2018, 38(10): 14-17. |
| [3] |
ROOKS M G, GARRETT W S. Gut microbiota, metabolites and host immunity[J]. Nature Reviews Immunology, 2016, 16(6): 341-352. DOI:10.1038/nri.2016.42 |
| [4] |
PENG Y, WANG Z, LU Y, et al. Intestinal microflora molecular markers of spleen-deficient rats and evaluation of traditional Chinese drugs[J]. World Journal of Gastroenterology, 2009, 15(18): 2220-2227. DOI:10.3748/wjg.15.2220 |
| [5] |
彭颖, 李晓波. 脾虚证与肠道微生态[J]. 世界华人消化杂志, 2012, 20(34): 3287-3291. |
| [6] |
SANDERS M E, MERENSTEIN D, MERRIFIELD C A, et al. Probiotics for human use[J]. Nutrition Bulletin, 2018, 43(3): 212-225. DOI:10.1111/nbu.12334 |
| [7] |
DICKS L M T, GELDENHUYS J, MIKKELSEN L S, et al. Our gut microbiota:a long walk to homeostasis[J]. Beneficial Microbes, 2018, 9(1): 3-20. DOI:10.3920/BM2017.0066 |
| [8] |
SÁNCHEZ B, DELGADO S, BLANCO-MIGUEZ A, et al. Probiotics, gut microbiota, and their influence on host health and disease[J]. Molecular Nutrition & Food Research, 2017, 61(1). DOI:10.1002/mnfr.201600240 |
| [9] |
罗云坚, 修宗昌, 黄穗平, 等. 脾气虚证免疫相关基因组学机制初探[J]. 中国中西医结合杂志, 2005, 25(4): 311-314. DOI:10.3321/j.issn:1003-5370.2005.04.006 |
| [10] |
HOD K, DEKEL R, AVIV COHEN N, et al. The effect of a multispecies probiotic on microbiota composition in a clinical trial of patients with diarrhea-predominant irritable bowel syndrome[J]. Neurogastroenterology and Motility, 2018, 30(12): e13456. DOI:10.1111/nmo.13456 |
| [11] |
张云娟, 张垚, 孙绍美, 等. 昆明犬肠道中乳杆菌的分离鉴定及16S rRNA同源性分析[J]. 中国微生态学杂志, 2012, 24(8): 686-690. |
| [12] |
楚渠, 彭云武. 益生菌菌种特性及主要作用[J]. 陕西农业科学, 2004(1): 65-66. DOI:10.3969/j.issn.0488-5368.2004.01.031 |
| [13] |
刘昆.犬源益生芽孢杆菌的筛选及其对攻毒幼犬的保护作用[D].硕士学位论文.雅安: 四川农业大学, 2009.
|
| [14] |
华鹤良.乳酸菌的分离鉴定及其抗菌肽与发酵性能研究[D].博士学位论文.扬州: 扬州大学, 2014.
|
| [15] |
徐海燕, 曹斌, 辛国芹, 等. 一株芽孢杆菌的分离鉴定及其益生潜质分析[J]. 家畜生态学报, 2012, 33(3): 48-54. DOI:10.3969/j.issn.1673-1182.2012.03.010 |
| [16] |
肖新云, 邓艳玲, 刘又嘉, 等. 番泻叶所致脾虚泄泻小鼠血常规的研究[J]. 湖北中医药大学学报, 2016, 18(6): 49-51. DOI:10.3969/j.issn.1008-987x.2016.06.15 |
| [17] |
徐孝平, 徐剑钦, 黄俊杰, 等. WHBE兔与日本大耳白兔腹泻型肠易激综合征模型的肠道菌群研究[J]. 中国实验动物学报, 2018, 26(2): 165-173. DOI:10.3969/j.issn.1005-4847.2018.02.005 |
| [18] |
武春霞.健康犬与腹泻犬粪便菌群的比较研究[D].硕士学位论文.北京: 中国农业大学, 2007.
|
| [19] |
朱年华, 李麟. 犬肠道微生物菌群结构与肠道免疫的研究进展[J]. 犬业科技, 2017(1): 18-20. |
| [20] |
SUCHODOLSKI J S, CAMACHO J, STEINER J M. Analysis of bacterial diversity in the canine duodenum, jejunum, ileum, and colon by comparative 16S rRNA gene analysis[J]. FEMS Microbiology Ecology, 2008, 66(3): 567-578. |
| [21] |
MIDDELBOS I S, BOLER B M V, QU A, et al. Phylogenetic characterization of fecal microbial communities of dogs fed diets with or without supplemental dietary fiber using 454 pyrosequencing[J]. PLoS One, 2010, 5(3). DOI:10.1371/journal.pone.0009768 |
| [22] |
WEXLER A G, GOODMAN A L. An insider's perspective:Bacteroides as a window into the microbiome[J]. Nature Microbiology, 2017, 2(5): 17026. DOI:10.1038/nmicrobiol.2017.26 |
| [23] |
向亚萍, 陈志谊, 罗楚平, 等. 芽孢杆菌的抑菌活性与其产脂肽类抗生素的相关性[J]. 中国农业科学, 2015, 48(20): 4064-4076. DOI:10.3864/j.issn.0578-1752.2015.20.008 |
| [24] |
JANIK R, THOMASON L A M, STANISZ A M, et al. Magnetic resonance spectroscopy reveals oral Lactobacillus promotion of increases in brain GABA, N-acetyl aspartate and glutamate[J]. NeuroImage, 2016, 125: 988-995. DOI:10.1016/j.neuroimage.2015.11.018 |
| [25] |
LIU X F, CAO S Q, ZHANG X W. Modulation of gut microbiota-brain axis by probiotics, prebiotics, and diet[J]. Journal of Agricultural and Food Chemistry, 2015, 63(36): 7885-7895. DOI:10.1021/acs.jafc.5b02404 |
| [26] |
陈奕慧, 林红燕. Ⅰ、Ⅱ类整合子在变形菌属中的分布及耐药性研究[J]. 中华医院感染学杂志, 2014, 24(3): 526-528. |
| [27] |
CHEN L, LI S, ZHENG J, et al. Effects of dietary Clostridium butyricum supplementation on growth performance, intestinal development, and immune response of weaned piglets challenged with lipopolysaccharide[J]. Journal of Animal Science and Biotechnology, 2018, 9(1): 62. DOI:10.1186/s40104-018-0275-8 |




