2. 中国农业科学院北京畜牧兽医研究所, 动物营养学国家重点实验室, 北京 100193;
3. 北京中农弘科生物技术有限公司, 北京 100193
2. State Key Laboratory of Animal Nutrition, Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. Beijing China-Agri Hongke Bio-Technology Co., Ltd., Beijing 100193, China
随着养猪生产集约化程度的提高,仔猪早期断奶技术已被广泛接受和使用。但是,仔猪在断奶阶段会面临营养、免疫和心理等方面的应激,进而导致仔猪腹泻、生长缓慢和肠道功能受损[1]。前人研究发现,断奶应激不仅可导致肠道炎症的发生,也可导致自由基代谢和抗氧化系统的紊乱,使得仔猪遭受严重的氧化应激[2-3]。氧化应激是由活性氧产生能力与机体抗氧化系统清除活性氧能力不平衡而引起的。断奶仔猪肠道抗氧化系统发育不成熟,因而极易遭受氧化应激[4]。最近研究表明,断奶应激可导致空肠黏膜超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性和基因表达量下调,并增加丙二醛(MDA)含量[5]。肠道氧化还原平衡遭到破坏,也伴随着肠道通透性增加、紧密连接蛋白表达量下降和肠细胞线粒体功能的紊乱。
短链果寡糖(scFOS)是指通过生物酶解蔗糖获得的含1~5个果糖单元的低聚糖。scFOS摄入能促进婴儿或成人肠道中的双歧杆菌和乳酸杆菌的定植,被认为是最有效的益生元[6]。母猪摄入scFOS能促进后代仔猪肠道免疫系统的发育,且新生仔猪摄入scFOS后可改善肠道形态并增加盲肠中短链脂肪酸如乙酸和丁酸的含量[7-8]。此外,scFOS摄入可显著改变新生仔猪肠道微生物组成,增加产丁酸菌的比例,并在一定程度上缓解短肠综合征[8]。Schokker等[9]通过对哺乳仔猪灌胃短链果寡糖:多聚果糖(scFOS : lcFOS)为1 : 9的混合液发现,该混合液灌胃可显著改变肠道微生物组成,并上调空肠黏膜紧密连接蛋白的表达。但关于scFOS在断奶仔猪上的研究还较少,且不清楚scFOS摄入对断奶仔猪肠道功能的调控效果。基于以上研究,我们推测scFOS可缓解断奶应激造成的仔猪肠道屏障受损。因此,本试验旨在研究scFOS摄入对断奶仔猪肠道氧化还原状态和屏障功能的影响,为其在养猪生产中的应用提供参考依据。
1 材料与方法 1.1 试验动物与试验设计试验选用12头体重为(7.02±0.04) kg的24日龄“杜×长×大”断奶仔猪,随机分配到对照组(n=6)和scFOS组(n=6)。对照组仔猪饲喂基础饲粮,scFOS组仔猪饲喂基础饲粮且每天每头饲喂1.2 g scFOS。scFOS购自日本明治制果株式会社,纯度为97.9%(scFOS组成:7.25%蔗果三糖、41.78%蔗果四糖、44.33%蔗果五糖和6.64%蔗果六糖)。试验期间,所有仔猪自由饮水,试验14 d后进行屠宰取样。
1.2 试验饲粮与饲养管理基础饲粮为玉米-豆粕型,饲粮营养水平满足或超过NRC(2012)7~11 kg猪营养需要推荐值,其组成及营养水平见表 1。所有仔猪单笼饲养于代谢笼中。试验前对圈舍及代谢笼进行冲洗、干燥和全面消毒。试验全期温度控制在26~28 ℃,相对湿度控制在60%左右。每天饲喂4次,少喂勤添,喂料量以料槽内略有余料为准。scFOS组每天在08:00和17:00拌料饲喂,共2次,每次每头猪饲喂0.6 g scFOS(每次称取少量饲粮拌匀以保证scFOS全部摄入)。每天记录采食量,试验期间未对仔猪使用任何抗生素类药物。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
于试验第15天清晨,对所有仔猪进行称重。称重后,对所有仔猪进行前腔静脉采血,并将血液转入含肝素钠的真空采血管中缓慢混匀,3 500 r/min离心10 min制备血浆,吸取上清液于0.5 mL EP管中,置于-20 ℃保存待测。
1.3.2 空肠和结肠黏膜所有仔猪在采血后进行屠宰,打开腹腔并迅速分离肠段,取空肠中段和结肠中段各10 cm左右的肠段,生理盐水冲洗后置于冰上纵向切开,用载玻片轻轻刮取黏膜并置于冻存管中,经液氮速冻后,于-80 ℃冰箱保存待测。
1.4 测定指标与方法 1.4.1 生长性能根据仔猪初始体重和试验末重以及采食量,计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.4.2 血浆二胺氧化酶(DAO)活性和D-乳酸含量采用南京建成生物工程研究所的DAO活性检测试剂盒,结合紫外光分光光度计测定血浆中DAO活性。采用酶联免疫吸附法测定血浆D-乳酸含量,测定步骤参照试剂盒说明书,试剂盒购自北京诚林生物科技有限公司。
1.4.3 肠道氧化还原状态指标称取一定量的空肠和结肠黏膜(0.5 g左右),按质量体积比1 : 9(g : mL)加入生理盐水,进行超声粉碎匀浆,2 000 r/min离心10 min,取上清液,-20 ℃保存待测。上清液中的GSH和氧化型谷胱甘肽(GSSG)、MDA含量以及SOD和GSH-Px活性采用紫外光分光光度计测定,测定步骤按照试剂盒说明书进行,试剂盒购自南京建成生物工程研究所。上清液中的蛋白质含量采用南京建成生物工程研究所的考马斯亮蓝试剂盒进行检测。
1.4.4 肠道氧化还原相关基因和紧密连接蛋白mRNA表达空肠和结肠黏膜总RNA提取采用Bio-Rad Aurum Total RNA Fatty and Fibrous Tissue Kit (Bio-Rad Laboratories,Hercules,CA,美国)进行提取。RNA纯度和浓度使用NanoDrop ND-1000(Nanodrop Technologies,Thermo Scientific,Wilmington,DE,美国)测定。采用ImProm-Ⅱ cDNA Synthesis Kit (Promega,Madison,WI,美国)进行cDNA合成。实时荧光定量测定肠道氧化还原相关基因和紧密连接蛋白的表达。基因引物序列见表 2。
|
|
表 2 基因引物序列 Table 2 Primer sequence of genes |
荧光定量PCR反应体系为10 μL:2 μL cDNA,2 μL无RNA酶水,上、下游引物各0.5 μL(5 μmol/L)和5 μL 2 × KAPA SYBR FAST qPCR Kit Master Mix。反应条件为:预变性95 ℃ 3 min,变性、退火、延伸(95℃ 20 s,60 ℃ 40 s, 72 ℃ 20 s),40个循环,熔解曲线过程在70~90 ℃,每5 s上升0.5 ℃。以TATA盒结合蛋白(TBP)、拓扑异构酶Ⅱβ(TOP2B)和肌动蛋白(ACTB)作为内参基因,并用qBase软件中的geNorm计算内参基因的平均表达稳定值(M),确保内参基因选择的正确性,同时计算每个样本的校正参数(normalization factor),用来计算目的基因的mRNA表达量。
1.5 统计分析所有数据采用SAS 9.0软件进行正态性检验,符合正态分布的数据采用非配对t检验进行显著性分析,非正态分布的数据采用Wilcoxon秩和检验进行显著性分析。以P < 0.05视为差异显著,0.05≤P < 0.10视为有趋势。
2 结果 2.1 scFOS摄入对断奶仔猪生长性能和血浆DAO活性与D-乳酸含量的影响如表 3所示,饲喂scFOS可显著提高仔猪ADG并显著降低F/G(P < 0.05)。scFOS摄入对仔猪末重和ADFI没有产生显著影响(P>0.05)。如表 4所示,scFOS摄入可显著降低仔猪血浆DAO活性和D-乳酸含量(P < 0.05)。
|
|
表 3 scFOS摄入对断奶仔猪生长性能的影响 Table 3 Effects of scFOS consumption on growth performance of weaning piglets |
|
|
表 4 scFOS摄入对断奶仔猪血浆生化指标的影响 Table 4 Effects of scFOS consumption on plasma biochemical indices of weaning piglets |
如表 5所示,scFOS摄入可显著提高仔猪空肠黏膜中GSH含量和GSH-Px活性(P < 0.05), 并显著降低MDA含量(P < 0.05),但对空肠黏膜中的GSSG含量、GSH/GSSG和SOD活性没有显著影响(P>0.05)。此外,scFOS摄入对结肠氧化还原状态相关指标没有显著影响(P>0.05)。
|
|
表 5 scFOS摄入对断奶仔猪肠道氧化还原状态的影响 Table 5 Effects of scFOS consumption on intestinal redox status of weaning piglets |
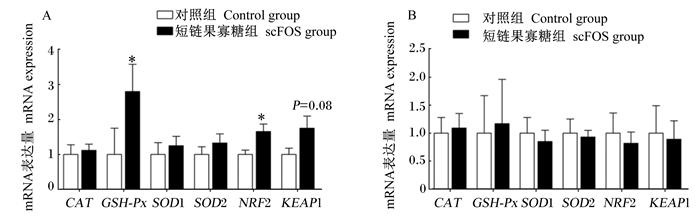
如图 1所示,scFOS摄入可显著上调空肠黏膜GSH-Px和核转录因子NF-E2相关因子2(NRF2)mRNA表达量(P < 0.05),有增加空肠黏膜Keleh样环氧氯丙烷相关蛋白1(KEAP1)mRNA表达量的趋势(P=0.08),但对空肠黏膜过氧化氢酶(CAT)、超氧化物歧化酶1(SOD1)和超氧化物歧化酶2(SOD2)mRNA表达量没有显著影响(P>0.05)。此外,scFOS摄入对结肠抗氧化基因表达均没有显著影响(P>0.05)。
|
*:组间差异显著(P < 0.05)。下图同。*:significant difference between groups (P < 0.05). The same as below. CAT:过氧化氢酶catalase;GSH-Px:谷胱甘肽过氧化物酶glutathion peroxidase;SOD1:超氧化物歧化酶1 superoxide dismutase 1;SOD2:超氧化物歧化酶2 superoxide dismutase 2;NRF2:核转录因子NF-E2相关因子2 nuclear transcription factor NF-E2 related factor 2;KEAP1:Keleh样环氧氯丙烷相关蛋白1 Keleh-like epichlorohydrin associated protein 1。 图 1 scFOS摄入对断奶仔猪空肠(A)和结肠(B)氧化还原相关基因mRNA表达的影响 Fig. 1 Effects of scFOS consumption on mRNA expression of redox-related genes in ileum (A) and colon (B) of weaning piglets |
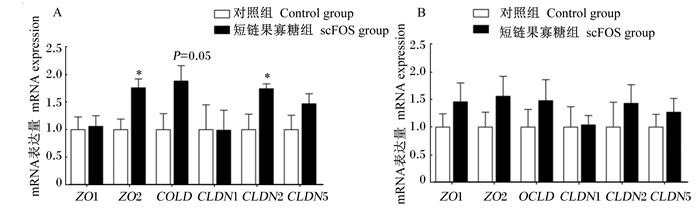
如图 2所示,scFOS摄入可显著上调空肠黏膜紧密连接蛋白2(ZO2)和封闭蛋白2(CLDN2)mRNA表达量(P < 0.05),有增加闭合蛋白(OCLD)mRNA表达量的趋势(P=0.05),但对其他紧密连接蛋白基因表达没有显著影响(P>0.05)。scFOS摄入对结肠所有紧密连接蛋白mRNA表达均没有显著影响(P>0.05)。
|
ZO1:紧密连接蛋白1 tight junction protein 1;ZO2:紧密连接蛋白2 tight junction protein 2;OCLD:闭合蛋白occludin;CLDN1:封闭蛋白1 claudin 1;CLDN2:封闭蛋白2 claudin 2;CLDN5:封闭蛋白5 claudin 5。 图 2 scFOS摄入对断奶仔猪空肠(A)和结肠(B)紧密连接蛋白mRNA表达的影响 Fig. 2 Effects of scFOS consumption on mRNA expression of tight junction proteins in ileum (A) and colon (B) of weaning piglets |
果寡糖作为益生元,是抗生素的替代品之一。前人研究表明,断奶仔猪摄入果寡糖后能显著提高饲料转化效率和空肠绒毛高度[10]。本研究与其结果相似,scFOS摄入后可显著提高断奶仔猪ADG并显著降低F/G。scFOS摄入后可促进仔猪免疫系统的发育和肠道有益菌群的定植,可能是其改善生长性能的内在机制[7-8]。但目前scFOS摄入对仔猪生长性能的影响也存在不一致的报道,Schokker等[9]发现scFOS摄入虽然增加了食糜中短链脂肪酸含量且促进了免疫系统的成熟,但对生长性能没有显著影响。出现上述差异的原因可能是由于本试验中scFOS供给方式与Schokker等[9]的研究不一致以及仔猪生长阶段不同所引起的。Schokker等[9]采用每2 d对哺乳仔猪进行scFOS灌胃,发现试验期间scFOS组仔猪腹泻严重,但本试验中并未观测到类似的现象。
DAO是肠黏膜上层绒毛细胞胞浆中具有高度活性的细胞内酶,在小肠黏膜上层绒毛中含量高且活性强,但在其他组织含量少且活性低。当肠黏膜细胞受损,DAO可释放入血,导致血浆中DAO活性增强。D-乳酸是肠道多种细菌的代谢产物,当肠黏膜受损或通透性增加时,血液中D-乳酸含量升高[11]。因此,血液中DAO活性和D-乳酸含量可反映肠黏膜受损程度和通透性变化。本研究发现,scFOS摄入显著降低了仔猪血浆DAO活性和D-乳酸含量,表明断奶后14 d仔猪肠黏膜完整性仍然受损,scFOS摄入可改善仔猪肠道屏障功能。与前人采用其他类型寡糖的研究结果[12-13]相似,壳寡糖或褐藻寡糖的摄入均可改善断奶仔猪肠道屏障功能。
3.2 scFOS摄入对断奶仔猪肠道氧化还原状态的影响断奶仔猪肠道发育不完全,易遭受氧化应激。前人研究表明,断奶应激可导致肠道产生大量自由基并降低肠道抗氧化能力[14]。Yin等[2]报道,断奶后3 d血浆中MDA含量可达到显著水平,蛋白质羰基含量在断奶后5 d达到最大值,DNA损伤则在1周内呈增加趋势,空肠抗氧化酶活性在断奶1周内显著下调,表明仔猪断奶后1周遭受严重氧化应激。与前人研究结果相似,对照组仔猪断奶2周后空肠MDA含量显著高于scFOS组。Wang等[15]研究发现,断奶应激显著降低了空肠中GSH含量和GSH/GSSG。GSH-Px在清除脂质过氧化物中起着重要的作用,GSH作为该酶促反应中的还原剂被转化为GSSG。本研究发现,scFOS摄入提高了断奶仔猪空肠GSH含量和GSH-Px活性,表明scFOS摄入在一定程度上增强了断奶仔猪抗氧化能力并缓解了氧化应激。
3.3 scFOS摄入对断奶仔猪肠道氧化还原相关基因和紧密连接蛋白mRNA表达的影响NRF2在机体抗氧化体系中扮演着重要角色,可调节二相解毒酶基因如谷胱甘肽合成和谷胱甘肽硫转移酶等的表达[2]。在本试验中,scFOS摄入显著上调了空肠NRF2 mRNA表达量,同时也增加了GSH-Px mRNA表达量,表明scFOS摄入提高了断奶仔猪空肠的抗氧化能力。本研究与前人研究结果相似,褐藻寡糖或壳寡糖的摄入可上调仔猪空肠NRF2 mRNA表达量,并促进GSH-Px、SOD1和SOD2 mRNA表达量[12-13]。Cao等[5]研究指出,断奶这一过程引起仔猪遭受氧化应激,进而导致肠道完整性受损。Wang等[16]也发现,仔猪肠道氧化还原状态的变化可引起肠道完整性或通透性的改变。本研究发现,scFOS摄入显著提高了仔猪空肠ZO2、OCLD和CLDN2 mRNA表达量。ZO是一种结合适应蛋白,与多种其他的紧密连接组分共同作用,参与维持肠道上皮完整,有利于机械屏障的维护[16]。以上结果表明,scFOS摄入缓解了仔猪空肠氧化应激,进而改善了肠道屏障功能。但是,scFOS对仔猪结肠抗氧化基因和紧密连接蛋白mRNA表达量没有显著影响,这可能与scFOS的发酵特性有关。有研究指出,scFOS在到达结肠前已几乎全部发酵,对小肠中的微生物菌群改变较大[9]。scFOS被微生物发酵产生大量的丁酸,而丁酸可通过改变上皮细胞类型分布和促进紧密连接蛋白表达来改善肠道黏膜屏障功能[17]。前人研究表明,scFOS摄入可显著促进断奶仔猪回肠和盲肠丁酸和异丁酸的产生,但对结肠短链脂肪酸的产生无显著影响[18]。丁酸能显著上调仔猪肠道紧密连接蛋白的表达进而增强肠道屏障功能[19]。因而本试验中scFOS对空肠和结肠抗氧化能力和屏障功能的影响出现差异可能与其发酵特性有关,但有待进一步证实。
4 结论scFOS摄入可提高仔猪在断奶后2周的ADG并降低F/G,这可能与肠道抗氧化能力的提高并肠道屏障功能的增强有关。
| [1] |
LALLÈS J P, BOSI P, SMIDT H, et al. Nutritional management of gut health in pigs around weaning[J]. Proceedings of the Nutrition Society, 2007, 66(2): 260-268. DOI:10.1017/S0029665107005484 |
| [2] |
YIN J, WU M M, XIAO H, et al. Development of an antioxidant system after early weaning in piglets[J]. Journal of Animal Science, 2014, 92(2): 612-619. DOI:10.2527/jas.2013-6986 |
| [3] |
BOMBA L, MINUTI A, MOISÁ S J, et al. Gut response induced by weaning in piglet features marked changes in immune and inflammatory response[J]. Functional & Integrative Genomics, 2014, 14(4): 657-671. |
| [4] |
XU J X, XU C C, CHEN X L, et al. Regulation of an antioxidant blend on intestinal redox status and major microbiota in early weaned piglets[J]. Nutrition, 2014, 30(5): 584-589. DOI:10.1016/j.nut.2013.10.018 |
| [5] |
CAO S T, WANG C C, WU H, et al. Weaning disrupts intestinal antioxidant status, impairs intestinal barrier and mitochondrial function, and triggers mitophagy in piglets[J]. Journal of Animal Science, 2018, 96(3): 1073-1083. DOI:10.1093/jas/skx062 |
| [6] |
BORNET F R J, BROUNS F, TASHIRO Y, et al. Nutritional aspects of short-chain fructooligosaccharides:natural occurrence, chemistry, physiology and health implications[J]. Digestive and Liver Disease, 2002, 34(Suppl2): S111-S120. |
| [7] |
LE BOURGOT C, FERRET-BERNARD S, LE NORMAND L, et al. Maternal short-chain fructo-oligosaccharide supplementation influences intestinal immune system maturation in piglets[J]. PLoS One, 2014, 9(9): e107508. DOI:10.1371/journal.pone.0107508 |
| [8] |
LOMAN B R, TAPPENDEN K A. Prebiotic short-chain fructooligosaccharides (scFOS) increases abundance of the butyrate producing microbial community differentially when administered with or without probiotic Lactobacillus rhamnosus GG (LGG) in piglets with short-bowel syndrome (SBS)[J]. The FASEB Journal, 2016, 30(suppl.1): 683. |
| [9] |
SCHOKKER D, FLEDDERUS J, JANSEN R, et al. Supplementation of fructooligosaccharides to suckling piglets affects intestinal microbiota colonization and immune development[J]. Journal of Animal Science, 2018, 96(6): 2139-2153. DOI:10.1093/jas/sky110 |
| [10] |
XU C L, CHEN X D, JI C, et al. Study of the application of fructooligosaccharides in piglets[J]. Asian-Australasian Journal of Animal Sciences, 2005, 18(7): 1011-1016. DOI:10.5713/ajas.2005.1011 |
| [11] |
MA X K, ZHANG S, PAN L, et al. Effects of lysozyme on the growth performance, nutrient digestibility, intestinal barrier, and microbiota of weaned pigs fed diets containing spray-dried whole egg or albumen powder[J]. Canadian Journal of Animal Science, 2017, 97(3): 466-475. |
| [12] |
WAN J, ZHANG J, CHEN D W, et al. Alginate oligosaccharide enhances intestinal integrity of weaned pigs through altering intestinal inflammatory responses and antioxidant status[J]. RSC Advances, 2018, 8(24): 13482-13492. DOI:10.1039/C8RA01943F |
| [13] |
YANG C M, FERKET P R, HONG Q H, et al. Effect of chito-oligosaccharide on growth performance, intestinal barrier function, intestinal morphology and cecal microflora in weaned pigs[J]. Journal of Animal Science, 2012, 90(8): 2671-2676. DOI:10.2527/jas.2011-4699 |
| [14] |
ZHU L H, ZHAO K L, CHEN X L, et al. Impact of weaning and an antioxidant blend on intestinal barrier function and antioxidant status in pigs[J]. Journal of Animal Science, 2012, 90(8): 2581-2589. DOI:10.2527/jas.2011-4444 |
| [15] |
WANG J J, CHEN L X, LI P, et al. Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation[J]. The Journal of Nutrition, 2008, 138(6): 1025-1032. DOI:10.1093/jn/138.6.1025 |
| [16] |
WANG W, DEGROOTE J, VAN GINNEKEN C, et al. Intrauterine growth restriction in neonatal piglets affects small intestinal mucosal permeability and mRNA expression of redox-sensitive genes[J]. The FASEB Journal, 2016, 30(2): 863-873. DOI:10.1096/fj.15-274779 |
| [17] |
ALENGHAT T, OSBORNE L C, SAENZ S A, et al. Histone deacetylase 3 coordinates commensal-bacteria-dependent intestinal homeostasis[J]. Nature, 2013, 504(7478): 153-157. DOI:10.1038/nature12687 |
| [18] |
SHIM S B, VERSTEGEN M W A, KIM I H, et al. Effects of feeding antibiotic-free creep feed supplemented with oligofructose, probiotics or synbiotics to suckling piglets increases the preweaning weight gain and composition of intestinal microbiota[J]. Archives of Animal Nutrition, 2005, 59(6): 419-427. DOI:10.1080/17450390500353234 |
| [19] |
DIAO H, JIAO A R, YU B, et al. Stimulation of intestinal growth with distal ileal infusion of short-chain fatty acid:a reevaluation in a pig model[J]. RSC Advances, 2017, 7(49): 30792-30806. DOI:10.1039/C7RA03730A |



