紫锥菊是原产美洲的一种菊科多年生植物,一直被应用于提高免疫力和创伤愈合,是目前受到国际普遍重视的一种免疫促进剂,它的提取物及其制剂销售额在美国医药市场排前5名[1]。紫锥菊提取物在兽药领域已被用做免疫增强剂。目前已有动物保健品公司推出了紫锥菊提取物(紫锥益毒清)为动物专用免疫增强抗病毒制剂,分为猪用及禽用2种。临床试验数据表明,紫锥益毒清可有效提高免疫力,修复受损的免疫系统,具有降低蓝耳病、圆环病毒病、传染性法氏囊炎及禽流感发病率等功效。目前,由于无抗化养殖的推进和紫锥菊显著的疗效,以紫锥菊提取物为饲料添加剂的开发趋势明显增强,在养殖业市场上具有广阔的应用前景。通常将紫锥菊的疗效归功于其中所含的酚酸类化合物[2-3],主要有菊苣酸、紫锥花苷、咖啡酸、对羟基苯甲酸、对香豆酸,原儿茶酸、丁香酸、阿魏酸、香草酸、咖啡奎尼酸、洋蓟酸等[4]。近年来,对菊苣酸的药理学研究显示其具有抗炎[5-6]、抗病毒[7]、抗氧化[8]、抗菌[9]、抗结肠癌[10]及缓解记忆减退[11]等功效。
随着对菊苣酸药理学的研究深入,研究者也在进行菊苣酸提取工艺的深入研究。目前对紫锥菊中菊苣酸的提取纯化多应用喷雾提取[12]、高速逆流色谱[13]及制备色谱[14],此技术所得化合物纯度高,但设备和操作的较为繁杂。近年来,分子印迹聚合物(molecular imprinted polymer,MIP)由于其特异性识别的性能引起国内外广泛学者的关注。MIP的制备过程分为3个步骤:首先是由特定印迹分子为模板与功能单体通过共价键或非共价键结合,再加入交联剂在MIP周围形成刚性聚合物,最后再将印迹分子洗脱下来。由此,在聚合物分子内留下了符合印迹分子结构的立体空穴,具有相关结构的药物可以在通过此空穴时被特性识别,而达到分离纯化的效果。由于MIP具有特异性识别和选择性吸附的能力,并且可以耐受极端pH环境及可重复使用等特性,已经被应用于化学传感器的制备、生物样品前处理及环境检测等方面。目前,国内对于MIP在天然药物中有效成分的提取分离中的应用较少,而MIP可以用于拥有相同母核结构的化合物的富集纯化。本研究首先以葡聚糖凝胶LH-20为固定相,对紫锥菊根进行柱色谱提取,得到菊苣酸单体,再用上述菊苣酸单体为印迹分子,制备MIP,用高效液相色谱(HPLC)法检测,达到对紫锥菊根中的菊苣酸和咖啡酸(图 1)的富集效果。
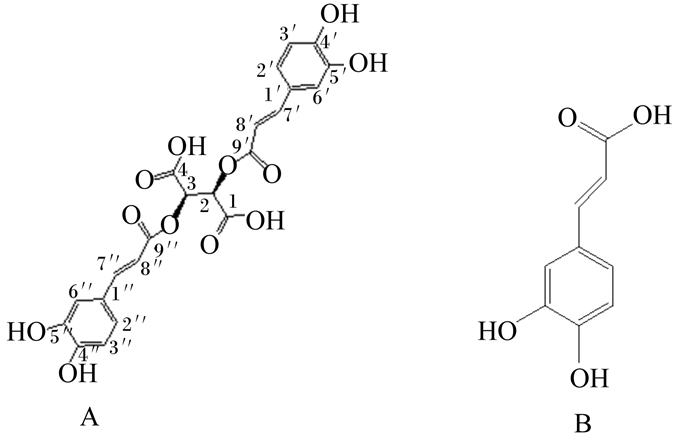
|
图 1 菊苣酸(A)和咖啡酸(B)化学结构 Fig. 1 Chemical structures of chicoric acid (A) and caffeic acid (B) |
Waters 1525 HPLC系统(包括二元高压梯度泵、自动进样器、柱温箱、2998二极管阵列检测器),超声清洗仪(宁波新芝生物科技股份有限公司),旋转蒸发器(上海亚荣生化仪器厂),冷冻干燥机(北京松源华兴科技有限公司),TDL-60B低速离心机(上海安亭科学仪器厂),ISO-9001电子天平(北京赛多利斯仪器系统有限公司),TTL-DC型多功能氮吹仪(北京同泰联科技发展有限公司)。
菊苣酸对照品,批号MUST-16010710,购自成都曼思特生物科技有限公司中国科学院成都生物研究所;乙腈、甲醇(色谱纯)均购自德国默克公司;磷酸、二甲基亚砜(DMSO)均为分析纯,紫锥菊根细粉(80目),均购自北京绿源生物有限公司;偶氮二异丁腈购自天津市科密欧化学试剂有限公司;4-乙烯基吡啶(4-VP)、乙二醇二甲基烯酸酯(EGDMA)均购自上海奉贤南桥阿拉丁工业公司。
1.2 试验方法 1.2.1 紫锥菊根细粉中菊苣酸的提取分离称取紫锥菊根细粉20.0 g至圆底烧瓶中,按照料液比(质量体积比)1 : 21加入80%的乙醇,充分浸泡后进行超声提取(超声功率:250 W;温度:60 ℃;时间:1 h),重复提取3次,合并提取液,过滤后旋蒸将乙醇蒸干,将旋蒸瓶内剩余溶液倒入平皿中进行冷冻干燥,得到提取物,减重法称量其质量。
将80 g葡聚糖凝胶LH-20倒入烧杯中,加入80%甲醇浸泡过夜,待其完全溶胀后装柱。称取上述提取物5.0 g,加入甲醇15 mL,超声使其完全溶解。将溶解物用0.45 μm过滤器进行过滤,湿法上样。用80%的甲醇溶液洗脱,采用HPLC法进行测定,用菊苣酸对照品进行对照试验,对含有菊苣酸的洗脱液进行收集,过滤后,旋蒸蒸干乙醇,剩余水溶液进行冷冻干燥,得到菊苣酸粗提物,再将粗提物反复上葡聚糖凝胶LH-20进行提取,依次用60%、40%的甲醇溶液洗脱,采用HPLC法进行测定,收集含有菊苣酸的洗脱液,旋蒸后进行冷冻干燥。
1.2.2 HPLC分析取测定样品粉末1.0 mg于2 mL离心管中,加入1 mL含有0.1%磷酸的乙腈:水(1 : 1)溶液,完全溶解后,取20 μL进行HPLC分析。流动相为乙腈(A)及含0.1%磷酸的水溶液(B),检测波长为327 nm,柱温:35 ℃,色谱柱为Waters sunfire column(5 μm,4.6 mm×250 mm),纯度测定为梯度条件即0~10 min,流动相A恒定占比25%,10~30 min,A线性上升至40%;30~45 min,流动相A恒定占比40%,45~60 min,A线性下降为25%。菊苣酸含量测定条件为等度条件即A : B=40 : 60。菊苣酸对照品同法处理后上样。
1.2.3 提取菊苣酸分子结构确证质谱分析:将1.2.1中提纯的菊苣酸经甲醇溶解后,进行飞行时间质谱分析(Bruker Compact QTOF),负离子模式,电喷雾(ESI)离子源,温度200 ℃,载气为氮气干燥气,载气流速4 L/min,雾化器压力0.03 MPa。
核磁共振波谱法(NMR)分析:将上述菊苣酸用氘代甲醇溶解后,进行NMR(BrukerAvance Ⅲ HD)分析,氢谱及碳谱数据用Bruker Daltonics Data Analysis 4.4进行归属。
1.2.4 菊苣酸MIP的制备将上述制备菊苣酸单体及咖啡酸单体(0.1 mmol)作为模板分子(template molecule,TM),选用4-乙烯基吡啶为功能单体(functional monomer,FM),按照模板分子与功能单体摩尔比1 : 4和1 : 40的用量同置于广口瓶中,加入二甲基亚砜或甲醇6 mL振荡混匀,超声10 min密封置于常温下振荡1.5 h。加入交联剂(crosslinker,CL)乙二醇二甲基烯酸酯,物质的量为30或300倍量的模板分子,振荡摇匀,加入引发剂偶氮二异丁腈40 mg,通入氮气5 min,密封放于60 ℃恒温振荡箱中反应24 h。将形成的固体聚合物取出,研磨成粉,过500目筛后,用冰乙酸-甲醇溶液(2 : 8)进行索氏提取48 h,温度为75 ℃,将提取物烘干即得MIP。同法不加入模板分子制作空白对照(NIP)。
1.2.5 紫锥菊根粉在MIP上的富集纯化取上述MIP 200.0 mg放入萃取柱中,用2 mL甲醇和2 mL超纯水依次过柱进行活化,另取紫锥菊根粉10.0 mg,加水10 mL,超声溶解后,上样到已活化的萃取柱中,自然流下,收集流出液,萃取柱用2 mL超纯水过柱洗脱杂质,最后用2 mL甲醇洗脱,收集洗脱液。再将上述流出液于同一MIP上重复上样5次,收集所有甲醇洗脱液,用氮气在40 ℃吹干后,称重,加入10 mL含有0.1%磷酸的乙腈:水(1 : 1)溶液,完全溶解后,取20 μL进行HPLC分析。另取10.0 mg紫锥菊根粉,加入0.1%磷酸的乙腈:水(1 : 1)溶液10 mL,60 ℃,超声5 min,完全溶解后,取20 μL进HPLC进行分析,检测条件同1.2.2,用标准曲线计算菊苣酸含量。
1.2.6 菊苣酸MIP选择吸附能力测定将NIP放入萃取柱中,如1.2.4同法处理,应用公式计算分配系数(K)=CA/CS(CA为药物被MIP或NIP吸收量,CS为未被吸收量)。菊苣酸MIP的选择性由印迹因子(imprinting factor,IF)值体现,计算公式为IF=KMIP/KNIP。富集倍数(enrichment factor,n)值为经MIP提取后与不经MIP提取后菊苣酸含量的比值。
1.2.7 菊苣酸MIP对菊苣酸和咖啡酸微量吸附能力测定将选定菊苣酸MIP(模板分子:功能单体:交联剂=1 : 40 : 300)放入萃取柱,用1 mL甲醇和1 mL超纯水依次过柱进行活化,取菊苣酸和咖啡酸浓度分别为20、50、100 ng/mL的混标溶液,上样到已经活化的萃取柱中,自然留下,用1 mL超纯水过柱洗脱杂质,最后用1 mL甲醇洗脱,收集洗脱液,进行HPLC分析,用标准曲线法进行定量,每个浓度样品平行制作3份,连续制备3 d,分别测定1 d及连续3 d的20、50、100 ng/mL的混标溶液,计算各测量值之间的相对标准偏差(RSD)值得到日内及日间精密度,同时用提取洗脱后样品中菊苣酸和咖啡酸的峰面积与相同浓度下标准品中菊苣酸的峰面积的比值计算提取回收率(准确度)。
2 结果与分析 2.1 HPLC分析经超声法提取后,得到菊苣酸粗品含量为6.4 g,再经葡聚糖凝胶LH-20富集纯化后所得菊苣酸纯品含量为336 mg,经HPLC分析,纯度为90.22%,结果见图 2。
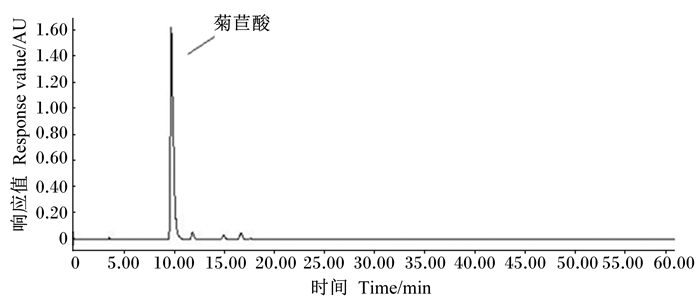
|
图 2 菊苣酸纯度分析HPLC色谱图 Fig. 2 HPLC chromatogram of purification analysis of chicoric acid |
菊苣酸纯品为白色粉末状化合物。经电喷雾质谱(ESI-MS)鉴定,其分子量质荷比(m/z)为473.071 6,见图 3。
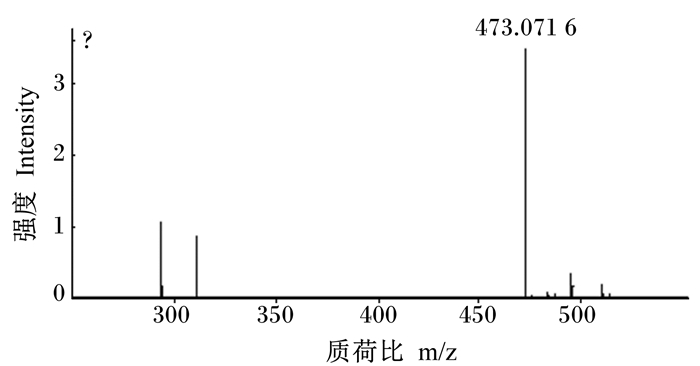
|
图 3 菊苣酸结构分析确证质谱图 Fig. 3 Representative MS chromatogram of structure analysis of chicoric acid |
菊苣酸粗品经5次MIP重复富集后,不同溶剂及摩尔比的提取效果及IF值见表 1。如表所示,采用二甲基亚砜为溶剂,模板分子:功能单体:交联剂摩尔比为1 : 4 : 30时,IF与n值最高,但在实际操作过程中,应用此比例制作出的MIP,溶胀后呈胶状,上样后,液体很难流下,所以此溶剂及摩尔比不作为最优选择,而采用n值次之的甲醇为溶剂,模板分子:功能单体:交联剂摩尔比为1 : 40 : 300为最优菊苣酸MIP。菊苣酸经过5次富集,每次富集的提取率见表 2。
|
|
表 1 不同溶剂及摩尔比的提取效果及IF值 Table 1 Extraction effects and IF value of different solvents and molar ratios |
|
|
表 2 菊苣酸经过5次富集提取率 Table 2 Extraction ratios after 5 times extraction of chicoric acid |
制定了菊苣酸和咖啡酸混标浓度为10.0~1 000.0 ng/mL的标准曲线,分别为y=109.76x-181.58和y=170.94x-152.86,标准曲线的相关系数(R2)值均大于0.999 9。
2.4.2 精密度和准确度测定菊苣酸和咖啡酸测定日间、日内精密度和准确度见表 3。如表所示,RSD值(精密度)均小于9.9%,提取回收率(准确度)在3个浓度下在71.3%~93.0%,表明菊苣酸MIP对低浓度药物具有稳定良好的富集效果。
|
|
表 3 菊苣酸和咖啡酸测定日间、日内精密度和准确度 Table 3 Within-day and between-day precision and accuracy of determination for chicoric and caffeic acid (n=3) |
菊苣酸MIP对紫锥菊根粉末中咖啡酸和菊苣酸富集效果见图 4。由图可见,菊苣酸MIP对于拥有相似母核结构的咖啡酸同样具有富集效果。
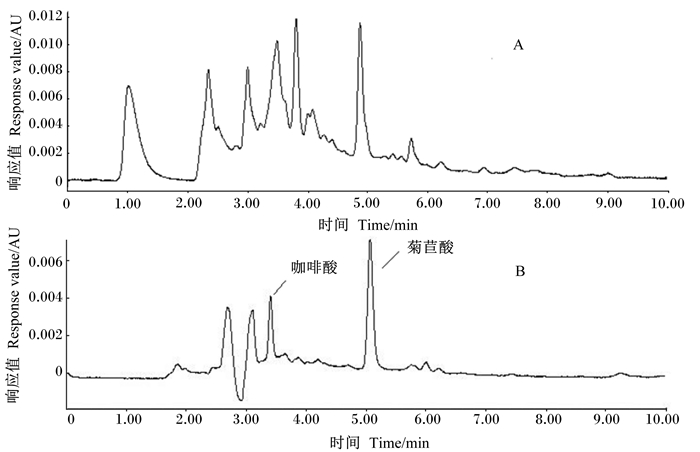
|
图 4 紫锥菊根粉经MIP提取前235 nm下色谱图(A)和紫锥菊根粉末经MIP提取后235 nm下色谱图(B) Fig. 4 Chromatograms of Echinacea purpurea root powder before MIP extraction at 235 nm (A) and Echinacea purpurea root powder after MIP extraction at 235 nm (B) |
在近些年的研究中,高纯度的菊苣酸多是由制备液相色谱进行分离,但此种方法分离量少,对设备的要求程度较高,而经典的柱色谱层析技术相对简单,应用新型固定相能让富集纯化效率有较大的提升。葡聚糖凝胶LH-20是兼具分子筛原理和反相分配作用的固定相填料,菊苣酸本身为兼具酚羟基和羧基的化合物,极性较大,所以选用甲醇/水反相溶剂系统进行分离,选用此种固定相具有死吸附小、可重复多次使用、分离效果可保持十几年不变等特点。
本研究所制备的MIP是近年来研究的热门材料,在本实验室之前的研究中,曾将其广泛应用于生物样品的提取纯化技术[15-16],此次首次应用于天然药物的富集提纯。在MIP的制备过程中,菊苣酸本身为水溶性化合物,在溶剂选择中,排除其不溶性溶剂如氯仿等,选择其可溶性的二甲基亚砜和甲醇作为备选方案,有利于菊苣酸MIP的形成。对于酸性分子多选用4-乙烯基吡啶为功能单体,而反之,则选择α-甲基丙烯酸为功能单体。在本实验室前期研究中,对比选择2种功能单体,结果显示应用4-乙烯基吡啶制备出的MIP提取效果更强,而菊苣酸又为咖啡酸衍生物,是有机酸型化合物,直接验证了以上论断。同时,菊苣酸结构中具有4个酚羟基,理论上呈现弱酸性模板分子,菊苣酸与碱性功能单体4-乙烯基吡啶可能形成1 : 4的配合物,但在实际试验中,此比例并未得到良好的提取富集效果,可能与菊苣酸酸分子结构中所显示的弱酸性除了酚羟基外还与羧基有关,所以在试验过程中,选用1 : 40的比例作为对比试验,结果也表明,高比例的功能单体可显著提高富集效果。以MIP为固定相,能重复使用5次以上,也可富集具有相关类似结构的化合物,对于含量较低的化合物富集效果尤为显著。MIP对有相似结构的化合物都具有富集效果,所以在本试验中用菊苣酸作为模板分子制作MIP,其对紫锥菊根粉末中的菊苣酸和咖啡酸具有富集效果,可以用于同母核药物的富集纯化。作为对比,试验中同时比较了具有相似母核结构的咖啡酸作为模板分子制备MIP,但其对菊苣酸富集纯化效果并不理想,推测可能与咖啡酸分子结构相对简单,所制备得到的MIP空穴结构并不能很好地嵌合识别结构相对复杂的菊苣酸有关。
4 结论本研究应用本实验室自提的菊苣酸作为模板分子,4-乙烯基吡啶为功能单体,乙二醇二甲基烯酸酯为交联剂合成了菊苣酸的MIP,并应用其对紫锥菊根粉末的提取物进行了纯化,结果表明其对于紫锥菊根粉末中的菊苣酸和咖啡酸均有富集效果。
| [1] |
闫晓慧, 谈锋. 3种松果菊属植物的鉴别、活性成分及生物技术研究进展[J]. 中草药, 2006, 37(2): 300-303. DOI:10.3321/j.issn:0253-2670.2006.02.055 |
| [2] |
CHIOU S Y, SUNG J M, HUANG P W, et al. Antioxidant, antidiabetic, and antihypertensive properties of Echinacea purpurea flower extract and caffeic acid derivatives using in vitro models[J]. Journal of Medicinal Food, 2017, 20(2): 171-179. DOI:10.1089/jmf.2016.3790 |
| [3] |
NYALAMBISA M, OYEMITAN I A, MATEWU R, et al. Volatile constituents and biological activities of the leaf and root of Echinacea species from South Africa[J]. Saudi Pharmaceutical Journal, 2017, 25(3): 381-386. DOI:10.1016/j.jsps.2016.09.010 |
| [4] |
姚兴东, 聂园梅, DATTA-GUPTA N. 紫锥花种属中酚类化合物的HPLC分析[J]. 分析科学学报, 2006, 22(2): 199-201. DOI:10.3969/j.issn.1006-6144.2006.02.022 |
| [5] |
JIANG L, LI W Z, WANG Y C, et al. Effects of cichoric acid extract from Echinacea purpurea on collagen-induced arthritis in rats[J]. The American Journal of Chinese Medicine, 2014, 42(3): 679-692. DOI:10.1142/S0192415X1450044X |
| [6] |
ZHU D, WANG Y T, DU Q W, et al. Cichoric acid reverses insulin resistance and suppresses inflammatory responses in the glucosamine-induced HepG2 cells[J]. Journal of Agriculture and Food Chemistry, 2015, 63(51): 10903-10913. DOI:10.1021/acs.jafc.5b04533 |
| [7] |
ZHANG H L, DAI L H, WU Y H, et al. Evaluation of hepatocyteprotective and anti-hepatitis B virus properties of cichoric acid from Cichorium intybus leaves in cell culture[J]. Biological and Pharmaceutical Bulletin, 2014, 37(7): 1214-1220. DOI:10.1248/bpb.b14-00137 |
| [8] |
SCHLERNITZAUER A, OIRY C, HAMAD R, et al. Chicoric acid is an antioxidant molecule that stimulates AMP kinase pathway in L6 myotubes and extends lifespan in Caenorhabditis elegans[J]. PLoS One, 2013, 8(11): e78788. DOI:10.1371/journal.pone.0078788 |
| [9] |
KUBAN-JANKOWSKA A, SAHU K K, GORSKA M, et al. Chicoric acid binds to two sites and decreases the activity of the YopH bacterial virulence factor[J]. Oncotarget, 2016, 7(3): 2229-2238. |
| [10] |
TSAI Y L, CHIU C C, CHEN J Y F, et al. Cytotoxic effects of Echinacea purpurea flower extracts and cichoric acid on human colon cancer cells through induction of apoptosis[J]. Journal of Ethnopharmacology, 2012, 143(3): 914-919. DOI:10.1016/j.jep.2012.08.032 |
| [11] |
LIU Q, CHEN Y W, SHEN C, et al. Chicoric acid supplementation prevents systemic inflammation-induced memory impairment and amyloidogenesis via inhibition of NF-kB[J]. The FASEB Journal, 2017, 31(4): 1494-1507. DOI:10.1096/fj.201601071R |
| [12] |
赵咏梅, 杨力. 紫锥菊中菊苣酸喷雾提取工艺的研究[J]. 陕西农业科学, 2018, 64(10): 32-35. DOI:10.3969/j.issn.0488-5368.2018.10.010 |
| [13] |
陈理. 高速逆流色谱分离制备菊苣酸单体[J]. 中国中药杂志, 2009, 34(13): 1732-1733. |
| [14] |
谢春燕, 徐新军, 谢鸷生, 等. 快速制备液相色谱分离紫锥菊中咖啡酰基酒石酸、菊苣酸和松果菊苷[J]. 中药新药与临床药理, 2012, 23(1): 90-94. DOI:10.3969/j.issn.1003-9783.2012.01.026 |
| [15] |
WANG G N, ZHANG L, SONG Y P, et al. Application of molecularly imprinted polymer based matrix solid phase dispersion for determination of fluoroquinolones, tetracyclines and sulfonamides in meat[J]. Journal of Chromatography B, 2017, 1065-1066: 104-111. DOI:10.1016/j.jchromb.2017.09.034 |
| [16] |
YANG K, WANG G N, LIU H Z, et al. Preparation of dual-template molecularly imprinted polymer coated stir bar based on computational simulation for detection of fluoroquinolones in meat[J]. Journal of Chromatography B, 2017, 1046: 65-72. DOI:10.1016/j.jchromb.2017.01.033 |




