霉菌毒素(mycotoxin)是世界各地农业产品中常见的霉菌次级代谢物,对人类和动物健康构成威胁。畜禽摄入含有霉菌毒素的饲料,霉菌毒素也会残留于畜产品中,即肉、蛋、奶和奶制产品[1]。霉菌毒素通常细分为田间霉菌毒素,即在收获前或收获后主要由镰刀菌属和链格孢菌属产生,以及在谷物干燥或储存期间主要由曲霉属和青霉属产生的储存霉菌毒素。霉菌毒素是气候依赖性化合物,高度依赖于收获前后的环境因素(如温度和水分含量),除此之外,微量营养素和昆虫损害程度都会影响霉菌毒素的滋生[2]。目前医学和农业主要关注的霉菌毒素包括:黄曲霉毒素(AF)、单端孢霉烯族毒素[如T-2毒素、新茄病镰刀菌烯醇(NEO)和呕吐毒素(DON)]、玉米赤霉烯酮(ZEA)、赭曲霉毒素A(OTA)及烟曲霉毒素[3]。迄今为止,已经报道了霉菌毒素会引起消化系统、泌尿系统、免疫系统和生殖系统方面的疾病[4],并且体内和体外研究都已阐明这些霉菌毒素诱导的毒性的机制。虽然霉菌毒素的毒性机制各有不同,但越来越多的研究表明霉菌毒素的毒性作用是通过氧化应激介导的[5-6]。目前氧化应激已成为研究热点,其也可以为解释霉菌毒素毒性机制提供新的方向和思路,更加全面地阐述霉菌毒素的毒性机制,也有助于为畜禽生产中解决霉菌毒素问题提供理论依据。
1 氧化应激机体氧化还原稳态的维持主要是依赖于机体氧化系统和抗氧化系统之间的动态平衡;这种动态平衡一旦被打破,活性氧自由基产生过多或者机体抗氧化系统遭到破坏,就会引起机体氧化应激[7-8]。许多研究相继表明,氧化应激可引起人和动物严重的氧化损伤,如生物大生子(蛋白质、核酸、脂质等)氧化而引起的结构与生理功能的改变[7-9],导致动物机体生理功能的失调,使机体处于亚健康或者疾病状态。动物机体内形成了3层主要防御氧化体系,第1道防线包括还原型谷胱甘肽(GSH)、维生素C和维生素E等小分子抗氧化剂直接清除活性氧(ROS)/活性氮(RNS),从而防止或延缓各种氧化应激的发生;机体抗氧化酶构成了中间的防御体系,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和谷胱甘肽过氧化物酶(GPx)被认为是主要的抗氧化酶,其引发自由基分解或将毒性化合物与GSH结合;抗氧化酶的修复及其功能的加强是机体的最后1道防线。另外,细胞内的氧化还原对之间的转化也是保证细胞正常氧化还原稳态的基础。细胞内主要的氧化还原对包括氧化型谷胱甘肽(GSSG)/GSH、半胱氨酸/胱氨酸(Cys/CySS)、氧化型硫氧还蛋白/还原型硫氧还蛋白[Trx-S2/Trx-(SH)2]、烟酰胺腺嘌呤二核苷酸磷酸/还原型烟酰胺腺嘌呤二核苷酸磷酸(NADP+/NADPH)[10]。
2 霉菌毒素的吸收与代谢动物机体对霉菌毒素的生物吸收率存在很大差异,主要取决于霉菌毒素类型以及动物物种的差异。胃肠道是霉菌毒素摄入和动物作用的起始位点,多数霉菌毒素的快速吸收发生在胃肠道的前端部分。对于非反刍动物,超过80%的AF在胃肠道内通过被动运输吸收,而其他主要霉菌毒素(OTA、FB和DON)在肠道中的吸收率在1%~60%[11]。此外,多种霉菌毒素(OTA、FB、ZEN和DON)被证实参与肠-肝循环[12],霉菌毒素通过胆汁进入肠-肝循环重吸收,并长时间残留于肠道。霉菌毒素在动物机体内的解毒代谢过程主要分为2个时期:Ⅰ期代谢过程主要发生在肝脏中的氧化反应,包括环氧化反应、水合反应、羟基化反应以及细胞色素P450的脱甲基化反应[13]。例如DON的深度氧化成去氧脱氧雪腐镰刀菌醇(DOM-1),此过程中的代谢在大部分动物机体内发生并且主要由肠道微生物参与[14-15]。在肠道中代谢时,肠道上皮细胞和肠道微生物都可以有效限制霉菌毒素的毒性作用,对于能够将许多霉菌毒素转化为无毒代谢物的反刍动物尤其如此。反刍动物对一些霉菌毒素的抗性归因于瘤胃中微生物菌群的解毒作用。许多霉菌毒素,如ZEA、DON和OTA,在吸收前被瘤胃微生物有效地去乙酰化和去环氧化[12]; Ⅱ期代谢过程主要是霉菌毒素与葡糖苷酸、磺酸盐以及谷胱甘肽等发生共轭反应。葡萄苷酸化过程主要发生在肠道微粒体,并且葡萄糖醛酸转移酶参与反应[15]。此外,禽类动物机体中Ⅱ期反应的转化率比猪的低很多。
3 霉菌毒素介导的氧化应激 3.1 AFAF是谷物(玉米、大米、燕麦、大麦和高粱)、花生、棉籽和核桃的天然污染物,主要由黄曲霉和寄生曲霉产生的次级代谢产物。AF是二呋喃香豆素的衍生物,因而在紫外光下能发出荧光,发出蓝色的是AFB1、AFB2,发出绿色的是AFG1、AFG2[16]。在摄入被AF污染的人或动物乳汁中发现的黄曲霉毒素M1和M2(AFM1、AFM2),分别是AFB1和AFB2的代谢产物[17]。体外研究[18-19]和体内研究[20]都证明AFB的毒性会引起机体氧化应激。肝脏和其他组织中的细胞色素P450酶(CYP)(包括CYP1A2、CYP3A4和CYP2A6)将AFB1转化为环氧化物(AFB1-8, 9-外切环氧化物、AFB1-8, 9-内切环氧化物)、AFM1、AFP1、AFQ1及其还原形式的黄曲霉毒素。最终AFB1-8, 9-外切环氧化物与细胞大分子(如线粒体、核酸和核蛋白)结合,发挥其细胞毒性作用[21]。摄入AFB引起机体细胞内抗氧化机制的一系列变化,如核因子E2相关因子2(Nrf2)、SOD、GPx和CAT表达,增加脂质的过氧化[18-19]。Chen等[22]报道在肉鸡饲粮中添加0.15、0.30和0.60 mg/kg AFB1,引起肉鸡脾脏GPx、GR和CAT活性降低,GSH含量降低,丙二醛(MDA)含量增加,诱导氧化应激。目前尚不清楚AFB是否通过增加ROS直接引起脂质过氧化,并且AFB1诱导脂质过氧化物(LPO)和共轭二烯的形成不仅在肝脏,而且在肾脏、大脑和皮肤组织中均有增加[23]。此外,AFB诱导ROS产生,降低抗炎细胞因子白细胞介素-4(IL-4)表达和诱导促炎细胞因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1α(IL-1α)、白细胞介素-1(IL-1)和白细胞介素-6(IL-6)以及一氧化氮(NO)表达来调节炎症反应[24]。Marin等[25]用AF(140和280 μg/kg)污染的饲粮饲喂断奶仔猪,发现低剂量AF抑制了猪的生长,并降低了猪的体液和细胞免疫水平。近年来,人们普遍认为氧化应激也会导致细胞凋亡,多数诱导细胞凋亡的因子也都是氧化应激的诱导剂[26]。Liu等[18]研究报道,AFB1引起肉鸡原代肝细胞中线粒体功能丧失,诱导细胞凋亡,并且通过线粒体产生ROS,参与Nrf2信号通路的调控。AFB解偶联线粒体氧化磷酸化,降低线粒体膜电位和线粒体通透性[[1820]]、激活细胞色素C、调节B淋巴细胞瘤2(Bcl2)/Bcl-2相关联X蛋白(Bax)基因表达并激活半胱天冬酶-9(caspase-9)和半胱天冬酶-3(caspase-3),诱导细胞凋亡[18-19]。
3.2 ZEAZEA是由几种镰刀菌产生的有毒化合物,具有生殖毒性、免疫毒性、致畸作用和遗传毒性。由于ZEA与内源性雌激素有结构相似性,因此能与子宫、乳腺、下丘脑、垂体等部位的雌二醇竞争性结合雌激素受体,从而发挥类雌激素样作用。这也是ZEA引起动物繁殖障碍(包括受精、着床、胎儿发育、排卵周期改变、精子受精能力和产仔数降低等)的主要机制。机体摄入ZEA后迅速在肠道被吸收,ZEA的代谢可分为2个阶段:包括Ⅰ期代谢和Ⅱ期代谢。在Ⅰ期过程中,ZEA的酮基团及其衍生物通过脂肪族羟基化被还原,并且引起代谢相应的醇。在3α-羟基类固醇脱氢酶(3α-HSD)或3β-羟基类固醇脱氢酶(3β-HSD)的催化作用下,将ZEA转化为α-玉米赤霉烯醇(α-ZEA)、β-玉米赤霉烯醇(β-ZEA)[27],然后参与Ⅱ期反应,与葡萄糖醛酸或磺酸结合并在尿液中排出[28]。除了肝脏和肠道,许多其他组织,如前列腺、睾丸、肾脏、下丘脑和卵巢也含有3α-HSD和3β-HSD,并具有代谢ZEA的能力。此外,肠-肝循环和胆汁排泄也是ZEA代谢的重要过程,肠-肝循环使得ZEA及其衍生物在循环系统中的残留、代谢和毒性作用的时间延长[29]。
体内研究[30]和体外研究[31]证明了ZEA诱导ROS产生和脂质过氧化的能力,引起氧化性DNA和线粒体损伤。Taranu等[32]研究了低浓度(10 μmol/L)ZEA对猪肠上皮细胞(IPEC-1)基因表达的影响。虽然低浓度的ZEA不影响细胞活力,但与对照相比,190个基因表达存在显著差异,其中包括编码谷胱甘肽过氧化物酶(GPx6、GPx2、GPx1)在内70%的基因被上调。Zhou等[33]将50、100、150 mg/kg ZEA饲喂妊娠期大鼠,发现血清和肝脏中SOD和CAT活性以剂量依赖性降低和MDA含量增加,结果表明,ZEA不仅能引起妊娠大鼠肝脏损伤,而且能诱导肝脏中细胞色素P450 2E1(CYP2E1)的mRNA的表达。ZEA诱导ROS的产生可能是通过线粒体NADPH氧化酶,将正常氧催化成超氧阴离子[34]。在用ZEA处理支气管上皮细胞6和24 h后,NADPH氧化酶的表达分别上调1.32和1.60倍[35]。研究表明,ZEA改变了线粒体的结构,且随着ZEA剂量的增加,线粒体膜电位以剂量依赖性方式显著降低[36]。因此,ZEN产生的ROS也可能破坏线粒体并诱导线粒体膜透化和降低细胞色素c氧化酶活性。
3.3 单端孢霉烯族毒素单端孢霉烯族毒素是一组主要由镰刀菌属真菌产生的霉菌毒素,是食物链中最常见的污染物。单端孢霉烯族毒素对动物毒性作用主要临床症状有:出血性腹泻、呕吐、白细胞减少、免疫抑制、繁殖障碍、骨损伤和组织放射性损伤等[15]。单端孢霉烯根据其特征官能团分为4种类型(A~D),分别属于A、B型的T-2毒素(A)和DON(B)因高毒性和分布广泛,因而更为关注。研究已经表明,氧化应激也是单端孢霉烯族毒素毒性作用的重要机制(图 1)[37]。单端孢霉烯族毒素能够显著增加机体ROS水平以及降低胞内谷胱甘肽S转移酶(GST)、SOD、CAT活性,进而造成脂质过氧化和DNA损伤,此过程中包括丝裂原激活的蛋白激酶(MAPK)的引发细胞凋亡的信号通路也会被激活[38-39]。然而,也有学者研究发现氧化应激的典型指标,包括ROS的蓄积、脂质过氧化作用以及热休克蛋白70(HSP-70)的诱导作用等并没有在单端孢霉烯族毒素毒性研究的试验结果中观察到,但同样会造成DNA损伤和细胞凋亡[40-41]。有学者认为使用的毒素剂量的不同是造成这种差异的主要原因[40-42]。T-2毒素是通过与蛋白质结合从而抑制肽基转移酶,其是60s核糖体亚基不可分割的一部分。随后抑制肽基转移酶反应,引发“核糖体毒性应激反应”,从而激活c-Jun N末端激酶(JNK)和MAPK等信号途径[43]。DON又名呕吐毒素,毒性比T-2毒素小,因其能引起猪的呕吐,故此得名。DON的毒性作用包括呕吐和厌食、肠道和免疫功能的下降、降低营养物质吸收率以及对慢性疾病的易感性增加[44]。
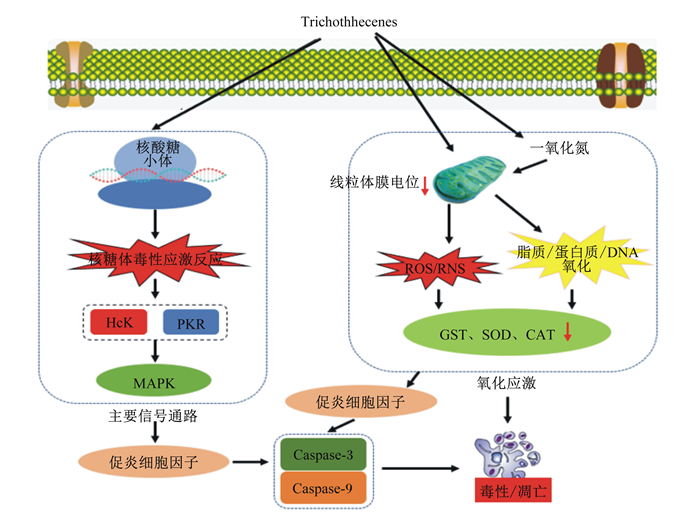
|
Trichothecenes:单端孢霉烯族毒素;Hck:造血细胞激酶hematopoietic cell kinase;PKR:蛋白激酶R protein kinase R;MAPK:丝裂原激活的蛋白激酶mitogen-activated protein kinase;ROS:活性氧reactive oxygen;RNS:活性氮reactive nitrogen;GST:谷胱甘肽S转移酶glutathione S transferase;SOD:超氧化物歧化酶superoxide dismutase;CAT:过氧化氢酶catalase;Caspase-3:半胱天冬酶-3;Caspase-9:半胱天冬酶-9。 图 1 单端孢霉烯族毒素介导的氧化应激机制 Fig. 1 Trichothecenes-mediated oxidative stress mechanism[53] |
单端孢霉烯族毒素使ROS水平增加,致使脂质过氧化,从而改变了生物膜的完整性、细胞氧化还原信号以及细胞的抗氧化水平[45]。单端孢霉烯族毒素可以造成不同动物的脂质过氧化。Sehata等[39]研究报道,在口服2 mg/kg T-2毒素的怀孕大鼠肝脏中检测到氧化应激和凋亡相关基因的表达增加,同时还检测到脂质代谢和代谢酶相关基因的表达降低。同时,他们的研究发现T-2毒素诱导氧化应激,激活了参与细胞凋亡的MAPK通路,特别是c-Jun基因在细胞凋亡过程中起重要作用。caspase-2对于T-2毒素诱导的细胞凋亡是必需的,并且凋亡信号主要通过介导caspase-8和caspase-3而不是线粒体途径传递[46]。与上述研究相反,有学者研究表明T-2毒素发挥毒性作用不会诱导机体氧化作用。Schuster等[47]研究了T-2毒素对大鼠脂质过氧化的影响,但没有观察到脂质过氧化。饲喂含有T-2毒素(10 mg/kg)和DON(10 mg/kg)的饲粮17 d后,尽管在鸡脾脏白细胞中发现DNA片段化,但未观察到脂质过氧化[40]。同样,给鸡饲喂含有T-2毒素(0.5~13.5 mg/kg)的饲粮17 d后,也没有检测到氧化应激相关指标的变化[48]。因此,可能是不同的动物摄入不同剂量的毒素会导致不同的结果。
DON可以诱导机体氧化应急,改变多种靶组织中的抗氧化防御系统(图 1)。对灌服单次剂量DON(28 mg/kg BW)的雄性大鼠进行的试验,结果发现肝组织中GSH、CAT和SOD活性显著降低[49]。Hou等[50]研究报道,在小鼠饲粮中添加含有AF(597 mg/kg)、ZEN(729 mg/kg)和DON(3.1 mg/kg)的混合毒素,屠宰后结果表明,小鼠血清和肝脏中GPx活性和MDA含量升高;肝脏、肾脏和脾脏的重量增加;肝脏和肾脏的组织病理学显著改变;肝脏和肾脏中SOD和CAT活性的降低表明霉菌毒素在体内具有毒性并且能够诱导小鼠产生氧化应激。与T-2毒素作用相似,有学者研究表明,氧化损伤不是DON毒性作用的主要机制。Bensassi等[41]研究了DON对人类结肠癌细胞的细胞毒性,没有观察到ROS的产生。因此,他们认为DON直接诱导DNA损伤,但不是通过ROS的介导的氧化损伤。此外,DON可以充当直接遗传毒性剂,导致DNA片段化并通过介导p53和caspase的途径引起细胞凋亡。Awad等[51]给肉鸡饲喂污染10 mg/kg DON的饲粮,观察到鸡淋巴细胞中的DNA损伤,但脂质过氧化的指标线粒体硫代巴比妥酸物质(TBARS)含量与对照组没有显著差异。Franki c ˇ等[52]研究在饲粮中添加DON(4 mg/kg)和T-2毒素(3 mg/kg)对断奶仔猪脂质过氧化、淋巴细胞DNA断裂的影响,结果表明,DON和T-2毒素显著增加猪淋巴细胞DNA损伤,但血浆和24 h尿液中的MDA排泄率以及红细胞GPx活性没有发生显著变化。因此,提出了类似的假设,即DNA损伤主要由DON的直接作用或通过不同的表观遗传机制诱导,例如与DNA形成复合物而不是通过自由基的诱导。
3.4 OTA赭曲霉毒素是由丝状真菌物种如曲霉菌和青霉菌产生的一组霉菌毒素,在自然界中存在3种不同的亚型:赭曲霉毒素A、B和C。OTA是对人类和动物致病性最强的,并且广泛存在于食品和饲料中,包括谷物、畜产品、干果、咖啡、葡萄酒和啤酒。OTA在肠道中被动吸收,在不同的动物肠道吸收率也会不同,猪对于OTA的吸收率在60%左右[54]。在循环系统中OTA同血浆中白蛋白产生高度的亲和力,结合程度也就决定了OTA血浆半衰期,在人体中半衰期长达1个月之久[55]。OTA在动物机体中的组织分布受到摄入毒素的浓度、饲粮组成及动物机体健康状态等因素的影响,然而在肾脏和肝脏中存在的有机阴离子转运蛋白(OATs)和有机阴离子转运多肽(OATPs)是细胞主要负责摄取OTA的膜转运蛋白,属于溶质载体转运蛋白家族[56]。OTA可以通过Ⅰ期和Ⅱ期酶进行生物转化,大多数代谢物显示出低毒性或无毒性。在肠道中,部分OTA被蛋白水解酶和肠道菌群产生的酶水解成赭曲霉毒素α(OTα)[57-58]。OTA结构中含有对氯苯酚(PCP)在Ⅰ期生物转化的过程中被CYP450催化氧化脱氯,转化成遗传毒性较低的赭曲毒素B(OTB),在Ⅱ期反应过程中,也同样会与硫酸盐、葡糖苷酸、己糖/戊糖以及GSH共轭作用[59-60]。
OTA具有毒性作用的机制比较复杂,包括诱导氧化应激、线粒体损伤、抑制蛋白质合成、形成OTA-DNA复合物等(图 2)。OTA被CYP450催化氧化脱氯,产生可以与巯基共价结合的具有醌型结构的反应性亲电子产物OTA-醌(OTQ)、2-脱氧鸟苷和其他复合物[61]。此外,OTA通过Fe3+作为辅助因子诱导脂质过氧化。在NADPH-CYP450还原酶的存在下,OTA-Fe3+复合物还原Fe3+形成OTA-Fe2+并产生的自由基导致脂质过氧化和DNA损伤[62]。研究表明,细胞内Zn2+水平也可能与OTA毒性有关,OTA可能通过对转运蛋白和金属硫蛋白的作用来消耗Zn2+[63]。在对Zn2+与肝细胞共培养过程中显示,OTA显著增加ROS浓度和几种金属硫蛋白的表达,同时降低SOD活性和CAT mRNA水平[64]。OTA通过线粒体产生ROS,导致脂质过氧化、促进细胞凋亡信号通路的激活、增加线粒体膜通透性、激活JNK和MAPK通路并影响内质网钙通道[65-66]。
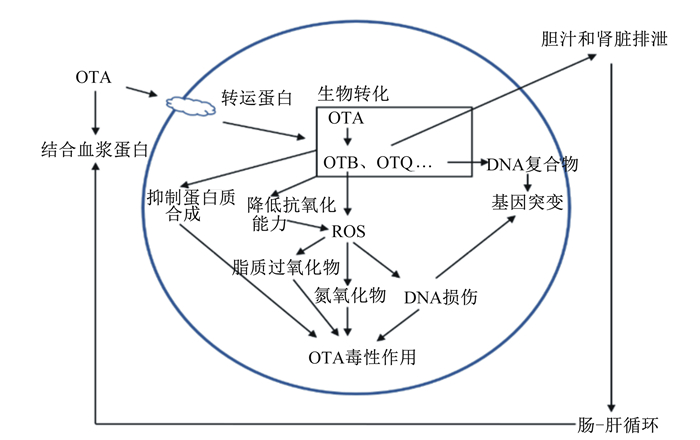
|
OTA:赭曲霉毒素A Ochratoxin A;OTB:赭曲霉毒素B Ochratoxin B;OTQ:赭曲霉毒素Q Ochratoxin Q;ROS:活性氧reactive oxygen。 图 2 OTA介导的氧化应激机制 Fig. 2 OTA-mediated oxidative stress mechanism |
霉菌毒素在自然界分布广泛,对人类和动物健康具有普遍威胁。由于性质差异,霉菌毒素的毒性作用和机制有所不同,但他们共同的毒性主要是致DNA损伤和细胞毒性。目前霉菌毒素的主要毒性作用已有报道,且多数集中在对于肝脏和肾脏的影响研究较多,而有关霉菌毒素介导的损伤作用研究甚少,虽然已有多数体内和体外试验已经证明霉菌毒素的毒性作用是造成机体氧化损伤,但是涉及信号途径的机制仍然没有阐释清楚。然而,尽管氧化应激能够部分解释霉菌毒素的毒性机制,但也未能完全诠释。今后研究中,应该多从分子水平探讨霉菌毒素的损伤机制,进一步阐明霉菌毒素介导的氧化应激的机制,从而为减少和修复霉菌毒素引起的氧化损伤提供理论依据,在从根本上减少生产中由霉菌毒素引起的动物氧化损伤、繁殖障碍、免疫抑制及其他相关疾病发生率的同时,也能保障畜产品的安全。
| [1] |
MARIN S, RAMOS A J, CANO-SANCHO G, et al. Mycotoxins:occurrence, toxicology, and exposure assessment[J]. Food and Chemical Toxicology, 2013, 60: 218-237. DOI:10.1016/j.fct.2013.07.047 |
| [2] |
MILANI J M. Ecological conditions affecting mycotoxin production in cereals:a review[J]. Veterinarni Medicina, 2013, 58(8): 405-411. DOI:10.17221/6979-VETMED |
| [3] |
WU F, GROOPMAN J D, PESTKA J J. Public health impacts of foodborne mycotoxins[J]. Annual Review of Food Science and Technology, 2014, 5: 351-372. DOI:10.1146/annurev-food-030713-092431 |
| [4] |
HASCHEK W M, VOSS K A, BEASLEY V R. 25-selected mycotoxins affecting animal and human health[J]. Handbook of Toxicologic Pathology, 2002, 1: 645-699. DOI:10.1016/B978-012330215-1/50026-0 |
| [5] |
ADHIKARI M, NEGI B, KAUSHIK N, et al. T-2 mycotoxin:toxicological effects and decontamination strategies[J]. Oncotarget, 2017, 8(20): 33933-33952. |
| [6] |
WANG X, WU Q H, WAN D, et al. Fumonisins:oxidative stress-mediated toxicity and metabolism in vivo and in vitro[J]. Archives of Toxicology, 2016, 90(1): 81-101. DOI:10.1007/s00204-015-1604-8 |
| [7] |
VALKO M, LEIBFRITZ D, MONCOL J, et al. Free radicals and antioxidants in normal physiological functions and human disease[J]. The International Journal of Biochemistry & Cell Biology, 2007, 39(1): 44-84. |
| [8] |
YIN J, REN W, LIU G, et al. Birth oxidative stress and the development of an antioxidant system in newborn piglets[J]. Free Radical Research, 2013, 47(12): 1027-1035. DOI:10.3109/10715762.2013.848277 |
| [9] |
CATALDI A. Cell responses to oxidative stressors[J]. Current Pharmaceutical Design, 2010, 16(12): 1387-1395. DOI:10.2174/138161210791033969 |
| [10] |
JONES D P. Redefining oxidative stress[J]. Antioxidants & Redox Signaling, 2006, 8(9/10): 1865-1879. |
| [11] |
AFSSA.Évaluation des risques liés à la présence de mycotoxines dans les chaînes alimentaires humaine et animale[R].Rapport Final.[S.l.]: AFSSA, 2009: 1-308.
|
| [12] |
CAVRET S, LECOEUR S. Fusariotoxin transfer in animal[J]. Food and Chemical Toxicology, 2006, 44(3): 444-453. DOI:10.1016/j.fct.2005.08.021 |
| [13] |
DHANASEKARAN D, SHANMUGAPRIYA S, THAJUDDIN N, et al.Aflatoxins and aflatoxicosis in human and animals[M]//Aflatoxins-biochemistry and molecular biology.Croatia: Intech, 2011.
|
| [14] |
PIERRON A, MIMOUN S, MURATE L S, et al. Microbial biotransformation of DON:molecular basis for reduced toxicity[J]. Scientific Reports, 2016, 6: 29105. DOI:10.1038/srep29105 |
| [15] |
WU Q H, DOHNAL V, HUANG L L, et al. Metabolic pathways of trichothecenes[J]. Drug Metabolism Reviews, 2010, 42(2): 250-267. DOI:10.3109/03602530903125807 |
| [16] |
DALVI R R. An overview of aflatoxicosis of poultry:its characteristics, prevention and reduction[J]. Veterinary Research Communications, 1986, 10(1): 429-443. DOI:10.1007/BF02214006 |
| [17] |
WATSON S, GONG Y Y, ROUTLEDGE M. Interventions targeting child undernutrition in developing countries may be undermined by dietary exposure to aflatoxin[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(9): 1963-1975. |
| [18] |
LIU Y, WANG W J. Aflatoxin B1 impairs mitochondrial functions, activates ROS generation, induces apoptosis and involves Nrf2 signal pathway in primary broiler hepatocytes[J]. Animal Science Journal, 2016, 87(12): 1490-1500. DOI:10.1111/asj.12550 |
| [19] |
WANG W J, XU Z L, YU C, et al. Effects of aflatoxin B1 on mitochondrial respiration, ROS generation and apoptosis in broiler cardiomyocytes[J]. Animal Science Journal, 2017, 88(10): 1561-1568. DOI:10.1111/asj.12796 |
| [20] |
SHI D Y, LIAO S Q, GUO S N, et al. Protective effects of selenium on aflatoxin B1-induced mitochondrial permeability transition, DNA damage, and histological alterations in duckling liver[J]. Biological Trace Element Research, 2015, 163(1/2): 162-168. |
| [21] |
BENNETT J W, KLICH M. Mycotoxins[J]. Clinical Microbiology Reviews, 2003, 16(3): 497-516. DOI:10.1128/CMR.16.3.497-516.2003 |
| [22] |
CHEN J, CHEN K J, YUAN S B, et al. Effects of aflatoxin B1 on oxidative stress markers and apoptosis of spleens in broilers[J]. Toxicology and Industrial Health, 2016, 32(2): 278-284. DOI:10.1177/0748233713500819 |
| [23] |
MADHUSUDHANAN N, KAVITHALAKSHMI S N, SHANMUGASUNDARAM K R, et al. Oxidative damage to lipids and proteins induced by aflatoxin B1 in fish (Labeo rohita)—protective role of Amrita Bindu[J]. Environmental Toxicology and Pharmacology, 2004, 17(2): 73-77. DOI:10.1016/j.etap.2004.03.002 |
| [24] |
MA Q G, LI Y, FAN Y, et al. Molecular mechanisms of lipoic acid protection against aflatoxin B1-induced liver oxidative damage and inflammatory responses in broilers[J]. Toxins, 2015, 7(12): 5435-5447. DOI:10.3390/toxins7124879 |
| [25] |
MARIN D E, TARANU I, BUNACIU R P, et al. Changes in performance, blood parameters, humoral and cellular immune responses in weanling piglets exposed to low doses of aflatoxin[J]. Journal of Animal Science, 2002, 80(5): 1250-1257. DOI:10.2527/2002.8051250x |
| [26] |
CHANDRA J, SAMALI A, ORRENIUS S. Triggering and modulation of apoptosis by oxidative stress[J]. Free Radical Biology and Medicine, 2000, 29(3/4): 323-333. |
| [27] |
MALEKINEJAD H, MAAS-BAKKER R F, FINK-GREMMELS J. Bioactivation of zearalenone by porcine hepatic biotransformation[J]. Veterinary Research, 2005, 36(5/6): 799-810. |
| [28] |
ZHENG W L, WANG B J, LI X, et al. Zearalenone promotes cell proliferation or causes cell death?[J]. Toxins, 2018, 10(5): 184. DOI:10.3390/toxins10050184 |
| [29] |
D'MELLO J P F, PLACINTA C M, MACDONALD A M C. Fusarium mycotoxins:a review of global implications for animal health, welfare and productivity[J]. Animal Feed Science and Technology, 1999, 80(3/4): 183-205. |
| [30] |
MARIN D E, PISTOL G C, NEAGOE I V, et al. Effects of zearalenone on oxidative stress and inflammation in weanling piglets[J]. Food and Chemical Toxicology, 2013, 58: 408-415. DOI:10.1016/j.fct.2013.05.033 |
| [31] |
QIN X S, CAO M J, LAI F N, et al. Oxidative stress induced by zearalenone in porcine granulosa cells and its rescue by curcumin in vitro[J]. PLoS One, 2015, 10(6): e0127551. DOI:10.1371/journal.pone.0127551 |
| [32] |
TARANU I, BRAICU C, MARIN D E, et al. Exposure to zearalenone mycotoxin alters in vitro porcine intestinal epithelial cells by differential gene expression[J]. Toxicology Letters, 2015, 232(1): 310-325. DOI:10.1016/j.toxlet.2014.10.022 |
| [33] |
ZHOU C, ZHANG Y, YIN S, et al. Biochemical changes and oxidative stress induced by zearalenone in the liver of pregnant rats[J]. Human & Experimental Toxicology, 2015, 34(1): 65-73. |
| [34] |
PFEIFFER E, WEFERS D, HILDEBRAND A A, et al. Catechol metabolites of the mycotoxin zearalenone are poor substrates but potent inhibitors of catechol-O-methyltransferase[J]. Mycotoxin Research, 2013, 29(3): 177-183. DOI:10.1007/s12550-013-0165-z |
| [35] |
SO M Y, TIAN Z P, PHOON Y S, et al. Gene expression profile and toxic effects in human bronchial epithelial cells exposed to zearalenone[J]. PLoS One, 2014, 9(5): e96404. DOI:10.1371/journal.pone.0096404 |
| [36] |
ZHENG W L, PAN S Y, WANG G G, et al. Zearalenone impairs the male reproductive system functions via inducing structural and functional alterations of sertoli cells[J]. Environmental Toxicology and Pharmacology, 2016, 42: 146-155. DOI:10.1016/j.etap.2016.01.013 |
| [37] |
EL GOLLI E, HASSEN W, BOUSLIMI A, et al. Induction of Hsp 70 in Vero cells in response to mycotoxins:cytoprotection by sub-lethal heat shock and by Vitamin E[J]. Toxicology Letters, 2006, 166(2): 122-130. DOI:10.1016/j.toxlet.2006.06.004 |
| [38] |
CHAUDHARI M, JAYARAJ R, BHASKAR A S B, et al. Oxidative stress induction by T-2 toxin causes DNA damage and triggers apoptosis via caspase pathway in human cervical cancer cells[J]. Toxicology, 2009, 262(2): 153-161. DOI:10.1016/j.tox.2009.06.002 |
| [39] |
SEHATA S, KIYOSAWA N, ATSUMI F, et al. Microarray analysis of T-2 toxin-induced liver, placenta and fetal liver lesions in pregnant rats[J]. Experimental and Toxicologic Pathology, 2005, 57(1): 15-28. |
| [40] |
FRANKI Č T, PAJK T, REZAR V, et al. The role of dietary nucleotides in reduction of DNA damage induced by T-2 toxin and deoxynivalenol in chicken leukocytes[J]. Food and Chemical Toxicology, 2006, 44(11): 1838-1844. DOI:10.1016/j.fct.2006.06.002 |
| [41] |
BENSASSI F, EL GOLLI-BENNOUR E, ABID-ESSEFI S, et al. Pathway of deoxynivalenol-induced apoptosis in human colon carcinoma cells[J]. Toxicology, 2009, 264(1/2): 104-109. |
| [42] |
SAHU S C, O'DONNELL M W Jr, WIESENFELD P L. Comparative hepatotoxicity of deoxynivalenol in rat, mouse and human liver cells in culture[J]. Journal of Applied Toxicology, 2010, 30(6): 566-573. DOI:10.1002/jat.1527 |
| [43] |
SHIFRIN V I, ANDERSON P. Trichothecene mycotoxins trigger a ribotoxic stress response that activates c-Jun N-terminal kinase and p38 mitogen-activated protein kinase and induces apoptosis[J]. Journal of Biological Chemistry, 1999, 274(20): 13985-13992. DOI:10.1074/jbc.274.20.13985 |
| [44] |
PAYROS D, ALASSANE-KPEMBI I, PIERRON A, et al. Toxicology of deoxynivalenol and its acetylated and modified forms[J]. Archives of Toxicology, 2016, 90(12): 2931-2957. DOI:10.1007/s00204-016-1826-4 |
| [45] |
KRISHNASWAMY R, DEVARAJ S N, PADMA V V. Lutein protects HT-29 cells against Deoxynivalenol-induced oxidative stress and apoptosis:prevention of NF-κB nuclear localization and down regulation of NF-κB and cyclo-oxygenase-2 expression[J]. Free Radical Biology and Medicine, 2010, 49(1): 50-60. DOI:10.1016/j.freeradbiomed.2010.03.016 |
| [46] |
HUANG P X, AKAGAWA K, YOKOYAMA Y, et al. T-2 toxin initially activates caspase-2 and induces apoptosis in U937 cells[J]. Toxicology Letters, 2007, 170(1): 1-10. DOI:10.1016/j.toxlet.2006.05.017 |
| [47] |
SCHUSTER A, HUNDER G, FICHTL B, et al. Role of lipid peroxidation in the toxicity of T-2 toxin[J]. Toxicon, 1987, 25(12): 1321-1328. DOI:10.1016/0041-0101(87)90010-9 |
| [48] |
REZAR V, FRANKIČ T, NARAT M, et al. Dose-dependent effects of T-2 toxin on performance, lipid peroxidation, and genotoxicity in broiler chickens[J]. Poultry Science, 2007, 86(6): 1155-1160. DOI:10.1093/ps/86.6.1155 |
| [49] |
RIZZO A F, ATROSHI F, AHOTUPA M, et al. Protective effect of antioxidants against free radical-mediated lipid peroxidation induced by DON or T-2 toxin[J]. Journal of Veterinary Medicine Series A, 1994, 41(1/2/3/4/5/6/7/8/9/10): 81-90. |
| [50] |
HOU Y J, ZHAO Y Y, XIONG B, et al. Mycotoxin-containing diet causes oxidative stress in the mouse[J]. PLoS One, 2013, 8(3): e60374. DOI:10.1371/journal.pone.0060374 |
| [51] |
AWAD W A, GHAREEB K, DADAK A, et al. Genotoxic effects of deoxynivalenol in broiler chickens fed low-protein feeds[J]. Poultry Science, 2012, 91(3): 550-555. DOI:10.3382/ps.2011-01742 |
| [52] |
FRANKIČ T, SALOBIR J, REZAR V. The effect of vitamin E supplementation on reduction of lymphocyte DNA damage induced by T-2 toxin and deoxynivalenol in weaned pigs[J]. Animal Feed Science and Technology, 2008, 141(3/4): 274-286. |
| [53] |
WU Q H, WANG X, NEPOVIMOVA E, et al. Antioxidant agents against trichothecenes:new hints for oxidative stress treatment[J]. Oncotarget, 2017, 8(66): 110708-110726. |
| [54] |
GALTIER P, ALVINERIE M, CHARPENTEAU J L. The pharmacokinetic profiles of ochratoxin A in pigs, rabbits and chickens[J]. Food and Cosmetics Toxicology, 1981, 19: 735-738. DOI:10.1016/0015-6264(81)90528-9 |
| [55] |
HAGELBERG S, HULT K, FUCHS R. Toxicokinetics of ochratoxin A in several species and its plasma-binding properties[J]. Journal of Applied Toxicology, 1989, 9(2): 91-96. DOI:10.1002/jat.2550090204 |
| [56] |
JUNG K Y, TAKEDA M, KIM D K, et al. Characterization of ochratoxin A transport by human organic anion transporters[J]. Life Sciences, 2001, 69(18): 2123-2135. DOI:10.1016/S0024-3205(01)01296-6 |
| [57] |
PITOUT M J. The hydrolysis of ochratoxin A by some proteolytic enzymes[J]. Biochemical Pharmacology, 1969, 18(2): 485-491. DOI:10.1016/0006-2952(69)90224-X |
| [58] |
MADHYASTHA M S, MARQUARDT R R, FROHLICH A A. Hydrolysis of ochratoxin A by the microbial activity of digesta in the gastrointestinal tract of rats[J]. Archives of Environmental Contamination and Toxicology, 1992, 23(4): 468-472. |
| [59] |
UENO Y. Biotransformation of mycotoxins in the reconstituted cytochrome P-450 system[J]. JSM Mycotoxins, 1985, 1985(22): 28-30. DOI:10.2520/myco1975.1985.22_28 |
| [60] |
GROSSE Y, BAUDRIMONT I, CASTEGNARO M, et al. Formation of ochratoxin A metabolites and DNA-adducts in monkey kidney cell[J]. Chemico-Biological Interactions, 1995, 95(1/2): 175-187. |
| [61] |
TOZLOVANU M, FAUCET-MARQUIS V, PFOHL-LESZKOWICZ A, et al. Genotoxicity of the hydroquinone metabolite of ochratoxin A:structure-activity relationships for covalent DNA adduction[J]. Chemical Research in Toxicology, 2006, 19(9): 1241-1247. DOI:10.1021/tx060138g |
| [62] |
OMAR R F, HASINOFF B B, MEJILLA F, et al. Mechanism of ochratoxin A stimulated lipid peroxidation[J]. Biochemical Pharmacology, 1990, 40(6): 1183-1191. DOI:10.1016/0006-2952(90)90382-U |
| [63] |
RANALDI G, CAPRINI V, SAMBUY Y, et al. Intracellular zinc stores protect the intestinal epithelium from Ochratoxin A toxicity[J]. Toxicology in Vitro, 2009, 23(8): 1516-1521. DOI:10.1016/j.tiv.2009.08.012 |
| [64] |
ZHENG J J, ZHANG Y, XU W T, et al. Zinc protects HepG2 cells against the oxidative damage and DNA damage induced by ochratoxin A[J]. Toxicology and Applied Pharmacology, 2013, 268(2): 123-131. DOI:10.1016/j.taap.2013.01.021 |
| [65] |
ZHU L Y, ZHANG B Y, DAI Y Q, et al. A review:epigenetic mechanism in ochratoxin a toxicity studies[J]. Toxins, 2017, 9(4): 113. DOI:10.3390/toxins9040113 |
| [66] |
SHEU M L, SHEN C C, CHEN Y S, et al. Ochratoxin A induces ER stress and apoptosis in mesangial cells via a NADPH oxidase-derived reactive oxygen species-mediated calpain activation pathway[J]. Oncotarget, 2017, 8(12): 19376-19388. |




