近年来,肠道微生物已逐渐成为生命科学领域的研究热点。哺乳动物胃肠道中栖息着数量庞大、种类繁多的微生物(细菌、真菌、古菌、病毒等),其中绝大多数是细菌。单胃动物肠道细菌的数量高达1014个,是细胞数量的10倍以上,由500种以上的细菌组成。仔猪出生后肠道微生物区系迅速发展,出生12 h后结肠中细菌的数量达到109~1010 CFU/g内容物,以厌氧菌和兼性厌氧菌为主,并在断奶以后逐渐形成稳定的肠道菌群[1]。肠道菌主要分为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidete)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和梭杆菌门(Fusobacteria),其中前2类菌门的数量超过全部肠道菌的90%。
在动物的进化过程中,肠道微生物与宿主形成了稳定的共生关系。微生物长期稳定的寄居在动物消化道内,它们的增殖和繁衍依赖动物机体提供适宜的环境因子和营养源。肠道菌群的黏附定植、组成变化和代谢活力直接或间接地影响和控制宿主的生长、发育以及各项生命活动。反之,肠道菌的定植和生长随着宿主动物的年龄、性别、生长环境、饮食营养的不同而发生波动和改变[2]。病原菌、药物、应激和外部刺激等引起的宿主的急剧生理变化会影响肠道菌群的多样性和稳定性,导致肠道微生态失衡。
1 肠道微生物的重要生理功能当前的研究证实,肠道菌对于宿主的健康生长具有不可估量的重要作用。除了协助宿主分解和消化进入肠道的各类营养物质(特别是膳食纤维),肠道菌群还能合成和产生多种营养功能物质(如B族维生素和部分功能性氨基酸等)。一些益生菌能够促进肠上皮黏液的分泌,协助宿主形成肠黏膜保护屏障,抑制外源致病菌群的定植[3]。细菌产生的代谢物、菌体蛋白、细菌素等经由迷走神经和循环途径参与宿主各种代谢调控与信号传导[4]。肠道微生态紊乱会引起宿主免疫失衡从而引发机体代谢表型障碍,并诱发多种疾病的发生,如抑郁症、帕金森症和肥胖症等[5-7]。通过补充益生菌或益生元来促进优势菌群的繁殖,或者采用菌群移植的方式恢复肠道稳态,能够有效地减少有害菌的数量,恢复或者促进宿主的健康发育[8]。
2 肠道菌群定植稳态影响动物肌肉生长和代谢骨骼肌是动物重要的组织器官,负责机体的运动和平衡,保护内脏器官,同时还是重要的能量储存和消耗器官[9]。骨骼肌组织可以通过分泌产生多种肌源性细胞因子,如鸢尾素、肌联素、肌肉抑制素和脑源性神经营养因子等,影响和干预其他组织的生理功能[10]。在畜牧生产中,猪、牛、羊和家禽等动物肌肉组织的生长和功能决定了动物的产肉量和肉品质量。所以,揭示肠道微生物对动物宿主肌肉生长的影响及作用机制具有重要的经济意义。
基于无菌动物的微生物移植试验整体反映了肠道微生物通过参与机体的物质代谢网络对宿主的生长和代谢表型进行调节,并直接影响到肌肉的生长、发育和代谢调控。Bäckhed等[11]试验发现,无菌小鼠的体脂蓄积量比带菌小鼠减少了60%,其葡萄糖耐受度和胰岛素敏感性均大幅度降低。在无菌小鼠的骨骼肌中,能量稳态相关的调控分子5′-单磷酸腺苷蛋白激酶(adenosine 5′-monophosphate activated protein kinase,AMPK)和负责线粒体氧化代谢的肉碱棕榈酰转移酶-1(carnitine palmitoyltransferase-1,CPT-1)蛋白都具有更高的表达量和蛋白活性。此外,无菌小鼠肠道内高水平的空腹诱导脂肪因子(fasting-induced adipose factor,Fiaf)增加了肌肉中过氧化物酶体增殖物受体γ共激活因子1α(peroxisome proliferators activated receptor gamma co-activator 1 alpha,PGC-1α)蛋白——一种主要的线粒体脂肪氧化调节分子。这些结果说明无菌小鼠的肌肉组织中脂肪氧化和能量消耗率都高于普通小鼠,而给无菌小鼠的肠道定植细菌后其骨骼肌的能量代谢效率有所减少[12]。
肠道微生物的组成与多样性有助于维持肌肉的正常生长和代谢能力。以不同的方法改变肠道菌群会直接影响肌肉的生长和功能。肥胖型的荣昌猪和瘦肉型的约克夏猪肠道微生物区系存在显著差异。将2种猪的肠道微生物通过粪菌移植方式传递给无菌小鼠后,受体小鼠表现出与供体猪相似的代谢表型[13]。与灌胃约克夏猪粪便的小鼠相比,灌喂荣昌猪粪便的小鼠体脂重具有增加的趋势,肌肉中的慢肌纤维比例提高,腓肠肌肌纤维直径和横截面积具有减小的趋势,腓肠肌的脂肪合成的能力提高,肌内脂肪增多。Liu等[14]分别给正常饮食与高脂饮食的小鼠移植多形拟杆菌,结果发现正常饮食小鼠的总脂肪含量减少,肌肉含量增加;而高脂饮食小鼠体重增长速度减慢,肌肉块重量也明显增加。还有研究表明,给健康的年轻小鼠额外补充植物乳杆菌(Lactobacillus plantarum)TWK10可以增加小鼠肌肉块的大小和运动能力(握力和游泳时间)[15]。Choi等[16]发现细菌形成的胞外囊泡(extracellular vesicles,EVs)参与了高脂饮食造成的小鼠骨骼肌组织的胰岛素抵抗和糖代谢紊乱。肌肉的强化也会影响到肠道菌群的组成和代谢强度。适量的运动和锻炼能够明显增强宿主的肠道健康,维持肠道菌群的多样化,增强代谢活力。这些研究说明肠道菌的定植和状态与肌肉的生长和功能存在密切联系。肠道菌的改变和波动会带来宿主生理与代谢的整体变化,往往会涉及肌肉组织的变化,包括肌肉生长、纤维转化和代谢调控等不同方面。
3 肠道菌代谢物影响肌肉生长和肌细胞发育进入消化道的营养物质经肠道菌分解和代谢产生的代谢物和次级代谢物,是肠道菌发挥不同生理调控功能的主要作用媒介,如短链脂肪酸(short-chain fatty acids,SCFAs)、多不饱和脂肪酸、次级胆汁酸、生物胺、5-羟色胺、吲哚丙酸等[17-19]。碳水化合物在大肠经微生物发酵后产生大量的乙酸、丙酸、丁酸、戊酸等SCFAs及其盐类化合物。SCFAs既可以作为后肠的能量物质,也可以维持肠道屏障功能和调节肠道动力。此外,SCFAs还可以作为效应分子,经由神经、免疫和循环系统影响大脑、肝脏、肌肉等不同器官的代谢和功能[20-22]。
丁酸钠是丁酸的化合物,可以治疗衰老小鼠的肌肉萎缩,增加小鼠后肢肌肉质量及活性氧和线粒体水平,减少骨骼肌中脂肪含量[23]。具体机制可能是:丁酸钠作为一种组氨酸去乙酰化酶抑制剂,不仅能提高骨骼肌细胞中乙酰化水平,还可抑制肌细胞生成素、肌肉特异性环指蛋白1(muscle specific ring finger protein,MuRF1)和肌萎缩蛋白Fbox-1(Atrogin-1)的表达。它还能降低泛素-蛋白酶体活性,减少神经损伤后的氧化应激,缓解神经压迫导致的肌肉损伤。除此之外,丙酸等其他SCFAs也可通过影响糖代谢参与机体的能量代谢,进而影响肌肉的生长发育。丙酸可作为糖异生的底物激活小鼠肠道的糖异生反应,补饲丙酸能够提高宿主的胰岛素敏感性和葡萄糖耐受量,减轻小鼠的体重[24]。Han等[25]也发现丙酸能够促进C2C12肌细胞的基础葡萄糖摄取。
此外,肠道损伤和微生态失衡会导致肠道内产生大量的炎症或毒性分子,并通过循环系统影响或损害其他组织的机能,例如革兰氏阴性菌的主要菌体成分脂多糖(lipopolysaccharide,LPS)和色氨酸降解物硫酸吲哚等[26-27]。高脂饮食、应激、药物等刺激引起肠道通透性增强,导致LPS等代谢物大量进入血液循环,引起包括肌肉组织在内的多个组织器官炎症反应和胰岛素信号途径的损伤[28-29]。此外,随着宿主动物的衰老,肌肉功能逐渐丧失和肌营养不良也都与肠道微生物群的生态失调以及肠道通透性增加相关——这会促进细菌有害代谢物进入循环系统并引起肌肉组织损伤[30]。有报道指出,肠道菌群依赖性的代谢物三甲胺-N-氧化物(trimethylamine-N-oxide,TMAO)进入血液循环后诱导宿主β-半乳糖苷酶、P53、P21等衰老标志物表达量上调,增加氧化应激反应,加速动物机体和细胞的衰老[31]。通过敲除TMAO产生酶——黄素单加氧酶3(flavin-containing monooxygenase,FMO3)基因,可以显著缓解高脂饮食导致的小鼠体脂增加,增加小鼠的肌肉块重量[32]。
4 肠道菌群影响肌纤维类型转化动物的肌肉由不同类型的肌纤维组成,一般根据其代谢特点可以分为两大类:氧化型纤维(Ⅰ型纤维,慢肌纤维)和酵解型纤维(Ⅱ型纤维,快肌纤维)。慢肌纤维含有更多的线粒体,通过有氧代谢获得能量;快肌纤维则主要通过糖原酵解获得能量。随着外部和内部环境因子(运动、营养、药物等)的变化,肌纤维类型的比例会发生变化,进而导致肌肉的功能和代谢类型的转变。目前的研究证实了肠道菌群的改变会影响肌纤维类型的转变,在Yan等[13]的试验中,肥胖型猪的菌群移植使得无菌小鼠肌肉中肌球蛋白重链7(myosin heavy chain 7,MYH7)基因表达水平升高,肌球蛋白重链4(myosin heavy chain 4,MYH4)基因表达水平降低,导致小鼠慢肌纤维的比例增多而快肌纤维的比例减少。并且补充植物乳杆菌增强小鼠的运动能力也伴随着肌纤维类型的变化——试验组小鼠腓肠肌中Ⅰ型纤维的比例显著增加[15]。这很有可能是因为肠道菌的定植和变化通过各类激素和细胞因子引起肌肉组织对能量的利用效率不同造成的。
一些细菌代谢产物也能够直接影响和调控肌纤维类型的转化。研究表明,补充丁酸盐可以有效促进小鼠骨骼肌中氧化型纤维的生长。饲粮添加丁酸钠上调了腓肠肌中肌球蛋白重链蛋白(myosin heavy chain,MyHC)Ⅰ和MyHCⅡa的基因表达水平,增加了肌肉中慢肌纤维标志因子肌红蛋白和肌钙蛋白的含量。在体外试验中,不同剂量的丁酸钠都能明显上调C2C12肌细胞系中MyHCⅡa的基因表达水平而下调MyHCⅡb的基因表达水平[33]。除此以外,共轭亚油酸、次级胆汁酸等细菌代谢产物也都能影响肌纤维类型的决定和转化[34-37]。
5 益生菌和益生元有益于维持动物的肌肉生长不同微生物对于肌肉的影响效果具有特异性,一些益生菌,如乳酸菌能够增强动物的肌肉生长和功能。检测分析表明恶病质的模型小鼠存在肠道乳酸菌属的缺失,给小鼠口服罗伊氏乳杆菌(Lactobacillus reuteri)100-23和格氏乳杆菌(Lactobacillus gasseri)311476可以降低小鼠体内炎症因子的水平,增加胫骨前肌肉块的大小[38]。但是同样的饲养条件下,补充嗜酸乳杆菌(Lactobacillus acidophilus)NCFM则没有上述效果。除此以外,Varian等[39]对自然衰老的小鼠以及易患恶病质的小鼠补饲罗伊氏乳杆菌ATCC-PTA-6475,发现小鼠的平均肌纤维横截面积增加。副干酪乳杆菌(Lactobacillus paracasei)PS23可以减缓小鼠衰老导致的肌肉质量和力量的丧失,维持肌肉中较高水平的活性氧和线粒体水平[40]。
这些研究反映了益生菌(主要是乳酸菌)与动物的肌肉发育和功能关系密切,也说明增加特定的有益菌或者细菌代谢物不但有利于正常情况下的肌肉生长,对于改善疾病导致的肌肉萎缩和肌肉功能障碍也会有帮助。直接给动物补充接种单一或复合有益菌(如乳酸菌)是动物生产中切实可行的措施,有益于肌肉的生长和功能。
以低聚糖为主的益生元是目前畜牧生产中常用于调理肠道的膳食补充剂,这些物质能够改变肠道环境,促进益生菌的生长,定向改变宿主表型。Cani等[41]采用纤维低聚果糖补饲肥胖小鼠,测序分析表明小鼠盲肠肠段双歧杆菌、乳酸杆菌丰度明显增加;此外,小鼠体内LPS含量以及炎症因子水平降低,胰高血糖素样肽(glucagon-likepeptide,GLP)-1基因表达水平上调,而葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptides,GIPs)基因表达水平降低,最终导致了小鼠肌肉质量显著增加。该研究还发现当益生元与GLP-2拮抗剂共同作用于肥胖小鼠,益生元作用受到抑制[42]。这说明纤维低聚果糖可能通过GLP-2依赖机制调节肠道菌群以及远端器官生长。但是,益生元补饲刺激动物的肌肉发育也具有明显的特异性。如在Bindels等[42]的试验中,添加果胶寡糖和菊粉喂养小鼠,2种益生元虽然都改变了肠道菌群的组成,影响了小鼠的脂肪沉积量和脂肪酸组成,但对宿主腓肠肌和比目鱼肌质量并无促进作用。
6 微生物-肌肉轴的作用途径通过汇总现有的研究,我们可以认为肠道菌群与肌肉组织之间存在紧密的联系和交流——定义为“肠道微生物-肌肉轴(gut microbiota-muscle axis)”。肠道微生物通过影响和调控机体的营养吸收、物质代谢、信号传导、激素和炎症因子分泌等不同方面作用于肌肉生长和代谢的调控:1)肠道微生物的营养全部来自宿主的食物,肠道菌群的增殖和维持对于营养和能量的需求会影响宿主的食欲和采食行为[43-44]。2)肠道菌群维持肠道结构完整和肠道健康,参与并介导了肠道内的营养吸收与代谢(如氨基酸合成等),这是肌肉、骨骼、脂肪等不同组织器官生长和发育的物质基础[45-46]。3)肠道菌代谢产生SCFAs、胆汁酸、5-羟色氨[47]等功能物质,经由神经和循环途径影响大脑和外周组织器官的机能,控制能量的储存与消耗。4)肠道菌还能作用到肝脏、胰腺、脂肪等分泌器官,影响胰岛素、胰高血糖素、瘦素等激素的分泌[19, 48],这些激素是肌肉生长和发育过程中的重要调节因素。5)肠道菌群紊乱和有害菌的入侵会导致炎症因子增加,引起肌肉等器官的病变和功能失调。综上所述,任何影响和改变肠道微生物的因素都会直接或间接地反应到肌肉的生长、发育、代谢和转化。这些也为我们的畜牧生产提供了新的思路——经由干预和改变肠道微生物(益生菌、益生元、菌群移植等)来影响和控制动物的肌肉生长(图 1),提高动物的生产效益。
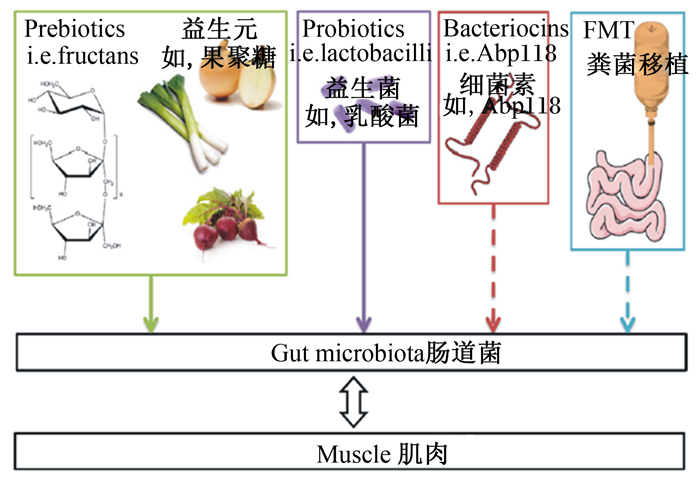
|
图 1 通过靶向肠道微生物的方式来调控肌肉生长 Fig. 1 The way to impact on muscle growth by targeting gut microbiota[20] |
从当前分散的研究中,我们可以逐渐认识到肠道微生物能够通过多层次、多途径影响和干预动物肌肉的生长和功能,但是具体机制还有待深入、系统的探索。未来,我们需要进一步明确肠道菌影响和调控肌肉生长和功能的主要作用途径:靶位点、靶分子和相关的信号传导通路等,特别是发挥主要调控作用的细菌产物(菌体蛋白、细菌素等)。此外,通过分析具有优良产肉性状的动物(品种)的肠道菌群,筛选和寻找优势菌株或者主要功能菌。然后,基于工程菌改造或者菌群移植的方式来改变劣势动物的产肉能力和肉品质,这具有理论的可能性和方法的可行性。
| [1] |
LEY R E, TURNBAUGH P J, KLEIN S, et al. Human gut microbes associated with obesity[J]. Nature, 2006, 444(7122): 1022-1023. DOI:10.1038/4441022a |
| [2] |
XIAO L, ESTELL J, KIILERICH P, et al. A reference gene catalogue of the pig gut microbiome[J]. Nature Microbiology, 2016, 1(12): 16161. DOI:10.1038/nmicrobiol.2016.161 |
| [3] |
杨伟平, 王建刚, 曹斌云. 猪肠道微生物群落组成变化及其影响因素[J]. 中国畜牧杂志, 2017, 53(1): 12-16. |
| [4] |
MULDERS R J, DE GIT K C G, SCHÉLE S L, et al. Microbiota in obesity:interactions with enteroendocrine, immune and central nervous systems[J]. Obesity Reviews, 2018, 19(4): 435-451. DOI:10.1111/obr.12661 |
| [5] |
PERRY R J, PENG L, BARRY N A, et al. Acetate mediates a microbiome-brain-β-cell axis to promote metabolic syndrome[J]. Nature, 2016, 534(7606): 213-217. DOI:10.1038/nature18309 |
| [6] |
STRANDWITZ P, KIM K H, TEREKHOVA D, et al. GABA-modulating bacteria of the human gut microbita[J]. Nature Microbiology, 2019, 4(3): 396-403. DOI:10.1038/s41564-018-0307-3 |
| [7] |
SAMPSON T, DEBELIUS J, THRON T, et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of parkinson's disease[J]. Cell, 2016, 167(6): 1469-1480. DOI:10.1016/j.cell.2016.11.018 |
| [8] |
MARCHESI J R, ADAMS D H, FAVA F, et al. The gut microbiota and host health:a new clinical frontier[J]. Gut, 2016, 65(2): 330-339. DOI:10.1136/gutjnl-2015-309990 |
| [9] |
GROSICKI G J, FIELDING R A, LUSTGARTEN M S. Gut microbiota contribute to age-related changes in skeletal muscle size, composition, and function:biological basis for a gut-muscle axis[J]. Calcified Tissue International, 2018, 102(4): 433-442. DOI:10.1007/s00223-017-0345-5 |
| [10] |
GUO B S, ZHANG Z K, LIANG C, et al. Molecular communication from skeletal muscle to bone:a review for muscle-derived myokines regulating bone metabolism[J]. Calcified Tissue International, 2016, 100(2): 184-192. |
| [11] |
BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [12] |
BÄCKHED F, MANCHESTER J K, SEMENKOVICH C F, et al. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice[J]. Proceeding of National Academy of Sciences of the United States of America, 2007, 104(3): 979-984. DOI:10.1073/pnas.0605374104 |
| [13] |
YAN H L, DIAO H, XIAO Y, et al. Gut microbiota can transfer fiber characteristics and lipid metabolic profiles of skeletal muscle from pigs to germ-free mice[J]. Scientific Reports, 2016, 6: 31786. DOI:10.1038/srep31786 |
| [14] |
LIU R X, HONG J, XU X Q, et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention[J]. Nature Medicine, 2017, 23(7): 859-868. DOI:10.1038/nm.4358 |
| [15] |
CHEN Y M, WEI L, CHIU Y S, et al. Lactobacillus plantarum TWK10 supplementation improves exercise performance and increases muscle mass in mice[J]. Nutrients, 2016, 8(4): 205. DOI:10.3390/nu8040205 |
| [16] |
CHOI Y, KWON Y, KIM D K, et al. Gut microbe-derived extracellular vesicles induce insulin resistance, thereby impairing glucose metabolism in skeletal muscle[J]. Scientific Reports, 2015, 5: 15878. DOI:10.1038/srep15878 |
| [17] |
ZHAO L, HUANG Y F, LU L, et al. Saturated long-chain fatty acid-producing bacteria contribute to enhanced colonic motility in rats[J]. Microbiome, 2018, 6: 107. DOI:10.1186/s40168-018-0492-6 |
| [18] |
DODD D, SPITZER M H, VAN TREUREN W, et al. A gut bacterial pathway metabolizes aromatic amino acids into nine circulating metabolites[J]. Nature, 2017, 551(7682): 648-652. DOI:10.1038/nature24661 |
| [19] |
NICHOLSON J K, HOLMES E, KINROSS J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336(6086): 1262-1267. DOI:10.1126/science.1223813 |
| [20] |
MARIÑO E, RICHARDS J L, MCLEOD K H, et al. Gut microbial metabolites limit the frequency of autoimmune T cells and protect against type 1 diabetes[J]. Nature Immunology, 2017, 18(5): 552-562. DOI:10.1038/ni.3713 |
| [21] |
CANFORA E E, MEEX RC R, VENEMA K, et al. Gut microbial metabolites in obesity, NAFLD and T2DM[J]. Nature Reviews Endocrinology, 2019, 15(5): 261-273. DOI:10.1038/s41574-019-0156-z |
| [22] |
LI Z, YI C X, KATIRAEI S, et al. Butyrate reduces appetite and activates brown adipose tissue via the gut-brain neural circuit[J]. Gut, 2017, 67(7): 1269-1279. |
| [23] |
WALSH M E, BHATTACHARYA A, SATARANATARAJAN K, et al. The histone deacetylase inhibitor butyrate improves metabolism and reduces muscle atrophy during aging[J]. Aging Cell, 2015, 14(6): 957-970. DOI:10.1111/acel.12387 |
| [24] |
费嘉, 罗军涛, 章小英, 等. 短链脂肪酸在肠道菌群调节人体能量代谢中的作用[J]. 中华糖尿病杂志, 2018, 10(5): 370-373. |
| [25] |
HAN J H, KIM I S, JUNG S H, et al. The effects of propionate and valerate on insulin responsiveness for glucose uptake in 3T3-L1 adipocytes and C2C12 myotubes via G protein-coupled receptor 41[J]. PLoS One, 2014, 9(4): e95268. DOI:10.1371/journal.pone.0095268 |
| [26] |
BOULANG C L, NEVES A L, CHILLOUX J, et al. Impact of the gut microbiota on inflammation, obesity, and metabolic disease[J]. Genome Medicine, 2016, 8(1): 42. DOI:10.1186/s13073-016-0303-2 |
| [27] |
Opdebeeck B, MAUDSLEY T, AZMI A, et al. Indoxyl sulfate and p-cresyl sulfate promote vascular calcification and associate with glucose intolerance[J]. Journal of the American Society of Nephrology, 2019, 30(5): 751-766. DOI:10.1681/ASN.2018060609 |
| [28] |
GULHANE M, MURRAY L, LOURIE R, et al. High fat diets induce colonic epithelial cell stress and inflammation that is reversed by IL-22[J]. Scientific Reports, 2016, 6: 28990. DOI:10.1038/srep28990 |
| [29] |
GUO S H, AL-SADI R, SAID H M, et al. Lipopolysaccharide causes an increase in intestinal tight junction permeability in vitro and in vivo by inducing enterocyte membrane expression and localization of TLR-4 and CD14[J]. The American Journal of Pathology, 2013, 182(2): 375-387. DOI:10.1016/j.ajpath.2012.10.014 |
| [30] |
BINDELS L B, DELZENNE N M. Muscle wasting:the gut microbiota as a new therapeutic target?[J]. The International Journal of Biochemistry & Cell Biology, 2013, 45(10): 2186-2190. |
| [31] |
KE Y L, LI D, ZHAO M M, et al. Gut flora-dependent metabolite trimethylamine-N-oxide accelerates endothelial cell senescence and vascular aging through oxidative stress[J]. Free Radical Biology Medicine, 2018, 116: 88-100. DOI:10.1016/j.freeradbiomed.2018.01.007 |
| [32] |
SCHUGAR R C, SHIH D M, WARRIER M, et al. The TMAO-producing enzyme flavin-containing monooxygenase 3 regulates obesity and the beginning of white adipose tissue[J]. Cell Reports, 2017, 19(12): 2451-2461. DOI:10.1016/j.celrep.2017.05.077 |
| [33] |
CHANG S, CHEN X L, HUANG Z Q, et al. Dietary sodium butyrate supplementation promotes oxidative fiber formation in mice[J]. Animal Biotechnology, 2018, 29(3): 212-215. DOI:10.1080/10495398.2017.1358734 |
| [34] |
TRINCHESE G, CAVALIERE G, PENNA E, et al. Milk from cow fed with high forage/concentrate ratio diet:beneficial effect on rat skeletal muscle inflammatory state and oxidative stress through modulation of mitochondrial functions and AMPK activity[J]. Frontiers in Physiology, 2019, 9: 1969. DOI:10.3389/fphys.2018.01969 |
| [35] |
CONTE G, SERRA A, CASAROSA L, et al. Effect of linseed supplementation on total longissimus muscle lipid composition and shelf-life of beef from young maremmana bulls[J]. Frontiers in Veterinary Science, 2019, 5: 326. DOI:10.3389/fvets.2018.00326 |
| [36] |
NIE Y F, JUN H U, YAN X H. Cross-talk between bile acids and intestinal microbiota in host metabolism and health[J]. Journal of Zhejiang University(Science B), 2015, 16(6): 436-446. |
| [37] |
SHIMIZU H, HAGIO M, IWAYA H, et al. Deoxycholic acid is involved in the proliferation and migration of vascular smooth muscle cells[J]. Journal of Nutritional Science and Vitaminology, 2014, 60(6): 450-454. DOI:10.3177/jnsv.60.450 |
| [38] |
BINDELS L B, BECK R, SCHAKMAN O, et al. Restoring specific Lactobacilli levels decreases inflammation and muscle atrophy markers in an acute leukemia mouse model[J]. PLoS One, 2012, 7(6): e37971. DOI:10.1371/journal.pone.0037971 |
| [39] |
VARIAN B J, GOURESHETTI S, POUTAHIDIS T, et al. Beneficial bacteria inhibit cachexia[J]. Oncotarget, 2016, 7(11): 11803-11816. |
| [40] |
CHEN L H, HUANG S Y, HUANG K C, et al. Lactobacillus paracasei PS23 decelerated age-related muscle loss by ensuring mitochondrial function in SAMP8 mice[J]. Aging, 2019, 11(2): 756-770. DOI:10.18632/aging.101782 |
| [41] |
CANI P D, POSSEMIERS S, VAN DE WIELE T, et al. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2-driven improvement of gut permeability[J]. Gut, 2009, 58(8): 1091-1103. DOI:10.1136/gut.2008.165886 |
| [42] |
BINDELS L B, NEYRINCK A M, SALAZAR N, et al. Non digestible oligosaccharides modulate the gut microbiota to control the development of leukemia and associated cachexia in mice[J]. PLoS One, 2015, 10(6): e0131009. DOI:10.1371/journal.pone.0131009 |
| [43] |
SAMPSON T R, MAZMANIAN S K. Control of brain development, function, and behavior by the microbiome[J]. Cell Host & Microbe, 2015, 17(5): 565-576. |
| [44] |
张亚南, 余凯凡, 朱伟云. 肠道微生物调控宿主食欲的研究进展[J]. 微生物学报, 2017, 57(7): 951-960. |
| [45] |
VALDES A M, WALTER J, SEGAL E, et al. Role of the gut microbiota in nutrition and health[J]. BMJ, 2018, 361: k2179. |
| [46] |
YAMASHIRO Y. Gut microbiota in health and disease[J]. Annals of Nutrition & Metabolism, 2017, 71(3/4): 242-246. |
| [47] |
FUKUMOTO S, TATEWAKI M, YAMADA T, et al. Short-chain fatty acids stimulate colonic transit via intraluminal 5-HT release in rats[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2003, 284(5): R1269-R1276. DOI:10.1152/ajpregu.00442.2002 |
| [48] |
PATTERSON E, RYAN P M, CRYAN J F, et al. Gut microbiota, obesity and diabetes[J]. Postgraduate Medical Journal, 2016, 92(1087): 286-300. DOI:10.1136/postgradmedj-2015-133285 |




