2. 湖南省畜禽安全生产协同创新中心, 长沙 410128
2. Hunan Co-Innovation Center of Animal Production Safety, Changsha 410128, China
有大量微生物定植于哺乳动物肠道中,对宿主的营养物质代谢和免疫机能具有深刻的影响[1]。在动物的幼龄阶段,肠道菌群参与宿主免疫系统的激活,并在肠屏障功能的构建过程中发挥重要作用[2]。出生后动物肠道菌群的定植受肠腔内氧环境影响:随着氧气消耗,微生物按照需氧、兼性厌氧和专性厌氧的次序在肠道进行定植,并最终形成从前肠段至后肠段不同类型与组成的微生物区系变化[2]。哺乳动物新生儿肠道定植菌最早以链球菌属(Streptococcus)和葡萄球菌属(Staphylococcus)等兼性厌氧菌占主导地位,此后迅速被双歧杆菌属(Bifidobacterium)、棒状杆菌属(Corynebacterium)、乳酸杆菌属(Lactobacillus)、瘤胃球菌属(Ruminococcus)等厌氧菌替代[3]。出生后的仔猪迅速构建母乳依赖型的肠道菌群,此后随着胃肠道发育带来的肠腔环境改变、饲粮结构逐渐丰富、断奶应激等因素,肠道内特定菌群的定植位点发生转变,微生物多样性逐渐丰富[4]。
尽管肠道菌群的重要性和定植规律不断得到揭示,肠道早期菌群的来源和定植的最早时间仍未确定。传统观点认为分娩前仔猪的肠道处于无菌状态,通过与食物、外界环境、母体产道和粪便的接触开始逐渐有微生物定植,并随着时间不断演化[5]。然而,对人类与啮齿类动物肠道早期定植菌的结构和来源的解析显示,哺乳动物肠道早期定植菌具有很强的母源特征,母体来源的微生物在子代肠道菌群的形成过程中发挥了重要作用[6]。仔猪出生后,必然与母猪的皮肤、粪便、尿液和栖居环境发生接触,来自这些部位的微生物有几率进入仔猪肠道中,但这不在本文讨论之列[5]。当前胎盘微生物组、母体产道微生物组和母乳微生物组为生命科学领域研究的热点,本文就此3个途径的母仔间微生物组的垂直传递及其内生来源进行讨论,旨在为幼龄仔猪肠道菌群的干预提供新的研究思路。
1 母仔间微生物组垂直传递的生理基础垂直传递是指遗传物质以及细菌、病毒等微生物由亲代传播到其子代的现象,哺乳动物广泛存在微生物母子间垂直传递的现象[7]。怀孕后期和哺乳期微生物的迁移现象是发生垂直传递的重要生理基础,其内在机制源于母体免疫功能与激素水平的共同作用。在妊娠阶段,母仔猪间存在以胎盘、脐带、羊水为媒介的物质交换。在分娩的准备阶段,微生物与宿主免疫-内分泌系统的交互作用使母体肠道、产道内的特定菌群及乳腺中所有共生菌群表现出进程性增殖,这为向子代进行有益菌群的垂直传递做好了必要准备[8]。同时,母体各部位之间存在明显的微生物迁移现象,来自各个部位的微生物可能通过内源途径迁移到母猪的产道、乳腺中,血流为微生物的迁移提供天然动力,单核细胞和树突状细胞承担了重要作用[9-10]。现已证实肠道菌群可通过穿越紧密连接蛋白、侵入肠上皮细胞和树突状细胞主动攫取等3种途径突破黏膜屏障[11]。进入血液的细菌通过某种未知的机制实现与免疫系统的共存,并随血流进入乳腺中,其潜在的共生机制可能是母体微生物组通过内源途径迁移的生理基础,这有待进一步研究[12]。此外,在动物生命早期阶段进入肠道的微生物及其DNA印迹可能对宿主免疫系统的构建与成熟起到激活作用,并影响后续微生物的定植,使宿主此后对疾病的发生产生耐受性(或易感性)[13]。有学者认为,在生命的早期阶段可能存在一个短暂的“窗口期”,此阶段动物肠道的免疫细胞可能在对抗原刺激进行免疫应答时优先产生耐受性,使菌群在此后有望定植在肠黏膜上而与宿主构建共生关系,并对肠上皮形态、肠免疫功能和免疫系统的发育等产生持续影响[14]。
2 母仔微生物组垂直传递的主要路径 2.1 胎盘途径 2.1.1 胎盘微生物传统观点认为子宫和动物胚胎处于无菌状态,仔猪在分娩过程及出生后通过与母体、外界环境、饲粮等接触使其肠道菌群逐渐成形。随着研究深入,健康孕体中脐带血、羊水和新生婴儿的胎粪中均发现有微生物存在,证明健康子宫并非无菌环境[15-16]。胎儿肠道菌群的雏形可能在母体子宫中就开始建立,母体与其子代之间在进行传统意义上“血脉”传承的同时,也可能以“胎盘-脐带血”或“胎盘-羊水”为途径进行了“菌脉”传递[17]。
胎盘是妊娠期连接母体和保护宫内胎儿的独特器官,由羊膜、丛密绒毛膜以及底蜕膜等组织构成[18]。胎盘在母体与胎儿间构建了一个可维持妊娠状态的免疫界面,减少胎儿受到母体免疫系统的排斥,同时也是母胎之间营养和代谢废物转运平台,并可产生多种肽类和甾体类激素调控母体和胎儿的相关代谢和发育[19]。传统观点认为胎盘处于无菌状态。Satokari等[20]首次在人类胎盘中鉴定出有乳酸杆菌和双歧杆菌的DNA。此后,Aagaard等[21]在无菌获取的胎盘切片中,使用高通量测序分析出厚壁菌门(Firmicutes)、软皮菌门(Tenericutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)等多类细菌存在,通过形态学观察并记录胎盘不同区域中细菌的存在情况,结果也证实胎盘中寄居了的一群低丰度但新陈代谢丰富的微生物群。以上结果意味着分娩前母体与胎儿间可能存在以胎盘和羊水为媒介的微生物组传递,而进一步研究表明,肠道菌群的定植可能在胚胎胃肠道成形的阶段即已经开始。雷达等[22]应用血液或组织DNA提取试剂盒提取出昆明系孕鼠怀孕12~13 d和怀孕19~20 d的胚胎胃肠道组织和胎盘组织菌群的DNA并进行高通量测序,结果显示三者在门水平上均存在4个优势菌群,分别是变形菌门(95.00%、88.14%、87.26%)、拟杆菌门(1.71%、2.15%、2.63%)、放线菌门(1.16%、4.10%、3.38%)及厚壁菌门(0.75%、2.62%、2.01%),在科水平均有9个优势菌科,其中以肠杆菌科(46.99%、44.34%、41.08%)、希瓦菌科(21.99%、21.10%、19.05%)、莫拉菌科(9.18%、7.09%、5.64%)为主。然而,尽管妊娠过程中母体与子代间的微生物垂直传递现象被不断证实,但胎盘中微生物的存在仍有争议。Lauder等[23]采用近似无菌的方法,未在人类胎盘中分离出细菌的DNA。医学上一般认为胎盘微生物与早产具有较高的相关性,但出生前肠道菌群的确切定植时间及其对胎儿的作用仍需进一步研究[16]。
2.1.2 胎盘微生物的潜在来源在胎盘内发现的特有微生物菌群在分类上兼性厌氧菌和专性厌氧菌并存,对样本中胎盘、口腔和肠道菌群多样性进行相关性分析的结果显示,胎盘微生物组具有与口腔微生物组最为相似的分类特征,但没有直接证据揭示口腔微生物是胎盘微生物的唯一来源及其具体迁移途径[21]。胎盘中被鉴定出数量最多的是来自肠道的非致病性大肠埃希氏菌(Escherichia coli),意味着肠道也可能是胎盘微生物的重要来源[21]。母体肠道与产道微生物迁移被认为是胎盘获得菌群的重要方式。研究人员通过追踪检测孕妇肠道、产道、血液和胎盘微生物变化,发现妊娠期间肠道和产道中微生物移位的频率出现明显升高的趋势,这些微生物可能通过上皮空隙进入到孕妇的血液中,并随着血液循环进入胎盘[24]。然而,由于胎盘微生物的存在仍有争议,活菌穿越胎盘屏障功能的证据也未见报道,胎盘微生物及其来源途径仍有待进一步确定。
2.2 产道途径 2.2.1 产道微生物分娩过程中母体产道的微生物区系也可能是不容忽视的仔猪肠道益生菌群的重要来源。哺乳动物产道内广泛定植的微生物称产道微生物群。在人体上产道微生物已被认为是参与保护宿主免受各种细菌、真菌和病毒感染的重要屏障,健康稳定的产道微生态对顺利妊娠和分娩十分重要,也是顺产儿重要的早期肠道菌群来源[25]。有学者指出剖腹产出生的孩子较顺产儿免疫失调风险增加,具有更高的哮喘、过敏性反应、炎性肠病等慢性病发病率[26]。Liu等[27]对比出生2~4 d内剖腹产新生儿与顺产新生儿的粪便微生物检测结果,发现二者肠道菌群结构存在差异,该阶段剖腹产新生儿肠道菌群以葡萄球菌属、梭状芽孢杆菌属(Clostridium)、肠杆菌属(Enterobacter)、链球菌属4个属最为常见,而顺产新生儿肠道菌群则以大肠埃希氏菌、拟杆菌属(Bacteroides)、长双歧杆菌(Bifidobacterium longum)为优势菌群。这意味着分娩方式对新生儿早期定植的肠道菌群结构具有显著影响,并影响到后续的身体健康。研究表明,健康女性产道中栖居着包括嗜酸乳杆菌(Lactobacillus acidophilus)、植物乳杆菌(Lactobacillus plantarum)在内的高丰度乳酸菌,这些乳酸菌能够利用产道上皮中的糖原产生乳酸、乙酸等有机酸,使得产道内局部环境pH保持在3.8~4.4,同时还能够产生过氧化氢等抑菌物质,再加上竞争性占位等作用共同拮抗病原微生物的生长繁殖,保证了产道菌群的健康与稳定[28]。进一步的研究发现妊娠早、中、晚期产道中乳酸菌多样性和丰度无显著差异,但在分娩前短期内乳酸杆菌的数量会迅速增加,这可能是为后续分娩过程中子代肠道对母体有益菌群的获取作必要的准备[29]。然而,大多数情况下母体产道微生物对子代健康状况的影响可能并不显著。Sakwinska等[30]对比了不同分娩方式与喂养模式婴儿的粪便与其母亲的产道菌群,结果显示大多数婴儿的肠道菌群与其母亲产道菌群的相似程度十分有限,这意味着只有极少数的产道菌群获得了在子代肠道内的有效定植。
2.2.2 产道微生物的潜在来源动物的产道并非封闭性的无氧环境,但产道微生物在结构上是好氧菌、兼性厌氧菌、专性厌氧菌并存。前两者对氧气的消耗使产道内氧环境处于微妙的平衡,可保证专性厌氧菌的正常存活,却无法解释产道中专性厌氧菌的来源[25]。一般认为需氧菌和兼性厌氧菌可由外源途径获取,但由于专性厌氧菌无法长时间暴露于有氧环境中,其来源引发了研究者们对于产道微生物内源获取的思考。对假丝酵母菌患者产道病原菌与肠道样品的分析结果显示,肠道携带的病原菌与妇女产道病原菌感染存在一定的联系,产道感染的病原菌与肠道同类型菌株的基因组相似度极高[31]。Freitas等[32]将人类的产道和肠道中双歧杆菌的全基因组进行对比,结果显示二者基本不存在差异。以上研究意味着肠道菌群很可能是产道微生物的内生来源,且来自肠道的有益菌和病原菌均有几率迁移到产道中。当前对母猪产道微生物及其对仔猪健康状况的影响还未见报道,有待进一步确认。
2.3 母乳途径 2.3.1 母乳微生物大量的研究证明健康的哺乳动物母乳中含有较低浓度的微生物,约1×103 CFU/mL,其中包括葡萄球菌属、链球菌属、肠球菌属、乳杆菌属和双歧杆菌属等共生菌,这些微生物随乳汁进入子代胃肠道进行定植,成为子代肠道早期定植菌的持续来源。对人乳微生物组进行高通量测序的结果表明,乳中微生物多样性超过传统观点的假设,且其多样性随着泌乳天数的增加逐渐变化。在门水平上,人乳第1周时以变形菌门(41%)、厚壁菌门(35%)和拟杆菌门(17%)为主,占93%以上,第3周时人乳中的厚壁菌门显示出最高的相对丰度(50%),人乳中属水平上种类始终超过200种[33]。多项研究表明,乳中始终存在以链球菌属与葡萄球菌属占主导地位的“核心”微生物群,且不受地理位置、母体状态与分析方法的影响,但母体的健康状况、胎次、分娩方式、膳食、遗传背景以及地理位置等因素均可影响或潜在影响乳中微生物多样性[34-35]。目前已证实在人类、啮齿动物、猪的乳房中,微生物的共生情况客观存在,微生物在乳房皮肤、乳导管、乳小叶和脂肪组织中均有分布[36]。Kemper等[37]最早于母猪的乳房组织中鉴定出细菌的存在,并确认母猪前后乳房中菌群结构差异明显,受产后泌乳障碍综合征的影响则不显著。对母猪初乳和新生仔猪肠道中乳酸菌的分离鉴定结果表明,二者具有极大程度的同源性,这意味着来自母乳的益生菌可有效地在新生仔猪肠道中进行定植[38]。Chen等[39]对选自20头母猪8个不同时间点的160份乳样进行16S rRNA高通量测序,分析结果表明猪乳中微生物随泌乳天数变化,但在组成和结构上保持总体稳定,猪乳中微生物的组成和多样性在初乳中变异性显著,而过渡乳和成熟乳中则较为稳定,厚壁菌门和变形菌门始终在猪乳中占主导地位。在属水平上,猪初乳中棒状杆菌属(Corynebacterium)和链球菌属显著高于过渡乳和成熟乳,而乳酸杆菌属、瘤胃球菌科(Ruminococcaceae)和毛螺旋菌科(Lachnospiraceae)的2种未知属以及1种未命名的梭菌目(Clostridiales)细菌作为优势菌属则在过渡乳和成熟乳中表现出较高的相对丰度。
2.3.2 母乳微生物的潜在来源母乳微生物的来源一直具有争议,传统假设认为母乳中本无菌,哺乳过程中受到皮肤与子代口腔微生物的“污染”而使乳汁中带有微生物,而新的研究证据则愈发证实微生物本身即为母乳的固有成分。早期研究证实,新生儿吮吸时有部分乳汁逆向流回乳房导管,乳房与子代间存在微生物交换,从子代口腔中回流到乳腺中的微生物可以在乳房导管等部位定植,再随母乳进入子代肠道[40]。同时,母乳微生物的多样性不同于任何体表区域的微生物区系,且受到分娩方式的影响,这意味着来自产道的微生物也可能通过子代口腔间接进入到母乳中[41]。以上研究可确认母乳微生物具有外源性,而微生物在乳房组织中的健康共存使其有望成为母乳的固有成分[42]。人体医学上,乳腺菌群和肠道菌群的结构与乳腺癌的发病率均具有相关性,提示肠道菌群与乳腺微生物间存在密切关联[43]。对母体粪便、母乳与婴儿粪便中双歧杆菌属、拟杆菌属、狄氏副拟杆菌属(Parabacteroides)和多种梭菌属(Clostridia)等厌氧菌的DNA图谱进行对比的结果表明,三者间具有高度同源性,进一步表明肠道菌群是母乳微生物的内在来源[44]。母乳、产妇粪便、婴儿粪便和母亲外周血单核细胞中发现的细菌DNA印迹显示出高度的同源性,这意味着肠道菌群可能通过血液途径被转移到哺乳期的乳腺中,并随母乳进入子代肠道[45]。
3 以母猪肠道菌群为靶点的仔猪肠道菌群调控基于普遍存在于哺乳动物的微生物迁移理论,母猪身体各部位的微生物组均有几率传递给仔猪[46]。但以上文中胎盘、产道和母乳微生物的潜在来源看,加之断奶前母猪粪便给仔猪肠道菌群带来的可能影响,母猪肠道菌群可从多种途径进入仔猪肠道,并在多个时间段持续对仔猪肠道菌群具有塑造能力,可被视为哺乳仔猪肠道菌群的最重要来源。仔猪肠道菌群的母源传递途径如图 1所示。已有权威报道指出,在分娩结束后的4个月内,人类母亲的皮肤、口腔、肠道、产道等多个部位的微生物组参与对子代肠道菌群的塑造,随着哺乳的持续进行,母体肠道菌群对子代肠道菌群的作用逐渐增大,而其他微生物组的作用则持续衰减[47]。因此,以母猪肠道菌群为靶点对哺乳仔猪肠道菌群结构进行营养性干预,值得引起研究者的注意。
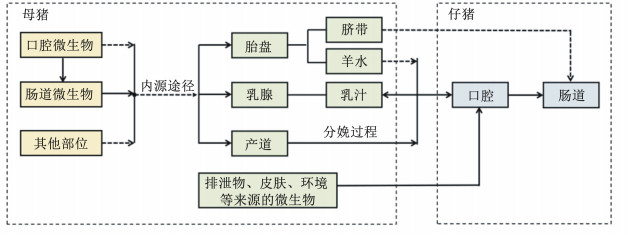
|
图 1 仔猪肠道菌群的母源传递简图 Fig. 1 A brief diagram of maternal transmission of intestinal microflora in piglets |
传统营养学研究中,对仔猪肠道菌群的调节倾向使用包括益生元、益生菌、酸化剂、抗生素、中草药制剂等可对菌群直接产生影响的饲料添加剂,此方法多应用于断奶仔猪,而在以母乳为主要食物来源的哺乳仔猪中研究相对较少[48]。基于母体肠道菌群对子代肠道早期定植菌产生塑造作用的假设,可成为幼龄仔猪肠道菌群调控的一种新思路。人类医学研究发现,母亲在妊娠末期服用抗生素可使婴儿肠道菌群多样性下降,这可能是抗生素在肠道、产道等多个部位抑制了相关菌群的增殖,进而使母子间菌群的垂直传递效应减弱[49]。另一研究发现,围产期女性补充膳食益生菌产品后,尽管并未在乳汁中发现同株益生菌的存在,子代的肠道功能因乳汁中白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、转化生长因子-β1(TGF-β1)等细胞因子水平显著变化而得到增强,但母乳菌群和肠道菌群结构是否变化未进行检测[50-51]。益生元类物质在母猪上的应用则直接体现出对哺乳仔猪肠道菌群结构的改善。Paβlack等[52]在母猪妊娠后期至哺乳期饲粮中额外添加菊粉,显著影响了哺乳仔猪的肠道菌群多样性。Cheng等[53]在母猪妊娠后期饲粮中添加瓜尔胶(一种可溶性膳食纤维),使哺乳期仔猪生长速度提高、腹泻率下降,仔猪粪便中乳酸杆菌的相对丰度显著增加。通过母猪肠道菌群有望实现对哺乳仔猪肠道菌群的有效干预,但此过程是否涉及胎盘、产道和母乳中微生物多样性的改变则未见报道,这有待进一步研究。
4 小结综上所述,母体微生物组可能通过胎盘、产道和乳汁等途径进入仔猪肠道中定植,使子代肠道菌群具有强烈的母源性。同时,子代肠道的母源菌群则具有强烈的母体肠源性特征,这使基于母体肠道菌群的营养性措施也可对仔猪肠道菌群结构产生影响。然而,在家畜生产领域微生物组垂直传递的报道仍然相对较少,母仔猪间微生物组的垂直传递及相关的营养性干预和涉及的菌群结构变化值得引起研究者的关注,相关研究的深入将为我国养猪业的发展提供理论指导。
| [1] |
段云峰, 金锋. 肠道微生物与皮肤疾病——肠-脑-皮轴研究进展[J]. 科学通报, 2017, 62(5): 360-371. |
| [2] |
VACCA I. Microbiota:clostridia protect from gut infections in early life[J]. Nature Reviews Microbiology, 2017, 15(6): 321. |
| [3] |
JIMÉNEZ E, MARÍN M L, MARTÍN R, et al. Is meconium from healthy newborns actually sterile?[J]. Research in Microbiology, 2008, 159(3): 187-193. DOI:10.1016/j.resmic.2007.12.007 |
| [4] |
夏耀耀, 任文凯, 黄瑞林, 等. 仔猪肠道微生物研究进展[J]. 中国实验动物学报, 2017, 25(6): 681-688. DOI:10.3969/j.issn.1005-4847.2017.06.018 |
| [5] |
COLLINS S M, BERCIK P. The relationship between intestinal microbiota and the central nervous system in normal gastrointestinal function and disease[J]. Gastroenterology, 2009, 136(6): 2003-2014. DOI:10.1053/j.gastro.2009.01.075 |
| [6] |
MCGUIRE M K, MCGUIRE M A. Got bacteria?The astounding, yet not-so-surprising, microbiome of human milk[J]. Current Opinion in Biotechnology, 2017, 44: 63-68. DOI:10.1016/j.copbio.2016.11.013 |
| [7] |
FINE P E. Vectors and vertical transmission:an epidemiologic perspective[J]. Annals of the New York Academy of Sciences, 1975, 266(1): 173-194. |
| [8] |
MACINTYRE D A, CHANDIRAMANI M, LEE Y S, et al. The vaginal microbiome during pregnancy and the postpartum period in a European population[J]. Scientific Reports, 2015, 5: 8988. DOI:10.1038/srep08988 |
| [9] |
MYSOREKAR I U, CAO B. Microbiome in parturition and preterm birth[J]. Seminars in Reproductive Medicine, 2014, 32(1): 50-55. DOI:10.1055/s-0033-1361830 |
| [10] |
KARLSSON H, LARSSON P, WOLD A E, et al. Pattern of cytokine responses to gram-positive and gram-negative commensal bacteria is profoundly changed when monocytes differentiate into dendritic cells[J]. Infection and immunity, 2004, 72(5): 2671-2678. DOI:10.1128/IAI.72.5.2671-2678.2004 |
| [11] |
FERNÁNDEZ L, LANGA S, MARTÍN V, et al. The human milk microbiota:origin and potential roles in health and disease[J]. Pharmacological Research, 2013, 69(1): 1-10. DOI:10.1016/j.phrs.2012.09.001 |
| [12] |
GAO J, LI L, HO P L, et al. Combining fluorescent probes and biofunctional magnetic nanoparticles for rapid detection of bacteria in human blood[J]. Advanced Materials, 2006, 18(23): 3145-3148. DOI:10.1002/adma.200601058 |
| [13] |
MILANI C, DURANTI S, BOTTACINI F, et al. The first microbial colonizers of the human gut:composition, activities, and health implications of the infant gut microbiota[J]. Microbiology and Molecular Biology Reviews, 2017, 81(4): e00036-17. |
| [14] |
王文娟, 孙冬岩, 孙笑非. 生命早期肠道菌群的定殖对免疫系统的影响[J]. 饲料研究, 2017(1): 24-27. |
| [15] |
DIGIULIO D B. Diversity of microbes in amniotic fluid[J]. Seminars in Fetal and Neonatal Medicine, 2012, 17(1): 2-11. DOI:10.1016/j.siny.2011.10.001 |
| [16] |
MSHVILDADZE M, NEU J, SHUSTER J, et al. Intestinal microbial ecology in premature infants assessed with non-culture-based techniques[J]. The Journal of Pediatrics, 2010, 156(1): 20-25. DOI:10.1016/j.jpeds.2009.06.063 |
| [17] |
王彦卓, 秦金红. 胎盘微生物菌群的发现与研究进展[J]. 中国微生态学杂志, 2015, 27(3): 368-372. |
| [18] |
韩小红, 樊江峰, 于艺腾, 等. 妊娠期和分娩前后牦牛胎盘组织形态学变化及细胞凋亡的研究[J]. 农业生物技术学报, 2018, 26(10): 1714-1722. |
| [19] |
FICHOROVA R N, ONDERDONK A B, YAMAMOTO H, et al. Maternal microbe-specific modulation of inflammatory response in extremely low-gestational-age newborns[J]. mBio, 2011, 2(1): e00280-10. |
| [20] |
SATOKARI R, GRÖNROOS T, LAITINEN K, et al. Bifidobacterium and Lactobacillus DNA in the human placenta[J]. Letters in Applied Microbiology, 2009, 48(1): 8-12. DOI:10.1111/j.1472-765X.2008.02475.x |
| [21] |
AAGAARD K, MA J, ANTONY K M, et al. The placenta harbors a unique microbiome[J]. Science Translational Medicine, 2014, 6(237): 237ra65. DOI:10.1126/scitranslmed.3008599 |
| [22] |
雷达, 林燕, 江逊, 等. 小鼠胚胎胃肠道和胎盘组织的菌群构成研究[J]. 中华儿科杂志, 2017, 55(3): 200-204. DOI:10.3760/cma.j.issn.0578-1310.2017.03.007 |
| [23] |
LAUDER A P, ROCHE A M, SHERRILL-MIX S, et al. Comparison of placenta samples with contamination controls does not provide evidence for a distinct placenta microbiota[J]. Microbiome, 2016, 4: 29. DOI:10.1186/s40168-016-0172-3 |
| [24] |
BLASER M J, DOMINGUEZ-BELLO M G. The human microbiome before birth[J]. Cell Host & Microbe, 2016, 20(5): 558-560. |
| [25] |
李晴, 汪艳珠, 刘宸妤, 等. 高通量测序时代的阴道微生物菌群的组成与维护[J]. 国际检验医学杂志, 2017, 38(18): 2584-2588. DOI:10.3969/j.issn.1673-4130.2017.18.030 |
| [26] |
SEVELSTED A, STOKHOLM J, B∅NNELYKKE K, et al. Cesarean section and chronic immune disorders[J]. Obstetrical & Gynecological Survey, 2015, 70(5): 303-305. |
| [27] |
LIU D, YU J L, LI L Q, et al. Bacterial community structure associated with elective cesarean section versus vaginal delivery in Chinese newborns[J]. Journal of Pediatric Gastroenterology and Nutrition, 2015, 60(2): 240-246. DOI:10.1097/MPG.0000000000000606 |
| [28] |
AAGAARD K, RIEHLE K, MA J, et al. A Metagenomic approach to characterization of the vaginal microbiome signature in pregnancy[J]. PLoS One, 2012, 7(6): e36466. DOI:10.1371/journal.pone.0036466 |
| [29] |
ROMERO R, HASSAN S S, GAJER P, et al. The vaginal microbiota of pregnant women who subsequently have spontaneous preterm labor and delivery and those with a normal delivery at term[J]. Microbiome, 2014, 2: 18. DOI:10.1186/2049-2618-2-18 |
| [30] |
SAKWINSKA O, FOATA F, BERGER B, et al. Does the maternal vaginal microbiota play a role in seeding the microbiota of neonatal gut and nose?[J]. Beneficial Microbes, 2017, 8(5): 763-778. DOI:10.3920/BM2017.0064 |
| [31] |
林晓丽, 李真, 左绪磊. 外阴阴道假丝酵母菌病患者肠道假丝酵母菌携带与阴道假丝酵母菌感染之间的关系[J]. 中华妇产科杂志, 2011, 46(7): 496-500. DOI:10.3760/cma.j.issn.0529-567x.2011.07.004 |
| [32] |
FREITAS A C, HILL J E, GERLACH R G. Bifidobacteria isolated from vaginal and gut microbiomes are indistinguishable by comparative genomics[J]. PLoS One, 2018, 13(4): e0196290. DOI:10.1371/journal.pone.0196290 |
| [33] |
MURPHY K, CURLEY D, O'CALLAGHAN T F, et al. The composition of human milk and infant faecal microbiota over the first three months of life:a pilot study[J]. Scientific Reports, 2017, 7: 40597. DOI:10.1038/srep40597 |
| [34] |
FITZSTEVENS J L, SMITH K C, HAGADORN J I, et al. Systematic review of the human milk microbiota[J]. Nutrition in Clinical Practice, 2017, 32(3): 354-364. DOI:10.1177/0884533616670150 |
| [35] |
GOMEZ-GALLEGO C, GARCIA-MANTRANA I, SALMINEN S, et al. The human milk microbiome and factors influencing its composition and activity[J]. Seminars in Fetal and Neonatal Medicine, 2016, 21(6): 400-405. DOI:10.1016/j.siny.2016.05.003 |
| [36] |
URBANIAK C, BURTON J P, REID G. Breast, milk and microbes:a complex relationship that does not end with lactation[J]. Women's Health, 2012, 8(4): 385-398. DOI:10.2217/WHE.12.23 |
| [37] |
KEMPER N, GERJETS I. Bacteria in milk from anterior and posterior mammary glands in sows affected and unaffected by postpartum dysgalactia syndrome (PPDS)[J]. Acta Veterinaria Scandinavica, 2009, 51: 26. DOI:10.1186/1751-0147-51-26 |
| [38] |
GONZÁLEZ V, BARRIOS V, GARCÍA DÍEZ M, et al.Isolation and characterization of lactic acid bacteria from colostrum of sows and intestine of new born piglets.Preliminary evaluation of their potential as probiotics[C]//Proceedings of the 14th Jordanas Sobre Produccion Animal, Zaragoza, Espana, De Mayo De.AIDA, 2011: 848-850.
|
| [39] |
CHEN W, MI J D, LV N, et al. Lactation stage-dependency of the sow milk microbiota[J]. Frontiers in Microbiology, 2018, 9: 945. DOI:10.3389/fmicb.2018.00945 |
| [40] |
MARTÍN V, MALDONADO-BARRAGÁN A, MOLES L, et al. Sharing of bacterial strains between breast milk and infant feces[J]. Journal of Human Lactation, 2012, 28(1): 36-44. DOI:10.1177/0890334411424729 |
| [41] |
CABRERA-RUBIO R, COLLADO M C, LAITINEN K, et al. The human milk microbiome changes over lactation and is shaped by maternal weight and mode of delivery[J]. The American Journal of Clinical Nutrition, 2012, 96(3): 544-551. DOI:10.3945/ajcn.112.037382 |
| [42] |
URBANIAK C, CUMMINS J, BRACKSTONE M, et al. Microbiota of human breast tissue[J]. Applied and Environmental Microbiology, 2014, 80(10): 3007-3014. DOI:10.1128/AEM.00242-14 |
| [43] |
PAULSEN J A, PTACEK T S, CARTER S J, et al. Gut microbiota composition associated with alterations in cardiorespiratory fitness and psychosocial outcomes among breast cancer survivors[J]. Supportive Care in Cancer, 2017, 25(5): 1563-1570. DOI:10.1007/s00520-016-3568-5 |
| [44] |
JOST T, LACROIX C, BRAEGGER C P, et al. Vertical mother-neonate transfer of maternal gut bacteria via breastfeeding[J]. Environmental Microbiology, 2014, 16(9): 2891-2904. DOI:10.1111/1462-2920.12238 |
| [45] |
RODRÍGUEZ J M. The origin of human milk bacteria:is there a bacterial entero-mammary pathway during late pregnancy and lactation[J]. Advances in Nutrition, 2014, 5(6): 779-784. DOI:10.3945/an.114.007229 |
| [46] |
MOELLER A H, CARO-QUINTERO A, MJUNGU D. Cospeciation of gut microbiota with hominids[J]. Science, 2016, 353(6297): 380-382. DOI:10.1126/science.aaf3951 |
| [47] |
FERRETTI P, PASOLLI E, TETT A, et al. Mother-to-infant microbial transmission from different body sites shapes the developing infant gut microbiome[J]. Cell Host & Microbe, 2018, 24(1): 133-145.e5. |
| [48] |
侯冠彧, 周汉林, 荀文娟, 等. 几种常用饲料添加剂对断奶仔猪肠道菌群调控的研究进展[J]. 中国畜牧兽医, 2016, 43(11): 2939-2944. |
| [49] |
YASSOUR M, VATANEN T, SILJANDER H, et al. Natural history of the infant gut microbiome and impact of antibiotic treatment on bacterial strain diversity and stability[J]. Science Translational Medicine, 2016, 8(343): 343ra81. DOI:10.1126/scitranslmed.aad0917 |
| [50] |
MASTROMARINO P, CAPOBIANCO D, MICCHELI A, et al. Administration of a multistrain probiotic product (VSL#3) to women in the perinatal period differentially affects breast milk beneficial microbiota in relation to mode of delivery[J]. Pharmacological Research, 2015, 95-96: 63-70. DOI:10.1016/j.phrs.2015.03.013 |
| [51] |
BALDASSARRE M E, DI MAURO A, MASTROMARINO P, et al. Administration of a multi-strain probiotic product to women in the perinatal period differentially affects the breast milk cytokine profile and may have beneficial effects on neonatal gastrointestinal functional symptoms.A randomized clinical tria[J]. Nutrients, 2016, 8(11): 677. DOI:10.3390/nu8110677 |
| [52] |
PAβLACK N, VAHJEN W, ZENTEK J. Dietary inulin affects the intestinal microbiota in sows and their suckling piglets[J]. BMC Veterinary Research, 2015, 11: 51. DOI:10.1186/s12917-015-0351-7 |
| [53] |
CHENG C S, WEI H K, XU C H, et al. Maternal soluble fiber diet during pregnancy changes the intestinal microbiota, improves growth performance, and reduces intestinal permeability in piglets[J]. Applied and Environmental Microbiology, 2018, 84(17): e01047-18. |




