2. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009
2. Jiangsu Co-Innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
1957年,硒(selenium)首次被证实是生命体内的一种基本元素,同年,谷胱甘肽过氧化物酶(GPx)也被发现和报道。然而,直到1973年,研究人员才发现硒与GPx具有重要的联系[1]。硒是GPx的组成成分,GPx的每1个亚基都含有1个硒元素。随着GPx的抗氧化作用被发现,硒元素在生命体中的作用也逐渐被重视起来。
动物体内硒的水平与免疫系统的功能密切相关。研究表明,饲粮中添加硒制剂能有效提升机体硒蛋白水平,从而提升免疫系统的机能:通过补充1~3 mg/kg的酵母硒能增加鱼类体内硒酶的活性,显著提高免疫球蛋白水平、呼吸爆发活性等先天免疫指标[2];用富硒苜蓿饲喂妊娠奶牛能提高犊牛血清中免疫球蛋白G(IgG)水平[3]。在免疫系统中,硒的抗氧化功能对维持免疫细胞正常形态以及活性氧(ROS)的清除都有极为重要的影响。同时,许多文献均表明补硒能显著提高动物的生产性能[4-5]。
1 硒蛋白硒蛋白主要是指含有硒代半胱氨酸(Sec)的蛋白,动物体内的Sec与其他已知的20种氨基酸一样,是经过严格的UGA密码子介导的翻译产物,因此被称为第21种氨基酸。但是,在动物体中,UGA通常作为终止密码子存在,因此需要一种硒代半胱氨酸插入序列(SECIS)与UGA共同引导编码。该过程由丝氨酸(Ser)与Sec特异性tRNA:tRNASec结合启动,Ser-tRNASec的丝氨酸残基被酶促磷酸化,并与硒供体单磷酸硒(Se~P)生成Sec-tRNASec。Sec-tRNASec在硒代半胱氨酸延伸因子(EFSec)的介导下向核糖体传递。SECIS结合蛋白2(SBP2)连接SECIS与核糖体并促进这一传递过程,SBP2与EFSec、SECIS共同构成SECIS复合体(图 1)[6]。硒蛋白存在于生命的所有3种形式(细菌、真核生物、古细菌),但仍有部分细菌和古细菌中未检测到硒蛋白[7]。目前在哺乳动物中已被发现的硒蛋白有数十种,包括GPx、硫氧还蛋白还原酶(TrxR)、脱碘酶(DIO)、硒蛋白P(SeP)、硒蛋白W、硒蛋白K、MsrB1等,但多数硒蛋白的功能目前仍不明确。
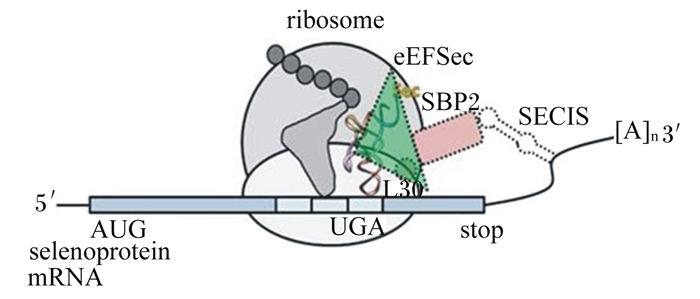
|
ribosome;核糖体;eEFSec:真核细胞硒代半胱氨酸延伸因子selenocysteine elongation factor in eukarya;SECIS:硒代半胱氨酸插入序列selenocysteine insertion sequence;SBP2:SECIS结合蛋白2 SECIS binding protein 2;AUG:起始密码子;UGA:与Sec连接的UGA密码子;selenoprotein:硒蛋白;L30:核糖体蛋白ribosomal protein。 图 1 真核细胞内SECIS复合体结构图 Fig. 1 Structure chart of SECIS complex in eukaryotic cells |
GPx是一类具有过氧化物酶活性的酶类总称,能将代谢过程中产生的过氧化物还原为羟基化合物并催化还原型谷胱甘肽(GSH)转化为氧化型谷胱甘肽(GSSH)。哺乳动物GPx含有8种同工酶,其中大部分为含硒酶。GPx1和GPx4广泛分布于各个组织中,GPx1在多种组织中均有表达,调节着细胞的氧化还原反应,GPx1(-/-)小鼠的组织表现出氧化产物增加,内皮型一氧化氮合酶功能障碍[8];而GPx4是目前研究最多的GPx,GPx4尽管水平较低,但在维持脂质膜结构稳定中至关重要。GPx4也是目前唯一确定的对胚胎发育和细胞存活至关重要的亚型,GPx4基因缺陷小鼠在胚胎早期死亡[9],这与Trsp(一种控制Sec插入蛋白质的基因)基因敲除小鼠几乎处于同一发育阶段,而敲除GPx2或GPx3的小鼠在发育过程中均表现正常[10-11]。此外,GPx4与铁死亡(ferroptosis)也有着密不可分的关系。铁死亡是近年被发现的一种铁依赖形式的细胞程序性死亡,其在形态学、遗传学以及生物化学方面不同于细胞坏死。该过程是由于GPx4失活,造成脂膜上活性氧的累积,进而引发铁死亡[12]。最近,Ingold等[13]在对Sec向Cys靶向突变GPx4cys/cys细胞的研究中发现,由过氧化物引起的细胞死亡仅能被铁死亡抑制剂阻断,不能通过其他细胞死亡如凋亡的抑制剂所抑制,表明了GPx4在铁死亡中的重要作用,同时该团队还证明除细胞铁死亡外,Sec位点的突变并不影响细胞正常的生长增殖,因为GPx4的功能可以被其他氧化还原酶取代。
1.2 TrxR硫氧还蛋白(Trx)是广泛存在于动物体内的一类氧化还原蛋白,TrxR是具有还原酶活性的硒蛋白,TrxR通过还原靶蛋白中的二硫键,将氧化型硫氧还蛋白转化为还原型硫氧还蛋白,是已知的唯一能再生还原型硫氧还蛋白的酶类。TrxR在哺乳动物中包括3个亚型:TrxR1(胞浆型)、TrxR2(线粒体型)和TrxR3(睾丸型),3种TrxR具有3个共同的结构域,即NADPH结合域、FAD结合域和二聚体结合域。此外,TrxR3还具有1个谷氧还蛋白结合域,使之能结合GSH[14]。TrxR影响多种疾病的发生与发展,并且近年来其作为癌症的抗癌药物靶点,引起广泛的关注[14-16]。此外Trx还是体内多种淋巴细胞的促生长因子,与多种细胞因子存在协同作用[17-18]。
Trx系统和GSH系统是体内2个独立的氧化还原系统,但两者在体内的作用联系紧密。研究表明,当TrxR活性不足时,生理浓度的GSH和GPx能降低Trx1的水平;此外,在酵母菌中Trx1和Trx2过表达分别提高GSH水平和降低GSSG水平,而Trx1、Trx2的缺失导致了GSSG在细胞中聚积[19]。
1.3 DIODIO是一种硒依赖性酶,包括碘代酪氨酸脱碘酶和碘代甲状腺氨酸脱碘酶2种。前者涉及到甲状腺激素分解代谢中碘的重利用,该过程依赖于原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)作为供氢体;后者能激活甲状腺素(T4)脱碘转化为更高活性的三碘甲状腺原氨酸(T3)[20],已有的研究表明,硒缺乏导致鸡体内T4脱碘过程受到阻碍,血液中T4大量累积而T3含量降低[21]。
1.4 SePSeP含有多个Sec残基,这意味着SeP在血液运输Sec中起重要作用。SeP将肝脏产生的Sec通过血浆运往全身各处,尤其是对脑和睾丸的硒供给[22]。也有研究表明,SeP是甲基汞中毒大鼠血液中汞的转运蛋白,因此,SeP可能还参与体内重金属的重分布,来减少其对肝脑等重要器官的损伤[23]。
1.5 其他硒蛋白生物体中大部分硒蛋白都表现出抗氧化功能,它们分布在生物功能的各个领域发挥着重要作用,包括细胞凋亡的调节、异常折叠的蛋白质及内质网的降解、生物膜的融合和蛋白质折叠等[24],但仍有一半硒蛋白的生物学功能未知,目前已发现的大多数都是依托氧化还原功能来实现的[25-27]。同时,体内大部分硒蛋白的水平与饮食摄入的硒含量呈正相关[28]。
2 硒蛋白与免疫硒蛋白在体内的代谢与机体免疫关系密切,0.25~0.50 mg/kg的亚硒酸钠能有效提升坏死性肠炎肉鸡的抗体水平[29]。此外,Sun等[30]发现,在脂多糖(LPS)诱导的猪炎症模型中,GPx活性表现出显著降低,硒代谢出现紊乱,证明机体免疫状态会对硒代谢产生影响。
2.1 硒与非特异性免疫 2.1.1 硒对吞噬细胞功能的影响吞噬细胞泛指生物体内以吞噬功能为主的细胞,包括单核-巨噬细胞和中性粒细胞,它们依赖于氧化还原的机制清除病原微生物。被病原激活的吞噬细胞能在短时间内释放大量ROS,辅助其杀伤被吞噬的病原微生物。完成杀伤后,多余的过氧化物通过GPx还原,因此,GPx的缺失会反馈性抑制过氧化物的再生成,导致呼吸爆发减弱。1项对成年猪的体内研究表明,饮食中添加0.36 mg/kg的酵母硒上调了粒细胞中多种与免疫相关的基因表达,包括主要组织相容性复合体I(MHC-Ⅰ)、整合素β1等[31]。Zhao等[32]观察到硒蛋白K基因缺失的小鼠表现出比正常小鼠更低的呼吸爆发水平,并且其在西尼罗河病毒感染后,存活率显著降低,表明硒蛋白K在病毒免疫中的重要作用。硒还影响动物体内巨噬细胞的杀菌活性。研究表明,0.6 mg/kg的亚硒酸钠不仅能增加巨噬细胞的活化和吞噬作用,并且能显著抑制金黄色葡萄球菌的增殖[33]。
2.1.2 硒对自然杀伤(NK)细胞和红细胞免疫影响Liao等[34]在硒缺陷小鼠的脾脏中观察到红髓巨噬细胞减少以及红细胞缺陷,由于硒蛋白的缺失,机体氧化应激引起红细胞溶血[35]。与之相似,在低硒饲养的雏鸡中观察到红细胞脆性增加,免疫功能障碍[36]。研究指出,饲粮中添加富硒益生菌能有效提高山羊红细胞数量[37],补充0.5 mg/kg的亚硒酸钠能显著缓解由甲巯咪唑引起的孕鼠贫血[38],同时硒蛋白活性在维持红细胞氧化稳态和预防溶血性贫血中也发挥重要作用[39]。
在一项对北美洲300多名成年男子的调查中,随着补硒人群血浆硒水平升高,红细胞硒水平升高,并且血浆硒水平与NK细胞数量呈现正相关[40]。相反,硒缺乏则可能导致NK细胞活性下降[41]。
2.1.3 硒对树突状细胞的影响树突状细胞是生物效应中最强的一类专职抗原递呈细胞,能诱导T细胞激发免疫应答,诱导特异性的细胞毒性T细胞生成,同时是目前已知的唯一能够激活未致敏初始T细胞的抗原递呈细胞(APC)。树突状细胞表面有丰富的抗原递呈因子(MHC-Ⅰ、MHC-Ⅱ)及共刺激因子(CD40、CD80、CD86等),而硒蛋白水平会影响这些表面标记物的表达[42]。
2.2 硒与特异性免疫饮食中缺乏硒会导致组织器官中硒蛋白水平减少,低水平的硒蛋白使细胞更容易发生氧化应激和凋亡[43-44]。此外,低硒蛋白水平还影响免疫细胞发育以及免疫反应[45]。免疫细胞是对硒敏感的细胞之一,且免疫细胞内表达大部分已知的硒蛋白,其中GPx1和GPx4在巨噬细胞和T淋巴细胞中的水平明显高于其他组织细胞[46]。
2.2.1 硒与细胞免疫经过抗原递呈细胞加工后递呈的MHC-抗原肽复合物被T细胞表面抗原受体(TCR)识别后,T细胞被激活,激活后的T细胞大量增殖,参与免疫反应。这种高度的代谢和增殖使线粒体呼吸链产生大量ROS[47],因此以GSH为主的抗氧化剂对ROS的控制显得尤为重要。在体内试验中,GSH的缺失消除了自身免疫疾病,但同时也阻断了病毒免疫[48]。
幼稚T细胞在接受抗原肽刺激时,会转化为效应T细胞参与免疫应答的中心环节,而在辅助T细胞(Th)活化到Th1、Th2、Th17、Treg等亚型的过程中,体内硒元素的作用十分重要。研究发现,与野生组相比,NADPH氧化酶缺陷小鼠体内Th1的细胞因子表达量更高,表明高度的还原环境可能会导致更高的Th1水平[49]。与之类似,Hoffmann等[50]观察到低饮食硒水平促使小鼠体内Th1/Th2偏向Th2方向,而高硒水平有利于Th1表型的表达。
炎性细胞因子是由免疫细胞合成并分泌的多肽类物质,包括白细胞介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、环氧合酶-2(COX-2)等,起着促进或抑制炎症等免疫学作用。饮食中添加0.32~0.33 mg/kg亚硒酸钠(以硒计)、硒代蛋氨酸和酵母硒均能显著降低猪肌肉组织中IFN-γ和COX-2的表达水平[51]。相对的,硒缺乏导致鸡脾脏内TNF-α、白细胞介素-8(IL-8)、IFN-γ等多种炎性因子表达量改变,严重降低了其免疫水平[52]。同时,硒还能上调巨噬细胞抗炎因子白细胞介素-10(IL-10)、白细胞介素-1ra(IL-1ra)并降低促炎因子白细胞介素-1β(IL-1β)、TNF-α等基因的表达[53-54]。
2.2.2 硒与体液免疫与T细胞相似,当B细胞表面抗原受体(BCR)接收刺激后,B细胞被活化,这个过程会产生大量的ROS,这些ROS的水平会影响B细胞下游信号的强度[55],而ROS在B细胞中的累积会减少CD19的表达,造成体液免疫抑制[56]。
体内B细胞对ROS的水平很敏感。在B细胞中,硒能降低白细胞三烯催化关键酶5-脂氧合酶的水平,鉴于白细胞三烯在B细胞增殖分化中的影响,细胞内硒水平可能在B细胞激活过程中也发挥了重要作用[57]。体内试验中,0.3 mg/kg的ADS18细菌有机硒添加剂有效提高了肉鸡血浆免疫球蛋白A(IgA)的含量[58]。同时,在饮食中添加硒促进了怀孕母猪与怀孕母牛乳汁中免疫球蛋白的含量,促进了免疫球蛋白从母体向幼崽的转移[3, 59],而有机硒比无机硒更有利于提升仔猪的血液硒水平[60]。此外,细胞内溶酶体的活性也与硒蛋白表达量呈正相关[61]。
2.3 硒与癌症免疫监视是体内免疫系统的基本功能之一,能及时清除体内的癌变细胞。当免疫监视功能低下时,癌突变细胞的增殖不再受抑制,引起临床上肿瘤的发生。较高的ROS水平能诱导DNA突变,促进癌症的发生,且高度的ROS水平对维持癌细胞的稳定性十分重要,因此,能清除ROS的硒蛋白家族在癌症预防过程中就显得举足轻重[62]。一项早期的在河南林县的研究发现,硒与维生素E、β-胡萝卜素联用显著降低了食道癌和胃癌的发病几率[63],同时,在该地区的研究还发现这些癌症的发病率与血清硒水平呈负相关[64]。尽管很多研究表明,硒可能具有抗癌活性,但一项来自Vinceti等[65]的调查显示补充硒似乎对预防癌症不起作用,那么在未来我们或许更应该聚焦于硒对癌症的治疗作用以及新型硒化合物的开发。低剂量的硒具有抗氧化作用,能减少胞内的ROS,但高剂量硒反而会促进超氧化物和过氧化物的产生[66-67],所以在临床应用时,硒的剂量也是应当关注的方面。
3 小结与展望硒蛋白在动物体内广泛存在,在不同的功能领域中各司其职,影响并维持着机体的正常代谢和免疫。在硒元素发现后50年的今天,人们越来越重视硒元素的补充,硒元素成为关系动物生产效益和人类健康的必要条件。随着新的研究工具的发现,更多的硒蛋白的生理功能也逐渐浮出水面。随着硒元素对动物免疫影响的研究的不断深入,新的硒作用靶点、新型的硒化合物被逐渐开发,为提高动物的免疫水平和生产效能提供了更多的理论基础。
| [1] |
FLOHE L, GVNZLER W A, SCHOCK H H. Glutathione peroxidase:a selenoenzyme[J]. FEBS Letters, 1973, 32(1): 132-134. DOI:10.1016/0014-5793(73)80755-0 |
| [2] |
MANSOUR A T E, GODA A A, OMAR E A, et al. Dietary supplementation of organic selenium improves growth, survival, antioxidant and immune status of meagre, Argyrosomus regius, juveniles[J]. Fish & Shellfish Immunology, 2017, 68: 516-524. |
| [3] |
WALLACE L G, BOBE G, VORACHEK W R, et al. Effects of feeding pregnant beef cows selenium-enriched alfalfa hay on selenium status and antibody titers in their newborn calves[J]. Journal of Animal Science, 2017, 95(6): 2408-2420. DOI:10.2527/jas.2017.1377 |
| [4] |
吴显实, 张克春, 卫程武, 等. 日粮添加富硒益生菌对奶牛硒吸收转化、抗氧化能力与生产性能的影响[J]. 中国兽医学报, 2010, 30(8): 1111-1114, 1132. |
| [5] |
韩博, 梁俭, 张一贤, 等. 日粮添加硒碘铜对宁夏地区奶牛生产和繁殖性能的影响[J]. 南京农业大学学报, 2000, 23(3): 76-80. |
| [6] |
SERRÃO V H B, SILVA I R, DE SILVA M T A, et al. The unique tRNASec and its role in selenocysteine biosynthesis[J]. Amino Acids, 2018, 50(9): 1145-1167. DOI:10.1007/s00726-018-2595-6 |
| [7] |
SANTESMASSES D, MARIOTTI M, GUIGÓ R. Computational identification of the selenocysteine tRNA (tRNASec) in genomes[J]. PLoS Computational Biology, 2017, 13(2): e1005383. DOI:10.1371/journal.pcbi.1005383 |
| [8] |
OELZE M, KRÖLLER-SCHÖN S, STEVEN S, et al. Glutathione peroxidase-1 deficiency potentiates dysregulatory modifications of endothelial nitric oxide synthase and vascular dysfunction in aging[J]. Hypertension, 2014, 63(2): 390-396. |
| [9] |
YANT L J, RAN Q T, RAO L, et al. The selenoprotein GPx4 is essential for mouse development and protects from radiation and oxidative damage insults[J]. Free Radical Biology and Medicine, 2003, 34(4): 496-502. DOI:10.1016/S0891-5849(02)01360-6 |
| [10] |
ESWORTHY R S, ARANDA R, MARTÍN M G, et al. Mice with combined disruption of GPx1 and GPx2 genes have colitis[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2001, 281(3): G848-G855. DOI:10.1152/ajpgi.2001.281.3.G848 |
| [11] |
OLSON G E, WHITIN J C, HILL K E, et al. Extracellular glutathione peroxidase (GPx3) binds specifically to basement membranes of mouse renal cortex tubule cells[J]. American Journal of Physiology-Renal Physiology, 2010, 298(5): F1244-F1253. DOI:10.1152/ajprenal.00662.2009 |
| [12] |
CAO J Y, DIXON S J. Mechanisms of ferroptosis[J]. Cellular and Molecular Life Sciences, 2016, 73(11/12): 2195-2209. |
| [13] |
INGOLD I, BERNDT C, SCHMITT S, et al. Selenium utilization by GPx4 is required to prevent hydroperoxide-induced ferroptosis[J]. Cell, 2018, 172(3): 409-422. DOI:10.1016/j.cell.2017.11.048 |
| [14] |
ZHANG J M, ZHANG B X, LI X M, et al. Small molecule inhibitors of mammalian thioredoxin reductase as potential anticancer agents:an update[J]. Medicinal Research Reviews, 2019, 39(1): 5-39. |
| [15] |
WHAYNE T F, J r. Thioredoxins in cardiovascular disease[J]. Canadian Journal of Physiology and Pharmacology, 2015, 93(11): 903-911. DOI:10.1139/cjpp-2015-0105 |
| [16] |
SCALCON V, BINDOLI A, RIGOBELLO M P. Significance of the mitochondrial thioredoxin reductase in cancer cells:an update on role, targets and inhibitors[J]. Free Radical Biology and Medicine, 2018, 127: 62-79. DOI:10.1016/j.freeradbiomed.2018.03.043 |
| [17] |
WAKASUGI N, TAGAYA Y, WAKASUGI H, et al. Adult T-cell leukemia-derived factor/thioredoxin, produced by both human T-lymphotropic virus type Ⅰ-and Epstein-Barr virus-transformed lymphocytes, acts as an autocrine growth factor and synergizes with interleukin 1 and interleukin 2[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(21): 8282-8286. DOI:10.1073/pnas.87.21.8282 |
| [18] |
MOUGIAKAKOS D, JOHANSSON C C, JITSCHIN R, et al. Increased thioredoxin-1 production in human naturally occurring regulatory T cells confers enhanced tolerance to oxidative stress[J]. Blood, 2011, 117(3): 857-861. DOI:10.1182/blood-2010-09-307041 |
| [19] |
TAN S X, GREETHAM D, RAETH S, et al. The thioredoxin-thioredoxin reductase system can function in vivo as an alternative system to reduce oxidized glutathione in Saccharomyces cerevisiae[J]. Journal of Biological Chemistry, 2010, 285(9): 6118-6126. DOI:10.1074/jbc.M109.062844 |
| [20] |
THOMAS S R, MCTAMNEY P M, ADLER J M, et al. Crystal structure of iodotyrosine deiodinase, a novel flavoprotein responsible for iodide salvage in thyroid glands[J]. Journal of Biological Chemistry, 2009, 284(29): 19659-19667. DOI:10.1074/jbc.M109.013458 |
| [21] |
孙东波, 张健, 丁岚峰, 等. 缺硒对鸡甲状腺功能的影响[J]. 黑龙江畜牧兽医, 2010(15): 108-110. |
| [22] |
HILL K E, ZHOU J D, MCMAHAN W J, et al. Deletion of selenoprotein P alters distribution of selenium in the mouse[J]. Journal of Biological Chemistry, 2003, 278(16): 13640-13646. DOI:10.1074/jbc.M300755200 |
| [23] |
LIU Y, ZHANG W, ZHAO J T, et al. Selenoprotein P as the major transporter for mercury in serum from methylmercury-poisoned rats[J]. Journal of Trace Elements in Medicine and Biology, 2018, 50: 589-595. DOI:10.1016/j.jtemb.2018.04.013 |
| [24] |
ROMAN M, JITARU P, BARBANTE C. Selenium biochemistry and its role for human health[J]. Metallomics, 2014, 6(1): 25-54. DOI:10.1039/C3MT00185G |
| [25] |
SHCHEDRINA V A, ZHANG Y, LABUNSKYY V M, et al. Structure-function relations, physiological roles, and evolution of mammalian ER-resident selenoproteins[J]. Antioxidants & Redox Signaling, 2010, 12(7): 839-849. |
| [26] |
HAN S J, LEE B C, YIM S H, et al. Characterization of mammalian selenoprotein O:a redox-active mitochondrial protein[J]. PLoS One, 2014, 9(4): e95518. DOI:10.1371/journal.pone.0095518 |
| [27] |
LU C L, QIU F C, ZHOU H J, et al. Identification and characterization of selenoprotein K:an antioxidant in cardiomyocytes[J]. FEBS Letters, 2006, 580(22): 5189-5197. DOI:10.1016/j.febslet.2006.08.065 |
| [28] |
CHEN X D, ZHAO Z P, ZHOU J C, et al. Evolution, regulation, and function of porcine selenogenome[J]. Free Radical Biology and Medicine, 2018, 127: 116-123. DOI:10.1016/j.freeradbiomed.2018.04.560 |
| [29] |
XU S Z, LEE S H, LILLEHOJ H S, et al. Dietary sodium selenite affects host intestinal and systemic immune response and disease susceptibility to necrotic enteritis in commercial broilers[J]. British Poultry Science, 2015, 56(1): 103-112. DOI:10.1080/00071668.2014.984160 |
| [30] |
SUN L H, PI D A, ZHAO L, et al. Response of selenium and selenogenome in immune tissues to LPS-induced inflammatory reactions in pigs[J]. Biological Trace Element Research, 2017, 177(1): 90-96. DOI:10.1007/s12011-016-0863-4 |
| [31] |
SONG K D, DOWD S E, LEE H K, et al. Long-term dietary supplementation of organic selenium modulates gene expression profiles in leukocytes of adult pigs[J]. Animal Science Journal, 2013, 84(3): 238-246. DOI:10.1111/j.1740-0929.2012.01060.x |
| [32] |
ZHAO Y, LI H, MEN L L, et al. Effects of selenoprotein S on oxidative injury in human endothelial cells[J]. Journal of Translational Medicine, 2013, 11: 287. DOI:10.1186/1479-5876-11-287 |
| [33] |
ARIBI M, MEZIANE W, HABI S, et al. Macrophage bactericidal activities against Staphylococcus aureus are enhanced in vivo by selenium supplementation in a dose-dependent manner[J]. PLoS One, 2015, 10(9): e0135515. DOI:10.1371/journal.pone.0135515 |
| [34] |
LIAO C, HARDISON R C, KENNETT M J, et al. Selenoproteins regulate stress erythroid progenitors and spleen microenvironment during stress erythropoiesis[J]. Blood, 2018, 131(23): 2568-2580. DOI:10.1182/blood-2017-08-800607 |
| [35] |
LIAO C, CARLSON B A, PAULSON R F, et al. The intricate role of selenium and selenoproteins in erythropoiesis[J]. Free Radical Biology and Medicine, 2018, 127: 165-171. DOI:10.1016/j.freeradbiomed.2018.04.578 |
| [36] |
邹悦, 梁峰, 周烁, 等. 低硒对鸡红细胞抗氧化功能与免疫功能影响的研究[J]. 黑龙江畜牧兽医, 2017(5): 171-175. |
| [37] |
鲁敏, 冉林武, 叶耿坪, 等. 日粮添加富硒益生菌对山羊血液学指标和抗氧化能力的影响[J]. 畜牧与兽医, 2013, 45(12): 94-97. |
| [38] |
AMARA I B, HAKIM A, TROUDI A. Protective effects of selenium on methimazole-induced anemia and oxidative stress in adult rats and their offspring[J]. Human & Experimental Toxicology, 2011, 30(10): 1549-1560. |
| [39] |
KAWATANI Y, SUZUKI T, SHIMIZU R, et al. Nrf2 and selenoproteins are essential for maintaining oxidative homeostasis in erythrocytes and protecting against hemolytic anemia[J]. Blood, 2011, 117(3): 986-996. DOI:10.1182/blood-2010-05-285817 |
| [40] |
HAWKES W C, RICHTER D, ALKAN Z. Dietary selenium supplementation and whole blood gene expression in healthy North American men[J]. Biological Trace Element Research, 2013, 155(2): 201-208. DOI:10.1007/s12011-013-9786-5 |
| [41] |
TANAKA A, KATO A, SUZUKI Y, et al. Association of increased indoleamine 2, 3-dioxygenase with impaired natural killer cell activity in hemodialysis patients[J]. Therapeutic Apheresis and Dialysis, 2014, 18(1): 19-23. DOI:10.1111/1744-9987.12071 |
| [42] |
SUN Z P, LIU C, PAN T R, et al. Selenium accelerates chicken dendritic cells differentiation and affects selenoproteins expression[J]. Developmental & Comparative Immunology, 2017, 77: 30-37. |
| [43] |
LIU Y, ZHAO H, ZHANG Q S, et al. Prolonged dietary selenium deficiency or excess does not globally affect selenoprotein gene expression and/or protein production in various tissues of pigs[J]. The Journal of Nutrition, 2012, 142(8): 1410-1416. DOI:10.3945/jn.112.159020 |
| [44] |
JIN X, XU Z, ZHAO X, et al. The antagonistic effect of selenium on lead-induced apoptosis via mitochondrial dynamics pathway in the chicken kidney[J]. Chemosphere, 2017, 180: 259-266. DOI:10.1016/j.chemosphere.2017.03.130 |
| [45] |
YANG T S, CAO C Y, YANG J, et al. miR-200a-5p regulates myocardial necroptosis induced by Se deficiency via targeting RNF11[J]. Redox Biology, 2018, 15: 159-169. DOI:10.1016/j.redox.2017.11.025 |
| [46] |
HUANG Z, ROSE A H, HOFFMANN P R. The role of selenium in inflammation and immunity:from molecular mechanisms to therapeutic opportunities[J]. Antioxidants & Redox Signaling, 2012, 16(7): 705-743. |
| [47] |
SENA L A, LI S, JAIRAMAN A, et al. Mitochondria are required for antigen-specific T cell activation through reactive oxygen species signaling[J]. Immunity, 2013, 38(2): 225-236. DOI:10.1016/j.immuni.2012.10.020 |
| [48] |
MAK T W, GRUSDAT M, DUNCAN G S, et al. Glutathione primes T cell metabolism for inflammation[J]. Immunity, 2017, 46(4): 675-689. DOI:10.1016/j.immuni.2017.03.019 |
| [49] |
JACKSON S H, DEVADAS S, KWON J, et al. T cells express a phagocyte-type NADPH oxidase that is activated after T cell receptor stimulation[J]. Nature Immunology, 2004, 5(8): 818-827. DOI:10.1038/ni1096 |
| [50] |
HOFFMANN F W, HASHIMOTO A C, SHAFER L A, et al. Dietary selenium modulates activation and differentiation of CD4+ T cells in mice through a mechanism involving cellular free thiols[J]. The Journal of Nutrition, 2010, 140(6): 1155-1161. DOI:10.3945/jn.109.120725 |
| [51] |
FALK M, BERNHOFT A, FRAMSTAD T, et al. Effects of dietary sodium selenite and organic selenium sources on immune and inflammatory responses and selenium deposition in growing pigs[J]. Journal of Trace Elements in Medicine and Biology, 2018, 50: 527-536. DOI:10.1016/j.jtemb.2018.03.003 |
| [52] |
KHOSO P A, ZHANG Y M, YIN H, et al. Selenium deficiency affects immune function by influencing selenoprotein and cytokine expression in chicken spleen[J]. Biological Trace Element Research, 2019, 187(2): 506-516. DOI:10.1007/s12011-018-1396-9 |
| [53] |
LEE B C, LEE S G, CHOO M K, et al. Selenoprotein MsrB1 promotes anti-inflammatory cytokine gene expression in macrophages and controls immune response in vivo[J]. Scientific Reports, 2017, 7: 5119. DOI:10.1038/s41598-017-05230-2 |
| [54] |
BI C L, WANG H, WANG Y J, et al. Selenium inhibits Staphylococcus aureus-induced inflammation by suppressing the activation of the NF-κB and MAPK signalling pathways in RAW264.7 macrophages[J]. European Journal of Pharmacology, 2016, 780: 159-165. DOI:10.1016/j.ejphar.2016.03.044 |
| [55] |
WHEELER M L, DEFRANCO A L. Prolonged production of reactive oxygen species in response to B cell receptor stimulation promotes B cell activation and proliferation[J]. The Journal of Immunology, 2012, 189(9): 4405-4416. DOI:10.4049/jimmunol.1201433 |
| [56] |
OGURA M, INOUE T, YAMAKI J, et al. Mitochondrial reactive oxygen species suppress humoral immune response through reduction of CD19 expression in B cells in mice[J]. European Journal of Immunology, 2017, 47(2): 406-418. |
| [57] |
WERZ O, SZELLAS D, STEINHILBER D. Reactive oxygen species released from granulocytes stimulate 5-lipoxygenase activity in a B-lymphocytic cell line[J]. European Journal of Biochemistry, 2000, 267(5): 1263-1269. DOI:10.1046/j.1432-1327.2000.01000.x |
| [58] |
DALIA A M, LOH T C, SAZILI A Q, et al. Effects of vitamin E, inorganic selenium, bacterial organic selenium, and their combinations on immunity response in broiler chickens[J]. BMC Veterinary Research, 2018, 14: 249. DOI:10.1186/s12917-018-1578-x |
| [59] |
CHEN J, ZHANG F T, GUAN W T, et al. Increasing selenium supply for heat-stressed or actively cooled sows improves piglet preweaning survival, colostrum and milk composition, as well as maternal selenium, antioxidant status and immunoglobulin transfer[J]. Journal of Trace Elements in Medicine and Biology, 2019, 52: 89-99. DOI:10.1016/j.jtemb.2018.11.010 |
| [60] |
GELDERMAN A, CLAPPER J. Effects of inorganic or organic selenium on immunoglobulins in swine[J]. Journal of Animal Science and Biotechnology, 2013, 4: 47. DOI:10.1186/2049-1891-4-47 |
| [61] |
CAO N, LI W Y, LI B X, et al. Transcriptome profiling reveals the immune response of goose T cells under selenium stimuli[J]. Animal Science Journal, 2017, 88(12): 2001-2009. DOI:10.1111/asj.12861 |
| [62] |
POLIMENI M, GAZZANO E. Is redox signaling a feasible target for overcoming multidrug resistance in cancer chemotherapy?[J]. Frontiers in Pharmacology, 2014, 5: 286. |
| [63] |
BLOT W J, LI J Y, TAYLOR P R, et al. Nutrition intervention trials in Linxian, China:supplementation with specific vitamin/mineral combinations, cancer incidence, and disease-specific mortality in the general population[J]. Journal of the National Cancer Institute, 1993, 85(18): 1483-1491. DOI:10.1093/jnci/85.18.1483 |
| [64] |
MARK S D, QIAO Y L, DAWSEY S M, et al. Prospective study of serum selenium levels and incident esophageal and gastric cancers[J]. Journal of the National Cancer Institute, 2000, 92(21): 1753-1763. DOI:10.1093/jnci/92.21.1753 |
| [65] |
VINCETI M, FILIPPINI T, GIOVANE C D. Selenium for preventing cancer[J]. Cochrane Database of Systematic Reviews, 2018, 1: CD005195. |
| [66] |
MISRA S, BOYLAN M, SELVAM A, et al. Redox-active selenium compounds-from toxicity and cell death to cancer treatment[J]. Nutrients, 2015, 7(5): 3536-3556. DOI:10.3390/nu7053536 |
| [67] |
BRIGELIUS-FLOHÉ R, FLOHÉ L. Selenium and redox signaling[J]. Archives of Biochemistry and Biophysics, 2017, 617: 48-59. DOI:10.1016/j.abb.2016.08.003 |




