2. 中国科学院亚热带农业生态研究所, 长沙 410125;
3. 西南大学动物科学学院, 重庆 402460
2. Institute of Subtropical Agricultural Ecology, Chinese Academy of Sciences, Changsha 410125, China;
3. College of Animal Science, Southwest University, Chongqing 402460, China
蛋氨酸作为生长山羊玉米-豆粕型精料和玉米-秸秆型饲粮的第一限制性氨基酸,能够提高反刍动物氨基酸利用效率,其缺乏会导致其他氨基酸的利用率下降[1]。瘤胃保护性蛋氨酸能改善反刍动物生产性能。据报道,瘤胃保护性蛋氨酸能提高山羊的产奶量和乳品质[2],提高荷斯坦奶公牛的生长效率和能量利用效率[3],泌乳期奶山羊饲喂瘤胃保护性蛋氨酸能够减少体重损失[4]。瘤胃非保护性蛋氨酸在反刍动物上的应用也有一定的研究。Barry等[5]研究发现,腹膜注射和口服DL-蛋氨酸均能提高青年绵羊的增重;王杰等[6]研究发现,限制饲粮中蛋氨酸水平会降低羔羊瘤胃重量、生长性能和屠宰性能,恢复蛋氨酸水平后,羔羊生长性能及内脏器官发育状况也随之恢复;而Lodman等[7]研究证明,DL-蛋氨酸对奶牛体重、体况都没有显著影响,DL-蛋氨酸对奶牛的产奶性能也没有显著影响[8]。这说明瘤胃非保护性蛋氨酸对反刍动物的影响具有不可预测性。研究表明,瘤胃非保护性氨基酸可能会对反刍动物营养与养生理功能产生积极或消极的影响,这可能与瘤胃微生物的存在有关[9],但相关原因仍需进一步研究证实。因此,氨基酸在瘤胃内的代谢是目前的一个研究热点。
细菌与原虫在瘤胃氮代谢过程中发挥着重要的作用。非保护性氨基酸在瘤胃中被细菌分解成氨态氮(NH3-N)、有机酸、二氧化碳(CO2),或者直接被微生物吸收合成微生物蛋白质,一些细菌缺乏将氨基酸从细胞质转运到细胞外的机制,所以当氨基酸吸收过量时必须以NH3-H的形式释放到胞外[10]。原虫最重要的功能是它们能吞噬大分子物质、蛋白质、碳水化合物(CHO)以及细菌,而且由于原虫不能利用NH3-N,所以原虫能为细菌生长提供可溶性蛋白质,调节细菌氮周转[11]。因此,非保护性氨基酸主要通过影响发酵参数与微生物氮代谢进而影响反刍动物营养与生理功能。但是细菌与原虫如何利用蛋氨酸以及如何通过利用蛋氨酸影响发酵参数和微生物氮代谢仍有待进一步研究。因此,本试验通过稳定同位素标记法探究蛋氨酸对体外发酵特性的影响、细菌与原虫对蛋氨酸的利用情况以及氮素在细菌与原虫之间的流转情况,以期为反刍家畜蛋氨酸营养提供理论基础。
1 材料与方法 1.1 试验材料发酵底物:玉米-豆粕型精料及玉米-秸秆型基础饲粮,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
添加剂:蛋氨酸为同位素标记的碳13蛋氨酸(13C-Met),纯度98%,碳13(13C)标记率99%,由美国安德沃公司提供,其中蛋氨酸碳链上的1号碳原子用13C标记。
1.2 试验方法 1.2.1 试验设计本试验采用单因子随机区组试验设计,设置对照组(C组)和试验组(T组),对照组不添加蛋氨酸,试验组添加0.33 μmol蛋氨酸(具体添加物为13C-Met,以0.18 mL溶液的形式添加到体外培养底物中),蛋氨酸添加量参照Fowler等[12]的研究。每组设置12、24、36、48、72 h 5个采样时间点,每个采样时间点设置3个样品重复。
1.2.2 人工瘤胃液配制晨饲前采集3头瘘管羊瘤胃食糜,用6层纱布过滤,滤液等体积混合后,装入事先充满CO2并预热到39.5 ℃的保温瓶中,迅速带回实验室,与39.5 ℃预热的厌氧缓冲液混合(缓冲液体积:瘤胃液体积=4:1),缓冲液按照Cone等[13]提供的配方配制,并持续通入CO2。
1.2.3 体外培养称取0.5 g玉米-豆粕型精料和0.5 g玉米-秸秆型饲粮于发酵瓶中,向试验组发酵瓶中加入0.18 mL蛋氨酸溶液,对照组加入0.18 mL蒸馏水。将发酵瓶置于39.5 ℃恒温培养箱中预热,向发酵瓶中通入CO2,随后加入60 mL发酵液,并持续通入CO2,立即加上瓶塞瓶盖,并使用针头放气,使内外压强保持一致,然后迅速放回恒温培养箱,39.5 ℃恒温摇床(50 r/min)培养。
1.2.4 样品采集与处理于发酵时间的12、24、36、48、72 h各采集10 mL发酵液于-20 ℃保存,用于全氮的测定;取1.5 mL发酵液,加入0.15 mL 25%偏磷酸,-20 ℃保存,用于挥发性脂肪酸(VFA)和氨态氮含量测定;剩余发酵液用400目尼龙布过滤,收集滤渣与滤液,利用pH计(REX PHS-3C,上海仪器设备厂)立即测定滤液pH;滤渣65 ℃烘干,供全氮含量测定;滤液500×g离心10 min收集沉淀,用10 mL生理盐水洗涤后再用500×g离心10 min,重复冲洗3次得到原虫;上清液离心(20 000×g,15 min,4 ℃)收集细菌,用生理盐水重复洗3遍得到细菌,细菌和原虫在-80 ℃下冷冻干燥供13C丰度(δ13C)测定。
1.2.5 指标测定方法 1.2.5.1 发酵参数测定方法NH3-N含量测定参照Wang等[14]的方法,VFA含量测定参考Chen等[15]方法,全氮含量的测定参考Horwitz[16]的方法,发酵液pH测定参照陈亮等[17]的方法。
1.2.5.2 δ13C测定方法稳定碳同位素丰度的测定参照Zhou等[18]的方法,采用MAT253型质谱仪测定,称取1 mg样品,加入装有1 g氧化铜(CuO)的Pyrex管中,排出空气,在550 ℃下燃烧6 h,使样品中的碳全部转化成CO2,稳定碳同位素的丰度用低温蒸馏CO2测定,以δ13C的形式表示。
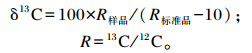
|
微生物氮和微生物蛋氨酸含量的计算公式[12]如下:

|

|
所有数据采用Excel 2013进行初步统计,数据采用SAS 9.2的Proc Mixed统计分析,组间差异采用contrast语句进行比较。P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 蛋氨酸对体外发酵特性的影响由表 2可知,添加蛋氨酸可极显著提高发酵液的pH(P<0.01),且随着时间的增加,各组发酵液pH极显著降低(P<0.01)。试验组与对照组之间发酵液的NH3-N含量无显著差异(P>0.05),但随着时间的增加,各组发酵液的NH3-N含量极显著增加(P<0.01)。添加蛋氨酸对发酵液各VFA、总挥发性脂肪酸(TVFA)含量及乙酸/丙酸均无显著影响(P>0.05),但随着时间的增加,各组各VFA、TVFA含量及乙酸/丙酸均显著或极显著增加(P<0.05或P<0.01)。除乙酸外,蛋氨酸与时间对各VFA、TVFA含量均无显著交互效应(P>0.05)。
|
|
表 2 蛋氨酸对体外发酵特性的影响 Table 2 Effects of Met on in vitro fermentation characteristics |
由表 3可知,添加蛋氨酸极显著提高了细菌和原虫δ13C(P<0.01)。试验组细菌δ13C在12~24 h显著降低(P<0.05),24~36 h显著升高(P<0.05),36~48 h显著降低(P<0.05),蛋氨酸与时间对细菌δ13C有极显著交互效应(P<0.01)。随着时间的增加,对照组细菌δ13C以及试验组和对照组原虫δ13C均无显著差异(P>0.05)。
|
|
表 3 蛋氨酸对细菌、原虫δ13C的影响 Table 3 Effects of Met on δ13C of bacteria and protozoa |
由表 4可知,在不同组之间以及不同时间点之间,未降解氮、总非氨态氮、总微生物氮、增加的微生物氮、总微生物蛋氨酸、增加的微生物蛋氨酸、细菌蛋氨酸、增加的细菌蛋氨酸、原虫蛋氨酸、增加的原虫蛋氨酸含量均没有显著差异(P>0.05),且蛋氨酸与时间对上述指标没有显著交互效应(P>0.05)。
|
|
表 4 蛋氨酸对微生物氮及原虫和细菌蛋氨酸含量的影响 Table 4 Effects of Met on microbial nitrogen and content of Met in protozoa and bacteria |
瘤胃pH作为研究瘤胃发酵的重要指标,其变化可以反映瘤胃内环境的状况,一般认为,瘤胃pH在5.5~7.5之间是保持瘤胃正常发酵的必要前提[19],本试验添加蛋氨酸极显著提高了发酵液的pH,但发酵过程中发酵液的pH在6.28~6.99变化,属于瘤胃发酵正常范围。NH3-N是瘤胃微生物降解饲料肽、氨基酸、蛋白质、尿素、氨化物及非蛋白氮的终产物;瘤胃微生物可以通过去氨基作用降解氨基酸产生NH3-N[8],而NH3-N是瘤胃微生物合成微生物蛋白的主要氮源,研究表明,瘤胃中约50%的细菌以NH3-N作为唯一氮源就能正常生长,并且有26%的细菌必须以NH3-N作为氮源维持生长需要[19]。Chung等[8]研究发现,添加0.26%的蛋氨酸对体外发酵液中的NH3-N含量没有显著影响,但添加0.52%的蛋氨酸能显著提高体外发酵液中的NH3-N含量。Baghbanzadeh-Nobari等[20]研究表明,饲粮添加0.12%蛋氨酸对母羊的瘤胃瘤胃发酵特性没有影响。通过这些研究结果我们发现蛋氨酸添加量低于0.26%时不会影响NH3-N的含量。而本研究中,蛋氨酸添加量为0.33 μmol/g底物(相当于饲粮的0.004 95%),添加量明显低于0.26%,故发酵液的NH3-N含量不受蛋氨酸的影响。蛋氨酸在瘤胃中被微生物分解成NH3-N与有机酸或者直接被微生物吸收利用,VFA是反刍动物重要的能量来源,可为宿主提供70%~80%的能量,乙酸是反刍动物脂肪合成的前体物,而丙酸则是葡萄糖合成的前体物,因此乙酸与丙酸的比例能影响反刍动物能量利用效率与能量储存部位[21]。Chung等[8]研究表明,添加0.52%的蛋氨酸能提高体外发酵液中的丁酸含量,而添加0.26%的蛋氨酸不影响体外发酵液中的VFA含量。而本研究中,发酵液的VFA、TVFA含量和乙酸/丙酸均无显著差异,可能是蛋氨酸的添加量较低,不足以引起VFA含量的变化。而随着时间的增加,NH3-N和VFA含量显著增加,这是因为分批培养过程中微生物降解饲料产生的NH3-N和VFA未被消耗而在发酵液中累积,VFA的累积导致pH随时间增长而下降。
3.2 蛋氨酸对细菌和原虫δ13C的影响瘤胃微生物可以通过去氨基作用脱去氨基酸的氨基,然后利用氨基酸中的碳为自身供能。本研究中,试验组的细菌δ13C显著高于对照组,说明细菌确实可以直接利用蛋氨酸,这与Onodera等[22]的研究结果(试验组的原虫δ13C极显著高于对照组)一致。而研究表明,在除去细菌的培养液中,原虫仅仅能生存3~4 d[23]。Quinn[24]发现在缺乏活菌的情况下,内毛虫(Entodinia)迅速死亡,只有等毛虫属(isotricha)繁殖迅速。Rahman等[25]通过试验推测出细菌与原虫之间的2个关系:第一,细菌可以作为原虫的营养物质;第二,消耗抑制原虫活动的代谢产物。Onodera等[22]研究发现,纤毛虫可以降解蛋氨酸酸产生二氨基丁酸;但Williams等[26]发现当有细菌存在的情况下,原虫更倾向于吞噬细菌获得生长所需的物质;王洪荣等[21]也证实了原虫能吞噬瘤胃细菌作为自身生长营养物质。所以,本试验中原虫体内13C可能来自吞噬细菌和直接摄取发酵液中13C-Met获得,但更多的来自于吞噬的细菌。细菌体内δ13C在12~72 h出现反复降低与升高的情况,这可能是细菌降解13C-Met后将含有13C的代谢产物释放的发酵液中以及细菌对代谢产物的重复吸收利用,即13C在细菌与发酵液之间周转造成的。
3.3 蛋氨酸对微生物氮和微生物蛋氨酸含量的影响瘤胃氮代谢分为2个部分,包括微生物对蛋白质的降解和微生物蛋白质的合成[27];瘤胃微生物利用饲料中的氮合成微生物蛋白质,可以提供反刍动物可吸收蛋白质总量的50%~80%[28],有研究表明,较低的pH能够降低粗蛋白质的降解率[29-30],但是瘤胃微生物产生的蛋白质水解酶能在一个较宽的pH范围内发挥活性[31],而本研究中pH在正常范围内波动,这可能是本研究中添加蛋氨酸显著提高pH,但未降解饲料氮含量没有显著变化的原因。Shriver等[32]研究发现,pH的改变不会影响微生物氮的含量,这是由于瘤胃微生物生长状态保持不变,这与本研究结果一致。氮是反刍动物氨基酸、多肽以及蛋白质合成必不可少的元素,研究表明,50%以上的微生物氮来源于NH3-N,其余的来自肽和氨基酸,当能量供应不足时,微生物通过去氨基作用将氨基酸转化成VFA供能,当能量充足时,微生物可以直接吸收利用氨基酸进行蛋白质合成[27],本研究中能量供应充足,故蛋氨酸主要被微生物吸收合成蛋白质,提高微生物氮的含量。Cardozo等[33]研究发现,连续培养物中多肽、氨基酸以及NH3-N的含量在采食8 h后恢复采食前水平,说明采食8 h后整个发酵内环境恢复稳定,微生物氮流转维持在平衡状态,而本研究中采样的时间点都在12 h以上,添加的蛋氨酸已被完全降解,故增加的微生物氮、细菌氮、原虫氮、微生物蛋氨酸、细菌蛋氨酸以及原虫蛋氨酸含量在不同组以及不同时间点之间都没有显著差异。
4 结论① 蛋氨酸能提高体外发酵的pH,但对NH3-N、VFA含量没有显著影响。
② 细菌可以直接摄取利用蛋氨酸。
③ 蛋氨酸对微生物氮代谢没有显著影响。
| [1] |
SHAN J G, TAN Z L, SUN Z H, et al. Limiting amino acids for growing goats fed a corn grain, soybean meal and maize stover based diet[J]. Animal Feed Science and Technology, 2007, 139(3/4): 159-169. |
| [2] |
TITI H H. Effect of long-term rumen-protected methionine supplementation on performance of Shami goats and growth performance of their kids[J]. Animal Production Science, 2017, 57(8): 1713-1718. DOI:10.1071/AN14862 |
| [3] |
TORRENTERA N, CARRASCO R, SALINAS-CHAVIRA J, et al. Influence of methionine supplementation of growing diets enriched with lysine on feedlot performance and characteristics of digestion in Holstein steer calves[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(1): 42-50. |
| [4] |
ALONSO-MÉLENDEZ E, MENDOZA G D, CASTREJÍN-PINEDA F A, et al. Milk production in dairy goats supplemented with different levels of ruminally protected methionine[J]. Journal of Dairy Research, 2016, 83(2): 148-150. DOI:10.1017/S002202991600011X |
| [5] |
BARRY T N, DREW K R. Responses of young sheep grazing swedes, turnips, and kale to intraperitoneal and oral supplementation with DL-methionine[J]. New Zealand Journal of Agricultural Research, 1978, 21(3): 395-399. DOI:10.1080/00288233.1978.10427425 |
| [6] |
王杰, 崔凯, 毕研亮, 等. 蛋氨酸限制与补偿对羔羊生长性能及内脏器官发育的影响[J]. 动物营养学报, 2016, 28(11): 3669-3678. DOI:10.3969/j.issn.1006-267x.2016.11.037 |
| [7] |
LODMAN D W, PETERSEN M K, CLARK C K, et al. Substitution of DL-methionine for soybean meal as a winter supplement for gestating cows grazing native range[J]. Journal of Animal Science, 1990, 68(12): 4361-4375. DOI:10.2527/1990.68124361x |
| [8] |
CHUNG Y H, BATEMAN Ⅱ H G, WILLIAMS C C, et al. Effects of methionine and lysine on fermentation in vitro and in vivo, nutrient flow to the intestine, and milk production[J]. Journal of Dairy Science, 2006, 89(5): 1613-1620. DOI:10.3168/jds.S0022-0302(06)72228-7 |
| [9] |
ONODERA R. Methionine and lysine metabolism in the rumen and the possible effects of their metabolites on the nutrition and physiology of ruminants[J]. Amino Acids, 1993, 5(2): 217-232. |
| [10] |
TAMMINGA S. A review on environmental impacts of nutritional strategies in ruminants[J]. Journal of Animal Science, 1996, 74(12): 3112-3124. DOI:10.2527/1996.74123112x |
| [11] |
ONODERA R, NAKAGAWA Y, KANDATSU M. Ureolytic activity of the washed cell suspension of rumen ciliate Protozoa[J]. Agricultural and Biological Chemistry, 1977, 41(11): 2177-2182. |
| [12] |
FOWLER C M, PLANK J E, DEVILLARD E, et al. Assessing the ruminal action of the isopropyl ester of 2-hydroxy-4-(methylthio) butanoic acid in continuous and batch cultures of mixed ruminal microbes[J]. Journal of Dairy Science, 2015, 98(2): 1167-1177. DOI:10.3168/jds.2014-8692 |
| [13] |
CONE J W, VAN GELDER A H, VISSCHER G J W, et al. Influence of rumen fluid and substrate concentration on fermentation kinetics measured with a fully automated time related gas production apparatus[J]. Animal Feed Science and Technology, 1996, 61(1/2/3/4): 113-128. |
| [14] |
WANG Z, HE Z X, BEAUCHEMin K A, et al. Comparison of two live Bacillus species as feed additives for improving in vitro fermentation of cereal straws[J]. Animal Science Journal, 2016, 87(1): 27-36. DOI:10.1111/asj.12346 |
| [15] |
CHEN L, REN A, ZHOU C S, et al. Effects of Lactobacillus acidophilus supplementation for improving in vitro rumen fermentation characteristics of cereal straws[J]. Italian Journal of Animal Science, 2016, 16(1): 52-60. |
| [16] |
HORWITZ W. Official methods of analysis of the Association of Official Analytical Chemists[M]. Washington D.C.: Association of Official Analytical Chemists, 1980.
|
| [17] |
陈亮, 任傲, 李斌, 等. 植物乳杆菌对玉米秸秆和水稻秸秆体外发酵特性的影响[J]. 动物营养学报, 2017, 29(2): 678-689. DOI:10.3969/j.issn.1006-267x.2017.02.038 |
| [18] |
ZHOU C S, CHEN L, TANG S X, et al. True digestibility of protein and amino acids in goats using plants naturally enriched in 13C as a label to determine endogenous amino acid excretion[J]. Animal Feed Science and Technology, 2016, 215: 37-46. DOI:10.1016/j.anifeedsci.2016.02.019 |
| [19] |
BROWN M S, PONCE C H, PULIKANTI R. Adaptation of beef cattle to high-concentrate diets:performance and ruminal metabolism[J]. Journal of Animal Science, 2006, 84(Suppl 1): E25-E33. |
| [20] |
BAGHBANZADEH-NOBARI B, TAGHIZADEH A, KHORVASH M, et al. Digestibility, ruminal fermentation, blood metabolites and antioxidant status in ewes supplemented with DL-methionine or hydroxy-4(methylthio) butanoic acid isopropyl ester[J]. Journal of Animal Physiology and Animal Nutrition, 2017, 101(5): e266-e277. DOI:10.1111/jpn.12600 |
| [21] |
王洪荣, 秦韬, 王超. 青蒿素对山羊瘤胃发酵和微生物氮素微循环的影响[J]. 中国农业科学, 2014, 47(24): 4904-4914. DOI:10.3864/j.issn.0578-1752.2014.24.014 |
| [22] |
ONODERA R, MIGITA R. Metabolism of threonine, methionine, and related-compounds in mixed rumen ciliate Protozoa[J]. Journal of Protozoology, 1985, 32(2): 326-330. DOI:10.1111/j.1550-7408.1985.tb03059.x |
| [23] |
COLEMAN G S. The preparation and survival of almost bacteria-free suspensions of Entodinium caudatum[J]. Journal of General Microbiology, 1962, 28(2): 271-281. DOI:10.1099/00221287-28-2-271 |
| [24] |
QUINN L Y. Continuous culture of ruminal microorganisms in chemically defined medium.Ⅰ.Design of continuous-culture apparatus[J]. Applied Microbiology, 1962, 10(6): 580-582. |
| [25] |
RAHMAN S A, PURSER D B, TYZNIK W J. Cultivation of rumen protozoa.Ⅰ.Factors influencing the cultivation of rumen oligotrich protozoa "In vitro"[J]. Journal of Eukaryotic Microbiology, 1964, 11(1): 51-55. |
| [26] |
WILLIAMS A G, COLEMAN G S.The rumen protozoa[M]//HOBSON P N, STEWART C S.The rumen microbial ecosystem.New York: Springer, 1992: 73-139.
|
| [27] |
BACH A, CALSAMIGLIA S, STERN M D. Nitrogen metabolism in the rumen[J]. Journal of Dairy Science, 2005, 88(Suppl.1): E9-E21. |
| [28] |
STORM E, ORSKOV E R. The nutritive value of rumen micro-organisms in ruminants.1.Large-scale isolation and chemical composition of rumen micro-organisms[J]. British Journal of Nutrition, 1983, 50(2): 463-470. DOI:10.1079/BJN19830114 |
| [29] |
ERFLE J D, BOILA R J, TEATHER R M, et al. Effect of pH on fermentation characteristics and protein degradation by rumen microorganisms in vitro[J]. Journal of Dairy Science, 1982, 65(8): 1457-1464. DOI:10.3168/jds.S0022-0302(82)82368-0 |
| [30] |
HOOVER W H, KINCAID C R, VARGA G A, et al. Effects of solids and liquid flows on fermentation in continuous cultures.Ⅳ.pH and dilution rate[J]. Journal of Animal Science, 1984, 58(3): 692-699. DOI:10.2527/jas1984.583692x |
| [31] |
WALLACE R J, ONODERA R, COTTA M A.Metabolism of nitrogen-containing compounds[M]//HOBSON P N, STEWART C S.The rumen microbial ecosystem.Netherlands: Springer, 1997.
|
| [32] |
SHRIVER B J, HOOVER W H, SARGENT J P, et al. Fermentation of a high concentrate diet as affected by ruminal pH and digesta flow[J]. Journal of Dairy Science, 1986, 69(2): 413-419. DOI:10.3168/jds.S0022-0302(86)80419-2 |
| [33] |
CARDOZO P W, CALSAMIGLIA S, FERRET A, et al. Effects of natural plant extracts on ruminal protein degradation and fermentation profiles in continuous culture[J]. Journal of Animal Science, 2004, 82(11): 3230-3236. DOI:10.2527/2004.82113230x |




