2. 广东省水产动物精准营养与高效饲料工程技术研究中心, 湛江 524088
2. Aquatic Animals Precision Nutrition and High Efficiency Feed Engineering Research Center of Guangdong Province, Zhanjiang 524088, China
鱼粉因具有蛋白质含量高、富含动物所需必需氨基酸、抗营养因子少且易被水产动物消化吸收等优点,一直是水产养殖动物饲料中不可或缺的首选蛋白质源[1]。据报道,全球渔获量的35%用来生产鱼粉[2]。太平洋国家中的秘鲁、智利、丹麦、冰岛等作为小型上层鱼类资源丰富的地区,是鱼粉的主要出口国,但近年来由于受厄尔尼诺现象的影响,小型上层鱼类产量严重下降[3]。随着水产养殖业的迅速发展,对鱼粉的需求量也越来越大,致使鱼粉供应量不能满足水产动物饲料生产的需求,因而鱼粉价格不断攀升,给饲料企业和养殖业带来了沉重的成本压力[4-5]。同时,鱼粉中含有较高的磷,而大多数鱼对其利用率低,饲料中鱼粉含量过多会对养殖水体环境造成污染[6]。植物性蛋白质源因资源较丰富、产量稳定且价格相对较低而成为替代鱼粉蛋白质的研究热点[7]。鱼类饲料中豆粕是利用最为广泛的一类植物蛋白质源。与其他植物蛋白质源相比,豆粕具有蛋白质含量高、消化率高、氨基酸比较平衡、含磷量较低、价格合理等优点,被认为是水产配合饲料中最佳的植物蛋白质源[8]。豆粕通过不同的加工工艺而有不同的产品——普通豆粕、去皮豆粕、发酵豆粕等,去皮豆粕是通过去皮工艺得到蛋白质含量较高的豆粕。去皮豆粕与普通豆粕相比,具有蛋白质含量高、代谢能含量高、纤维含量低、赖氨酸含量与利用率高等优点[9-10]。去皮豆粕替代鱼粉的研究报道已见鲫鱼(Carassius auratus)[11]、草鱼(Ctenopharyngodon idellus)[12]、胡子鲇(Clarias fuscus)[13]和幼建鲤(Cyprinus carpio var. Jian)[14]等。
多鳞(Sillago siharna)属于鲈形目(Perciformes)、鲈亚目(Percoidei)、鳍科(Sillaginidae)、鳍属(Sillago),俗称沙钻、沙锥、船丁鱼。在我国渤海、南海等沿海均有分布。多鳞曾是我国近海捕捞业中占有相当重要地位的海洋经济鱼类,但由于近海的过度捕捞使得多鳞野生数量锐减,自然资源几近枯竭。直至多鳞人工育苗成功,其养殖规模逐年扩大,缓解了多鳞渔业资源下降的趋势[15]。作为一种新兴的养殖品种,多鳞的研究多集中在繁殖、组织学、发育生物学、资源等方面[15-18],其营养及饲料学方面的研究仅见本实验室报道[19-20]。因此,本试验旨在考察饲料中去皮豆粕替代鱼粉对多鳞幼鱼生长性能、免疫指标及相关酶活性的影响,探讨多鳞饲料中去皮豆粕的适宜替代水平,为多鳞精准配合饲料的研发提供基础数据。
1 材料与方法 1.1 试验设计与饲料配制以红鱼粉、去皮豆粕等为蛋白质源,鱼油、大豆卵磷脂为脂肪源配制基础饲料,分别用0、8%、16%、24%、32%、40%的去皮豆粕替代饲料中的鱼粉,配制成6种等氮等脂的试验饲料(DSM0、DSM8、DSM16、DSM24、DSM32、DSM40),试验饲料组成及营养水平见表 1。饲料原料粉碎后过60目筛,按配方称重,微量组分采用逐级扩大法混合均匀,然后加入鱼油和卵磷脂,手动搓散,过筛后放入V型立式混合机中混合均匀后,加入适量(30%~40%)的水,混合均匀,用双螺杆挤条机(F-26,华南理工大学)加工成2 mm的颗粒饲料,风干至饲料水分含量为10%左右,编号封口袋分装,置于-20 ℃冰箱保存备用。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of test diets (air-dry basis) |
试验用多鳞鱼苗购自湛江市龙海天育苗试验基地。养殖试验在湛江市东海岛广东海洋大学海洋生物研究基地进行。鱼苗于4.5 m×4.9 m×1.8 m的室外水泥池中暂养至试验所需规格。鱼苗禁食24 h后分组,根据试验设计选取540尾体格健壮、大小均匀、平均体质量为(6.0±0.6) g的幼鱼,随机分为6组(DSM0、DSM8、DSM16、DSM24、DSM32、DSM40组),每组3重复,每重复1个0.5 m3玻璃缸桶,每桶放30尾鱼。各组试验鱼分别投喂对应的6种试验饲料,每天投喂2次(08:00和17:00),投喂量为多鳞总重的5%~8%,以眼观达到饱食为止。每天换水1次,每次50%。不间断充气,定期监测水质,试验期间水温为23~26 ℃,溶氧含量为5~6 mg/L,盐度为21~24,养殖期8周。
1.3 样品采集养殖试验结束饥饿24 h后,对每个试验桶内多鳞进行称重并计数,计算增重率(WGR)、特定生长率(SGR)、成活率(SR)、饲料系数(FCR)、摄食率(FI)。每桶随机取5尾鱼,称重并测量体长;然后剖取肝脏称重,以计算肝体比(HSI)和肥满度(CF)。每桶再随机取5尾全鱼,吸干体表水分,放入编号封口袋中,-20 ℃冰箱保存,待测鱼体常规成分。最后每桶再随机选取5尾鱼,剖开腹腔,分离肝脏、前肠、中肠、后肠[21],液氮保存,然后放入-80 ℃冰箱,待测酶活性。
1.4 分析测定方法生长性能指标计算公式如下:
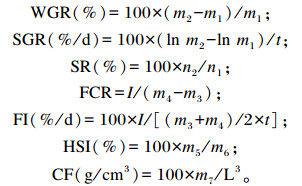
|
式中:m1、m2为试验始、末鱼平均体质量(g);n1、n2为试验始、末鱼尾数;t为试验期(d);I为摄入的饲料总干质量(g);m3、m4为试验始、末鱼总重(g);m5为肝胰脏重量、m6为该尾鱼体重(g);m7为鱼的体重(g)、L为该尾鱼体长(cm)。
试验饲料、全鱼样本的常规营养成分测定采用AOAC(1995)[22]方法进行,其中水分含量测定采用105 ℃烘干恒重法;粗蛋白质含量采用凯氏定氮法测定(仪器为KjeltecTM 8400,丹麦);粗脂肪含量采用索氏抽提法测定(提取溶剂为石油醚);粗灰分含量采用箱式电阻炉550 ℃灼烧恒重法测定。
肝脏超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)及碱性磷酸酶(AKP)活性,丙二醛(MDA)含量及肠道消化酶活性均使用南京建成生物工程研究所提供的试剂盒测定,样品的处理、试剂的配制及测定过程均严格按照试剂盒说明书提供的方法进行。
1.5 数据统计分析采用SPSS 20.0统计软件对试验数据进行单因素方差分析(one-way ANOVA),若有显著性差异(P < 0.05)则进行Duncan氏多重比较,统计数据采用平均值±标准差表示。以WGR和SGR为评价指标,经折线模型拟合得出多鳞幼鱼饲料中去皮豆粕替代鱼粉的最适水平。
2 结果 2.1 去皮豆粕替代鱼粉对多鳞生长性能和形态学指标的影响由表 2可知,随着饲料中去皮豆粕替代水平的增加,WGR及SGR呈先增加后降低的趋势,并且在DSM24组有最大值,DSM24组的WGR显著高于其他各组(P < 0.05);DSM32组的WGR显著高于DSM0组(P < 0.05);DSM0组的WGR与DSM8和DMS16组无显著差异(P < 0.05);DSM40组的WGR显著低于DMS24和DMS32组(P < 0.05)。DSM24组的SGR与DSM32组无显著差异(P>0.05),但显著高于其他各组(P < 0.05);DSM40组的SGR最低,显著低于其他各组(P < 0.05)。FCR、FI及HSI随着去皮豆粕替代鱼粉水平的增加呈先下降后升高的趋势。DSM24组的FCR最低,显著低于DSM40组(P < 0.05),但与其他各组无显著差异(P>0.05);而DSM24组的FI显著低于DSM0、DSM8和DSM40组(P < 0.05),与其他2组无显著差异(P>0.05)。DSM16组的HSI最低,显著低于DSM40组(P < 0.05),但与其他各组无显著差异(P>0.05)。饲料中去皮豆粕替代鱼粉的水平不影响多鳞幼鱼的SR和CF(P>0.05)。
|
|
表 2 去皮豆粕替代鱼粉对多鳞生长性能和形态学指标的影响 Table 2 Effects of dehulled soybean meal replacing fish meal on growth performance and morphological indexes of Sillago sihama |
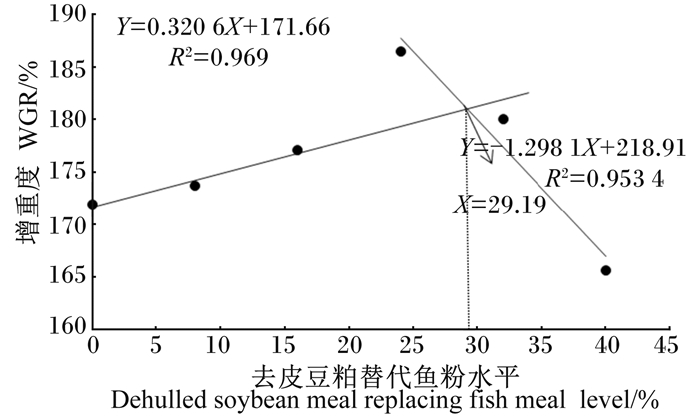
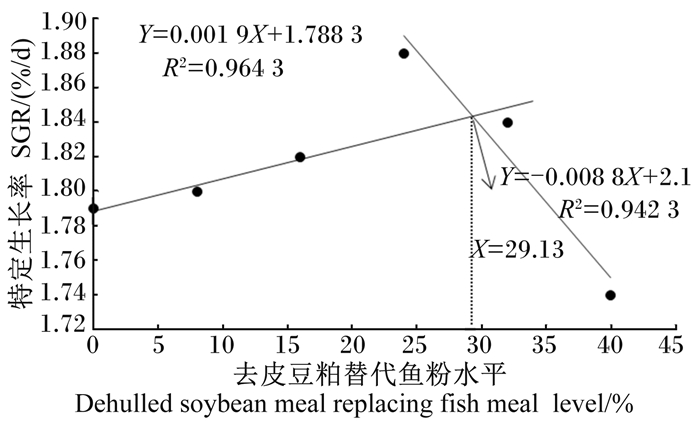
如图 1所示,以WGR为评价指标,通过折线模型拟合得出多鳞幼鱼饲料中去皮豆粕替代鱼粉的适宜水平为29.19%(Y=0.320 6X+171.66,R2=0.969 0;Y=-1.298 1X+218.91,R2=0.953 4)。以SGR为评价指标,通过折线模型拟合得出多鳞幼鱼饲料中去皮豆粕替代鱼粉的适宜水平为29.13%(Y=0.001 9X+1.788 3,R2=0.964 3;Y= -0.008 8X+2.100 0,R2=0.942 3),与WGR为评价指标得到的数据相近(图 2)。
|
图 1 去皮豆粕替代鱼粉水平与多鳞增重率的关系 Fig. 1 Relationship between dehulled soybean meal replacing fish meal level and WGR of Sillago sihama |
|
图 2 去皮豆粕替代鱼粉水平与多鳞特定生长率的关系 Fig. 2 Relationship between dehulled soybean meal replacing fish meal levle and SGR of Sillago sihama |
由表 3可知,除DSM24组外,去皮豆粕替代鱼粉显著降低了全鱼粗蛋白质和粗脂肪含量(P < 0.05),而对全鱼粗灰分含量无显著影响(P>0.05)。
|
|
表 3 饲料中去皮豆粕替代鱼粉对多鳞全鱼常规成分的影响(湿物质基础) Table 3 Effects of dehulled soybean meal replacing fish meal on body composition of Sillago sihama (wet matter basis) |
由表 4可知,肝脏SOD、AKP活性呈先升高后降低趋势。DSM16、DSM24组的肝脏SOD活性最高,与DSM8及DSM32组无显著差异(P>0.05),但显著高于DSM0、DSM32、DSM40组(P < 0.05)。DSM16、DSM24组间肝脏AKP活性无显著差异(P>0.05),但显著高于其他各组(P < 0.05);DSM0组肝脏AKP活性与DSM8组无显著差异(P>0.05),但显著高于DSM40组并显著低于DSM16、DSM24组(P < 0.05)。去皮豆粕替代鱼粉水平在8%~32%时,肝脏CAT活性无显著差异(P>0.05),但显著高于DSM0、DSM32、DSM40组(P < 0.05)。随着去皮豆粕替代鱼粉水平的增加,肝脏MDA含量呈逐渐升高的趋势,肝脏GOT、GPT活性呈稳定后上升趋势。DSM32组肝脏MDA含量与DSM40组无显著差异(P>0.05),但显著高于DSM0、DSM8组(P < 0.05);DSM16、DSM24组肝脏MDA含量与各组均无显著差异(P>0.05)。DSM40组肝脏GOT活性显著高于其他各组(P < 0.05),其他各组间无显著差异(P>0.05)。DSM40组肝脏GPT活性显著高于DSM0、DSM8组(P < 0.05),与其他各组无显著差异(P>0.05)。
|
|
表 4 去皮豆粕替代鱼粉对多鳞 |
由表 5可知,DSM40组前肠淀粉酶活性显著高于其他各组(P < 0.05),其他各组前肠淀粉酶活性无显著差异(P>0.05);中肠淀粉酶活性随着去皮豆粕替代鱼粉水平的升高呈现先升高后下降趋势,DSM40组中肠淀粉酶活性显著低于其他各组(P < 0.05),当去皮豆粕替代鱼粉水平为40%时,中肠淀粉酶活性显著低于其他各组(P < 0.05);后肠淀粉酶活性在替代水平为16%、24%和32%时,淀粉酶活性显著高于DSM0组(P < 0.05)。
|
|
表 5 去皮豆粕替代鱼粉对多鳞 |
前肠:去皮豆粕替代鱼粉水平在0~32%时,各组淀粉酶活性无显著差异(P>0.05),DSM40组淀粉酶活性最高,显著高于DSM16、DSM24和DSM32组(P < 0.05),与DSM0及DSM8组无显著差异(P>0.05)。蛋白酶活性呈先上升后下降的趋势,DSM32组蛋白酶活性最高,显著高于其他各组(P < 0.05),DSM24组蛋白酶活性与DSM8、DSM16组无显著差异(P>0.05),但显著高于DSM0、DSM40组并显著低于DSM32组(P < 0.05);DSM0组蛋白酶活性显著高于DSM40组(P < 0.05)。去皮豆粕替代鱼粉水平不影响前肠脂肪酶活性(P>0.05)。
中肠:随着去皮豆粕替代鱼粉水平的升高,中肠淀粉酶活性呈先升高后降低的趋势,替代水平超过24%时,淀粉酶活性显著下降(P < 0.05)。DSM40组淀粉酶活性最低且显著低于其他各组(P < 0.05);DSM16组淀粉酶活性最高,与DSM24组无显著差异(P>0.05),但显著高于其他各组(P < 0.05)。DSM0组淀粉酶活性显著低于DSM16组并显著高于DSM32和DSM40组(P < 0.05)。去皮豆粕替代鱼粉水平不影响中肠蛋白酶和脂肪酶活性(P>0.05)。
后肠:后肠淀粉酶活性呈先上升后下降趋势,蛋白酶活性呈平稳后下降趋势。DSM16、DSM24组淀粉酶活性与DSM32组无显著差异(P>0.05),但显著高于其他各组(P < 0.05);DSM0与DSM40组淀粉酶活性无显著差异(P>0.05),但显著低于除DSM8组外的其他各组(P < 0.05)。去皮豆粕替代鱼粉水平在0~32%时,各组间蛋白酶活性无显著差异(P>0.05),DSM40组蛋白酶活性最低,显著低于其他各组(P < 0.05)。去皮豆粕替代鱼粉水平不影响后肠脂肪酶活性(P>0.05)。
3 讨论 3.1 去皮豆粕替代鱼粉对多鳞生长性能和形态学指标的影响在本试验中,去皮豆粕替代鱼粉对多鱗的存活率无显著影响,这与褐点石斑鱼[23]、鳡[24]、罗氏沼虾[25]的研究结果一致,这表明在一定替代水平内,豆粕替代鱼粉未对存活率产生影响[26]。在黑鲷(Acanthopagrus schlegeli)[27]、尼罗罗非鱼(Oreochromis niloticus)[28]、日本沼虾(Macrobrachium nipponense)[29]的研究中,饲料中适宜的发酵豆粕替代鱼粉水平分别为40%、37.4%和25%,而本试验中,多鳞的饲料中去皮豆粕替代鱼粉的适宜水平为29.1%,说明替代水平与鱼种、初重、选用的动植物蛋白质源、饲料加工、试验条件等密切相关。王赛等[4]研究表明,不同蛋白质源替代鱼粉降低了褐点石斑鱼的FI,与本试验结果不符,这可能与本试验饲料配方中诱食剂的添加有关;何娇娇等[30]、林佳洁[31]研究发现,发酵豆粕分别替代45%和50%的鱼粉不影响大黄鱼(Larimichthys crocea)和黄金鲫(Carassius auratus)的WGR、SGR和FCR;而吴莉芳等[32]的研究中发现,豆粕替代水平超过24%时,黄金鲈(Perca flavescens)的WGR和SGR显著低于对照组;混合蛋白粉替代鱼粉超过60%时,珍珠龙胆石斑鱼(♀Epinephelus fuscoguttatus× Epinephelus lanceolat)幼鱼的WGR和SGR显著低于对照组[33];玉米蛋白粉替代45%鱼粉时,显著抑制了大菱鲆(Scophthalmus maximus L.)幼鱼的生长, 降低了饲料效率[34];本试验中,去皮豆粕替代40%鱼粉,SGR显著低于DSM0组。此外,Murashita等[35]报道,长期摄食豆粕可导致虹鳟(Oncorhynchus mykiss)胆汁酸合成相关基因及肝胆循环相关基因表达的下调;饲料中高水平的豆粕可导致日本鲈鱼(Lateolabrax japonicus)肠道损伤,炎症基因表达上调[36]。综合前人和本试验结果表明,超过一定替代水平,养殖对象生长性能显著下降,其可能的原因之一是在一定的范围内添加的动植物蛋白质源,使得饲料中的必需氨基酸含量和比例更加平衡,从而获得了不弱于甚至优于对照组的生长性能,但超出一定范围后,鱼粉含量的降低导致了必需氨基酸含量的快速下降,加上动植物蛋白质源中的抗营养因子水平升高及适口性下降等原因使得饲料中营养成分消化率和吸收率降低,最终导致了养殖对象生长性能的下降。
CF、HSI等形态学指标是反映试验对象营养状况和生理状态的指标[37],蝇蛆粉的添加水平不影响黄颡鱼的CF、HSI和脏体比(VSI)[38],黄姑鱼(Nibea albflora)[7]、虹鳟[39]、金头鲷[40]、大黄鱼[41]的试验结果也表明蛋白质源替代鱼粉的水平不影响CF、HSI和VSI。而本试验中,去皮豆粕替代鱼粉水平不影响多鳞的CF,但HSI随着替代水平的升高呈先下降后升高趋势,DSM040组的HSI与DSM0组无显著差异,但显著高于其他替代组,这与齐口裂腹鱼(Schizothorax prenanti)[5]研究结果一致。而大菱鲆的研究结果表明,CF随着发酵菜粕替代鱼粉水平的升高呈先上升后下降的趋势,100%替代组的CF显著低于其他低水平替代组,但替代水平不影响HSI[27]。随着替代鱼粉水平的增加,牙鲆(Paralichthys olivaceus)的HSI呈逐渐升高的趋势[42];Liang等[43]的研究结果表明,50%替代鱼粉组尖吻鲈(Lateolabrax japonicas)的CF、HSI和VSI显著低于对照组。试验对象形态学指标的差异可能来自于鱼种、食性、试验用蛋白质源等的不同。其可能的原因是在一定的范围内的替代,饲料中氨基酸比例适宜,抗营养因子含量不高,适口性不影响摄食,则动物生长和肝脏的发育保持一致,则HSI基本稳定或下降。当替代水平升高,饲料中必需氨基酸含量降低及抗营养因子升高及适口性下降,导致生长抑制,体重增加速度变缓[23, 27, 34];肝脏组织损伤肿大及脂肪代谢异常导致肝脏脂肪蓄积[41, 44-45],使肝脏重量非正常升高,2个因素综合作用从而出现HSI升高现象。
3.2 去皮豆粕替代鱼粉对多鳞全鱼常规成分的影响动植物蛋白质源替代鱼粉对试验对象体成分的影响不尽相同。黑鲷[27]、虹鳟[39]、黄鳍鲷(Acanthopagrus latus)[46]体成分均不受试验蛋白质源替代鱼粉水平影响;肉骨粉替代鱼粉水平不影响金头鲷体水分、体蛋白质和体灰分含量,但高水平替代组体脂肪含量显著下降[40];大豆浓缩蛋白替代水平不影响大黄鱼体水分、体蛋白质含量,但体脂肪含量呈下降后稳定趋势,体灰分含量则呈相反趋势[47];而发酵豆粕替代水平不影响大黄鱼体水分、体蛋白质、体脂肪含量,体灰分含量稳中有升[41];小球藻粉替代鱼粉水平不影响鲫鱼的体灰分含量,但体水分、体蛋白质含量下降,体脂肪含量升高[44];随替代鱼粉水平的升高,巨石斑体水分含量显著升高,体蛋白质、体脂肪和体灰分含量显著下降[48];大菱鲆[49]体水分、体蛋白质、体脂肪含量不受复合蛋白质源替代鱼粉水平的影响,但体灰分含量显著升高;发酵菜籽粕替代56.25%~75.00%的鱼粉显著降低了真鲷[50]的体蛋白质、体脂肪和体灰分含量;发酵棉籽粕替代24%鱼粉显著降低了黑鲷的体蛋白质含量,但不影响体水分、体脂肪、体灰分含量[51];本试验中去皮豆粕替代鱼粉水平不影响鱼体水分和灰分含量,但显著降低了粗脂肪和粗蛋白质含量,与以上结果有所不同,这是由于动植物蛋白质源替代对体成分的影响受鱼种、食性、试验蛋白质源等因素的影响。体蛋白质含量下降的可能原因是与鱼粉相比,动植物蛋白质源的蛋氨酸和赖氨酸含量低,当替代水平过高时,饲料氨基酸严重不平衡,影响了体蛋白质的合成量,从而导致粗蛋白质含量的降低[52]。也可能是高水平的动植物蛋白质源导致肠道、肝脏结构损伤[36, 41, 53-54],营养物质消化吸收率降低[37, 54]而影响了体成分。
3.3 去皮豆粕替代鱼粉对多鳞肝脏免疫及代谢酶活性的影响鱼类虽然具有特异性免疫功能,但与陆生动物相比还不够完善,在鱼类防御病原微生物入侵机制中非特异性免疫系统仍发挥着重要作用,SOD、AKP及CAT均是评价机体免疫力和健康状况的重要指标[55]。SOD和CAT是细胞内的重要抗氧化酶,主要作用是清除体内多余的自由基,防止过氧化对机体造成损伤,可增强吞噬细胞的防御能力及提高免疫应答水平。AKP是一种水解非特异性磷酸单酯的酶,可催化所有磷酸单酯的水解并生成磷酸根离子和自由羟基,是鱼类生理活动及疾病诊断的重要指标之一,在机体内参与磷酸基团的转移、代谢,并与RNA、DNA及蛋白质的代谢有关[56-57],当存在于肝脏中时可参与肝细胞的排泄功能[58]。机体正常代谢过程中,活性氧如超氧阴离子自由基、羟基自由基和过氧化氢的产生和消除维持着动态平衡,过量的自由基会导致脂质过氧化,作为脂质过氧化物的主要成分的MDA,具有较强的生物毒性,可导致细胞结构和功能的损伤[59]。本试验中肝脏SOD、AKP和CAT活性呈先升高后降低趋势,MDA含量随着去皮豆粕替代水平的升高呈不断上升的趋势。齐口裂腹鱼血清SOD活性和真鲷血清CAT活性随着豆粕和发酵菜籽粕替代水平的升高呈先上升后下降的趋势[5, 37],这与本试验研究结果一致;何娇娇等[53]研究中大黄鱼血清SOD活性和MDA含量变化也与本试验结果类似。而杂交鳢肝脏SOD和CAT活性表现为随着复合蛋白质源替代水平的增加呈先上升后稳定的趋势[60];日本沼虾血清SOD活性不受替代水平影响,而CAT活性表现为先下降后升高的趋势[29];棉籽粕替代鱼粉水平(0~60%)不影响乌苏里黄颡鱼肝脏SOD和CAT活性,但替代水平在50%~60%时,肝脏MDA含量显著升高,AKP活性变化与本试验结果类似[61]。造成这些免疫指标趋势变化不同的原因可能和试验鱼种、选用的蛋白质源、测定的组织等有关。
GOT和GPT主要存在于肝细胞中,在血清中含量很低,只有肝细胞受损时,细胞膜通透性增强或细胞坏死,才大量进入血液[41, 62]。在本试验中,肝脏GOT和GPT活性在DSM40组显著升高,其他各组无显著差异,这与向枭等[5]、王立改等[7]、Serge等[37]的研究结果类似。这说明肝脏能够耐受一定量的植物蛋白质源,当替代水平过高时,将影响肝脏蛋白质代谢。而发酵豆粕替代水平不影响黄金鲫肝胰脏GOT活性,但35%~70%的替代水平显著降低了黄金鲫肝胰脏GPT活性[31];发酵菜籽粕替代水平不影响真鲷血清GOT活性,但GPT活性表现为先下降后上升的趋势[37];罗非鱼血清GOT、GPT活性则表现为随着发酵豆粕替代水平的升高呈先下降后升高的趋势[45];大黄鱼[53]血清、真鲷[50]血清和杂交鳢[60]肝脏GPT活性随蛋白质源替代鱼粉水平的增加而逐渐升高,但GOT活性无显著变化;而黄颡鱼[63]、牙鲆[42]、大黄鱼[41, 47]血液GOT、GPT活性不受蛋白质源替代鱼粉水平的影响。
3.4 去皮豆粕替代鱼粉对多鳞肠道消化酶活性的影响消化酶是鱼类消化腺和消化系统分泌的对营养物质起消化作用的酶类,其活性的高低反映了鱼类对营养物质的消化能力。一般认为动植物蛋白质源替代鱼粉水平较高时,消化酶活性会下降。本试验中去皮豆粕替代水平不影响前、中、后肠的脂肪酶活性及中肠蛋白酶活性,前肠淀粉酶活性表现为DSM40组显著高于其他替代组,中、后肠淀粉酶和前、后肠蛋白酶活性均表现为先升高后下降趋势。吴莉芳等[12]的研究中去皮豆粕替代鱼粉水平不影响草鱼前、中、后肠的脂肪酶活性,前、中、后肠的淀粉酶活性呈先升高后降低趋势,与本试验类似,但前、中、后肠蛋白酶活性呈逐渐降低趋势,不同于本试验的结果。豆粕替代水平不影响日本鲈鱼[54]和花鲈[64]中肠蛋白酶和淀粉酶活性,但显著降低了前肠蛋白酶、淀粉酶和脂肪酶活性。大黄鱼肠道蛋白酶活性随着豆粕替代水平升高而显著下降,脂肪酶活性呈先升高后下降趋势,淀粉酶活性不受替代水平影响[65]。随着豆粕替代鱼粉水平的提高,牛蛙[Rana (Lithobates) catesbeiana]肠道蛋白酶的活性显著降低,而肠道淀粉酶和脂肪酶活性显著提高[66]。胭脂鱼(Myxocyprinus asiaticus)饲料中豆粕替代水平超过一定量时,肝胰脏淀粉酶、肠道脂肪酶及肠道蛋白酶活性显著低于对照组[67]。豆粕替代水平超过30%时显著降低了日本鲈鱼胃蛋白酶活性[68]。但也有研究表明,鱼粉替代水平不影响消化酶活性,如豆粕替代水平不影响褐点石斑鱼肠道胰蛋白酶、淀粉酶和脂肪酶活性[23],发酵豆粕替代水平不影响黄鳍鲷肠道蛋白酶、脂肪酶和淀粉酶活性[46]。大豆蛋白源替代鱼粉引起消化酶变化的可能原因是饲料中豆粕替代水平升高,则碳水化合物含量升高,可能会诱导淀粉酶活性的升高,但同时饲料中抗营养因子含量升高则可能降低消化酶活性,此外,随着去皮豆粕替代水平的升高,饲料中微晶纤维素含量随之减少,而高含量的纤维素会降低鱼类消化吸收能力,因此淀粉酶活性的变化是三者共同作用的结果;且鱼种、食性、测定组织的不同,使得消化酶活性的变化趋势也不尽相同。
4 结论饲料中去皮豆粕替代鱼粉水平影响多鳞幼鱼的生长性能、形态学指标、免疫指标和肠道消化酶活性。以WGR和SGR为评价指标,折线模型拟合得出多鳞幼鱼配合饲料中去皮豆粕替代鱼粉的适宜水平为29.1%。
| [1] |
周歧存, 麦康森, 刘永坚, 等. 动植物蛋白源替代鱼粉研究进展[J]. 水产学报, 2005, 29(3): 404-410. |
| [2] |
TACON A G J, DOMINY W G.Overview of world aquaculture and aquafeed production//World aquaculture Society.World aquaculture' 99.Baton Rouge, LA: World Aquaculture Society, 1999: 853.
|
| [3] |
刘雅丹. 世界鱼粉业的现状、问题和发展前景[J]. 科学养鱼, 1999(10): 3-4. |
| [4] |
王赛, 陈刚, 张健东, 等. 不同蛋白质源部分替代鱼粉对褐点石斑鱼幼鱼生长性能、体组成以及血清生化指标的影响[J]. 动物营养学报, 2012, 24(1): 160-167. DOI:10.3969/j.issn.1006-267x.2012.01.023 |
| [5] |
向枭, 周兴华, 陈建, 等. 饲料中豆粕蛋白替代鱼粉蛋白对齐口裂腹鱼幼鱼生长性能、体成分及血液生化指标的影响[J]. 水产学报, 2012, 36(5): 723-731. |
| [6] |
VIELMA J, LALL S P, KOSKELA J, et al. Influence of low dietary cholecalciferol intake on phosphorus and trace element metabolism by rainbow trout (Oncorhynchus mykiss, Walbaum)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 1999, 122(1): 117-125. |
| [7] |
王立改, 曾文繁, 楼宝, 等. 发酵豆粕替代鱼粉对黄姑鱼幼鱼生长性能、血清生化指标及肝脏中类胰岛素生长因子-Ⅰ基因表达的影响[J]. 动物营养学报, 2018, 30(3): 989-998. DOI:10.3969/j.issn.1006-267x.2018.03.023 |
| [8] |
沈斌乾, 陈建明, 叶金云, 等. 饲料中豆粕蛋白替代鱼粉蛋白对花 生长的影响[J]. 水产养殖, 2008, 29(2): 1-4. DOI:10.3969/j.issn.1004-2091.2008.02.001 |
| [9] |
王宏平, 王志晖. 去皮豆粕的生产与应用[J]. 中国油脂, 2005, 30(6): 10-12. DOI:10.3321/j.issn:1003-7969.2005.06.002 |
| [10] |
张晶. 去皮豆粕及其在饲料中的应用[J]. 吉林畜牧兽医, 2004(3): 17-18. DOI:10.3969/j.issn.1672-2078.2004.03.008 |
| [11] |
程秋根.去皮豆粕和发酵豆粕对鲫鱼生长和非特异性免疫力的影响.硕士学位论文.苏州: 苏州大学, 2008. http://d.wanfangdata.com.cn/Thesis/Y1305132
|
| [12] |
吴莉芳, 秦贵信, 赵元, 等. 饲料中去皮豆粕替代鱼粉比例对草鱼消化酶活力的影响[J]. 中国畜牧杂志, 2010, 46(1): 23-27. |
| [13] |
吴莉芳, 秦贵信, 孙泽威, 等. 饲料中去皮豆粕替代鱼粉对埃及胡子鲇消化酶活力和肠道组织的影响[J]. 中山大学学报(自然科学版), 2010, 49(4): 99-105. |
| [14] |
张锦秀.大豆蛋白源对幼建鲤生长性能及肠道免疫的影响.硕士学位论文.雅安: 四川农业大学, 2003.
|
| [15] |
黄洋, 杜涛, 黄海立. 多鳞sillago sihama Forskál人工繁殖研究[J]. 广东海洋大学学报, 2013, 33(1): 15-21. DOI:10.3969/j.issn.1673-9159.2013.01.005 |
| [16] |
曹剑香, 简纪常, 黄洋, 等. 多鳞消化系统的形态学和组织学研究[J]. 水产科学, 2010, 29(6): 339-343. DOI:10.3969/j.issn.1003-1111.2010.06.007 |
| [17] |
万瑞景. 多鳞早期发育形态[J]. 海洋水产研究, 1996, 17(1): 35-41. |
| [18] |
刘金殿, 朱立新, 卢伙胜, 等. 北部湾多鳞生长与死亡参数的估算[J]. 浙江海洋学院学报(自然科学版), 2010, 29(1): 64-69. DOI:10.3969/j.issn.1008-830X.2010.01.014 |
| [19] |
HUANG Q C, KWAKU A, DU T, et al. Dietary vitamin a requirement of Sillago sihama Forskál[J]. Aquaculture Research, 2018, 49(7): 2587-2596. DOI:10.1111/are.13725 |
| [20] |
何昊伦, 董晓慧, 谭北平, 等. 多鳞对饲料中n-3高不饱和脂肪酸需要量的研究[J]. 动物营养学报, 2018, 30(11): 4514-4525. DOI:10.3969/j.issn.1006-267x.2018.11.028 |
| [21] |
ZHANG L, FENG L, JIANG W D, et al. Vitamin A deficiency suppresses fish immune function with differences in different intestinal segments:the role of transcriptional factor NF-κB and p38 mitogen-activated protein kinase signalling pathways[J]. British Journal of Nutrition, 2017, 117(1): 67-82. DOI:10.1017/S0007114516003342 |
| [22] |
HORWITZ D W. Official methods of analysis of AOAC international[M]. 16th ed. Gaithersburg, MD: AOAC International, 1995.
|
| [23] |
刘洋, 孟连仲, 张建雄. 豆粕替代鱼粉对褐点石斑鱼生长、营养组成及血液指标影响[J]. 中国饲料, 2018(4): 60-64. |
| [24] |
谢敏, 曾国清, 向建国, 等. 豆粕部分替代鱼粉对鳡生长、肌肉成分及血浆生化指标的影响[J]. 江苏农业科学, 2018, 46(13): 165-169. |
| [25] |
杨景丰, 华雪铭, 郭子好, 等. 发酵豆粕替代鱼粉和豆粕对罗氏沼虾生长、血清生化及免疫基因表达的影响[J]. 水生生物学报, 2018, 42(4): 719-727. |
| [26] |
艾庆辉, 谢小军. 水生动物对植物蛋白源利用的研究进展[J]. 中国海洋大学学报, 2005, 35(6): 929-935. |
| [27] |
AZARM H M, LEE S M. Effects of partial substitution of dietary fish meal by fermented soybean meal on growth performance, amino acid and biochemical parameters of juvenile black sea bream Acanthopagrus schlegeli[J]. Aquaculture Research, 2014, 45(6): 994-1003. DOI:10.1111/are.12040 |
| [28] |
HASSAAN M S, SOLTAN M A, ABDEL-MOEZ A M. Nutritive value of soybean meal after solid state fermentation with Saccharomyces cerevisiae for Nile tilapia, Oreochromis niloticus[J]. Animal Feed Science and Technology, 2015, 201: 89-98. DOI:10.1016/j.anifeedsci.2015.01.007 |
| [29] |
DING Z L, ZHANG Y X, YE J Y, et al. An evaluation of replacing fish meal with fermented soybean meal in the diet of Macrobrachium nipponense:growth, nonspecific immunity, and resistance to Aeromonas hydrophila[J]. Fish & Shellfish Immunology, 2015, 44(1): 295-301. |
| [30] |
何娇娇, 王萍, 冯建, 等. 发酵豆粕对大黄鱼生长、肠道结构及肠道微生物菌群的研究[J]. 水生生物学报, 2018, 42(5): 919-928. |
| [31] |
林佳洁.发酵豆粕替代鱼粉对黄金鲫生长、免疫及肠道组织的影响.硕士学位论文.长春: 吉林农业大学, 2016.
|
| [32] |
吴莉芳, 瞿子惠, 周锴, 等. 豆粕替代鱼粉对黄金鲈生长及肠道组织的影响[J]. 西北农林科技大学学报(自然科学版), 2017, 45(6): 1-8. |
| [33] |
李学丽, 王际英, 宋志东, 等. 两种豆粕部分替代鱼粉在珍珠龙胆石斑鱼幼鱼饲料中的研究[J]. 上海海洋大学学报, 2017, 26(5): 716-725. |
| [34] |
许丹丹, 何艮, 周慧慧, 等. 玉米蛋白粉部分替代鱼粉对大菱鲆幼鱼的生长性能和游离氨基酸代谢的影响[J]. 中国海洋大学学报, 2016, 46(2): 26-34. |
| [35] |
MURASHITA K, RØNNESTAD I, FURUITA H, et al. Effects of dietary soybean meal on the bile physiology in rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 2018, 490: 303-310. DOI:10.1016/j.aquaculture.2018.02.047 |
| [36] |
ZHANG C X, RAHIMNEJAD S, WANG Y R, et al. Substituting fish meal with soybean meal in diets for Japanese seabass (Lateolabrax japonicus):effects on growth, digestive enzymes activity, gut histology, and expression of gut inflammatory and transporter genes[J]. Aquaculture, 2018, 483: 173-182. DOI:10.1016/j.aquaculture.2017.10.029 |
| [37] |
SERGE D, SHUNSUKE K, MANABU I, et al. Growth performance, blood health, antioxidant status and immune response in red sea bream (Pagrus major) fed Aspergillus oryzae fermented rapeseed meal (RM-Koji)[J]. Fish & Shellfish Immunology, 2018, 75: 253-262. |
| [38] |
苏时萍, 杨启超, 苏雷, 等. 2种虫源性蛋白替代鱼粉对黄颡鱼幼鱼生长、体成分和蛋白酶活性的影响[J]. 福建农林大学学报(自然科学版), 2010, 39(6): 608-613. |
| [39] |
TUSCHE K, ARNING S, WUERTZ S, et al. Wheat gluten and potato protein concentrate-promising protein sources for organic farming of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2012, 344-349: 120-125. DOI:10.1016/j.aquaculture.2012.03.009 |
| [40] |
SARA M, SILVIA M L, ANA T V, et al. Meat and bone meal as partial replacement for fish meal in diets for gilthead seabream (Sparus aurata) juveniles:growth, feed efficiency, amino acid utilization, and economic efficiency[J]. Aquaculture, 2017, 468: 271-277. DOI:10.1016/j.aquaculture.2016.10.024 |
| [41] |
冯建, 王萍, 何娇娇, 等. 发酵豆粕替代鱼粉对大黄鱼幼鱼生长性能、体成分、血清生化指标及肝脏组织形态的影响[J]. 动物营养学报, 2016, 28(11): 3493-3502. DOI:10.3969/j.issn.1006-267x.2016.11.016 |
| [42] |
刘襄河, 叶继丹, 王子甲, 等. 饲料中豆粕替代鱼粉比例对牙鲆生长性能及生化指标的影响[J]. 水产学报, 2010, 34(3): 450-458. |
| [43] |
LIANG X F, HU L, DONG Y C, et al. Substitution of fish meal by fermented soybean meal affects the growth performance and flesh quality of Japanese seabass (Lateolabrax japonicus)[J]. Animal Feed Science and Technology, 2017, 229: 1-12. DOI:10.1016/j.anifeedsci.2017.03.006 |
| [44] |
石西, 罗智, 黄超, 等. 小球藻替代鱼粉对鲫生长、体组成、肝脏脂肪代谢及其组织学的影响[J]. 水生生物学报, 2015, 39(3): 498-506. |
| [45] |
HASAN M R, MACINTOSH D J, JAUNCEY K. Evaluation of some plant ingredients as dietary protein sources for common carp (Cyprinus carpio L.) fry[J]. Aquaculture, 1997, 151(1/2/3/4): 55-70. |
| [46] |
EHSANI J, AZARM H M, MANIAT M, et al. Effects of partial substitution of dietary fish meal by fermented soybean meal on growth performance, body composition and activity of digestive enzymes of juvenile yellowfin sea bream (Acanthopagrus latus)[J]. International Journal of Biosciences, 2014, 5(4): 99-107. DOI:10.12692/ijb/5.4.99-107 |
| [47] |
冯建, 王萍, 何娇娇, 等. 大豆浓缩蛋白替代鱼粉对大黄鱼幼鱼生长、体成分、血清生化指标及肝组织学的影响[J]. 中国水产科学, 2017, 24(2): 268-277. |
| [48] |
GARCIA-ORTEGA A, KISSINGER K R, TRUSHENSKI J T. Evaluation of fish meal and fish oil replacement by soybean protein and algal meal from Schizochytrium limacinum in diets for giant grouper Epinephelus lanceolatus[J]. Aquaculture, 2016, 452: 1-8. DOI:10.1016/j.aquaculture.2015.10.020 |
| [49] |
董纯, 周慧慧, 麦康森, 等. 复合蛋白源替代鱼粉对大菱鲆生长、体组成和表观消化率的影响[J]. 中国海洋大学学报, 2015, 45(4): 27-34. |
| [50] |
DOSSOU S, KOSHIO S, ISHIKAWA M, et al. Effect of partial replacement of fish meal by fermented rapeseed meal on growth, immune response and oxidative condition of red sea bream juvenile, Pagrus major[J]. Aquaculture, 2018, 490: 228-235. DOI:10.1016/j.aquaculture.2018.02.010 |
| [51] |
SUN H, TANG J W, YAO X H, et al. Partial substitution of fish meal with fermented cottonseed meal in juvenile black sea bream (Acanthopagrus schlegelii) diets[J]. Aquaculture, 2015, 446: 30-36. DOI:10.1016/j.aquaculture.2015.04.020 |
| [52] |
刘沛, 叶金云, 邵仙萍, 等. 饲料中小肽豆粕替代鱼粉对青鱼幼鱼生长及其体组成的影响[J]. 浙江海洋学院学报(自然科学版), 2014, 33(1): 72-78. DOI:10.3969/j.issn.1008-830X.2014.01.013 |
| [53] |
何娇娇, 王萍, 冯建, 等. 玉米蛋白粉替代鱼粉对大黄鱼生长、血清生化指标及肝脏组织学的影响[J]. 水生生物学报, 2017, 41(3): 506-515. |
| [54] |
HOSSAIN S, KOSHIO S, ISHIKAWA M, et al. Substitution of dietary fishmeal by soybean meal with inosine administration influences growth, digestibility, immunity, stress resistance and gut morphology of juvenile amberjack Seriola dumerili[J]. Aquaculture, 2018, 488: 174-188. DOI:10.1016/j.aquaculture.2018.01.037 |
| [55] |
MING J H, YE J Y, ZHANG Y X, et al. Effects of dietary reduced glutathione on growth performance, non-specific immunity, antioxidant capacity and expression levels of IGF-Ⅰ and HSP70 mRNA of grass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2015, 438: 39-46. DOI:10.1016/j.aquaculture.2014.12.038 |
| [56] |
ROUBATY C, PORTMANN P. Relation between intestinal alkaline phosphatase activity and brush border membrane transport of inorganic phosphate, D-glucose, and D-glucose-6-phosphate[J]. Pflügers Archiv, 1988, 412(5): 482-490. DOI:10.1007/BF00582536 |
| [57] |
GIANNINI E G, TESTA R, SAVARINO V. Liver enzyme alteration:a guide for clinicians[J]. CMAJ, 2005, 172(3): 367-379. DOI:10.1503/cmaj.1040752 |
| [58] |
王石莹, 闫素梅. 碱性磷酸酶在动物骨骼代谢中的研究进展[J]. 饲料博览, 2009(4): 14-17. DOI:10.3969/j.issn.1001-0084.2009.04.005 |
| [59] |
MING J H, XIE J, XU P, et al. Effects of emodin and vitamin C on growth performance, biochemical parameters and two HSP70s mRNA expression of Wuchang bream (Megalobrama amblycephala Yih) under high temperature stress[J]. Fish & Shellfish Immunology, 2012, 32(5): 651-661. |
| [60] |
林仕梅, 马卉佳, 徐韬, 等. 复合蛋白源替代鱼粉对杂交鳢生长、体组成与生化指标的影响[J]. 水产学报, 2018, 42(5): 744-753. |
| [61] |
BU X Y, CHEN A J, LIAN X Q, et al. An evaluation of replacing fish meal with cottonseed meal in the diet of juvenile Ussuri catfish Pseudobagrus ussuriensis:growth, antioxidant capacity, nonspecific immunity and resistance to Aeromonas hydrophila[J]. Aquaculture, 2017, 479: 829-837. DOI:10.1016/j.aquaculture.2017.07.032 |
| [62] |
吉红, 程小飞, 李杰, 等. 蚕蛹替代鱼粉对框鳞镜鲤幼鱼生长性能、体成分及健康状况的影响[J]. 水产学报, 2012, 36(10): 1599-1611. |
| [63] |
文远红, 曹俊明, 黄燕华, 等. 蝇蛆粉替代鱼粉对黄颡鱼幼鱼生长性能、体组成和血浆生化指标的影响[J]. 动物营养学报, 2013, 25(1): 171-181. DOI:10.3969/j.issn.1006-267x.2013.01.022 |
| [64] |
王亚如.豆粕替代鱼粉对花鲈生长性能和肠道健康的影响.硕士毕业论文.厦门: 集美大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10390-1017085715.htm
|
| [65] |
张帆, 张文兵, 麦康森, 等. 饲料中豆粕替代鱼粉对大黄鱼生长、消化酶活性和消化道组织学的影响[J]. 中国海洋大学学报, 2012, 42(S1): 75-82. |
| [66] |
方卫东, 鲁康乐, 张春晓, 等. 豆粕替代鱼粉对牛蛙生长、体组成、消化酶活力及肝脏生化指标的影响[J]. 水产学报, 2016, 40(11): 1742-1752. |
| [67] |
YU D H, GONG S Y, YUAN Y C, et al. Effects of replacing fish meal with soybean meal on growth, body composition and digestive enzyme activities of juvenile Chinese sucker, Myxocyprinus asiaticus[J]. Aquaculture Nutrition, 2013, 19(1): 84-90. DOI:10.1111/j.1365-2095.2012.00945.x |
| [68] |
LI Y, AI Q H, MAI K S, et al. Comparison of high-protein soybean meal and commercial soybean meal partly replacing fish meal on the activities of digestive enzymes and aminotransferases in juvenile Japanese seabass, Lateolabrax japonicus (Cuvier, 1828)[J]. Aquaculture Research, 2014, 45(6): 1051-1060. DOI:10.1111/are.12042 |




