2. 水产高效健康生产湖南省协同创新中心, 常德 415000;
3. 农业部淡水渔业和种质资源利用重点实验室, 中国水产科学研究院淡水渔业研究中心, 无锡 214081;
4. 常德大北农饲料有限公司, 津市 415401
2. Collaborative Innovation Center for Efficient and Health Production of Fisheries in Hunan Province, Changde 415000, China;
3. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China;
4. Changede DBN Feed Co., Ltd., Jinshi 415401, China
随着水产养殖技术的不断发展以及湖泊和水库的限养,集约化高密度养殖已是大势所趋。为了获得较高的养殖产量和最大的经济效益,生产者会尽可能的提高养殖密度。但如果养殖密度过高,鱼体长时间处于应激状态,则需要大量的能量来维持生理平衡、抵御应激反应,易造成生理功能紊乱、生长速率降低、免疫力降低[1],严重时甚至会造成死亡[2]。而养殖密度过低则不利于对水资源的充分利用,而且对于集群动物来说,养殖密度过低对其生长有负面影响[3]。目前有关营养调控缓解环境胁迫的研究主要集中在抗急性胁迫方面,如适量维生素C、维生素E均可增强青鱼幼鱼的免疫力和抗氨氮胁迫能力[4-5]。而通过营养调控来缓解慢性胁迫的研究较少,有研究表明,在长期密度胁迫中,饲料中添加维生素C可提高南美白对虾(Penaeus vannamei)的免疫力[6]。
牛磺酸(Tau)又名牛胆酸,其化学性质稳定,以游离形式广泛分布于动物组织细胞中。牛磺酸不仅有促进鱼类生长性能[7-8]和增强机体免疫的能力[9-10],而且还有抗急性胁迫的能力。有研究表明,黄斑蓝子鱼(Siganus canaliculatus)[11]经过0.02‰的牛磺酸浸泡2 d后可提高鱼体抗急性拥挤胁迫能力。在本课题组前期研究表明,当鱼粉含量低于20%时,会显著降低青鱼幼鱼的生长性能[12];此外,在含10%鱼粉饲料中添加0.1%~0.2%的牛磺酸(饲料中牛磺酸占比为0.17%~0.27%)可促进青鱼幼鱼生长,提高机体免疫力和抗急性拥挤胁迫能力[13]。但有关饲料中添加牛磺酸能否缓解慢性拥挤胁迫尚未见报道。本试验通过研究牛磺酸在不同养殖密度下对青鱼幼鱼生长、免疫及抗胁迫能力的影响,探讨其是否具有缓解慢性拥挤胁迫的能力,以期为牛磺酸在水产养殖实践生产中的应用提供理论依据。
1 材料与方法 1.1 试验饲料在含20%鱼粉的实用饲料配方基础上,分别添加0、0.10%的牛磺酸,并且按照等氮等能原则设计出2种试验饲料(鱼粉、牛磺酸的添加量参考本课题组前期研究结果[14]),其组成及营养水平见表 1。饲料制备时,鱼粉和豆粕等饲料原料先经粉碎,过40目筛网,再按配比从小到大逐级定量均匀混合;然后将其倒入V型搅拌机充分混合25 min;随后将鱼油与已混好的干粉充分混匀,再加入适量的水揉匀,将其加工制成直径为1.5 mm的颗粒饲料,晾干至饲料水分含量为10%左右,置于-20 ℃冰箱中保存备用。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验鱼是由湖南省水产科学研究所购买的同批次人工孵化的青鱼鱼苗,在湖南省娄底市新化县车田江水库网箱(5 m×5 m×5 m)中暂养14 d,待暂养结束后将青鱼幼鱼[初重为(2.50±0.02) g]分组,开始正式试验。采用双因素试验设计(初始密度×牛磺酸添加量),初始密度设低(50尾/网箱)、中(100尾/网箱)、高(200尾/网箱)3个水平,牛磺酸设0、0.10% 2个添加量,共形成6个处理,每个处理设3个重复,另外多做1个重复,用于补足第8周采样所用鱼及死鱼,按照均重补至每网箱。养殖试验在车田江水库网箱(1.5 m×1.5 m×1.5 m)中进行,持续16周,分别在第8、16周末采样1次。日投饵量为每网箱体重的2%~5%,投喂3次(08:00、12:00、17:00)。试验期间的水温为(26±3) ℃。每天做好养殖记录,如水温、死鱼情况等。
1.3 样本采集试验第8周及第16周结束时,禁食24 h,对各网箱中青鱼进行记数、称重,计算生长指标。从各试验网箱随机取5尾青鱼,用丁香油进行麻醉,1 mL注射器尾静脉取血,将血液混合并置于无菌离心管中,4 ℃静置过夜,3 000 r/min离心10 min,取上层血清置于-80 ℃冰箱保存备用。每网箱随机选取3尾青鱼测体长、体重,冰盘迅速解剖并分离内脏团、肝脏、肠道,称量肝脏、内脏重量,计算形体指标,并用冷冻的去离子水冲去剔除的肠周围脂肪和内容物,取前肠放入1.5 mL离心管中,编号并标记,放入-80 ℃冰箱保存备用。每网箱随机取5尾青鱼置于-20 ℃冰箱冰冻作全鱼样品,用于体成分的测定。
1.4 检测指标与方法 1.4.1 生长指标青鱼成活率(SR)、增重率(WGR)、饲料系数(FCR)、肥满度(CF)、肝体比(HSI)、脏体比(VSI)的计算方法(第16周WGR和FCR以初始体重计算;第16周SR以第1次采样后补完鱼计算)如下:
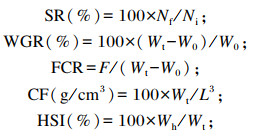
|
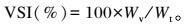
|
式中:Nf为网箱内最终鱼数量;Ni为网箱内最初鱼数量;W0为平均每尾初始体重(g);Wt为平均每尾终末体重(g);F为平均饲料摄入量(g);Wh为每尾肝脏重量(g);Wv为每尾内脏重量(g);L为鱼体体长(cm)。
1.4.2 体成分测定鱼体常规成分测定参照AOAC(1995)[15]的方法。其中,水分含量的测定采用105 ℃烘箱干燥恒重法,粗蛋白质含量的测定采用凯氏定氮法,粗脂肪含量的测定采用索氏抽提法,粗灰分含量的测定采用550 ℃灼烧法。
1.4.3 肠道消化酶活性测定测定前将样品解冻,测定淀粉酶和脂肪酶的样品用生理盐水进行匀浆,测定胰蛋白酶活性的样品用匀浆介质进行匀浆,用离心机3 500 r/min离心10 min,取上清液保存待测。用南京建成生物工程研究所生产的试剂盒测定肠道消化酶活性,所用仪器为UV-5200型分光光度计。
1.4.4 血清指标的测定血清胰岛素类生长因子-1(IGF-1)、生长激素(GH)、皮质醇(COR)、免疫球蛋白M(IgM)、肠道分泌型免疫球蛋白A(S-IgA)含量用酶联免疫吸附测定法进行测定,甘油三酯(TG)、总胆固醇(TC)、丙二醛(MDA)、葡萄糖(GLU)含量及超氧化物歧化酶(SOD)、溶菌酶(LSZ)活性采用南京建成生物工程研究所生产的试剂盒,在Thermo-1510酶标仪上进行检测。
1.5 统计分析试验结果先利用Excel 2013进行统计,再利用SPSS 19.0软件进行单因素方差分析(one-way ANOVA)与双因素方差分析(two-way ANOVA),当单因素方差分析处理之间差异显著(P < 0.05)时,则用Duncan氏法进行多重比较,试验数据用“平均值±标准误”表示。
2 结果 2.1 生长性能由表 2可知,在试验第8周时,牛磺酸对青鱼幼鱼的终末体重、WGR、FCR和SR均无显著影响(P>0.05),而养殖密度对上述指标均有显著影响(P < 0.05)。牛磺酸添加量为0时青鱼幼鱼的WGR随着养殖密度的升高先上升后下降,牛磺酸添加量为0.10%时青鱼幼鱼的WGR则随着养殖密度的升高而降低;FCR与其相反。在6个处理中,以未添加牛磺酸且养殖密度为50尾/网箱的处理WGR最高,FCR最低。牛磺酸添加量为0时,低密度组的SR最高,显著高于中密度组(P < 0.05);牛磺酸添加量为0.10%时,高密度组的SR最高,显著高于中密度组(P < 0.05)。养殖密度和牛磺酸对青鱼幼鱼的体形指标(HSI、VSI和CF)均无显著影响(P>0.05)。牛磺酸和养殖密度对青鱼幼鱼的生长性能无显著的交互作用(P>0.05)。
|
|
表 2 不同养殖密度下牛磺酸对青鱼幼鱼生长性能的影响 Table 2 Effects of Tau on growth performance of juvenile black carp under different stocking densities (n=3) |
在试验第16周时,青鱼幼鱼的WGR有随着密度升高呈下降趋势,且在牛磺酸添加量为0时高密度组显著低于低、中密度组(P < 0.05),FCR与其相反。饲料中添加牛磺酸有提高WGR的趋势且在高密度组有显著升高(P < 0.05),FCR与其相反,同时添加牛磺酸高密度处理的WGR达到了未添加牛磺酸中密度处理水平。牛磺酸添加量为0时青鱼幼鱼的VSI有随着养殖密度的升高呈上升的趋势,且在高密度组显著高于低密度组(P < 0.05),HSI和CF没有显著变化(P>0.05);但饲料中添加牛磺酸可使青鱼幼鱼的VSI、HSI和CF下降,且中密度组的VSI显著降低(P < 0.05)。牛磺酸和养殖密度对青鱼幼鱼的SR和VSI有显著的交互作用(P < 0.05)。
2.2 体成分由表 3可知,在试验第8周时,养殖密度对青鱼幼鱼体成分没有显著影响(P>0.05),而饲料中添加牛磺酸会显著降低各密度组的水分含量(P < 0.05),显著提高各密度组的粗灰分含量(P < 0.05),一定程度提高粗脂肪含量(P>0.05),并且能够显著提高低密度组的粗蛋白质含量(P < 0.05)。牛磺酸和养殖密度对青鱼幼鱼的粗灰分含量有显著的交互作用(P < 0.05)。
|
|
表 3 不同养殖密度下牛磺酸对青鱼幼鱼体成分的影响 Table 3 Effects of Tau on body composition of juvenile black carp under different stocking densities (n=3) |
在试验16周时,牛磺酸和养殖密度对青鱼幼鱼体成分没有显著影响且二者没有显著的交互作用(P>0.05)。
2.3 血清中GH和IGF-1含量由表 4可知,在试验第8周时,青鱼幼鱼血清中GH和IGF-1含量各组间差异不显著(P>0.05)。牛磺酸和养殖密度对青鱼幼鱼血清中GH和IGF-1含量无显著的交互作用(P>0.05)。
|
|
表 4 不同养殖密度下牛磺酸对青鱼幼鱼血清中GH和IGF-1含量的影响 Table 4 Effects of Tau on serum GH and IGF-1 contents of juvenile black carp under different stocking densities (n=3) |
在试验第16周时,高养殖密度有使青鱼幼鱼血清中GH和IGF-1含量降低(P>0.05),饲料中添加牛磺酸可提高青鱼幼鱼血清中GH和IGF-1含量,且高密度组血清中GH含量显著升高(P < 0.05)。牛磺酸和养殖密度对青鱼幼鱼血清中GH和IGF-1含量无显著的交互作用(P>0.05)。
2.4 肠道消化酶活性由表 5可知,在试验第8周时,青鱼幼鱼肠道脂肪酶和淀粉酶活性随着养殖密度的升高有升高的趋势,且在牛磺酸添加量为0时高密度组肠道淀粉酶活性显著高于低密度组(P < 0.05),牛磺酸添加量为0.10%时高密度组肠道淀粉酶活性显著高于低、中密度组(P < 0.05)。在高养殖密度下,饲料中添加牛磺酸可显著提高肠道胰蛋白酶活性(P < 0.05)。饲料中添加牛磺酸可不同程度提高各密度组肠道脂肪酶活性,其中高密度组脂肪酶活性显著提高(P < 0.05)。牛磺酸和养殖密度对青鱼幼鱼肠道消化酶活性无显著的交互作用(P>0.05)。
|
|
表 5 不同养殖密度下牛磺酸对青鱼幼鱼肠道消化酶活性的影响 Table 5 Effects of Tau on intestinal digestive enzyme activities of juvenile black carp under different stocking densities (n=3) |
在试验第16周时,青鱼幼鱼肠道脂肪酶和淀粉酶活性随着养殖密度的升高呈先上升后下降的趋势,胰蛋白酶活性则逐渐下降,其中在牛磺酸添加量为0时中密度组肠道淀粉酶活性显著高于低、高密度组(P < 0.05)。饲料中添加牛磺酸可不同程度降低各密度组肠道胰蛋白酶和淀粉酶活性,其中中密度组淀粉酶活性显著降低(P < 0.05)。牛磺酸和养殖密度对青鱼幼鱼肠道消化酶活性无显著的交互作用(P>0.05)。
2.5 血清免疫及抗氧化指标由表 6可知,在试验第8周时,随着养殖密度的升高,血清中MDA含量呈上升的趋势,IgM含量呈下降的趋势,在牛磺酸添加量为0.10%时高密度组血清中MDA含量显著高于中、低密度组(P < 0.05)。血清中S-IgA含量随着养殖密度的升高先升高后降低,在添加和不添加牛磺酸的情况下均表现为中密度组显著高于低密度组(P < 0.05)。在高养殖密度下,饲料中添加牛磺酸显著提高血清中MDA含量(P < 0.05)。牛磺酸和养殖密度对青鱼幼鱼血清中LSZ活性有显著的交互作用(P < 0.05)。
|
|
表 6 不同养殖密度下牛磺酸对青鱼幼鱼血清免疫及抗氧化指标的影响 Table 6 Effects of Tau on serum immune and antioxidant parameters of juvenile black carp under different stocking densities (n=3) |
在试验第16周时,牛磺酸添加量为0时,随着养殖密度的升高,血清中S-IgA含量呈下降趋势,血清中MDA含量呈升高的趋势。饲料中添加牛磺酸有提高各密度组血清中IgM含量和SOD活性的趋势,并且有降低各密度组血清中S-IgA的含量,但差异均未达显著水平(P>0.05)。牛磺酸和养殖密度对青鱼幼鱼血清免疫及抗氧化指标无显著的交互作用(P>0.05)。
2.6 血清应激指标由表 7可知,在试验第8周时,牛磺酸添加量为0.10%时,中密度组血清中TC含量显著高于低、高密度组(P < 0.05),高密度组血清中TG含量显著低于低、中密度组(P < 0.05)。饲料中添加牛磺酸可显著提高中密度组血清中TC含量(P < 0.05),并显著降低高密度组血清中COR含量(P < 0.05)。牛磺酸和养殖密度对青鱼幼鱼血清中TC和TG含量有显著的交互作用(P < 0.05)。
|
|
表 7 不同养殖密度下牛磺酸对青鱼幼鱼血清应激指标的影响 Table 7 Effects of Tau on serum stress parameters of juvenile black carp under different stocking densities (n=3) |
在试验第16周时,牛磺酸添加量为0时中密度组血清中TG含量显著低于低密度组(P < 0.05),牛磺酸添加量为0.10%时中、低密度组血清中TG含量显著低于高密度组(P < 0.05)。饲料中添加牛磺酸可不同程度提高各密度组血清中COR含量,且低密度组血清中COR含量显著提高(P < 0.05)。牛磺酸和养殖密度对青鱼幼鱼血清中TG含量有显著的交互作用(P < 0.05)。
3 讨论 3.1 不同养殖密度下牛磺酸对青鱼幼鱼生长性能的影响高养殖密度作为一种慢性胁迫因子,会对鱼类造成一定程度的应激效应,机体需要消耗更多的能量来应对胁迫,以维持正常的代谢过程,进而导致鱼类机体免疫损伤或死亡[16]。本试验结果表明,随着养殖密度的升高,WGR有下降的趋势,且后期高密度组降低显著,这与在尾斑石脂鲤(Brycon insignis)[17]上的研究结果一致。而当饲料中添加0.10%牛磺酸时,可提高中、高密度组的WGR,且高密度组WGR可达到未添加牛磺酸时中密度组的养殖效果。这可能是因为牛磺酸具有缓解高密度所带来的慢性胁迫应激效果,从而改善高密度下的养殖效果。本试验结果还证实,高养殖密度会使青鱼幼鱼血清中GH和IGF-1含量降低,这与在虹鳟(Oncorhynchus mykiss)[18]上所得结果类似。而当饲料中添加牛磺酸时可提高GH和IGF-1的分泌,其原因是牛磺酸可提高血清中甲状腺激素[三碘甲状腺原氨酸(T3)、甲状腺素(T4)]的含量,从而调控IGF-1和GH的分泌,进而改善鱼类的生长和发育[19-20]。肠道消化酶活性的高低直接反映了机体对营养物质的消化吸收能力,并且消化酶的分泌可以促进机体摄食,进而提高生长性能。在本试验养殖后期,高密度组青鱼幼鱼肠道消化酶活性低于中密度组,其原因是高养殖密度胁迫环境会影响鱼体摄食,从而导致消化酶活性降低,并且机体处在应激状态下会影响体内酶的合成和分泌[21]。而饲料中添加牛磺酸可提高养殖前期高密度组脂肪酶和胰蛋白酶的活性。
3.2 不同养殖密度下牛磺酸对青鱼幼鱼免疫及抗胁迫能力的影响高养殖密度作为胁迫因子会对鱼类免疫及抗氧化能力造成一定影响[22]。LSZ是鱼类重要的非特异性免疫因子之一,被分泌到血液及黏液中发挥溶菌效应[23]。有研究表明,当鱼体受到急性胁迫后,通常伴随着血液LSZ活性升高,而慢性胁迫则会造成LSZ活性降低[24]。在本试验中,青鱼幼鱼血清中LSZ活性随着养殖密度的升高没有显著变化。这些结果的不同提示,胁迫后鱼体LSZ活性变化的趋向可能受到诸多因素的影响,如胁迫的类型、强度和时间等[25]。IgM是鱼类主要的一种抗体,在本试验后期青鱼幼鱼血清中IgM含量随着养殖密度的升高而下降,这与在智利油南鲫鱼(Eleginops maclovinus)[26]、虹鳟[27]上所得结果基本一致,说明长期拥挤胁迫使会在一定程度上降低青鱼幼鱼的免疫力。饲料中添加牛磺酸可增加血清IgM的含量,说明牛磺酸的添加可增强机体免疫力,从而缓解高养殖密度慢性胁迫。当鱼类面临环境与生理胁迫时会产生氧化压力,鱼体内SOD活性和MDA含量的高低间接反映了机体的抗氧化能力[28]。本研究结果表明,随着养殖密度的升高,青鱼幼鱼血清中MDA含量增加,表明高密度组鱼体受到拥挤胁迫时机体能耗升高,促进了氧自由基的产生,导致血清中MDA含量升高。牛磺酸的添加能促使中、高密度组血清中SOD活性上升,这可能是因为牛磺酸能在高养殖密度环境下增强机体清除超氧阴离子自由基的能力,从而减轻过多的活性氧自由基对机体所造成的氧化损伤,降低脂质过氧化程度。
应激反应是机体对外界刺激的一种非特异性防御反应,鱼体的应激灵敏信号是血清COR和GLU含量的变化,通常高养殖密度应激下血清COR含量呈上升趋势[17]。本试验结果显示,经过8周养殖后,随着养殖密度的升高,青鱼幼鱼血清中COR含量有上升趋势,与曹阳等[29]的研究结果基本一致。而添加牛磺酸能够降低各养殖密度下青鱼幼鱼血清中COR的含量,且高密度组效果最明显,这与黄斑篮子鱼[11]浅水应激结果类似,说明在饲料中添加牛磺酸有助于缓解高养殖密度环境对青鱼幼鱼所带来的负面影响。但经过16周的养殖后,血清中COR的含量反而出现降低,可能的原因是鱼体经长时间养殖后对环境胁迫已逐渐适应,从而血清中COR含量随着养殖时间的延续逐渐下降[30]。可反映机体处于应激状况的另一重要特征是血脂含量的变化,目前已有报道表明养殖密度对虹鳟[31]和欧洲狼鲈(Dicentrarchus labrax)[32]血清中TC和TG含量有影响。血清中的TC和TG主要来源于肠道对于脂类的吸收以及肝脏中脂肪的代谢,鱼体利用自身的平衡与调节机制,增加了肝脏中脂肪的代谢,以提供更多能量来满足抗应激的需求[33]。本研究结果显示,在饲料中添加牛磺酸可提高低、中密度组血清中TC含量,表明牛磺酸对青鱼幼鱼脂肪代谢有一定的促进作用,这与刘兴旺等[34]、Hoseini等[35]的研究结果相似。但在高养殖密度下牛磺酸对青鱼幼鱼脂肪代谢没有直接影响,具体原因有待进一步研究。
4 结论在本试验条件下,养殖密度在100尾/网箱时最适合青鱼幼鱼生长,养殖密度升高到200尾/网箱时会使青鱼幼鱼生长减慢,免疫力下降,抗氧化能力降低;饲料中添加0.10%牛磺酸能够提高青鱼幼鱼的生长性能和免疫力,且在养殖密度为200尾/网箱时效果最好,并可缓解前期高密度养殖引起的慢性胁迫反应。
| [1] |
宋志飞, 温海深, 李吉方, 等. 养殖密度对流水养殖系统中俄罗斯鲟幼鱼生长的影响[J]. 水产学报, 2014, 38(6): 835-842. |
| [2] |
TAKAGI S, MURATA H, GOTO T, et al. Hemolytic suppression roles of taurine in yellowtail Seriola quinqueradiata fed non-fishmeal diet based on soybean protein[J]. Fisheries Science, 2006, 72(3): 546-555. DOI:10.1111/j.1444-2906.2006.01183.x |
| [3] |
孙大川, 谭洪新, 罗国芝, 等. 养殖密度对宝石鲈生长性能和血液生化指标的影响[J]. 渔业现代化, 2009, 36(2): 12-15. DOI:10.3969/j.issn.1007-9580.2009.02.003 |
| [4] |
胡毅, 黄云, 文华, 等. 维生素C对青鱼幼鱼生长、免疫及抗氨氮胁迫能力的影响[J]. 水产学报, 2013, 37(4): 565-573. |
| [5] |
黄云, 胡毅, 文华, 等. 维生素E对青鱼幼鱼生长、免疫及抗氨氮胁迫能力的影响[J]. 水生生物学报, 2013, 37(3): 507-514. |
| [6] |
陈亚坤.Vc对拥挤胁迫下南美白对虾免疫机能的影响[D].硕士学位论文.保定: 河北农业大学, 2011.
|
| [7] |
LÓPEZ L M, FLORES-IBARRA M, BAÑUELOS-VARGAS I, et al. Effect of fishmeal replacement by soy protein concentrate with taurine supplementation on growth performance, hematological and biochemical status, and liver histology of totoaba juveniles (Totoaba macdonaldi)[J]. Fish Physiology and Biochemistry, 2015, 41(4): 921-936. DOI:10.1007/s10695-015-0058-5 |
| [8] |
YUN B, AI Q H, MAI K S, et al. Synergistic effects of dietary cholesterol and taurine on growth performance and cholesterol metabolism in juvenile turbot (Scophthalmus maximus L.) fed high plant protein diets[J]. Aquaculture, 2012, 324-325: 85-91. DOI:10.1016/j.aquaculture.2011.10.012 |
| [9] |
YANG H J, TIAN L X, HUANG J W, et al. Dietary taurine can improve the hypoxia-tolerance but not the growth performance in juvenile grass carp Ctenopharyngodon idellus[J]. Fish Physiology and Biochemistry, 2013, 39(5): 1071-1078. DOI:10.1007/s10695-012-9763-5 |
| [10] |
凌云.牛磺酸对虎纹蛙(Hoplobatrachus rugulosa)非特异性免疫、消化酶活力及抗氧化能力的影响[D].硕士学位论文.金华: 浙江师范大学, 2012.
|
| [11] |
卢玉标, 游翠红, 王树启, 等. 浅水应激后黄斑蓝子鱼生理指标变化及牛磺酸的抗应激作用[J]. 水生生物学报, 2014, 38(1): 68-74. |
| [12] |
毛盼, 胡毅, 李金龙, 等. 豆粕替代鱼粉对青鱼幼鱼生长及生理生化指标的影响[J]. 淡水渔业, 2013, 43(5): 50-56,67. DOI:10.3969/j.issn.1000-6907.2013.05.009 |
| [13] |
田芊芊, 胡毅, 毛盼, 等. 低鱼粉饲料中添加牛磺酸对青鱼幼鱼生长、肠道修复及抗急性拥挤胁迫的影响[J]. 水产学报, 2016, 40(9): 1330-1339. |
| [14] |
毛盼.青鱼幼鱼低鱼粉饲料中添加牛磺酸的应用研究[D].硕士学位论文.长沙: 湖南农业大学, 2014.
|
| [15] |
AOAC.Official methods of analysis of AOAC international[S].16th ed.Arlington, VA: Association of Official Analytical Chemists International, 1995: 1094.
|
| [16] |
程佳佳, 李吉方, 温海深, 等. 养殖密度对杂交鲟幼鱼生长、肌肉组分和血液生理生化指标的影响[J]. 中国水产科学, 2015, 22(3): 433-441. |
| [17] |
TOLUSSI C E, HILSDORF A W S, CANEPPELE D, et al. The effects of stocking density in physiological parameters and growth of the endangered teleost species piabanha, Brycon insignis(Steindachner, 1877)[J]. Aquaculture, 2010, 310(1/2): 221-228. |
| [18] |
刘群.水库网箱养殖密度对虹鳟福利状况的影响及生理机制[D].博士学位论文.青岛: 中国海洋大学, 2014.
|
| [19] |
高春生, 范光丽, 王艳玲. 牛磺酸对黄河鲤鱼血清T3、T4含量的影响[J]. 安徽农业科学, 2007, 35(21): 6440. DOI:10.3969/j.issn.0517-6611.2007.21.052 |
| [20] |
CLAY L A, WANG S Y, WOLTERS W R, et al. Molecular characterization of the insulin-like growth factor-Ⅰ(IGF-Ⅰ) gene in channel catfish (Ictalurus punctatus)[J]. Biochimica et Biophysica Acta:Gene Structure and Expression, 2005, 1731(3): 139-148. DOI:10.1016/j.bbaexp.2005.10.001 |
| [21] |
肖鸣鹤, 肖英平, 吴志强, 等. 养殖密度对克氏原螯虾幼虾生长、消化酶活力和生理生化指标的影响[J]. 水产学报, 2012, 36(7): 1088-1093. |
| [22] |
HEGAZI M M, ATTIA Z I, ASHOUR O A. Oxidative stress and antioxidant enzymes in liver and white muscle of Nile tilapia juveniles in chronic ammonia exposure[J]. Aquatic Toxicology, 2010, 99(2): 118-125. DOI:10.1016/j.aquatox.2010.04.007 |
| [23] |
MAGNADOTTIR B. Immunological control of fish diseases[J]. Marine Biotechnology, 2010, 12(4): 361-379. DOI:10.1007/s10126-010-9279-x |
| [24] |
陈成勋, 邢克智, 孙学亮. 急性拥挤胁迫对半滑舌鳎血液指标的影响[J]. 华北农学报, 2011, 26(1): 229-233. |
| [25] |
FEVOLDEN S E, RØED K H, FJALESTAD K. A combined salt and confinement stress enhances mortality in rainbow trout (Oncorhynchus mykiss) selected for high stress responsiveness[J]. Aquaculture, 2003, 216(1/2/3/4): 67-76. |
| [26] |
VARGAS-CHACOFF L, MARTÍNEZ D, OYARZÚN R, et al. Combined effects of high stocking density and Piscirickettsia salmonis treatment on the immune system, metabolism and osmoregulatory responses of the Sub-Antarctic Notothenioid fish Eleginops maclovinus[J]. Fish & Shellfish Immunology, 2014, 40(2): 424-434. |
| [27] |
YARAHMADI P, MIANDARE H K, FAYAZ S, et al. Increased stocking density causes changes in expression of selected stress-and immune-related genes, humoral innate immune parameters and stress responses of rainbow trout (Oncorhynchus mykiss)[J]. Fish & Shellfish Immunology, 2016, 48: 43-53. |
| [28] |
VIARENGO A, CANESI L, MARTINEZ P G, et al. Pro-oxidant processes and antioxidant defence systems in the tissues of the Antarctic scallop (Adamussium colbecki) compared with the Mediterranean scallop (Pecten jacobaeus)[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 1995, 111(1): 119-126. DOI:10.1016/0305-0491(94)00228-M |
| [29] |
曹阳, 李二超, 陈立侨, 等. 养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响[J]. 水生生物学报, 2014, 38(5): 968-974. |
| [30] |
王文博, 汪建国, 李爱华, 等. 拥挤胁迫后鲫鱼血液皮质醇和溶菌酶水平的变化及对病原的敏感性[J]. 中国水产科学, 2004, 11(5): 408-412. DOI:10.3321/j.issn:1005-8737.2004.05.005 |
| [31] |
刘群, 温海深, 李吉方, 等. 网箱养殖密度对虹鳟甲状腺激素及血脂指标的影响[J]. 水生生物学报, 2014, 38(6): 1076-1083. |
| [32] |
DI MARCO P, PRIORI A, FINOIA M G, et al. Physiological responses of European sea bass Dicentrarchus labrax to different stocking densities and acute stress challenge[J]. Aquaculture, 2008, 275(1/2/3): 319-328. |
| [33] |
CHEN X R, NIU C J, PU L J. Effects of stocking density on growth and non-specific immune responses in juvenile soft-shelled turtle, Pelodiscus sinensis[J]. Aquaculture Research, 2007, 38(13): 1380-1386. DOI:10.1111/j.1365-2109.2007.01813.x |
| [34] |
刘兴旺, 麦康森, 刘付志国, 等. 动植物蛋白源及牛磺酸对大菱鲆摄食、生长及体组成的影响[J]. 中国海洋大学学报, 2018, 48(5): 25-31. |
| [35] |
HOSEINI S M, HOSSEINI S A, ESKANDARI S, et al. Effect of dietary taurine and methionine supplementation on growth performance, body composition, taurine retention and lipid status of Persian sturgeon, Acipenser persicus(Borodin, 1897), fed with plant-based diet[J]. Aquaculture Nutrition, 2018, 24(1): 324-331. DOI:10.1111/anu.12563 |




