2. 上海海洋大学水产与生命学院, 上海 201506;
3. 中国水产科学研究院南海水产研究所深圳实验基地, 深圳 518121
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201506, China;
3. Shenzhen Base of South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shenzhen 518121, China
叶酸(folic acid)于1930年和1941年被分别从酵母和菠菜中分离出来,并于1945年被正式命名为叶酸。叶酸由碟啶环、谷氨酸和对氨基苯甲酸3部分组成[1]。是鱼类正常发育和生长过程中必需的一种B族维生素。不同形式的辅酶可以作为一碳单位的供体或载体来发挥作用,在生物体内以最活泼的四氢叶酸(FH4)形式存在,作为极其重要的辅助因子介导一碳单位转运,从而影响蛋白质、核苷酸和泛酸的合成及分子的甲基化[2]。研究发现,叶酸在提高动物免疫力[3]、促进动物生长[4]和提高动物繁殖[5-6]等方面也具有重要的作用。在水产动物叶酸缺乏症的研究中发现,叶酸缺乏时水生动物出现生长不佳、游动缓慢、成活率下降等现象[7-8]。饲料中添加适宜水平的叶酸能够促进虹鳟(Oncorhynchus mykiss)[9](0.3~0.6 mg/kg)、草鱼(Ctenopharyngodonidella)[10](3.6~4.3 mg/kg)、吉奥罗非鱼(Oreochromisniloticus × O.aureus)[11](0.82 mg/kg)、吉富罗非鱼(Oreochromisniloticus)[12](0.4~0.7 mg/kg)、斑点叉尾(Ictalurus punctatus)[13](1.5 mg/kg)和石斑鱼(Epinephelus malabaricus)[14](0.8 mg/kg)等的生长。叶酸在鱼体内由于不能由其他物质合成或合成很少不能满足正常的生长发育,因此必须从食物中获取[12]。
卵形鲳鲹属鲈形目、鯵科、鲳鯵属,其生长快、鱼肉细嫩、味鲜美,为名贵的食用鱼类,是目前海水养殖中大量使用配合饲料的几种鱼类之一[15]。本实验室已研究了肌醇对卵形鲳鲹生长的影响以及卵形鲳鲹对饲料中泛酸(21.03 mg/kg)和维生素B2(4.23~6.24 mg/kg)的需要量[16-18],但目前国内外关于卵形鲳鲹对叶酸需要量的研究还未见报道。因此,本试验旨在通过投喂添加不同水平叶酸的半纯化饲料,研究其对卵形鲳鲹幼鱼生长性能、体成分、血清生化和免疫指标、肝脏抗氧化指标和叶酸积蓄量的影响,以确定卵形鲳鲹幼鱼对饲料中叶酸的需要量。
1 材料与方法 1.1 试验饲料以酪蛋白(不含维生素)、大豆浓缩蛋白、豆粕、花生粕、鱼粉为主要蛋白质源,以玉米淀粉为主要糖源,以鱼油和大豆卵磷脂为主要脂肪源制作基础饲料,其组成及营养水平见表 1。在基础饲料中分别按照0、1、2、3、4、5和6 mg/kg 7个水平添加叶酸(纯度98%,购自美国Sigma公司),以微晶纤维素作为填充剂,配制等氮等能的7种试验饲料。饲料原料经过粉碎,过40目孔径筛网,按表 1配比混合均匀,少量的组分采用逐级扩大法混合,初步混匀后放入搅拌机(SZ250,广州旭众食品有限公司)搅拌10 min取出,再按比例加入鱼油和大豆卵磷脂,细心搓碎至无较大团状物后过40目筛网,然后倒进搅拌机搅拌10 min,加入约40%的水后再搅拌5 min。最后用双螺杆挤条机(F-26,广州华南理工大学)挤压成直径为2.0和2.5 mm 2种规格的条状物,用造粒机(G-500,广州华南理工大学)制成沉性颗粒饲料。将制得的饲料在18 ℃空调房内晾干,放于冰箱中密封保存。试验饲料中叶酸水平委托广东省食品工业研究所采用高效液相色谱法(GB/T 9695.28—2008)检测,得出实际水平分别为0.31、0.94、1.76、2.83、4.20、5.69和6.32 mg/kg。
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
养殖试验在中国水产科学研究院南海水产研究所深圳试验基地完成。养殖试验开始前,试验鱼停食24 h,然后用丁香酚(成都艾科达化学试剂有限公司)麻醉,挑选大小均匀、健康、有活力、平均初始体质量为(7.77±0.10) g的幼鱼525尾,随机分成7组,每组3个重复,每个重复25尾。各组分别投喂叶酸水平依次为0.31(对照)、0.94、1.76、2.83、4.20、5.69和6.32 mg/kg的7种试验饲料。
试验鱼放于21个网箱(1.0 m×1.0 m×1.2 m),每个网箱25尾。试验开始后每天投喂2次(07:00和17:00),表观饱食投喂,每天通过对池塘加放水,置换5~10 cm高度的池塘水,连续充气,试验期8周。试验期间详细记录每个网箱的采食量,在养殖过程中若发现有试验鱼死亡,及时将死鱼捞出,并做好记录。整个养殖过程中池塘水温为29.1~31.8 ℃,溶解氧浓度为4.8~5.5 mg/L,盐度为15‰~18‰,pH为7.0~7.8。
1.3 样品的采集与测定方法 1.3.1 样品采集与制备养殖试验结束后,试验鱼停食24 h,麻醉后,称取各个网箱里试验鱼的总质量并记录其试验鱼尾数。从每个网箱中随机抽取3尾鱼,放于-20 ℃保存,用于全鱼粗蛋白质、粗脂肪、水分和粗灰分含量测定;再从每个网箱中随机选出5尾鱼进行编号(第1个网箱的5条鱼分别为1-1、1-2、1-3、1-4、1-5,依次类推),分别测其体质量和体长并记录数据,然后尾静脉取血(注射器用1%的肝素钠润洗),将所取得的血液注入对应编号的离心管中,4 ℃条件静置2 h后离心(3 000 r/min,10 min),所得到的上清收集在离心管中,用于血清生化和免疫指标的测定;采血后,将试验鱼解剖并迅速分离出内脏和肝脏,称其质量后,收集肝脏样品保存于冻存管中,用于肝脏抗氧化指标和叶酸积蓄量的测定;血清和肝脏放于-80 ℃保存备用。最后将5尾解剖鱼去皮共取20 g左右背部肌肉,放入同一个密封袋中,置于-20 ℃保存,用于肌肉营养成分的测定。
1.3.2 生长性能的测定主要生长性能采用以下公式求得:

|
全鱼和肌肉水分含量采用常压干燥法在105 ℃的烘箱中烘至恒重来计算,粗脂肪含量采用索氏抽提法(乙醚做萃取剂)测定,粗蛋白质含量采用凯氏定氮法(FOSS 2003)测定,粗灰分含量采用马弗炉(YATMATO FO610C)550 ℃灼烧法测定。
1.3.4 血清生化指标的测定血清总胆固醇(TCHO)、总蛋白(TP)、甘油三酯(TG)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)含量委托广州新海医院检验中心采用贝克曼全自动生化分析仪(HITACHI-7180日立,日本)进行测定。
1.3.5 血清免疫指标的测定血清溶菌酶(LZM)活性及补体3(C3)、补体4(C4)含量均采用南京建成生物工程研究所试剂盒测定,具体方法严格参照试剂盒说明书操作。
1.3.6 肝脏抗氧化指标和叶酸积蓄量的测定肝脏总抗氧化能力(T-AOC)及过氧化氢酶(CAT)、碱性磷酸酶(ALP)活性采用南京建成生物工程研究所试剂盒测定,具体方法参照试剂盒说明书操作。肝脏叶酸积蓄量委托广州食品研究所依据GB 5009.211—2014进行测定。
1.4 数据统计与分析试验数据采用Excel 2007软件进行初步处理后通过SPSS 23.0软件进行单因素方差分析(one-way ANOVA),若出现显著性差异(P < 0.05),再用Duncan氏法进行多重比较,数据以“平均值±标准差”表示。
2 结果 2.1 饲料中叶酸水平对卵形鲳鲹幼鱼生长性能的影响如表 2所示,4.20 mg/kg组卵形鲳鲹幼鱼的增重率和特定生长率显著高于对照组(P<0.05),饲料系数显著低于对照组(P < 0.05),其余各组之间无显著差异(P>0.05)。饲料中叶酸水平对卵形鲳鲹幼鱼的存活率、肝体比、脏体比和肥满度均无显著影响(P>0.05)。
|
|
表 2 饲料中叶酸水平对卵形鲳鲹幼鱼生长性能的影响 Table 2 Effects of dietary folic acid levels on growth performance of juvenile Trachinotus ovatus |
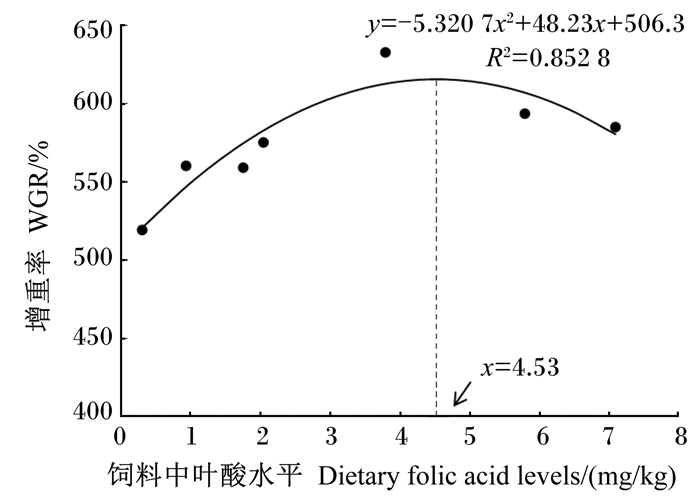
如图 1所示,对卵形鲳鲹幼鱼的增重率(y)与饲料中叶酸水平(x)进行二次回归分析,得出方程y=-5.320 7x2+48.23x+506.3 (R2=0.852 8),对其求解,得出饲料中叶酸水平为4.53 mg/kg时,卵形鲳鲹幼鱼的增重率最大。
|
图 1 卵形鲳鲹幼鱼的增重率与饲料中叶酸水平的关系 Fig. 1 Relation between dietary folic acid levels and WGR of juvenile Trachinotus ovatus |
如表 3所示,饲料中叶酸水平对卵形鲳鲹幼鱼的全鱼和肌肉各营养成分均无显著影响(P>0.05)。
|
|
表 3 饲料中叶酸水平对卵形鲳鲹幼鱼全鱼和肌肉营养成分的影响s Table 3 Effects of dietary folic acid levels on nutritive components in whole fish and muscle of juvenile Trachinotus ovatus |
如表 4所示,对照组血清总胆固醇含量最高,1.76 mg/kg组血清总胆固醇含量显著低于对照组(P < 0.05),其余各组之间无显著差异(P>0.05)。5.69 mg/kg组血清甘油三酯含量显著低于对照组(P < 0.05),其余各组之间无显著差异(P>0.05)。饲料中叶酸水平对血清总蛋白、高密度脂蛋白和低密度脂蛋白含量均无显著影响(P>0.05)。
|
|
表 4 饲料中叶酸水平对卵形鲳鲹幼鱼血清生化指标的影响 Table 4 Effects of dietary folic acid levels on serum biochemical indices of juvenile Trachinotus ovatus |
如表 5所示,0.94 mg/kg组的血清溶菌酶活性与对照组无显著差异(P>0.05),其他各组的血清溶菌酶活性均显著高于对照组(P < 0.05)。2.83、4.20、5.69和6.32 mg/kg组的血清补体3和补体4含量均显著高于对照组(P < 0.05),且4.20 mg/kg组的血清补体3和补体4含量最高。
|
|
表 5 饲料中叶酸水平对卵形鲳鲹幼鱼血清免疫指标的影响 Table 5 Effects of dietary folic acid levels on serum immune indices of juvenile Trachinotus ovatus |
如表 6所示,0.94、1.76、2.83、4.20、5.69和6.32 mg/kg组的肝脏总抗氧化能力和过氧化氢酶活性显著高于对照组(P < 0.05),除0.94 mg/kg组外,其余各组之间无显著差异(P>0.05)。0.94、1.76、2.83、4.20、5.69和6.32 mg/kg组的肝脏叶酸积蓄量显著高于对照组(P < 0.05)。
|
|
表 6 饲料中叶酸水平对卵形鲳鲹幼鱼肝脏抗氧化指标和叶酸积蓄量的影响 Table 6 Effects of dietary folic acid levels on liver antioxidant indices and folic acid accumulation of juvenile Trachinotus ovatus |
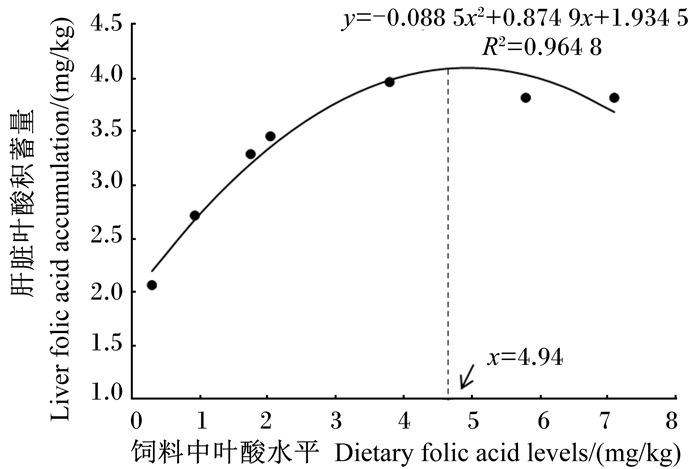
如图 2所示,对卵形鲳鲹幼鱼的肝脏叶酸积蓄量(x)与饲料中叶酸水平(y)进行二次回归分析,得出方程y=-0.088 5x2+0.874 9x+1.934 5 (R2=0.964 8),对其求解,得出饲料中叶酸水平为4.94 mg/kg时,卵形鲳鲹幼鱼肝脏叶酸积蓄量最大。
|
图 2 卵形鲳鲹幼鱼的肝脏叶酸积蓄量与饲料中叶酸水平的关系 Fig. 2 Relation between dietary folic acid levels and liver folic acid accumulation of juvenile Trachinotus ovatus |
大多数水产动物的生长过程中不能合成自身生长所需要的叶酸,需从饮食中摄取[12]。在虹鳟[19]、罗非鱼[11-12]、草鱼[10]、中华绒螯蟹(E.sinensis)[20]和凡纳滨对虾(L. vannamei)[21]的研究中发现,在饲料中添加一定量的叶酸才能够更好地满足生长的需求,与本试验结果一致。本试验中,依据卵形鲳鲹的增重率和肝脏叶酸积蓄量进行回归分析,得出卵形鲳鲹对叶酸的适宜需要量分别为4.53和4.94 mg/kg,此结果与虹鳟[19](0.3~0.6 mg/kg)、吉奥罗非鱼[19](0.82 mg/kg)、中华绒螯蟹[20](2.3 mg/kg)和草虾(Penaeus monodon)[22](1.9~2.1 mg/kg)的适宜需要量差异较大。而草鱼[10](3.6~4.3 mg/kg)与本试验所得适宜需要量相近。以上研究结果可以表明,以不同动物或不同种类的鱼作为研究对象时所呈现的结果均有较大差异。
在草虾(Penaeus monodon)[22]、大黄鱼(Pseudosciaena crocea)和鲈鱼(Lateolabrax japonicus)[23]的研究中发现,饲料中缺乏叶酸会导致死亡率升高,生长受到一定的抑制。本试验研究过程中,试验鱼未出现缺乏症并且各试验组间存活率无显著差异,可能是基础饲料中的叶酸含量能够满足卵形鲳鲹幼鱼的基本生长性能,这与凡纳滨对虾的研究结果[21]一致。在斑点叉尾(Ictalurus punctatus)的研究中发现,其肠道有合成叶酸的能力[13],但是投喂添加叶酸的试验组的试验鱼生长率比未添加组的生长率有明显的提高[11]。本试验研究中也发现,当基础饲料中添加适量的叶酸时增重率显著高于对照组。以上结果表明,在本试验条件下,基础饲料中添加适量的叶酸对卵形鲳鲹幼鱼的生长有一定的有促进作用。
血清甘油三酯和总胆固醇含量通常被作为评价鱼类健康的重要指标[24]。本试验研究发现,饲料中添加适量的叶酸能够显著降低血清甘油三酯、总胆固醇含量,表明叶酸能够影响卵形鲳鲹幼鱼的脂质代谢,此结果与草鱼[10]和小鼠[25]的研究相一致。在对急性脑卒中患者的研究中也发现,叶酸可降低患者的血清甘油三酯和低密度脂蛋白胆固醇含量,能明显改善患者的血脂水平。但目前关于叶酸影响鱼类血清生化指标的报道较少,其具体的影响机制有待进一步深入的研究。
缺乏叶酸会造成动物免疫力的下降,补充适量的叶酸能促进动物机体免疫细胞的生成和免疫酶的合成,进而增强动物的免疫性能[26]。补体3、补体4和溶菌酶也可用来反映水生动物的健康状况,它们与增重率具有类似的变化趋势。饲料中添加适量的叶酸对提高卵形鲳鲹幼鱼的免疫性能有一定的作用。因为叶酸能够促进抗体的生成,调动机体的免疫功能[27]。
抗氧化水平在一定程度上反映动物体的健康状况。叶酸可与自由基竞争结合,从而清除动物机体内的自由基,防止其对生物体造成伤害[26]。总抗氧化能力代表和反映了机体抗氧化酶系统和非酶促系统对外来刺激的代偿能力以及机体自由基代谢的状态,是衡量机体抗氧化系统功能状况的综合性指标[28]。本试验研究发现,随着饲料中叶酸水平的增加,卵形鲳鲹幼鱼血清总抗氧化能力也随之升高,在饲料中叶酸水平为4.20 mg/kg时,血清总抗氧化能力最高,并显著高于对照组。总抗氧化能力和过氧化氢酶具有清除氧自由基的能力,过氧化氢酶能够催化过氧化氢(H2O2)分解为水(H2O)和氧气(O2)[29]。蛋白质组学分析也表明,叶酸对大鼠肝脏的抗氧化酶表达量及其活力都有显著影响[30-31]。在叶酸的抗氧化性研究中发现,叶酸对羟自由基和超氧阴离子具有较强的清除作用[32]。在本试验研究中,随着饲料中叶酸水平的升高,血清过氧化氢酶活性随之升高,当饲料中叶酸水平高于2.83 mg/kg时,各组间无显著差异。各试验组血清总抗氧化能力和过氧化氢酶活性均显著高于对照组。推测对照组叶酸含量可能由于不能满足正常的机体代谢,产生大量氧自由基,会不同程度地消耗机体的抗氧化酶,降低机体的总抗氧化能力。因此,饲料中添加适量叶酸可以较好地维持卵形鲳鲹机体的抗氧化能力。
肝脏叶酸含量也是鱼类维生素需要量的重要参数之一[33]。本试验中,卵形鲳鲹肝脏叶酸积蓄量随饲料中叶酸添加水平的增加而增加,但当饲料中叶酸水平超过4.20 mg/kg时,肝脏叶酸积蓄量则达到了平台期,该结果与杂交罗非鱼[11]、吉富罗非鱼[12]、大黄鱼和鲈鱼[23]的研究结果一致,在草虾[22]的研究中也发现了类似的趋势。这些研究结果表明,当肝脏中叶酸蓄积量达到平台期时,饲料中叶酸水平已满足卵形鲳鲹生长的需要量。
4 结论① 在本试验条件下,饲料中适宜的叶酸水平可以提高卵形鲳鲹幼鱼的生长性能,增强机体的免疫力,并维持机体的抗氧化能力。
② 以增重率和肝脏积蓄量作为评价指标,通过回归分析得出卵形鲳鲹幼鱼对饲料中叶酸的需要量分别为4.53和4.94 mg/kg。
| [1] |
盘瑶晖. 叶酸在动物生产中的应用[J]. 饲料与畜牧, 2015(11): 45-47. |
| [2] |
许丽惠, 谢丽曲, 林丽花. 叶酸的研究进展[J]. 福建畜牧兽医, 2013(2): 34-36. DOI:10.3969/j.issn.1671-9646-B.2006.05.009 |
| [3] |
晏家友. 叶酸在养猪生产中的应用[J]. 养猪, 2012(6): 15-16. DOI:10.3969/j.issn.1002-1957.2011.04.019 |
| [4] |
支丽慧, 李世召, 杨小军, 等. 孵化期注射叶酸对肉仔鸡生产性能及免疫功能的影响[J]. 动物营养学报, 2013, 25(11): 2567-2575. DOI:10.3969/j.issn.1006-267x.2013.11.009 |
| [5] |
MATTE J J, GIRARD C L, BRISSON G J. Folic acid and reproductive performances of sows[J]. Journal of Animal Science, 1984, 59(4): 1020-1025. DOI:10.2527/jas1984.5941020x |
| [6] |
刘静波, 姚英, 余冰, 等. 叶酸对初产母猪繁殖性能和宫内发育迟缓仔猪肾脏功能基因表达的影响[J]. 动物营养学报, 2010, 22(2): 278-284. |
| [7] |
朱伟, 麦康森. 水产动物B族维生素营养研究方法进展[J]. 水产学报, 2001, 25(4): 373-378. DOI:10.3321/j.issn:1000-0615.2001.04.016 |
| [8] |
康凯, 王相勇. 动物泛酸、叶酸缺乏症的诊断与防治[J]. 现代畜牧科技, 2014(10): 157. DOI:10.3969/j.issn.1673-1921.2014.10.146 |
| [9] |
COWEY C B, WOODWARD B. The dietary requirement of young rainbow trout (Oncorhynchus mykiss) for folic acid[J]. The Journal of Nutrition, 1993, 123(9): 1594-1600. DOI:10.1002/1098-108X(199309)14:2<223::AID-EAT2260140213>3.0.CO;2-G |
| [10] |
赵智勇, 文华, 吴凡, 等. 草鱼鱼种叶酸需要量的研究[J]. 上海海洋大学学报, 2008, 17(2): 187-192. |
| [11] |
SHIAU S Y, HUANG S Y. Dietary folic acid requirement for maximum growth of juvenile tilapia Oreochromis niloticus×O.aureus[J]. Fisheries Science, 2011, 67(4): 655-659. DOI:10.1046/j.1444-2906.2001.00302.x |
| [12] |
吴金平.吉富罗非鱼对饲料叶酸、生物素和胆碱需要量研究[D].硕士学位论文.上海: 上海海洋大学, 2015: 19-26.
|
| [13] |
DUNCAN P L, LOVELL R T, BUTTERWORTH C E, J r, et al. Dietary folate requirement determined for channel catfish, Ictalurus punctatus[J]. The Journal of Nutrition, 1993, 123(11): 1888-1897. DOI:10.1002/1098-108X(199311)14:3<383::AID-EAT2260140318>3.0.CO;2-1 |
| [14] |
LIN Y H, LIN H Y, SHIAU S Y. Dietary folic acid requirement of grouper, Epinephelus malabaricus, and its effects on non-specific immune responses[J]. Aquaculture, 2012, 317(1/2/3/4): 133-137. DOI:10.1016/j.aquaculture.2011.04.010 |
| [15] |
王刚, 李加儿, 区又君, 等. 卵形鲳鲹胚胎及早期仔鱼耗氧量的研究[J]. 生态科学, 2010, 29(6): 518-523. DOI:10.3969/j.issn.1008-8873.2010.06.004 |
| [16] |
黄忠, 林黑着, 牛津, 等. 肌醇对卵形鲳鲹生长、饲料利用和血液指标的影响[J]. 南方水产科学, 2011, 7(3): 39-44. |
| [17] |
荀鹏伟, 林黑着, 黄忠, 等. 卵形鲳鲹对饲料中泛酸的需求量[J]. 南方水产科学, 2018, 14(5): 80-87. |
| [18] |
黄倩倩, 林黑着, 周传朋, 等. 卵形鲳鲹幼鱼对维生素B2的需要量[J]. 南方水产科学, 2019, 15(1): 69-76. |
| [19] |
李志华, 王军霞, 谢松. 虹鳟营养需求的研究进展[J]. 水产科学, 2004, 23(2): 39-44. DOI:10.3969/j.issn.1003-1111.2004.02.012 |
| [20] |
魏建军, 张帆, 田文静, 等. 饲料中添加叶酸和VB12对中华绒螯蟹幼蟹生长、非特异性免疫和抗病力的影响[J]. 水生生物学报, 2015, 39(6): 1069-1075. DOI:10.7541/2015.141 |
| [21] |
夏明宏.凡纳滨对虾幼虾对生物素、烟酸、叶酸和胆碱需要量的研究[D].硕士学位论文.宁波: 宁波大学, 2014: 26-35.
|
| [22] |
SHIAU S Y, HUANG S Y. Dietary folic acid requirement determined for grass shrimp, Penaeus monodon[J]. Aquaculture, 2001, 200(3/4): 339-347. DOI:10.1016/s0044-8486(00)00598-6 |
| [23] |
张春晓.大黄鱼、鲈鱼主要B族维生素和矿物质-磷的营养生理研究[D].博士学位论文.青岛: 中国海洋大学, 2006.
|
| [24] |
COZ-RAKOVAC R, STRUNJAK-PEROVIC I, HACMANJEK M, et al. Blood chemistry and histological properties of wild and cultured sea bass (Dicentrarchus labrax) in the North Adriatic Sea[J]. Veterinary Research Communications, 2005, 29(8): 677-687. DOI:10.1007/s11259-005-3684-z |
| [25] |
马俊.甜菜碱、叶酸的降血脂、抗氧化作用及对血管内皮细胞的氧化损伤修复功能[D].硕士学位论文.沈阳: 辽宁大学, 2016.
|
| [26] |
罗佳捷, 张彬, 王洁, 等. 叶酸在动物生产中的应用研究进展[J]. 广东饲料, 2013, 22(2): 27-29. DOI:10.3969/j.issn.1005-8613.2013.02.008 |
| [27] |
DHUR A, GALAN P, HERCBERG S. Folate status and the immune system[J]. Progress in Food & Nutrition Science, 1991, 15(1/2): 43-60. |
| [28] |
谭树华, 何典翼, 严芳, 等. 亚硝酸钠对鲫鱼肝脏丙二醛含量和总抗氧化能力的影响[J]. 农业环境科学学报, 2005, 24(增刊): 21-24. DOI:10.3321/j.issn:1672-2043.2005.z1.006 |
| [29] |
YANG S P, WU Z H, JIAN J C, et al. Effect of marine red yeast Rhodosporidium paludigenum on growth and antioxidant competence of Litopenaeus vannamei[J]. Aquaculture, 2010, 309(1/2/3/4): 62-65. DOI:10.1016/j.aquaculture.2010.09.032 |
| [30] |
HUANG R F, HSU Y C, LIN H L, et al. Folate depletion and elevated plasma homocysteine promote oxidative stress in rat livers[J]. The Journal of Nutrition, 2001, 131(1): 33-38. DOI:10.1093/jn/131.1.33 |
| [31] |
CHANSON A, SAYD T, ROCK E, et al. Proteomic analysis reveals changes in the liver protein pattern of rats exposed to dietary folate deficiency[J]. The Journal of Nutrition, 2005, 135(11): 2524-2529. DOI:10.1038/sj.ijo.0803058 |
| [32] |
迟晓星, 张涛, 赵静, 等. 叶酸的提取及抗氧化性研究[J]. 现代食品科技, 2011, 27(10): 1234-1237. DOI:10.3969/j.issn.1673-9078.2011.10.015 |
| [33] |
JOBLING M. National Research Council (NRC):nutrient requirements of fish and shrimp[J]. Aquaculture International, 2012, 20(3): 601-602. DOI:10.1007/s10499-011-9480-6 |




