2. 河北农业大学动物医学院, 保定 071001;
3. 河北省牛羊胚胎工程技术研究中心, 保定 071001
2. College of Veterinary Medicine, Hebei Agricultural University, Baoding 071001, China;
3. Embryo Engineering and Technological Center of Cattle and Sheep of Hebei, Baoding 071001, China
反刍动物对饲粮氮的利用率仅为15%~40%[1-2],提高反刍动物对氮的利用率有利于节约饲料成本和缓解粪氮排放对环境造成的污染。啤酒花(Humulus lupulus L.)为桑科葎草属草本植物,含有α-苦味酸和β-苦味酸等抗菌活性物质[3-4]。Lavrenčič等[5]在体外试验中发现,啤酒花可抑制饲粮蛋白质在体外瘤胃发酵中的降解,增加过瘤胃蛋白含量;Flythe等[6-7]研究表明,啤酒花可降低山羊瘤胃中氨基酸和小肽的产氨速率,并证实了这种效果来源于啤酒花中的β-苦味酸。氯化铈(CeCl3)是稀土矿经化学提炼后稀土元素铈的无机盐化合物,不仅具备提高动物生产性能的作用,还有调控反刍动物瘤胃发酵和氮代谢的功能。刘江波等[8]体外试验发现,氯化铈能降低南江黄羊瘤胃氨态氮(NH3-N)生成速率,提高微生物蛋白(microbial protein,MCP)产量。Lin等[9]试验发现,氯化铈可提高肉牛瘤胃微生物氮(microbial nitrogen,MN)产量。此外,啤酒花和氯化铈还被认为是当前饲用抗生素的潜在有效替代品[9-11]。有关稀土添加剂(以铈、镧、镨为主和其他一些镧系元素中某些成分组成的混合物)在奶牛、肉牛和绵羊上的应用已进行了研究[12-14]。综上所述,有关啤酒花颗粒(hops pellets,HP)和氯化铈对泌乳奶牛瘤胃发酵的影响未见报道;基于啤酒花能降低饲粮蛋白质在瘤胃的降解和瘤胃NH3-N浓度,而氯化铈具有提高NH3-N利用率的作用,两者组合使用是否具有协同效应也未见报道。因此,本试验通过体外法研究添加不同比例啤酒花颗粒和氯化铈及其组合对瘤胃发酵的影响,为其在奶牛生产中应用提供依据。
1 材料与方法 1.1 试验材料啤酒花颗粒产地为新疆,形状柱形,直径约0.3 cm,高为1.0~1.5 cm,重量为0.3~0.5 g,由成熟的啤酒花雌花序整花经烘干压制而成,其中α-苦味酸含量为3.70%,β-苦味酸含量为3.60%。氯化铈使用纯度为99.9%的七水氯化铈(CeCl3·7H2O),购自上海阿拉丁生化科技有限公司。发酵底物为高产奶牛全混合日粮(total mixed ration,TMR),其组成及营养水平见表 1。啤酒花颗粒和TMR在试验前粉碎,过1 mm筛。
|
|
表 1 全混合日粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the TMR (DM basis) |
试验采用4×4两因子试验设计。啤酒花颗粒浓度设定参考Flythe等[6-7]的报道,分别为空白(0 mg/L)、低(L,3.34 mg/L)、中(M,6.67 mg/L)、高(H,10.00 mg/L)4个水平,以满足在发酵底物干物质中含量分别为0、0.5、1.0、1.5 g/kg;七水氯化铈浓度设定参考刘江波等[8]和Lin等[9]的报道,分别为空白(0 mg/L)、低(l,1.33 mg/L)、中(m,1.60 mg/L)、高(h,1.87 mg/L)4个水平,以满足在发酵底物干物质中含量分别为0、0.20、0.24、0.28 g/kg。按照啤酒花颗粒与氯化铈的不同组合,共分为16个组,分别为C(空白对照)、l、m、h、L、Ll、Lm、Lh、M、Ml、Mm、Mh、H、Hl、Hm、Hh组,每个组设置5个重复。具体试验设计见表 2。
|
|
表 2 试验设计 Table 2 Experiment design |
选取健康状况良好、胎次相同、体重接近、装有永久性瘤胃瘘管的泌乳中期成年荷斯坦奶牛3头作为瘤胃液供体动物,其饲粮配方参照NRC(2001)奶牛营养需要和牛场配方进行配制。对试验牛进行散栏饲养,每天早、中、晚共3次饲喂和挤奶,自由饮水。于体外试验开始当天,采集晨饲前2 h的瘘管牛瘤胃液,将采集的3头牛的瘤胃液过滤4层纱布后混匀,装入经预热(39 ℃)并通有二氧化碳(CO2)的保温瓶中,密封保证恒温厌氧,迅速带回实验室。
1.4 体外培养使用美国ANKOM RFS气体测量系统作为人工瘤胃装置。参照Goering等[15]配制人工瘤胃缓冲液。发酵前,向发酵瓶中称取过1 mm筛的TMR样品1 g,并按试验设计浓度添加相应种类或组合的添加剂,将发酵瓶置于39 ℃恒温气浴摇床中预热。将瘤胃液与39 ℃预热好的人工瘤胃缓冲液按照1 : 4的比例混匀,量取150 mL于发酵瓶中,迅速旋紧模块,同时做空白处理。操作时全程使用CO2保持厌氧环境,操作完成后打开摇床开始发酵。发酵时间为24 h,发酵完成后记录发酵产生的累计压力,用于计算产气量(gas production,GP),并迅速使用校正好的UB-7型(美国)酸度计测定发酵液pH,然后利用碎冰降温终止发酵。
1.5 指标测定及方法将完成发酵的瘤胃液,使用已编号和称重的尼龙布(50 μm)过滤,收集过滤后的瘤胃液样品。将带有残渣的尼龙布65 ℃烘48 h至恒重,以计算体外干物质消化率(dry matter digestibility,DMD)。
采用冯宗慈等[16]比色法测定瘤胃液NH3-N浓度,仪器使用分光光度计INESA-UV754N(中国)。
参照Cotta等[17]的差速离心法分离MCP,并参照GB/T 6432—94测定MCP产量[18]。
使用安捷伦7890A气相色谱(美国),参照外标分析法[19]测定挥发性脂肪酸(volatile fatty acid,VFA)产量。
24 h GP根据理想气体方程,计算将压力换算成GP,公式如下:
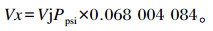
|
式中:Vx为39 ℃产气体积(mL);Vj为发酵瓶顶部空间体积(mL);Ppsi为气体测量系统自动记录的压力(kPa)。
根据各自GP和气压进行校正,减去空白发酵瓶GP即为该瓶GP。
1.6 数据分析采用SAS 8.0软件中MIXED程序进行双因素方差分析,差异显著时用Duncan氏法进行多重比较,混合模型包括啤酒花颗粒、氯化铈的处理效应,以及啤酒花颗粒和氯化铈的交互作用。P < 0.05为差异显著,P < 0.01为差异极显著,0.05<P<0.10为有提高或降低的趋势。
2 结果 2.1 啤酒花颗粒与氯化铈单独或组合添加对DMD和GP的影响由表 3可知,氯化铈对DMD和GP有显著影响(P<0.05)。l组的DMD和GP最高,显著高于C组(P<0.05)。啤酒花颗粒对DMD和GP无显著影响(P>0.05)。氯化铈与啤酒花颗粒组合对DMD和GP未产生显著交互作用,但有提高的趋势(P=0.085、P=0.097)。
|
|
表 3 啤酒花颗粒与氯化铈单独或组合添加对体外发酵DMD、GP、pH、MCP产量和NH3-N浓度的影响 Table 3 Effects of HP and CeCl3 individually or combined addition on DMD, GP, pH, MCP yield and NH3-N concentration in vitro fermentation |
由表 3可知,各组pH在6.38~6.44之间,其中C组pH最高。氯化铈对pH有显著影响(P<0.05),l组pH较C组显著降低(P<0.05)。氯化铈与啤酒花颗粒组合对pH的交互作用显著(P<0.05),其中Lh、Ll组较C组显著降低(P<0.05)。啤酒花颗粒对pH无显著影响(P>0.05)。
各组NH3-N浓度在9.22~12.24 mg/dL之间,啤酒花颗粒对NH3-N浓度有显著影响(P<0.05),啤酒花颗粒与氯化铈组合对NH3-N浓度的交互作用显著(P<0.05)。其中,M、L组NH3-N浓度较C组显著降低(P<0.05),各组合中,Hm、Hl、Mh、Mm、Ml、Lm、Ll组NH3-N浓度较C组均极显著降低(P<0.01)。氯化铈对NH3-N浓度无显著影响(P>0.05)。
啤酒花颗粒、氯化铈均对MCP产量有显著影响(P<0.05),啤酒花颗粒与氯化铈组合对MCP产量的交互作用显著(P<0.05)。C组的MCP产量最低,Ll组最高。与C组比较,m、Hh组的MCP产量显著提高(P<0.05),M、h、l、Hm、Hl、Mh、Mm、Ml、Lm、Ll组的MCP产量极显著提高(P<0.01)。
2.3 啤酒花颗粒与氯化铈单独或组合添加对VFA浓度的影响由表 3可知,氯化铈、啤酒花颗粒对乙酸、丙酸和总挥发性脂肪酸(TVFA)浓度有显著影响(P<0.05),对丁酸浓度和乙酸/丙酸无显著影响(P>0.05),啤酒花颗粒与氯化铈组合对乙酸、丙酸和TVFA浓度的交互作用显著(P<0.05)。其中,l组的乙酸、丙酸和TVFA浓度均为最高,较C组显著提高(P<0.05)。各组合中,Mh、Lh、Ll组的TVFA浓度较C组显著提高(P<0.05)。啤酒花颗粒对乙酸、丙酸、丁酸、TVFA浓度和乙酸/丙酸均无显著影响(P>0.05)。
3 讨论 3.1 啤酒花颗粒与氯化铈单独或组合添加对DMD和GP的影响DMD和GP在一定程度上反映了微生物对底物的发酵程度。研究表明,DMD和GP呈高度正相关[20]。刘江波[21]发现,浓度为0.003%~0.024%的氯化铈可提高南江黄羊体外瘤胃液发酵24 h的GP和有机物降解率,本试验结果与之相同。不同浓度的氯化铈均提高了DMD和GP,其中1.33 mg/L的添加量效果最明显,且为各试验组中最高值。Yang等[22]研究发现,含400或800 mg/kg稀土混合物(含51%氯化铈)的饲粮在体外连续发酵24 h后,其GP、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)消化率均提升,但淀粉的消化率不变。这可能是氯化铈中的铈离子对原虫的毒害作用减少了对纤维降解菌的吞噬和竞争[11, 22],以及铈离子对大肠杆菌、芽孢杆菌等有害菌的絮凝促进了胃肠道环境的稳定,从而提高了纤维降解菌的数量[23]。通过原子力显微镜也观察到铈离子还可通过侨联作用等方式,将纤维素酶与纤维素更好地结合,提升纤维素降解酶的活性[24-25]。从而提高了DMD和GP。然而,张婷婷[11]在体外试验中观察到0.4~1.0 mmol/㎏的氯化铈并未影响饲粮发酵过程中24 h总GP和DMD,在分析菌群时还发现氯化铈对不同纤维降解菌的影响并不一致。这可能与饲粮底物精粗比和氯化铈添加量有关,具体氯化铈如何对菌群的调控还有待探究。
Narvaez等[26]报道0.8 mg/mL的啤酒花可降低饲粮发酵48 h的GP,Lavrenčič等[5]发现0.250~1.125 mg/mL的啤酒花可抑制发酵24 h后的DMD,这在本试验中均未发现;在各添加剂组合中,6.67或3.34 mg/L的啤酒花颗粒与氯化铈组合后较其单独添加的DMD和GP均有提升的趋势。这表明啤酒花颗粒与氯化铈的组合可产生互补作用,氯化铈对DMD的促进作用可抵消啤酒花颗粒可能存在的抑制效果。
3.2 啤酒花颗粒与氯化铈单独或组合添加对pH、NH3-N浓度和MCP产量的影响本试验中各组pH均处于正常范围之内,可以满足瘤胃微生物的生长环境要求[27]。瘤胃中VFA浓度是影响培养液pH的关键因素,本试验中,l、Lh和Ll组的pH显著降低,主要与它们的VFA浓度,尤其是乙酸浓度较高引起的。
NH3-N浓度与发酵基质中蛋白质降解速率、能氮平衡程度、微生物的利用效率相关[28],体外微生物生长的最佳NH3-N浓度为50~80 mg/L[29]。本试验中各组NH3-N浓度均高于推荐范围。单独添加啤酒花颗粒的组别(L、M、H组)较C组均有不同程度地下降,其中L、M组达显著水平。这可能是由于啤酒花或啤酒花中β-苦味酸作为植物性离子载体,具有降低革兰氏阳性菌离子跨膜梯度和破坏其能量代谢的特性,从而抑制了瘤胃中高效产氨菌的活性,减缓底物中蛋白质、小肽和氨基酸的分解速率,降低了NH3-N浓度[5-6]。体外试验发现,0.8 mmol/kg的氯化铈可降低培养液24 h原虫的数量,而原虫数量的减少将增加以NH3-N为主要氮源菌群的数量,从而使NH3-N浓度降低[11, 29-31]。本试验中,1.60或1.33 mg/L的氯化铈单独添加仅有降低NH3-N浓度的趋势,但与啤酒花颗粒的组合则显著降低,且下降幅度高于各添加剂的单独使用。这表明啤酒花颗粒与氯化铈的组合使用可相互促进,发挥出更大的效果。
本试验中,各试验组MCP产量较C组均有不同程度地提升,其中M组显著升高。据报道,瘤胃内快速和过量的NH3-N生成是限制微生物氮合成的因素之一[30]。啤酒花颗粒可能通过降低NH3-N的生成速率,保证了MCP合成所用氮源充分有效的供给,提高了MCP产量。同时,各氯化铈单独添加组MCP产量均显著提高,氯化铈对VFA浓度的提升,可改善能氮平衡[32],使生成的NH3-N更多地转化为MCP。在酒花颗粒与氯化铈组合添加时,同NH3-N浓度变化相似,1.60或1.33 mg/L氯化铈与啤酒花颗粒的组合对MCP产量提升幅度最大,并高于其单独添加效果,这可能是啤酒花降低了由NH3-N过量释放造成的氮源浪费以及氯化铈对氮源利用率的增强,使酒花颗粒与氯化铈产生了正组合效应。
3.3 啤酒花颗粒与氯化铈单独或组合添加对VFA浓度的影响饲粮中添加0.003%~0.024%的氯化铈可提高南江黄羊瘤胃液体外发酵24 h后乙酸、丙酸和TVFA的浓度[8]。这与本研究结果一致,本试验中,添加1.33 mg/L的氯化铈提高了瘤胃乙酸、丙酸和TVFA浓度。Lin[9]在肉牛饲养试验中发现,饲喂氯化铈可提高饲粮的NDF和ADF消化率,促进瘤胃乙酸和丙酸的产生。但有报道称,0.4~1.0 mmol/kg的氯化铈对发酵24 h后VFA浓度并无影响[11],这可能与发酵底物营养水平和瘤胃液供体动物不同有关。各添加剂组合应用中,Mh、Lh、Ll组TVFA浓度显著提升,这可能也与氯化铈促进纤维降解,提高DMD有关。
4 结论① 啤酒花颗粒可降低瘤胃NH3-N浓度,提升MCP产量,以中浓度(6.67 mg/L)效果最好。
② 氯化铈可提高MCP产量,增强瘤胃碳水化合物发酵,以低浓度(1.33 mg/L)效果最好。
③ 啤酒花颗粒与氯化铈组合可互相补充,发挥协同作用,在降低瘤胃NH3-N浓度,提升MCP产量的同时,增强瘤胃碳水化合物发酵。以低浓度(3.34 mg/L)啤酒花颗粒和低浓度(1.33 mg/L)氯化铈的组合效果最优。
| [1] |
KOHN R A, DINNEEN M M, RUSSEK-COHEN E. Using blood urea nitrogen to predict nitrogen excretion and efficiency of nitrogen utilization in cattle, sheep, goats, horses, pigs, and rats[J]. Journal of Animal Science, 2005, 83(4): 879-889. DOI:10.2527/2005.834879x |
| [2] |
HUHTANEN P, HRISTOV A N. A meta-analysis of the effects of dietary protein concentration and degradability on milk protein yield and milk N efficiency in dairy cows[J]. Journal of Dairy Science, 2009, 92(7): 3222-3232. DOI:10.3168/jds.2008-1352 |
| [3] |
OSHUGI M, BASNET P, KADOTA S, et al. Antibacterial activity of traditional medicines and an active constituent lupulone from Humulus lupulus against Helicobacter pylori[J]. Journal of Traditional Chinese Medicine, 1997, 14(3): 186-191. |
| [4] |
MOIR M. Hops-a millennium review[J]. Journal of the American Society of Brewing Chemists, 2000, 58(4): 131-146. DOI:10.1094/ASBCJ-58-0131 |
| [5] |
LAVREN ČIČA, LEVART A, KOŠIR I J, et al. Influence of two hop (Humulus lupulus L.) varieties on in vitro dry matter and crude protein degradability and digestibility in ruminants[J]. Journal of the Science of Food and Agriculture, 2014, 94(6): 1248-1252. DOI:10.1002/jsfa.6407 |
| [6] |
FLYTHE M D, AIKEN G E, GELLIN G L, et al. Hops (Humulus lupulus) β-acid as an inhibitor of caprine rumen hyper-ammonia-producing bacteria in vitro[J]. Agriculture, Food and Analytical Bacteriology, 2015, 5(1): 29-36. |
| [7] |
FLYTHE M D. The antimicrobial effects of hops (Humulus lupulus L.) on ruminal hyper ammonia-producing bacteria[J]. Letters in Applied Microbiology, 2009, 48(6): 712-717. |
| [8] |
刘江波, 薛白, 闫天海, 等. 不同氯化铈水平对南江黄羊瘤胃体外发酵的影响[J]. 中国畜牧杂志, 2012, 48(5): 31-34. |
| [9] |
LIN S X, WEI C, ZHAO G Y, et al. Effects of supplementing rare earth element cerium on rumen fermentation, nutrient digestibility, nitrogen balance and plasma biochemical parameters in beef cattle[J]. Journal of Animal Physiology and Animal Nutrition, 2015, 99(6): 1047-1055. DOI:10.1111/jpn.12295 |
| [10] |
FLYTHE M D, KAGAN I A, WANG Y X, et al. Hops (Humulus lupulus L.) bitter acids:modulation of rumen fermentation and potential as an alternative growth promoter[J]. Frontiers in Veterinary Science, 2017, 4: 131. DOI:10.3389/fvets.2017.00131 |
| [11] |
张婷婷.稀土元素镧、铈、镨对体外瘤胃发酵、甲烷生成及微生物区系的影响[D].博士学位论文.北京: 中国农业大学, 2015. http: //cdmd.cnki.com.cn/Article/CDMD-10019-1015584417.htm
|
| [12] |
吴丹丹, 吕永艳, 孙友德, 等. 小肽和稀土不同添加量组合对奶牛产奶性能及氮排泄的影响[J]. 中国畜牧杂志, 2016, 52(17): 62-67. |
| [13] |
梁欢, 赵向辉, 许兰娇, 等. 烟酸、果寡糖及柠檬酸稀土组合对肉牛瘤胃体外发酵特性及菌群结构的影响[J]. 动物营养学报, 2018, 30(5): 1996-2005. |
| [14] |
于静.添喂稀土对绵羊消化代谢的影响[D].硕士学位论文.乌鲁木齐: 新疆农业大学, 2009. http: //www.cnki.com.cn/Article/CJFDTotal-XJNY201004002.htm
|
| [15] |
GOERING H K, VAN SOEST P J. Forage fiber analysis:apparatus, reagents, procedures, and some applica-tions[M]. Washington, D.C.: Agricultural Research Service, United States Department of Agriculture, 1970: 379.
|
| [16] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(6/7): 37. |
| [17] |
COTTA M A, RUSSELL J B. Effect of peptides and amino acids on efficiency of rumen bacterial protein synthesis in continuous culture[J]. Journal of Dairy Science, 1982, 65(2): 226-234. DOI:10.3168/jds.S0022-0302(82)82181-4 |
| [18] |
中华人民共和国国家质量监督检验检疫总局. 饲料中粗蛋白的测定[M]. 北京: 中国标准出版社, 2002.
|
| [19] |
KHORASANI G R, OKINE E K, KENNELLY J J. Forage source alters nutrient supply to the intestine without influencing milk yield[J]. Journal of Dairy Science, 1996, 79(5): 862-872. DOI:10.3168/jds.S0022-0302(96)76435-4 |
| [20] |
张文璐, 李杰, 吕元勋. 体外产气法与尼龙袋法评定粗饲料干物质降解率的相关性分析[J]. 饲料工业, 2009, 30(7): 30-32. |
| [21] |
刘江波.稀土元素对南江黄羊瘤胃发酵、生长性能及血液指标的影响[D].硕士学位论文.雅安: 四川农业大学, 2012. http: //cdmd.cnki.com.cn/Article/CDMD-10626-1013157354.htm
|
| [22] |
OZUTSUMI Y, TAJIMA K, TAKENAKA A, et al. Real-time PCR detection of the effects of protozoa on rumen bacteria in cattle[J]. Current Microbiology, 2006, 52(2): 158-162. DOI:10.1007/s00284-005-0266-9 |
| [23] |
YANG W Z, LAARMAN A, HE M L, et al. Effect of rare earth elements on in vitro rumen microbial fermentation and feed digestion[J]. Animal Feed Science and Technology, 2009, 148(2/3/4): 227-240. |
| [24] |
曹永范, 张冬艳, 王丽, 等. 稀土离子对纤维素酶活性的影响[J]. 内蒙古工业大学学报, 2010, 29(2): 104-106. |
| [25] |
余兴莲.稀土离子对纤维酶活性的影响及其机理[D].硕士学位论文.宁波: 宁波大学, 2008. http: //cdmd.cnki.com.cn/Article/CDMD-11646-2010025883.htm
|
| [26] |
NARVAEZ N, WANG Y X, XU Z, et al. Effects of hop varieties on ruminal fermentation and bacterial community in an artificial rumen (rusitec)[J]. Journal of the Science of Food and Agriculture, 2013, 93(1): 45-52. DOI:10.1002/jsfa.5725 |
| [27] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [28] |
张吉鹍, 邹庆华, 王金芬, 等. 稻草与多水平苜蓿混合瘤胃体外发酵组合效应的整体研究[J]. 饲料工业, 2011, 32(17): 40-48. |
| [29] |
王之盛, 李胜利. 反刍动物营养学[M]. 北京: 中国农业出版社, 2016.
|
| [30] |
CALSAMIGLIA S, FERRET A, REYNOLDS C K, et al. Strategies for optimizing nitrogen use by ruminants[J]. Animal, 2010, 4(7): 1184-1196. DOI:10.1017/S1751731110000911 |
| [31] |
BACH A, CALSAMIGLIA S, STERN M D. Nitrogen metabolism in the rumen[J]. Journal of Dairy Science, 2005, 88(Suppl.1): E9-E21. |
| [32] |
申军士.日粮能氮释放同步性对奶牛瘤胃代谢、生产效率与性能的影响研究[D].博士学位论文.杭州: 浙江大学, 2013. http: //cdmd.cnki.com.cn/Article/CDMD-10335-1013186929.htm
|




