2. 江苏农牧科技职业学院动物医学院, 泰州 225300;
3. 江苏雅博动物健康科技有限责任公司, 泰州 225300
2. Department of Animal Medicine, Jiangsu Agri-Animal Husbandry Vocational College, Taizhou 225300, China;
3. Abram(Jiangsu) Animal Heath Co., Ltd., Taizhou 225300, China
宠物幼犬消化道发育并未完全,消化功能薄弱,胃肠蠕动能力较差,胃肠屏障功能不完善,容易激发炎症反应,导致疾病的发生[1]。不少学者针对幼犬健康从营养学、病原学及免疫学等角度进行研究,取得不少成果,而关于微生态制剂在宠物食品及疾病防治方面的运用报道较少[2]。研究表明,动物双歧杆菌具有维持肠道菌群平衡、增强免疫系统及控制内毒素产生等多种促进健康和预防疾病的益生及保健作用[3]。地衣芽孢杆菌进入动物肠胃后可分泌大量的消化酶,刺激肠道蠕动,增强动物消化吸收营养物质的能力[4]。乳酸链球菌可分泌乳酸链球菌素,在肠道定植后可形成一道天然屏障来抵御外来病原菌的入侵[5]。屎肠球菌是一种产乳酸菌,在动物体内可调节肠道菌群结构、肠道形态与黏液层以及肠上皮细胞免疫功能[6]。上述单一益生菌在动物上均有应用,但多种益生菌联合应用的研究较少。因此,本试验拟将动物双歧杆菌、地衣芽孢杆菌、乳酸链球菌和屎肠球菌,根据各自功效特点按一定比例制成复合益生菌制剂,通过分析不同补喂剂量的复合益生菌制剂对幼犬生长性能、肠道动力及肠道屏障功能的影响,评估该复合益生菌制剂对幼犬生长发育及促进健康方面的功效,为其在宠物幼犬保健方面的应用提供理论参考。
1 材料与方法 1.1 试验材料试验用复合益生菌制剂购于江苏雅博动物健康科技有限责任公司,含动物双歧杆菌(ATCC 25527,活菌数≥1.2×109 CFU/g)、地衣芽孢杆菌(ATCC 14580,活菌数≥0.4×109 CFU/g)、乳酸链球菌(BNCC 175978,活菌数≥0.2×109 CFU/g)和屎肠球菌(BNCC 194759,活菌数≥0.2×109 CFU/g),总菌数≥2.0×109 CFU/g。对比益生菌为宠儿香康源益生菌(总菌数≥1.5×108 CFU/g),含嗜酸乳杆菌(活菌数≥5×107CFU/g)、粪肠球菌(活菌数≥5×107CFU/g)和长双歧杆菌(活菌数≥5×107CFU/g),购于北京百林康源生物技术有限公司。
1.2 试验动物与分组将40条6周龄左右的贵宾犬(泰迪型,由江苏省宠物繁育中心提供)随机分为5组,每组2个重复,每个重复4只犬。其中,试验A组幼犬饲喂基础饲粮+0.2 g/(kg BW·d)复合益生菌制剂,试验B组幼犬饲喂基础饲粮+0.6 g/(kg BW·d)复合益生菌制剂,试验C组幼犬饲喂基础饲粮+1.0 g/(kg BW·d)复合益生菌制剂,阴性对照组幼犬饲喂基础饲粮,对比对照组幼犬饲喂基础饲粮+1.0 g/(kg BW·d)宠儿香康源益生菌。所有益生菌制剂均溶于20 mL温开水后灌服。试验开始前先饲喂基础饲粮7 d,预饲结束后进行为期30 d的饲养试验,试验期间犬只单笼饲养,自由采食、饮水,环境温度为室温,每天对饲养环境及用具进行消毒。基础饲粮参考NRC(2016)犬营养标准配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验结束后,各组幼犬空腹经前臂头静脉采血5 mL装入试管中,在37 ℃水浴锅中静置,待分层后吸取上清液于离心管中,按1 500 r/min离心5 min,取上清液置于4 ℃冰箱中保存待测。
1.3.2 肠黏膜制备采血完成后,每个重复选择2只幼犬屠宰,打开腹腔,取回肠中段约5 cm,刮取肠黏膜,用锡箔纸包裹后,置液氮中保存备用。
1.4 指标测定 1.4.1 生长性能测定在试验前1天和试验结束后1天早晨,对各组幼犬分别空腹称重,计算平均日增重。试验期间每天定时观察记录各重复幼犬的腹泻和便秘只次,计算腹泻(便秘)率。

|
采用酶联免疫吸附测定(ELISA)法检测血清中胃动素(MTL)、胃泌素(GAS)、P物质(SP)和血管活性肠肽(VIP)的含量,试剂盒均购于南京建成生物工程研究所,操作均按照试剂盒附带说明书执行。
1.4.3 血清肠道屏障功能指标的测定采用ELISA法检测血清中二胺氧化酶(DAO)活性及D-乳酸和内毒素(LPS)的含量,DAO活性检测试剂盒购于上海江莱生物科技有限公司,D-乳酸和LPS含量ELISA试剂盒购于上海彩佑实业有限公司,操作均按照试剂盒附带说明书执行。
1.4.4 血清炎性细胞因子含量的测定采用免疫比浊法测定血清中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和白细胞介素-10(IL-10)的含量,试剂盒购于南京建成生物工程研究所,操作均按照试剂盒附带说明书执行。
1.4.5 空肠黏膜相关基因mRNA表达的相对定量取空肠黏膜,用Trizol Reagent提取肠道组织中的总RNA,反转录后采用实时荧光定量PCR(RT-qPCR)法,以β-肌动蛋白(β-actin)为内参基因,检测幼犬空肠黏膜中闭合蛋白(occludin)、闭锁小带蛋白-1(ZO-1)及肌球蛋白轻链激酶(MLCK)基因mRNA的相对表达量,引物由有上海生工生物技术有限公司设计和合成,详见表 2。目的基因mRNA的相对表达量用2-ΔΔCt法计算。
|
|
表 2 引物信息 Table 2 Primer information |
试验数据用SPSS 19.0软件的单因素分析分析程序进行组间差异统计学检验,腹泻率用卡方检验,结果用平均值±标准差表示,P < 0.05表示差异有统计学意义。
2 结果 2.1 补喂复合益生菌制剂对幼犬生长性能的影响由表 3可知,各组初始体重无显著差异(P>0.05)。与阴性对照组相比,试验C组的终末体重、平均日增重显著升高(P < 0.05),腹泻率、便秘率显著降低(P < 0.05);试验B组仅平均日增重显著升高(P < 0.05);试验A组各指标无显著变化(P>0.05)。与对比对照组相比,试验C组的平均日增重显著升高(P < 0.05);试验B组各指标无显著变化(P>0.05);试验A组的终末体重、平均日增重显著降低(P < 0.05),腹泻率、便秘率显著升高(P < 0.05)。
|
|
表 3 补喂复合益生菌制剂对幼犬生长性能的影响 Table 3 Effects of supplementary feeding complex-probiotic-preparation on growth performance of puppies |
补喂复合益生菌制剂对幼犬血清胃肠激素含量的影响见图 1。与阴性对照组相比,试验C组血清中MTL含量升高[(241.2±25.6) ng/L vs. (218.6±22.4) ng/L],差异显著(P < 0.05),VIP含量降低[(17.8±1.9) ng/L vs. (20.1±2.2) ng/L],差异显著(P < 0.05),GAS和SP含量变化不大,无显著差异(P>0.05);试验A组、试验B组各指标均无显著变化(P>0.05)。与对比对照组相比,各试验组血清中MTL、GAS、SP和VIP含量均无显著变化(P>0.05)。
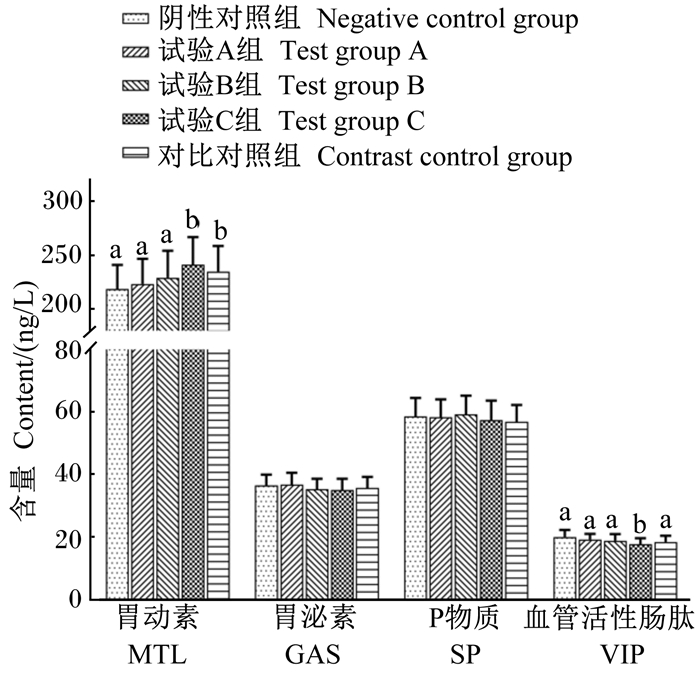
|
数据柱上标相同或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with the same or no letters mean no significant difference (P>0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 补喂复合益生菌制剂对幼犬血清胃肠激素含量的影响 Fig. 1 Effects of supplementary feeding complex-probiotic- preparation on gastrointestinal hormone contents in serum of puppies |
由表 4可知,试验C组血清中DAO活性及D-乳酸和LPS含量均低于阴性对照组,差异显著(P < 0.05),与对比对照组则无显著差异(P>0.05);试验A组、试验B组血清中DAO活性、D-乳酸含量与阴性对照组、对比对照组均无显著差异(P>0.05),而LPS含量则显著低于阴性对照组(P < 0.05)。
|
|
表 4 补喂复合益生菌制剂对幼犬血清肠道屏障功能指标的影响 Table 4 Effects of supplementary feeding complex-probiotic-preparation on intestinal barrier function indicators in serum of puppies |
由表 5可知,与阴性对照组相比,试验C组血清中TNF-α含量显著降低(P < 0.05),IL-10含量显著升高(P < 0.05);试验B组血清中TNF-α含量显著降低(P < 0.05)。与对比对照组相比,各试验组血清中TNF-α、IL-10含量均无显著变化(P>0.05)。血清中IL-6含量各组间均无显著变化(P>0.05)。
|
|
表 5 补喂复合益生菌制剂对幼犬血清炎性细胞因子含量的影响 Table 5 Effects of supplementary feeding complex-probiotic-preparation on inflammatory cytokine contents in serum of puppies |
补喂复合益生菌制剂对幼犬空肠黏膜相关基因mRNA相对表达量的影响见图 2。与阴性对照组比较,试验C组空肠黏膜中occludin mRNA的相对表达量显著上调(P < 0.05);试验C组和试验B组ZO-1 mRNA的相对表达量上调,MLCK mRNA的相对表达量下调,差异均显著(P < 0.05);试验A组各基因mRNA的相对表达量无显著变化(P>0.05)。与对比对照组比较,试验A组空肠黏膜中occludin、ZO-1 mRNA的相对表达量显著降低(P < 0.05),MLCK mRNA的相对表达量显著升高(P < 0.05);试验B组和试验C组各基因mRNA的相对表达量无显著变化(P>0.05)。此外,试验C组空肠黏膜中occludin mRNA的相对表达量显著高于试验A组(P < 0.05),ZO-1 mRNA的相对表达量显著高于试验A组和试验B组(P < 0.05),试验C组和试验B组空肠黏膜中MLCK mRNA的相对表达量显著低于试验A组(P < 0.05)。
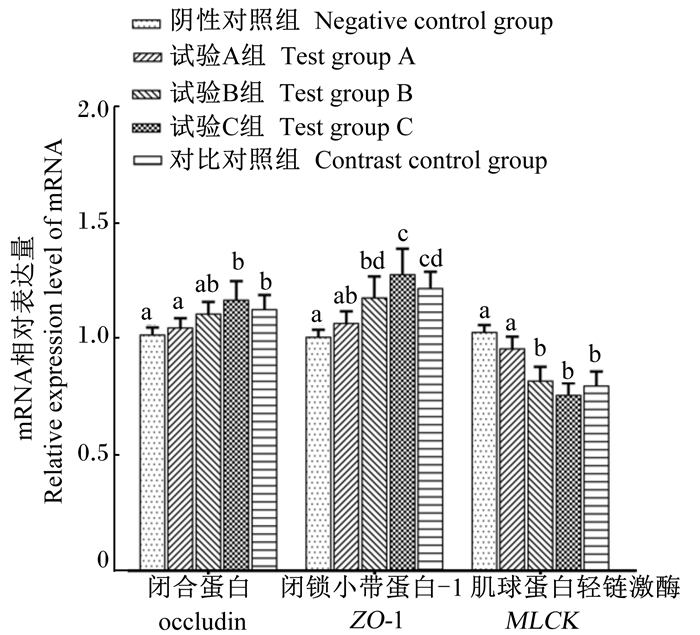
|
图 2 补喂复合益生菌制剂对幼犬空肠黏膜相关基因mRNA相对表达量的影响 Fig. 2 Effects of supplementary feeding complex-probiotic- preparation on mRNA relative expression levels of related genes in jejunum mucosa of puppies |
幼犬由于断奶应激、饲养环境改变及母源抗体降低等因素很容易导致消化功能紊乱,进一步影响其生长发育。而益生菌作为一类有益于宿主的活性微生物,常作为饲料添加剂应用于畜牧生产上,益生菌通过维持肠道菌群平衡,保持益生菌优势地位,促进肠胃消化吸收,从而提高生产性能。研究表明,不论单种益生菌还是复合益生菌均具有一定促进幼犬生长的作用。吴德华等[7]在研究纳豆芽孢杆菌对断奶仔犬增重和肠道菌群影响的试验中发现饲粮中添加0.2%的纳豆芽孢杆菌可使仔犬平均日增重提高27.48%;燕珍寿等[8]发现给予复合益生菌制剂不但可提高幼龄金毛巡回猎犬的平均日增重和料重比,还可减少腹泻的发病率。本研究结果表明,补喂不同剂量的复合益生菌制剂均可提高幼犬的平均日增重,降低腹泻率,且试验C组效果>试验B组>试验A组,呈量效关系。这可能是由于复合益生菌制剂中的地衣芽孢杆菌增强了肠道消化酶活性,提高了营养物质利用率所致,另外,这些益生菌进入肠道后均可抑制致病菌生长,从而减少腹泻的发生。
3.2 补喂复合益生菌制剂对幼犬胃肠动力的影响胃肠运动,特别是胃肠移行性复合运动(MMC),具有促进消化道内营养物质消化吸收的作用,主要受肠神经系统和胃肠激素调节[9]。近年来的研究指出,MLT可刺激MMC的发生与移行,是启动移行性复合运动Ⅲ相的重要启动因子之一[10]。GAS可刺激胃酸、胰液和胆汁的分泌,延缓胃排空,提高胃肠道化学消化吸收能力[11-12]。莫伟彬等[13]研究发现,补充益生菌可以提高竭性运动大鼠血清中MLT、GAS含量,并使其逐渐恢复到安静时的水平。SP可明显引起肠运动增强、胆囊收缩、胰液分泌量增加,并可刺激唾液分泌,Bayguinov等[14]发现SP可通过刺激胃肠壁内神经元的去极化,促使胃肠道平滑肌的收缩。以上3种物质均为兴奋消化道运动的胃肠激素,而VIP是一种抑制消化道运动的激素,能引起人和动物胃肠平滑肌的强烈舒张。赵力芳[15]在研究双歧杆菌三联活菌胶囊治疗儿童腹泻时发现,益生菌能显著降低VIP及5-HT含量,从而有效改善临床症状,提高疗效。本研究发现,补喂复合益生菌制剂可以在生理范围内提升血清中MLT含量,降低VIP含量,以试验C组效果最佳。根据结果推断,对胃肠激素MLT、VIP的调节是是本试验所用复合益生菌制剂维护幼犬健康的作用机制之一。
3.3 补喂复合益生菌制剂对幼犬肠道屏障功能的影响DAO是肠黏膜上层绒毛细胞内酶,胃肠黏膜受损后,大量的DAO被释放入肠腔,并通过肠壁细胞间隙及淋巴回流到达血液循环,血浆DAO的活性与肠黏膜上皮细胞的完整性和成熟度密切相关。Fukudome等[16]通过给小鼠注射5-氟尿嘧啶证实DAO活性反映了肠道黏膜的损伤程度。D-乳酸是肠道细菌的代谢产物,肠黏膜受损后肠腔内大量D-乳酸通过受损部位进入血液,使血液中D-乳酸含量升高,因此血液中D-乳酸含量升高往往提示肠黏膜损伤及通透性增高[17]。LPS是革兰阴性菌细胞壁的成分,现有研究认为,LPS的分子质量比细菌小,更容易穿过肠道黏膜屏障,肠道黏膜屏障受损后,可导致血液中LPS含量升高。有研究表明,益生菌降低急性腹泻大鼠血液中D-乳酸和LPS含量,减轻腹泻指数[18]。本研究结果表明,按1.0 g/(kg BW·d)的剂量补喂复合益生菌制剂可降低幼犬血清中DAO活性及D-乳酸和LPS的含量,而其他2个剂量的效果不明显,说明高剂量复合益生菌具有降低肠黏膜通透性,减少肠道中LPS进入血液循环。
幼犬免疫系统发育不完全,容易受到断奶应激、饲粮改变及环境改变等因素的影响,特别是肠道内LPS,容易激发促炎细胞因子IL-6、TNF-α等,抑制抗炎细胞因子IL-4、IL-10等。研究发现,炎性细胞因子对肠道屏障有着一定的影响,促炎细胞因子损伤肠道黏膜屏障,増加上皮通透性,提高病原菌易感性,从而激活甚至扩大炎症反应[19];相反,抗炎细胞因子能够通过降低肠道上皮通透性,缓解肠道炎症反应和肠道黏膜损伤[20]。Sturm等[21]的研究认为益生菌能够通过调控TNF-α、TNF-β、IL-10等细胞炎症介质来起到抑制肠道炎症的作用。Custodero等[22]通过Meta分析发现,益生菌可以显著地减少中老年人血清中IL-6和C-反应蛋白的含量,从而减少全身性炎症的发生。本研究发现,复合益生菌制剂可以降低血清中TNF-α的含量,试验C组和试验B组与阴性对照组有显著差异,与对比对照组差异不显著,且试验C组血清中IL-10含量上升。上述结果说明本试验所用复合益生菌制剂可以抑制促炎细胞因子,激发抗炎细胞因子,发挥缓解机体炎症反应,提高肠道黏膜屏障功能,减少疾病发生,且呈量效关系。
紧密连接相关蛋白是胃肠道机械屏障的基础结构,可维持正常的细胞旁通透性,防止大分子有毒物质如细菌代谢产物等通过细胞旁连接入侵机体,主要包括跨膜蛋白occludin、封闭蛋白-1(claudin-1)及胞内蛋白ZO-1等,其含量变化和结构改变均可影响肠道屏障功能。研究发现,MLCK对紧密连接相关蛋白表达及结构具有调控作用,MLCK表达量的增加可提高肌球蛋白轻链(MLC)的磷酸化水平,导致与其相连的ZO-1和occludin蛋白结构发生变化,表达量降低,从而提高肠上皮细胞旁通透性[23]。先已证实益生菌可提高紧密连接蛋白的表达,增强上皮紧密连接的完整性。给新生仔猪口服罗伊氏乳杆菌I5007后,空肠和回肠上皮occludin、ZO-1、claudin-1的蛋白表达量显著增加[24]。在饲粮中添加0.02%的植物乳酸杆菌可提高断奶仔猪肠道黏膜occludin-1、ZO-1基因mRNA的表达量[25]。但关于益生菌与MLCK相互关系的研究较少。本研究中,复合益生菌制剂不但可上调幼犬空肠黏膜occludin、ZO-1基因mRNA的相对表达量,还可下调MLCK基因mRNA的相对表达量,说明该复合益生菌制剂提高肠道机械性屏障作用涉及到肠道紧密连接蛋白及其信号转导调节,具体机制还需进一步研究。
4 结论综上所述,补喂复合益生菌制剂可以提高幼犬的平均日增重,减少腹泻率和便秘率,增强胃肠动力,降低肠黏膜损伤,保护肠黏膜机械性屏障作用,缓解机体炎症反应水平,说明复合益生菌制剂对幼犬具有保健作用,按每天1 g/kg BW的剂量补喂时效果最佳。
| [1] |
陈丽玲, 陈丽雄. Beagle幼犬腹泻的综合防治[J]. 中国畜牧兽医, 2006, 33(11): 90-91. DOI:10.3969/j.issn.1671-7236.2006.11.031 |
| [2] |
SALISU S S, NURA S, SHAAIBU A S, et al. Potentials of probiotics as alternative therapy in combating bacterial diseases:a review[J]. British Journal of Applied Science and Technology, 2014, 4(9): 1392-1410. DOI:10.9734/BJAST/2014/6577 |
| [3] |
MAKIOKA Y, TSUKAHARA T, IJICHI T, et al. Oral supplementation of Bifidobacterium longum strain BR-108 alters cecal microbiota by stimulating gut immune system in mice irrespectively of viability[J]. Bioscience, Biotechnology, and Biochemistry, 2018, 82(7): 1180-1187. DOI:10.1080/09168451.2018.1451738 |
| [4] |
曹煜成, 李卓佳, 冯娟, 等. 地衣芽孢杆菌胞外产物消化活性的研究[J]. 热带海洋学报, 2005, 24(6): 6-12. DOI:10.3969/j.issn.1009-5470.2005.06.002 |
| [5] |
王运东, 张俊秀, 韩真. 微生态制剂干预肠易激综合征患者疗效meta分析[J]. 中国微生态学杂志, 2011, 23(6): 543-545. |
| [6] |
CHIANG M L, CHEN H C, CHEN K N, et al. Optimizing production of two potential probiotic Lactobacilli strains isolated from piglet feces as feed additives for weaned piglets[J]. Asian-Australasian Journal of Animal Science, 2015, 28(8): 1163-1170. DOI:10.5713/ajas.14.0780 |
| [7] |
吴德华, 杜莉, 徐汉坤, 等. 纳豆芽孢杆菌对仔犬日增重和肠道菌群的影响[J]. 家畜生态学报, 2009, 30(3): 64-67. DOI:10.3969/j.issn.1673-1182.2009.03.016 |
| [8] |
燕珍寿, 许琴, 周宇翔. 添加益生菌对仔犬生长性能影响的研究[J]. 中国畜牧兽医文摘, 2014, 30(5): 200, 201. |
| [9] |
赵平, 董蕾, 兰康, 等. 多种胃肠激素在消化间期移行性复合运动中作用的研究[J]. 中华消化杂志, 2005, 25(2): 95-97. DOI:10.3760/j.issn:0254-1432.2005.02.009 |
| [10] |
CARLINI V P, GHERSI M, SCHIÖTH H B, et al. Ghrelin and memory:differential effects on acquisition and retrieval[J]. Peptides, 2010, 31(6): 1190-1193. DOI:10.1016/j.peptides.2010.02.021 |
| [11] |
牛亭惠, 吴国泰, 陈振鹤, 等. 幼龄厌食模型大鼠胃肠激素变化规律研究进展[J]. 甘肃中医学院学报, 2017, 34(1): 82-85. |
| [12] |
DOCKRAY G, DIMALINE R, VARRO A. Gastrin:old hormone, new functions[J]. Pflügers Archiv, 2005, 449(4): 344-355. DOI:10.1007/s00424-004-1347-5 |
| [13] |
莫伟彬, 杨衍滔, 郭艳菊, 等. 益生菌干预对运动大鼠胃肠激素与AQP4表达的影响[J]. 中国实验动物学报, 2018, 26(4): 411-417. DOI:10.3969/j.issn.1005-4847.2018.04.001 |
| [14] |
BAYGUINOV O, HAGEN B, SANDERS K M. Substance P modulates localized calcium transients and membrane current responses in murine colonic myocytes[J]. British Journal of Pharmacology, 2003, 138(7): 1233-1243. DOI:10.1038/sj.bjp.0705139 |
| [15] |
赵力芳. 双歧杆菌三联活菌胶囊联合思密达对儿童腹泻血浆VIP、NPY及肠黏膜5-HT的影响[J]. 中国微生态学杂志, 2015, 27(8): 917-920. |
| [16] |
FUKUDOME I, KOBAYASHI M, DABANAKA K, et al. Diamine oxidase as a marker of intestinal mucosal injury and the effect of soluble dietary fiber on gastrointestinal tract toxicity after intravenous 5-fluorouracil treatment in rats[J]. Medical Molecular Morphology, 2014, 47(2): 100-107. DOI:10.1007/s00795-013-0055-7 |
| [17] |
朱锦龙, 方兴亮. 急性胰腺炎患者早期血浆D-乳酸和内毒素水平与病情严重度评估系统的相关性研究[J]. 中华危重症医学杂志(电子版), 2013, 6(5): 41-43. DOI:10.3877/cma.j.issn.1674-6880.2013.05.011 |
| [18] |
胡长霞.益生菌对轮状病毒性腹泻小鼠肠道屏障的影响及机制的探讨[D].硕士学位论文.武汉: 华中科技大学, 2013. http: //cdmd.cnki.com.cn/Article/CDMD-10487-1014028896.htm
|
| [19] |
AL-SADI R, YE D M, SAID H M, et al. Cellular and molecular mechanism of interleukin-1β modulation of Caco-2 intestinal epithelial tight junction barrier[J]. Journal of Cellular and Molecular Medicine, 2011, 15(4): 970-982. DOI:10.1111/j.1582-4934.2010.01065.x |
| [20] |
FORSYTH C B, BANAN A, FARHADI A, et al. Regulation of oxidant-induced intestinal permeability by metalloprotease-dependent epidermal growth factor receptor signaling[J]. Journal of Pharmacology and Experimental Therapeutics, 2007, 321(1): 84-97. DOI:10.1124/jpet.106.113019 |
| [21] |
STURM A, RILLING K, BAUMGART D C, et al. Escherichia coli Nissle 1917 distinctively modulates T-cell cycling and expansion via Toll-like receptor 2 signaling[J]. Infection and Immunity, 2005, 73(3): 1452-1465. DOI:10.1128/IAI.73.3.1452-1465.2005 |
| [22] |
CUSTODERO C, MANKOWSKI R T, LEE S A, et al. Evidence-based nutritional and pharmacological interventions targeting chronic low-grade inflammation in middle-age and older adults:a systematic review and meta-analysis[J]. Ageing Research Reviews, 2018, 46: 42-59. DOI:10.1016/j.arr.2018.05.004 |
| [23] |
CHEN S W, ZHU J, ZUO S, et al. Protective effect of hydrogen sulfide on TNF-α and IFN-γ-induced injury of Intestinal epithelial barrier function in Caco-2 monolayers[J]. Inflammation Research, 2015, 64(10): 789-797. DOI:10.1007/s00011-015-0862-5 |
| [24] |
杨凤娟, 曾祥芳, 谯仕彦. 罗伊氏乳杆菌I5007对新生仔猪肠道形态、二糖酶活性和紧密连接蛋白表达的影响[J]. 中国农业科学, 2014, 47(22): 4506-4515. DOI:10.3864/j.issn.0578-1752.2014.22.016 |
| [25] |
李雪莉, 虞徳夫, 王超, 等. 植物乳杆菌制剂对断奶仔猪肠道黏膜功能和微生物菌群及短链脂肪酸的影响[J]. 南京农业大学学报, 2018, 41(3): 504-510. |



