2. 广西大学动物科学技术学院, 南宁 530004;
3. 珠海市现代农业发展中心, 珠海 519000
2. College of Animal Science and Technology, Guangxi University, Nanning 530004, China;
3. Zhuhai Modern Agriculture Development Center, Zhuhai 519000, China
灵芝(Ganoderma lucidum)作为一种传统的食药两用真菌, 其主要成分包括:多糖类化合物、三萜类和核苷类等, 具有调节免疫、抗肿瘤、抗病毒、抗衰老、抗氧化、保肝、镇静、镇痛、降血糖等作用[1-4], 作为名贵药材广泛地应用于人体保健品中。随着人们生活水平的提高, 灵芝因其具有种类多、分布广的优势, 同时灵芝液体培养工艺[5-7]已发展成熟, 可实现快速、大批量生产的要求, 显著降低生产成本, 使灵芝不再是高价格的中草药, 可满足广大消费者的需求。从目前的研究可知, 灵芝主要应用在医学和食品行业, 林伟龙等[8]灌喂3、9 g/(kg·d)复方赤灵芝营养粉给昆明小鼠, 探究其对小鼠的抗疲劳和抗氧化作用;何嘉烽等[9]用5、10和20 mg/(kg·d)自制水溶性灵芝粉灌喂BALB/C小鼠, 探究其对小鼠免疫活性的影响。但是, 灵芝在养殖业中应用的报道较少, 且灵芝在养殖业中运用还存在诸多问题, 如添加形式、添加剂量及其对动物生长的影响机制尚不明确。因此, 若能将灵芝的诸多功能运用于养殖业中, 可提高动物免疫力, 从而降低饲养成本, 改善动物肉品质, 能够更好地满足人类对肉类食品的追求。SD大鼠是动物界、脊索动物门、哺乳纲、啮齿目动物, 在科学试验中作为模型动物研究药理、毒理等;同属于啮齿目的竹鼠肉味鲜美、营养丰富, 广泛分布在我国南方省份, 有较高的药用价值和经济价值[10-11]。
因此, 本试验通过鉴定一种灵芝的菌种, 以SD大鼠为模型, 并用此灵芝按照体重10 mL/(kg·d)灌喂SD大鼠4周, 计算平均日采食量(ADFI)、平均日增重(ADG), 采集背最长肌测定肌苷酸、总蛋白和各种氨基酸的含量等相关指标, 探究该灵芝对SD大鼠生长性能和营养物质沉积等方面的影响, 为无柄灵芝在啮齿目动物中的应用提供依据。
1 材料与方法 1.1 灵芝菌属确定本试验灵芝菌种来源于珠海市现代农业发展中心, 菌种为液体状, 无菌条件下加入5 mL含菌丝的菌液至灭菌的马铃薯葡萄糖液体培养基, 28 ℃、150 r/min摇床培养4 d, 多层无菌纱布进行固液分离, 得到灵芝菌液和菌丝。按照四正柏生物公司植物DNA柱式提取试剂盒说明书提取灵芝菌的DNA, 琼脂糖凝胶电泳, 判断DNA分子质量大小范围。灵芝菌ITS序列扩增引物由上海生工生物工程技术服务有限公司合成, 进行PCR扩增, 扩增条件:95 ℃预变性5 min, 98 ℃变性10 s, 51~61 ℃退火30 s, 72 ℃延伸1 min, 共35个循环, 72 ℃补平5 min, 12 ℃终止。扩增产物送往生工生物工程(上海)股份有限公司测序部测序, 得到的序列用BLAST(Basic Local Alignment Search Tool)在NCBI上进行比对, 通过同源性系数确定灵芝菌属。
1.2 试验动物及设计选取3周龄健康雄性SD大鼠共36只, 约重60 g, 大鼠和饲料均购买于广东省医学实验动物中心, 预饲3 d, 随机分为3组:灌喂马铃薯葡萄糖水组(对照组)、灌喂无柄灵芝菌液组(菌液组)和灌喂无柄灵芝菌丝组(菌丝组), 每组4个重复, 每个重复3只大鼠。每天09:00—10:00灌喂, 按照10 mL/(kg BW·d)连续灌喂4周。试验期间自由采食和饮水。
1.3 样品采集与制备第4周试验期结束时, 禁食12 h, 称重后用10%水合氯醛麻醉, 解剖SD大鼠, 取肝脏、心脏、肾脏、脾脏和胸腺称重, 取背最长肌, -80 ℃冻存。
1.4 测定指标 1.4.1 生长性能测定SD大鼠在试验开始和结束时称重, 计算平均日增重;试验开始和结束时称各组剩余饲粮重量, 计算平均日采食量;根据平均日采食量和平均日增重计算饲料转化率(FCR), 公式如下:
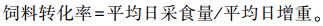
|
称心脏、肝脏、脾脏、肾脏和胸腺的器官重量, 根据公式计算器官指数:
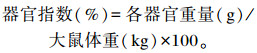
|
按照南京建成生物工程研究所试剂盒说明书, 用BCA法测定背最长肌中总蛋白含量。
釆用高效液相色谱法(HPLC)测定背最长肌中肌苷酸的含量, 其中HPLC色谱条件为色谱柱:ZORBAX SB-C18柱(5 μm, 4.6 mm×250 mm);流动相:A为甲醇溶液, B为0.05 mol/L磷酸盐缓冲液, v(A):v(B)=5:95;检测波长:254 nm;洗脱液流速:1 mL/min;进样量:20 μL;柱温:25 ℃;运行时间:标准工作液运行4 min, 样品提取液运行10 min。根据标准品和样品峰面积的比例计算SD大鼠背最长肌中肌苷酸含量, 计算公式为:
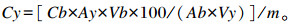
|
式中:Cy表示大鼠肉样溶液中肌苷酸含量(mg/g);Cb表示标准工作液中肌苷酸含量(mg/mL);Ay表示大鼠肉样溶液峰面积响应值;Ab表示肌苷酸标准品的峰面积;Vy表示大鼠肉样溶液进样量(μL);Vb表示肌苷酸标准液进样量(μL);m为肉样重(g)。
采用日立L8900全自动氨基酸分析仪测定氨基酸含量。分析条件:分离柱(4.6 mm×60 mm), 洗脱液流速为0.4 mL/min, 柱温为70 ℃, 柱压为9.267 MPa。反应柱:茚三酮缓冲液和茚三酮溶液流速均为0.35 mL/min, 柱温为135 ℃, 柱压为1.078 MPa。每个样品分析周期为53 min。按上述操作后, 样品中氨基酸含量计算公式为:
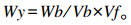
|
式中:Wy表示大鼠肉样溶液中氨基酸的含量(nmol/μL);Wb表示20 μL大鼠肉样溶液中氨基酸含量(nmol);Vb表示进样量(20 μL);Vf表示大鼠肉样溶液复溶后的体积(1 000 μL)。
1.5 统计分析结果采用平均值±标准误表示。采用SPSS 19.0软件进行one-way ANOVA方差分析, Duncan氏法进行多重比较, 其中生长性能相关指标以P<0.10为差异显著, 其他指标均以P<0.05为差异显著。
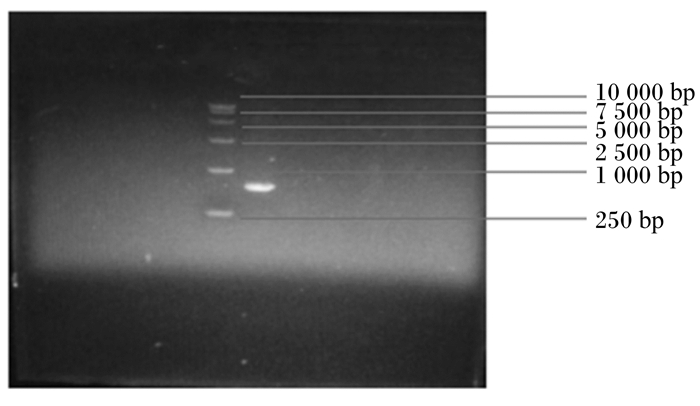
2 结果与分析 2.1 灵芝菌ITS序列测序结果由图 1可知, 该DNA电泳条带清晰, 与10 000 bp的Marker对比可知, 此灵芝的DNA大小在250~1 000 bp。经序列测定, 该灵芝DNA的ITS序列共有624个碱基。
|
图 1 提取灵芝DNA琼脂糖凝胶电泳 Fig. 1 Extraction of Ganoderma lucidum DNA agarose gel electrophoresis |
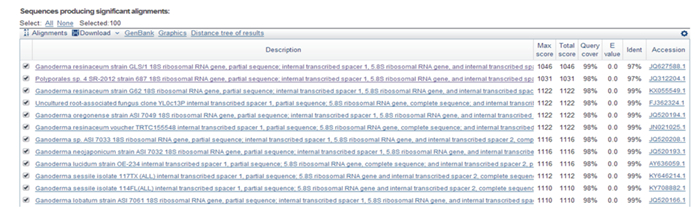
将该试验的灵芝菌ITS扩增后序列在NCBI网站上BLAST检测同源性系数。由图 2可知, 在DNA数据库中与该灵芝菌种与多孔菌目、俄勒冈灵芝及树舌灵芝的同源性为98%, 与无柄灵芝的同源性达到99%, 因此该菌种为无柄灵芝。
|
图 2 灵芝菌种ITS序列测序比对结果 Fig. 2 Ganoderma lucidum strain ITS sequence sequencing alignment results |
由表 1可知, 与对照组相比, 菌液组平均日增重显著提高(P<0.10), 平均日采食量和饲料转化率无显著变化(P>0.10), 菌丝组平均日采食量显著降低(P<0.10), 平均日增重和饲料转化率无显著变化(P>0.10)。
|
|
表 1 无柄灵芝对SD大鼠生长性能的影响 Table 1 Effects of sessile Ganoderma lucidum on growth performance of SD rats (n=12) |
由表 2可知, 与对照组相比, 菌液组和菌丝组心脏、肝脏、脾脏、肾脏和胸腺指数均无显著差异(P>0.05)。
|
|
表 2 无柄灵芝对SD大鼠内脏器官指数的影响 Table 2 Effects of sessile Ganoderma lucidum on visceral organ indexes of SD rats (n=12) |
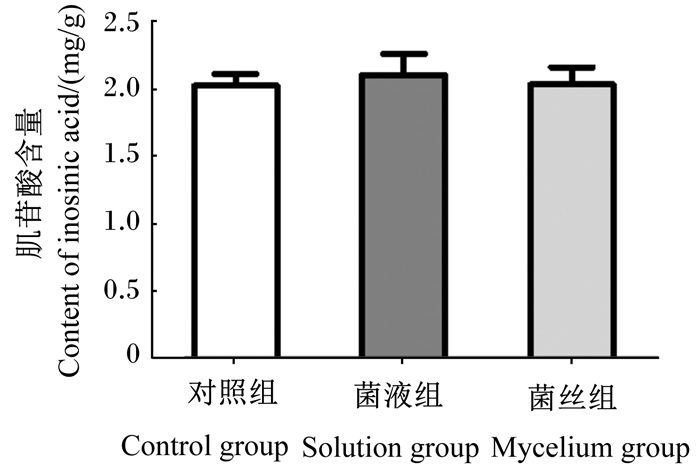
由图 3可知, SD大鼠背最长肌中肌苷酸含量, 对照组为(2.02±0.09) mg/g, 菌液组为(2.10±0.16) mg/g, 菌丝组为(2.03±0.13) mg/g。与对照组相比, 菌液组和菌丝组均可提高背最长肌中肌苷酸含量, 但未达到差异显著水平(P>0.05)。
|
数据柱标注相同字母或无字母表示差异不显著(P>0.05), 不同字母表示差异显著(P<0.05)。下图同。 Value bars with the same or no letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P < 0.05). The same as below. 图 3 无柄灵芝对SD大鼠背最长肌中肌苷酸含量的影响 Fig. 3 Effects of sessile Ganoderma lucidum on content of inosinic acid in Longissimus dorsi of SD rats |
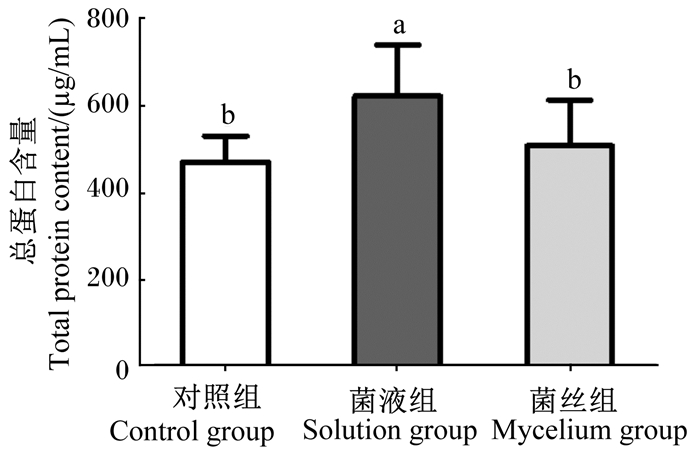
由图 4可知, SD大鼠背最长肌中总蛋白含量, 对照组为(471.84±59.41) μg/mL, 菌液组为(623.56±117.42) μg/mL, 菌丝组为(508.17±105.94) μg/mL。菌液组和菌丝组背最长肌中总蛋白含量较高, 其中菌液组显著高于对照组(P<0.05)。
|
图 4 无柄灵芝对SD大鼠背最长肌中总蛋白含量的影响 Fig. 4 Effects of sessile Ganoderma lucidum on total protein content in Longissimus dorsi of SD rats |
由表 3可知, 菌液组和菌丝组多种氨基酸含量均高于对照组, 其中菌液组的天冬氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、缬氨酸、蛋氨酸、异亮氨酸、酪氨酸、苯丙氨酸、组氨酸、精氨酸等12种氨基酸含量显著高于对照组(P<0.05);菌丝组与对照组相比, 各氨基酸含量均无显著差异(P>0.05)。
|
|
表 3 无柄灵芝对SD大鼠背最长肌中氨基酸含量的影响 Table 3 Effects of sessile Ganoderma lucidum on amino acid contents in Longissimus dorsi of SD rats |
通过分析动物的平均日增重和饲料转化率, 可直接反映出饲料添加剂的有效性。本试验中, 与对照组相比, 菌液组SD大鼠平均日增重显著提高, 而平均日采食量和饲料转化率没有显著变化, 推测是因为液体培养无柄灵芝的菌液中含有多糖、多肽、生物碱、三萜类、有机锗等具有生物活性的成分[12], 可促进动物机体健康成长。与对照组相比, 菌丝组的平均日采食量显著降低, 而平均日增重和饲料转化率没有显著变化, 推测其原因是无柄灵芝菌丝中含有多糖、蛋白质、氨基酸等物质, 为机体生长发育提供必需的营养, 从而减少动物对饲粮的消耗。本试验结果在一定程度上能够用前人的研究成果解释, 有报道表明灵芝及其提取物有抑制肿瘤、抗氧化的作用, 同时调节免疫、促进动物的生长[13-17]。另外, 邢瑞虎等[18]研究发现, 肉鸡基础饲粮中添加不同水平的灵芝培养物替代部分玉米, 结果表明灵芝菌培养物添加在饲粮中能改善低营养水平情况下肉鸡的生长性能。因此, 无柄灵芝可以作为动物饲粮的营养补充剂, 起到平衡大鼠饲粮、增强动物体质的作用, 同时提高饲料报酬, 降低畜牧生产中的养殖成本。
脏器指数可以直观地反映动物机体的健康程度, 其中新陈代谢的主要器官是肝脏和肾脏, 作为最大的消化腺, 肝脏功能正常与否可以间接反映机体的健康状况。陈铁晖等[19]研究发现, 给小鼠灌喂不同剂量的灵芝孢子油软胶囊内容物, 测定其免疫指标, 结果表明灵芝具有多种有效的生物学活性, 可以提高小鼠的免疫功能。与对照组相比, 菌液组和菌丝组大鼠的心脏、肝脏、脾脏、肾脏和胸腺指数差异均不显著, 液体培养的无柄灵芝菌液和菌丝可能对机体无毒性作用, 对器官也没有明显的损伤。
3.2 无柄灵芝对SD大鼠背最长肌中肌苷酸含量的影响肌苷酸可在水和碱溶液中形成稳定的芳香族化合物, 由于肌肉收缩过程中消耗能量, 使肌细胞利用ATP, 并在ATP酶、腺苷脱氢酶等的作用下分解形成。影响肉品鲜味的物质主要有无机盐、氨基酸和核苷酸代谢产物等, 其中对肌肉鲜味贡献较大成分是肌苷酸。目前, 肌苷酸的含量已成为国际公认的衡量肉鲜味优劣的重要指标[20-22]。
本试验结果显示, 与对照组相比, 菌液组和菌丝组的肌苷酸含量均有提高, 但未达到差异显著水平, 由此推测给大鼠灌喂无柄灵芝培养物可以提高肉中肌苷酸的含量, 和高艳敏等[23]研究结果基本一致。可能的原因是无柄灵芝中含有生物碱, 可加速大鼠肌肉中脂肪酸的β-氧化, 从而促进ATP的生成[24];亦或是无柄灵芝含有脂肪酸, 通过β-氧化增加ATP生成量[25]。
3.3 无柄灵芝对SD大鼠背最长肌中总蛋白及各种氨基酸含量的影响氨基酸作为肌肉中重要的鲜味和香味的前体物质, 其种类、含量及组成比例都对肉品味的优劣有着巨大的影响[26]。有研究表明, 畜禽肌肉呈现鲜味的基本成分包括谷氨酸、天冬氨酸和甘氨酸, 其中谷氨酸增加鲜味的作用最为显著, 可缓冲碱、酸等物质产生的不良味道, 与形成咸味有关, 甘氨酸则是呈甘味氨基酸。Mizuno等[27]研究表明, 灵芝糖肽复合物对合成核酸及蛋白质的代谢有影响, 对机体的物质代谢起调节作用。
本试验中, 菌液组和菌丝组背最长肌中总蛋白含量均高于对照组, 测定了17种氨基酸的含量, 其中菌液组有12种氨基酸含量显著高于对照组, 菌丝组各氨基酸含量与对照组相比差异均不显著。可能的原因是液体培养无柄灵芝的菌液中营养成分比菌丝复杂, 灌喂SD大鼠后消化吸收水分中的多糖类、多肽类及氨基酸而提高了背最长肌中氨基酸含量;无柄灵芝中含有一些矿物元素, 作为消化酶的激活剂, 从而促进蛋白质的消化吸收。以上结果表明, 菌液组和菌丝组的大鼠肉具有较高的风味, 营养物质含量也高于一般的肉品。由背最长肌中氨基酸含量的检测结果可知, 试验鼠的肌肉中氨基酸种类颇丰, 含有7种人体必需的氨基酸(赖氨酸、异亮氨酸、亮氨酸、缬氨酸、苏氨酸、苯丙氨酸), 这一结果与竹鼠肉[28]十分相似, 进一步了说明无柄灵芝增加SD大鼠营养物质的沉积, 提高肉制品风味, 在一定程度上能够反映无柄灵芝对竹鼠也会有相似的影响。
4 结论① 灌喂无柄灵芝菌液显著提高SD大鼠的平均日增重, 灌胃无柄灵芝菌丝显著降低大鼠的平均日采食量, 但均对饲料转化率和器官指数无显著影响, 表明在大鼠饲粮中添加无柄灵芝具有较好的安全性。
② 灌喂无柄灵芝菌液、菌丝未能显著影响SD大鼠背最长肌中肌苷酸含量, 但灌喂菌液显著提高背最长肌中总蛋白和天冬氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、缬氨酸、蛋氨酸、异亮氨酸、酪氨酸、苯丙氨酸、组氨酸、精氨酸等12种氨基酸的含量, 说明无柄灵芝菌液可提高大鼠肌肉中蛋白质沉积和肉质风味品质。
| [1] |
彭杨芷, 苏悦, 芦光亮, 等. 灵芝主要功效现代研究进展[J]. 亚太传统医药, 2016, 12(18): 71. |
| [2] |
张晓云, 杨春清. 灵芝的化学成分和药理作用[J]. 国外医药(植物药分册), 2006, 21(4): 152-155. DOI:10.3969/j.issn.1674-5515.2006.04.003 |
| [3] |
LEE S Y, RHEE H M. Cardiovascular effects of mycelium extract of Ganoderma lucidum:inhibition of sympathetic outflow as a mechanism of its hypotensive action[J]. Chemical and Pharmaceutical Bulletin, 1990, 38(5): 1359-1364. DOI:10.1248/cpb.38.1359 |
| [4] |
SONE Y, OKUDA R, WADA N, et al. Structures and antitumor activities of the polysaccharides isolated from fruiting body and the growing culture of mycelium of Ganoderma lucidum[J]. Agricultural and Biological Chemistry, 1985, 49(9): 2641-2653. |
| [5] |
刘冬, 李世敏, 许柏球, 等. 灵芝菌丝体深层液体发酵培养基研究[J]. 微生物杂志, 2001, 21(2): 15-17. |
| [6] |
李秀娟.灵芝液体发酵过程中微量元素的富集及多糖产量提高的研究[D].硕士学位论文.北京: 中国农业大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10019-2005061298.htm
|
| [7] |
TANG Y J, ZHONG J J. Role of oxygen supply in submerged fermentation of Ganoderma lucidum for production of Ganoderma polysaccharide and ganoderic acid[J]. Enzyme and Microbial Technology, 2003, 32(3/4): 478-484. |
| [8] |
林伟龙, 李兆安, 蔡金艳. 复方赤灵芝营养粉对小鼠抗疲劳作用和氧化损伤模型小鼠的影响[J]. 广东药科大学学报, 2019, 35(2): 242-245. |
| [9] |
何嘉烽, 吴小勇, 尹辉, 等. 水溶性灵芝粉的制备及其免疫调节活性评价[J]. 广东药科大学学报, 2018, 34(3): 288-292. |
| [10] |
宋兴超, 杨福合, 邢秀梅, 等. 我国竹鼠资源种类、价值及人工驯养前景[J]. 特种经济动植物, 2009, 12(2): 8-10. DOI:10.3969/j.issn.1001-4713.2009.02.005 |
| [11] |
刘克俊, 万火福, 张文明, 等. 竹鼠养殖业现状、前景及发展对策[J]. 广西畜牧兽医, 2017, 33(4): 180-183. DOI:10.3969/j.issn.1002-5235.2017.04.005 |
| [12] |
李志宏. 中华灵芝宝抗肿瘤作用及机理研究[J]. 黑龙江医药, 2002, 15(4): 285-287. DOI:10.3969/j.issn.1006-2882.2002.04.024 |
| [13] |
YEH C H, CHEN H C, YANG J J, et al. Polysaccharides PS-G and protein LZ-8 from Reishi (Ganoderma lucidum) exhibit diverse functions in regulating murine macrophages and T lymphocytes[J]. Journal of Agricultural and Food Chemistry, 2010, 58(15): 8535-8544. DOI:10.1021/jf100914m |
| [14] |
ZHAO H Y, LUO Y Y, LU C, et al. Enteric mucosal immune response might trigger the immunomodulation activity of Ganoderma lucidum polysaccharide in mice[J]. Planta Medica, 2010, 76(3): 223-227. DOI:10.1055/s-0029-1186055 |
| [15] |
张群豪, 於东晖, 林志彬. 用血清药理学方法研究灵芝浸膏GLE的抗肿瘤作用机制[J]. 北京医科大学学报, 2000, 32(3): 210-213. DOI:10.3321/j.issn:1671-167X.2000.03.005 |
| [16] |
WANG J G, ZHANG L N, YU Y H, et al. Enhancement of antitumor activities in sulfated and carboxymethylated polysaccharides of Ganoderma lucidum[J]. Journal of Agricultural and Food Chemistry, 2009, 57(22): 10565-10572. DOI:10.1021/jf902597w |
| [17] |
游育红, 林志彬. 灵芝多糖肽的抗氧化作用[J]. 药学学报, 2003, 38(2): 85-88. |
| [18] |
邢瑞虎, 郭艳丽, 何玉鹏, 等. 灵芝菌培养物对肉鸡生长性能、抗氧化性能和免疫功能的影响[J]. 甘肃农业大学学报, 2013, 48(6): 29-33. |
| [19] |
陈铁晖, 陈润. 灵芝孢子油软胶囊对小鼠免疫功能影响的实验研究[J]. 安徽预防医学杂志, 2016, 22(6): 367-370, 374. |
| [20] |
张晓羊, 王永强, 张文举, 等. 嗜酸乳杆菌发酵棉籽粕对黄羽肉鸡生长性能、屠宰性能和血清生化指标的影响[J]. 动物营养学报, 2016, 28(12): 3885-3893. |
| [21] |
陈继兰.鸡肉肌苷酸和肌内脂肪含量遗传规律及相关候选基因的研究[D].博士学位论文.北京: 中国农业大学, 2004: 3-5. http://cdmd.cnki.com.cn/Article/CDMD-10019-2004077901.htm
|
| [22] |
王永强, 张晓羊, 刘建成, 等. 嗜酸乳杆菌发酵棉籽粕对黄羽肉鸡肌肉营养成分和风味特性的影响[J]. 动物营养学报, 2017, 29(12): 4419-4432. DOI:10.3969/j.issn.1006-267x.2017.12.022 |
| [23] |
高艳敏, 边连全, 刘显军. 中草药复方制剂对桂香鸡生长性能和肉品质的影响[J]. 中国畜牧杂志, 2015, 51(3): 72-76. DOI:10.3969/j.issn.0258-7033.2015.03.017 |
| [24] |
汪以真, 许梓荣, 冯杰. 甜菜碱对猪肉品质的影响及机理探讨[J]. 中国农业科学, 2000, 33(1): 94-99. |
| [25] |
刘莉莹.茶病灵芝、树灵芝和无柄紫灵芝化学成分及生物活性研究[D].博士学位论文.北京: 北京协和医学院, 2017.
|
| [26] |
BONI I, NURUL H, NORYATI I. Comparison of meat quality characteristics between young and spent quails[J]. International Food Research Journal, 2010, 17(3): 661-666. |
| [27] |
MIZUNO T, WANG G Y, ZHANG J, et al. Reishi, Ganoderma lucidum and Ganoderma tsugae:bioactive substances and medicinal effects[J]. Food Reviews International, 1995, 11(1): 151-166. DOI:10.1080/87559129509541025 |
| [28] |
郭蓉, 王安明, 罗轶. 竹鼠肌肉营养成分分析[J]. 黑龙江畜牧兽医, 2015(2): 191-193. |




