2. 新疆伊犁昭苏县畜牧兽医站, 昭苏 835600
2. Animal Husbandry and Veterinary Station of Zhaoli County in Yili of Xinjiang, Zhaosu 835600, China
随着马产业的持续发展,纯血马被大规模引进,纯血马本土化繁殖逐渐增加。由于气候、地理位置、饲草料组成、营养水平及饲养管理等因素导致本地出生的纯血马驹生长滞后、体弱易生病等,严重影响纯血马驹的生长。肠道菌群在动物健康方面扮演着重要角色,包括促进肠道发育、调节肠道pH、减缓肠道应激及提高肠道免疫等。当前,幼龄动物肠道菌群多样性的研究主要集中于幼畜断奶后,由于断奶导致的应激,使断奶动物胃肠道功能失衡,易引发腹泻等疾病,严重影响动物的生长发育[1-4]。而针对断奶前动物肠道菌群多样性的研究鲜见报道。李晓斌等[5]研究了3~6月龄马驹肠道菌群的特点,结果显示3~6月龄马驹肠道菌群中优势菌分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、螺旋体菌门(Spirochaetes)、梭杆菌门(Fusobacteria)、无壁菌门(Tenericutes)、放线菌门(Actinobacteria)、TM7、广古菌门(Euryarchaeota),其中以厚壁菌门、拟杆菌门、变形菌门及疣微菌门的丰度较高。研究显示,腹泻或肠道炎症使马驹肠道中变形菌门、莫拉菌属及产气荚膜梭菌等丰度增加[6]。因此,由于肠道健康因素,导致肠道菌群丰度存在较大差异。目前,在国内本土繁育的纯血马数量不断增加的情况下,研究断奶前马驹肠道菌群结构及多样性,对纯血马本土化繁育马驹的健康养殖意义重大。因此,本试验以新疆昭苏伊犁马繁育研究中心的自繁纯血马断奶前马驹为研究对象,通过高通量测序技术检测其粪便菌群多样性,为丰富断奶前马驹肠道菌群组成、多样性及马驹肠道健康的研究提供参考依据。
1 材料与方法 1.1 试验动物试验动物为新疆昭苏县喀拉苏伊犁马研究繁育中心本土繁育的纯血马断奶前马驹。
1.2 试验设计本试验选择2018年3月出生、兽医常规检查正常(包括采食、饮水、精神状态、心率、呼吸及体温等)、体重[(128.56±8.34) kg]相近的纯血马哺乳公马驹5匹(编号分别为CJ1、CJ2、CJ3、CJ4和CJ5)。所有马驹均在同一条件下进行饲养管理,在断奶前1周采集马驹粪便样品。
1.3 饲养管理及补充料营养水平所有马驹均自由觅乳、采食牧草和饮水,每天按每100 kg体重补喂0.65 kg精料补充料,将全天的补喂量平均分成3份,分别在09:00、14:00、18:00分3次等量补喂。马驹3~6月龄的精料补充料组成及营养水平见表 1。
|
|
表 1 精料补充料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the concentrate supplement (DM basis) |
在采样当天,为便于样品采集,将马驹全天舍饲饲养(日常马驹白天活动场饲养,夜间舍饲饲养),并给马驹套戴收粪袋,将马驹每次排出的粪便收集于集粪桶内,混合均匀,按照四分法采集5 g样品,液氮速冻,最终将马驹全天采集的所有粪便样品-20 ℃冷冻保存,检测时全部解冻混合均匀,取样测定。将粪便样品按照马驹编号对应编号为CJ1、CJ2、CJ3、CJ4和CJ5。
1.5 指标测定马驹粪便细菌DNA的提取、PCR扩增、Illumina HiSeq测序及结果分析均由北京诺禾致源生物信息科技有限公司协助完成。
1.6 数据处理将原始数据进行拼接、过滤,得到有效数据。然后基于有效数据进行操作分类单元(OTU)聚类和物种分类分析。最后对OTU进行丰度、alpha多样性、维恩图和聚类分析。
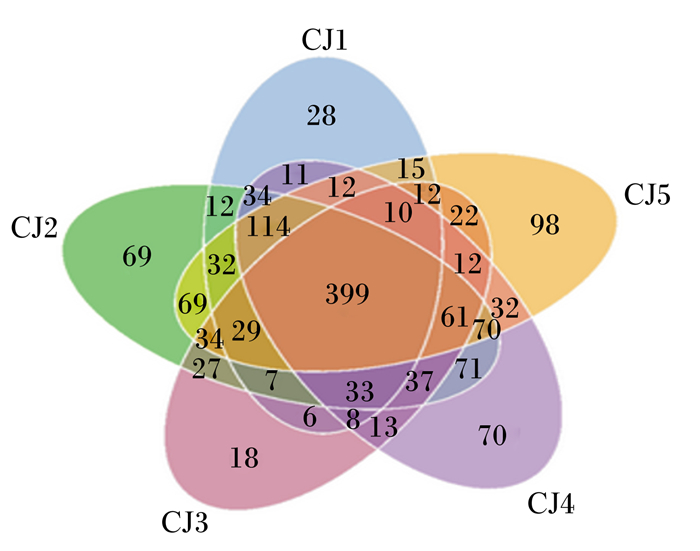
2 结果与分析 2.1 基于OTU的维恩图图 1为基于OTU的维恩图,结果显示,编号为CJ1、CJ2、CJ3、CJ4和CJ5的马驹粪便菌群中共有的OTU为399个,即表示它们相同的物种有399个,CJ1特有的OUT为28个、CJ2为69个、CJ3为18个、CJ4为70个、CJ5为98个。由此可见,CJ2、CJ4和CJ5特有的物种要多于CJ1和CJ3。
|
图 1 基于OTU的维恩图 Fig. 1 Venn map based on OTU |
由表 2可知,对5个样品在97%一致性阈值下的alpha多样性指数,观察的物种数分别是CJ5>CJ2>CJ4>CJ3>CJ1。Shannon、Chao1及ACE指数均表现为CJ2、CJ4和CJ5高于CJ3和CJ1,说明CJ2、CJ4和CJ5具有较高的菌群多样性。
|
|
表 2 alpha多样性指数 Table 2 Alpha diversity indexes |
由表 3可知,在门水平上,断奶前马驹粪便中排在前10的菌门为变形菌门、厚壁菌门、拟杆菌门、放线菌门、广古菌门、疣微菌门、螺旋体菌门、未明确细菌(unidentified_Bacteria)、纤维杆菌门及无壁菌门,其中厚壁菌门、拟杆菌门、变形菌门和放线菌门的丰度之和在90%以上。编号为CJ2、CJ4、CJ5的马驹粪便中以厚壁菌门为优势菌门,其次是拟杆菌门;而编号为CJ1和CJ3的马驹粪便中优势菌门为变形菌门,丰度分别为74.01%和75.72%。
|
|
表 3 门水平上马驹粪便菌群丰度 Table 3 Abundances of fecal microflora for foals at phylum level |
由表 4可知,在科水平上,断奶前马驹粪便中排在前10的菌科为莫拉菌科(属于变形菌门)、瘤胃菌科(属于厚壁菌门)、毛螺科、动性球菌科(属于厚壁菌门)、芽孢杆菌科、理研菌科、链球菌科(属于厚壁菌门)、未明确梭菌目(unidentified_Clostridiales)、Christensenellaceae及微球菌。其中,莫拉菌科是编号为CJ1和CJ3的马驹粪便的优势菌科,丰度分别为73.51%和75.47%;瘤胃菌科是编号为CJ2、CJ4、CJ5的马驹粪便菌群中的优势菌科,丰度分别为21.70%、11.80%、18.05%。此外,编号为CJ2、CJ4、CJ5的马驹粪便菌群中毛螺科、动性球菌科、芽孢杆菌科、理研菌科、链球菌科、Christensenellaceae及微球菌的丰度均高于CJ1和CJ3。
|
|
表 4 科水平上马驹粪便菌群丰度 Table 4 Abundance of fecal microflora for foals at family level |
表 5是在属水平上检测到的断奶前马驹粪便中排在前10的菌属。不动杆菌属是编号为CJ1和CJ3的马驹粪便中的主要菌属,丰度分别为71.09%和75.41%;编号为CJ2、CJ4及CJ5的马驹粪便中以芽孢杆菌、幽门螺杆菌、链球菌属、甲烷粒菌属等为主要菌属;编号为CJ2的马驹粪便中阿克曼菌属的丰度为2.79%,相对于其他马驹较高。
|
|
表 5 属水平上马驹粪便菌群丰度 Table 5 Abundances of fecal microflora for foals at genus level |
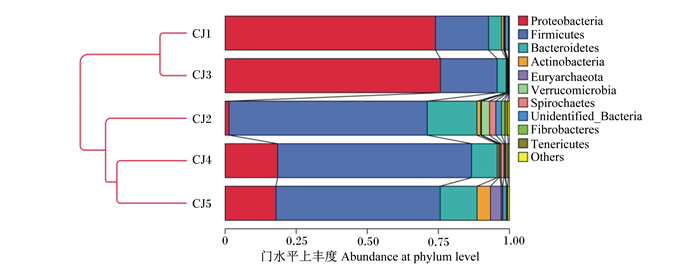
由图 2可知,在门水平上,粪便菌群结构相近的马驹被聚为一类。CJ1和CJ3变形菌门、厚壁菌门及拟杆菌门的丰度接近,被分为一类;CJ4、CJ5与CJ2因多数菌种丰度相近被分为一类。
|
Proteobacteria:变形菌门;Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Actinobacteria:放线菌门;Euryarchaeota:广古菌门;Verrucomicrobia:疣微菌门;Spirochaetes:螺旋体菌门;Unidentified_Bacteria:未明确细菌;Fibrobacteres:纤维杆菌门;Tenericutes:无壁菌门;其他:Others。 图 2 基于Weighted Unifrac距离的UPGMA系统发育树 Fig. 2 UPGMA phylogenetic tree based on Weighted Unifrac distance |
肠道是机体复杂的内环境,细菌是构成这一环境的首要因子,肠道菌群在维持肠道稳态、保持健康、提高肠道免疫及缓解饲粮改变造成的应激等方面扮演重要角色[7-8]。研究证明,肠道菌群对幼龄动物早期发育包括促免疫系统发育、肠道黏膜结构完整和饲粮消化(碳水化合物结构饲粮)等[9-11]。在马匹中,肠道菌群结构的破坏与多种因素有关,最显著的是结肠炎[12]、蹄叶炎[13]和马驹的短暂性腹泻[14],而饲养管理、饲粮结构类型的改变亦是影响肠道菌群结构发生变化的重要因素。
断奶应激影响幼龄动物健康生长的重要因素之一。目前,大多数研究证明断奶应激对幼龄动物的生长发育和生长性能有不利影响,包括生长速度减慢和养分消化率降低[15-17]。此外,断奶应激不仅损害幼龄动物的固有免疫,增加其患病风险[18-20],还会引起自发性免疫系统疾病[21],导致生长发育迟缓,甚至死亡。而肠道菌群在缓解这一应激中发挥着重要作用。因此,了解断奶前幼龄动物肠道菌群定植规律、结构、种类及丰度,对于丰富和增加肠道菌群多样性和减缓应激损伤意义重大。
Costa等[22]研究显示,180日龄夸特马马驹粪便中主要菌门为厚壁菌门、变形菌门、未明确细菌、疣微菌门、螺旋体菌门、放线菌门、拟杆菌门、酸杆菌门、衣原体门和纤维杆菌门,其中厚壁菌门的丰度为65%。本试验结果显示,纯血马断奶前马驹粪便菌群在门水平上排名前10的菌种为变形菌门、厚壁菌门、拟杆菌门、放线菌门、广古菌门、疣微菌门、螺旋体菌门、unidentified_Bacteria、纤维杆菌门及无壁菌门。厚壁菌门、拟杆菌门、变形菌门、疣微菌门、放线菌门及螺旋体菌门是马属动物消化道中主要的菌群,在生长马驹粪便中厚壁菌门的丰度最高,其次是拟杆菌门和变形菌门,这与李晓斌等[5]在6月龄伊犁马上的研究结果一致,6月龄伊犁马粪便厚壁菌门丰度为67.89%,拟杆菌门丰度为2.75%,变形菌门丰度为12.56%,疣微菌门丰度为10.19%。但本试验中,5匹纯血马驹中,编号为CJ1和CJ3的马驹粪便中变形菌门的丰度最高,分别达到了74.01%和75.72%,且变形菌门丰度的升高影响了厚壁菌门和拟杆菌门的丰度。厚壁菌门、拟杆菌门是草食动物肠道中主要的优势菌群,在降解饲粮、调节肠道pH、维持肠道健康中扮演重要角色。变形菌门是细菌界中最大的一个门,以病原菌为主,包括大肠杆菌、沙门氏菌、霍乱弧菌、幽门螺杆菌等,这类细菌丰度增加是肠道病变的表现。正常机体肠道中有益菌和有害菌处于动态平衡,肠道出现炎症反应时,有害菌将迅速增长,抑制有益菌繁殖,导致肠道中厚壁菌门和拟杆菌门丰度降低,而变形菌门丰度升高[23]。因此,本试验中编号为CJ1和CJ3的马驹粪便中变形菌门丰度异常升高,可能与其肠道存在炎症有关。研究显示,在3月龄之后的马驹粪便中,厚壁菌门、疣微菌门等的丰度之和在90%以上。厚壁菌门包括的细菌种类繁多,在大多数动物胃肠道中占优势地位,而大多数细菌与纤维降解有直接的关系,如毛螺菌科(Lachnospiraceae)和疣微菌科(Ruminococcaceae)[24]。但这一菌门也存在一些有害菌,例如艰难梭菌(Clostridium difficile)和产气荚膜梭菌(Clostridium perfringens),这不得不引起注意。李晓斌等[5]研究结果显示,伊犁马3月龄时粪便中拟杆菌门为优势菌,丰度为40.97%,而随着马驹月龄增加,粪便中拟杆菌门丰度降低,到6月龄时仅为2.75%;但厚壁菌门的丰度从3月龄的33.19%增加至6月龄的67.89%。随着马驹月龄增加,厚壁菌门丰度增加,拟杆菌门丰度降低,与马驹饲粮中纤维素的增加有直接关系,草食动物肠道中大部分纤维降解菌隶属于厚壁菌门,由于马驹纤维性饲料摄入的增加,促使厚壁菌门丰度升高。本试验中,编号为CJ2、CJ4及CJ5的马驹粪便中厚壁菌门丰度较高,为60%左右,与以上原因一致。
在科和属水平上,编号为CJ1和CJ3的马驹粪便中属于变形菌门的莫拉菌科和不动杆菌属丰度在各自的分类水平上均在70%以上,是其分类水平上的主要优势菌。而编号为CJ2、CJ4与CJ5的马驹粪便中属于厚壁菌门和拟杆菌门的瘤胃菌科、芽孢杆菌科、链球菌科及芽孢杆菌属、链球菌属等丰度明显高于莫拉菌科和不动杆菌属。这说明变形菌门丰度升高,可能影响了莫拉菌科和不动杆菌属丰度的变化。本试验结果显示,阿克曼菌属的丰度在编号为CJ2、CJ4与CJ5的马驹粪便中明显高于编号为CJ1和CJ3的马驹粪便中。研究显示,阿克曼菌在1月龄马驹粪便中被检测到,reads值接近40%[25]。阿克曼菌是肠道中降解黏蛋白的主要菌,而在人类肠道中这类菌是常驻菌的一部分。在肠道中,阿克曼菌可以以黏蛋白作为能源物质,从而通过竞争作用保护肠道免受致病菌的侵害。与其他肠道菌不同的是,阿克曼菌可以储备黏蛋白,即使在肠道中没有营养物质(特别是在禁食期间),也可以正常繁衍生息[26-27]。在马驹肠道菌群逐渐稳定阶段阿克曼菌可能扮演着重要角色。
4 结论本地自繁纯血马断奶前马驹粪便中丰度较高的菌门为厚壁菌门、拟杆菌门、变形菌门、放线菌门;肠道炎症马驹粪便中厚壁菌门和拟杆菌门的丰度降低,变形菌门、莫拉菌科和不动杆菌属的丰度较高,为各自分类水平上的优势菌。
| [1] |
曾秀玲, 熊力, 华莹, 等. 复合益生菌对早期断奶仔猪生长性能和体液免疫水平的影响研究[J]. 畜牧与饲料科学, 2019(2): 20-24. |
| [2] |
黄小流, 颜小星, 张童童, 等. 马齿苋多糖对早期断奶大鼠生长性能、血清生化指标和肠道形态的影响[J]. 动物营养学报, 2019, 31(4): 1773-1780. |
| [3] |
张瑞阳, 孟玲, 李方方, 等. 包被丁酸钠对断奶仔猪生长性能、血清生化指标、养分表观消化率和粪便微生物菌群的影响[J]. 动物营养学报, 2019, 31(5): 2296-2302. |
| [4] |
马露, 刘文慧, 阿拉腾珠拉, 等. 外源添加短链脂肪酸调控断奶前犊牛胃肠道健康发育潜在功能和机制[J]. 动物营养学报, 2019, 31(6): 2465-2470. |
| [5] |
李晓斌, 赵国栋, 刘振, 等. 3~6月龄伊犁马肠道微生物群落多样性的研究[J]. 动物营养学报, 2017, 29(5): 1535-1544. |
| [6] |
JULLIAND V, GOACHET A G.Fecal microflora as a marker of cecal or colonic microflora in horses[C]//Proceedings of the 19th Equine Science Society Symposium.Tucson, Arizona, 2015.
|
| [7] |
TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al. A core gut microbiome in obese and lean twins[J]. Nature, 2009, 457(7228): 480-484. DOI:10.1038/nature07540 |
| [8] |
DOMINGUEZ-BELLO M G, COSTELLO E K, CONTRERAS M, et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(26): 11971-11975. DOI:10.1073/pnas.1002601107 |
| [10] |
BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [10] |
RUSSELL S L, GOLD M J, WILLING B P, et al. Perinatal antibiotic treatment affects murine microbiota, immune responses and allergic asthma[J]. Gut Microbes, 2013, 4(2): 158-164. DOI:10.4161/gmic.23567 |
| [11] |
FAVIER C F, VAUGHAN E E, DE VOS W M, et al. Molecular monitoring of succession of bacterial communities in human neonates[J]. Applied and Environmental Microbiology, 2002, 68(1): 219-226. DOI:10.1128/AEM.68.1.219-226.2002 |
| [12] |
HARLOW B E, LAWRENCE L M, FLYTHE M D. Diarrhea-associated pathogens, lactobacilli and cellulolytic bacteria in equine feces:responses to antibiotic challenge[J]. Veterinary Microbiology, 2013, 166(1/2): 225-232. |
| [13] |
MOREAU M M, EADES S C, REINEMEYER C R, et al. Illumina sequencing of the V4 hypervariable region 16S rRNA gene reveals extensive changes in bacterial communities in the cecum following carbohydrate oral infusion and development of early-stage acute laminitis in the horse[J]. Veterinary Microbiology, 2014, 168(2/3/4): 436-441. |
| [14] |
KUHL J, WINTERHOFF N, WULF M, et al. Changes in faecal bacteria and metabolic parameters in foals during the first six weeks of life[J]. Veterinary Microbiology, 2011, 151(3/4): 321-328. |
| [15] |
MONTAGNE L, BOUDRY G, FAVIER C, et al. Main intestinal markers associated with the changes in gut architecture and function in piglets after weaning[J]. British Journal of Nutrition, 2007, 97(1): 45-57. DOI:10.1017/S000711450720580X |
| [16] |
WIJTTEN P J, VAN DER MEULEN J, VERSTEGEN M W. Intestinal barrier function and absorption in pigs after weaning:a review[J]. British Journal of Nutrition, 2011, 105(7): 967-981. DOI:10.1017/S0007114510005660 |
| [17] |
MOESER A J, KLOK C V, RYAN K A, et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2007, 292(1): G173-G81. DOI:10.1152/ajpgi.00197.2006 |
| [18] |
HU C H, XIAO K, LUAN Z S, et al. Early weaning increases intestinal permeability, alters expression of cytokine and tight junction proteins, and activates mitogen-activated protein kinases in pigs[J]. Journal of Animal Science, 2013, 91(3): 1094-1101. DOI:10.2527/jas.2012-5796 |
| [19] |
MOESER A J, RYAN K A, NIGHOT P K, et al. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2007, 293(2): G413-G421. DOI:10.1152/ajpgi.00304.2006 |
| [20] |
SMITH F, CLARK J E, OVERMAN B L, et al. Early weaning stress impairs development of mucosal barrier function in the porcine intestine[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2010, 298(3): G352-G363. DOI:10.1152/ajpgi.00081.2009 |
| [21] |
MAIN R G, DRITZ S S, TOKACH M D, et al. Increasing weaning age improves pig performance in a multisite production system[J]. Journal of Animal Science, 2004, 82(5): 1499-1507. DOI:10.2527/2004.8251499x |
| [22] |
COSTA M C, STÄMPFLI H R, ALLEN-VERCOE E, et al. Development of the faecal microbiota in foals[J]. Equine Veterinary Journal, 2016, 48(6): 681-688. DOI:10.1111/evj.12532 |
| [23] |
FLINT H J, BAYER E A. Plant cell wall breakdown by anaerobic microorganisms from the mammalian digestive tract[J]. Annals of the New York Academy of Sciences, 2008, 1125: 280-288. DOI:10.1196/annals.1419.022 |
| [24] |
REEVES A E, KOENIGSKNECHT M J, BERGIN I L, et al. Suppression of Clostridium difficile in the gastrointestinal tracts of germfree mice inoculated with a murine isolate from the family Lachnospiraceae[J]. Infection and Immunity, 2012, 80(11): 3786-3794. DOI:10.1128/IAI.00647-12 |
| [25] |
DERRIEN M, VAUGHAN E E, PLUGGE C M, et al. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(5): 1469-1476. DOI:10.1099/ijs.0.02873-0 |
| [26] |
SUCHODOLSK J S, STEPHENSON C E, BUONO A, et al. Postnatal development of the canine fecal microbiome[M]. Red Hook, NY: Curran Associates, Inc, 2013.
|
| [27] |
COSTA M C, STÄMPFLI H R, ARROYO L G, et al. Changes in the equine fecal microbiota associated with the use of systemic antimicrobial drugs[J]. BMC Veterinary Research, 2015, 11: 19. DOI:10.1186/s12917-015-0335-7 |




