2. 中国农业大学动物科技学院, 动物营养学国家重点实验室, 北京 100193
2. State Key Laboratory of Animal Nutrition, College of Animal Science & Technology, China Agricultural University, Beijing 100193, China
棉酚是一种存在于棉属植物中的多酚羟基双萘醛类化合物,可通过降低单胃动物血液携氧能力和红细胞溶血导致其死亡[1]。反刍动物对于棉酚的耐受性高于单胃动物[2]。研究显示,反刍动物瘤胃微生物对棉酚具有降解作用,使反刍动物在长期采食含有棉酚的棉副产品后不表现中毒现象[3]。体外发酵研究结果表明,瘤胃微生物吸收了一部分棉酚,随着消化时间的延长,瘤胃微生物体内的棉酚被逐步降解[4]。Tang等[5]研究发现,棉酚经瘤胃微生物发酵48 h后,左旋棉酚和右旋棉酚的降解率分别可达85.22%和87.18%。目前反刍动物瘤胃降解棉酚的机制有2种报道:1)棉酚与瘤胃中的可溶性蛋白质结合,形成不能被吸收的结合棉酚随粪便排出体外[6];2)体外培养研究中运用棉酚作为碳源分离培养出大量棉酚降解菌[7-9],瘤胃微生物可能利用棉酚作为碳源供自身生长。瘤胃微生物对棉酚具体的降解机制以及有哪些微生物参与了棉酚降解仍需进一步研究。
瘤胃原虫参与利用植物纤维素和淀粉转化为挥发性脂肪酸,同时可以吞食细菌降低细菌对淀粉的消化。在体外培养中,添加1~10 μmol/L棉酚时抑制了大部分原虫的生长[10]。在培养液中初次添加棉酚后导致了微生物数量下降,但是长期添加棉酚时微生物产生了适应性[11]。然而,也有体外试验发现添加醋酸棉酚时原虫数量显著升高[12]。在饲粮中棉酚添加量为100 mg/kg时绵羊瘤胃内容物中原虫数量显著高于对照组[13]。因此,棉酚对反刍动物瘤胃原虫有怎样的影响仍需进一步研究。目前的研究大多数集中在棉酚对瘤胃液中微生物数量的影响,而对瘤胃液中原虫种群多样性、各原虫种属相对丰度的影响鲜有报道,并且运用常规的显微镜计数方法研究瘤胃液中原虫数量在方法上存在很大难度。本试验拟运用常规显微镜计数方法测定醋酸棉酚对绵羊瘤胃液原虫数量的影响,并结合高通量测序技术分析醋酸棉酚对绵羊瘤胃液中原虫种属结构和多样性的影响,为深入研究棉酚对瘤胃微生物的影响提供试验依据。
1 材料与方法 1.1 试验动物与样品采集本试验于2017年7—10月在新疆惠康畜牧生物科技有限公司羊场进行。选取8只安装有永久性瘤胃瘘管的哈萨克羊母羊,随机分为2组,分别为试验组和对照组,每组4只。根据体重确定基础饲粮营养水平,其中精料补充料、玉米青贮、苜蓿、小麦秸秆分别为体重的1.5%、0.5%、1.0%、1.0%(干物质基础)。试验绵羊进行14 d的基础饲粮预饲后进入试验期,试验期内(第1~47天)对照组绵羊饲喂基础饲粮,试验组绵羊第1~26天在每千克基础饲粮中添加醋酸棉酚361 mg,第27~47天醋酸棉酚添加量增加至722 mg。基础饲粮营养水平参考《肉羊饲养标准》(NY/T 816—2004),基础饲粮组成及营养水平见表 1。醋酸棉酚购自湖北鑫源顺医药化工有限公司,纯度为98%。将基础饲粮和醋酸棉酚每天平均分为2份,分别在08:00和20:00饲喂,饲喂时先将醋酸棉酚与50 g粉状精料补充料混合均匀饲喂,待绵羊采食完后,将剩余的精料补充料、玉米青贮、小麦秸杆、苜蓿混合均匀后饲喂,自由饮水。试验绵羊统一饲养管理,定期清理瘘管。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
采集试验期第20(每千克饲粮中添加361 mg醋酸棉酚的第20天)、37(每千克饲粮中添加722 mg醋酸棉酚的第10天)和47天(每千克饲粮中添加722 mg醋酸棉酚的第20天)晨饲后3 h瘤胃液样品,用60目尼龙袋过滤,迅速分装后冻存于液氮中保存待测。
1.2 瘤胃液中微生物总DNA提取、扩增和测序瘤胃液原虫样品送至北京诺禾致源科技股份有限公司分析瘤胃液中原虫多样性。取瘤胃液原虫样品,采用十六烷基三甲基溴化铵(hexadecyltrimethy ammonium bromide,CTAB)法提取原虫的基因组总DNA,检测纯度和浓度后,稀释至1 ng/μL备用。以稀释后的基因组DNA为模板,使用18SV4(350 bp),通用引物为528F(5′-GCGGTAATTCCAGCTCCAA-3′)和706R(5′-AATCCRAGAATTTCACCTCT-3′),采用PCR扩增瘤胃液中原虫。PCR产物经2%凝胶电泳检测,使用Qiagen Gel Extraction Kit(Qiagen,德国)纯化PCR产物。使用TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用Illumina HiSeq 2500系统上机测序。将测序数据进行处理后,将相似性大于97%的序列聚类为1个操作分类单元(OTU),以最小值均一化处理,后续瘤胃液中原虫多样性分析均基于均一化后处理结果。
1.3 瘤胃液中原虫计数瘤胃液中原虫计数参照Nsabimana等[14]和卢德勋等[15]的方法。将瘤胃液原虫用甲基绿福尔马林(MFS)染液进行染色,置于改进后的血球计数板(在计数室的两边用胶水固定厚度为0.40 mm的玻片,使计数室深度为0.50 mm)上用光学显微镜计数。根据下面的公式计算每毫升瘤胃液中原虫数量:
原虫数量(个/mL)=每个小方格原虫数×8.0×105×稀释倍数。
式中:8.0×105为每毫升瘤胃液占用的小方格数。
1.4 数据统计与分析试验数据先应用Excel 2010整理,然后采用SPSS 22.0进行独立样本t检验,结果以平均值±标准差(mean±SD)表示,以P < 0.05为差异显著。
2 结果 2.1 醋酸棉酚对绵羊瘤胃液中原虫数量的影响由表 2可知,第20天,与对照组相比,试验组绵羊瘤胃液中原虫数量显著降低(P < 0.05);第37和47天,试验组与对照组绵羊瘤胃液中原虫数量差异不显著(P>0.05)。
|
|
表 2 醋酸棉酚对绵羊瘤胃液中原虫数量的影响 Table 2 Effects of gossypol acetic acid on protozoa number in rumen fluid of sheep |
本试验中的24个样品共得到1 408 756条高质量序列,平均每个样品58 698条序列,以97%的一致性聚类为131个OTU。本试验中各组样品的测序覆盖度均达到99%,能够满足后续分析。绵羊瘤胃液中原虫样品稀释曲线如图 1所示,稀释曲线最终逐渐平缓,说明在此测序深度下已经覆盖了瘤胃液中绝大部分的原虫样品。
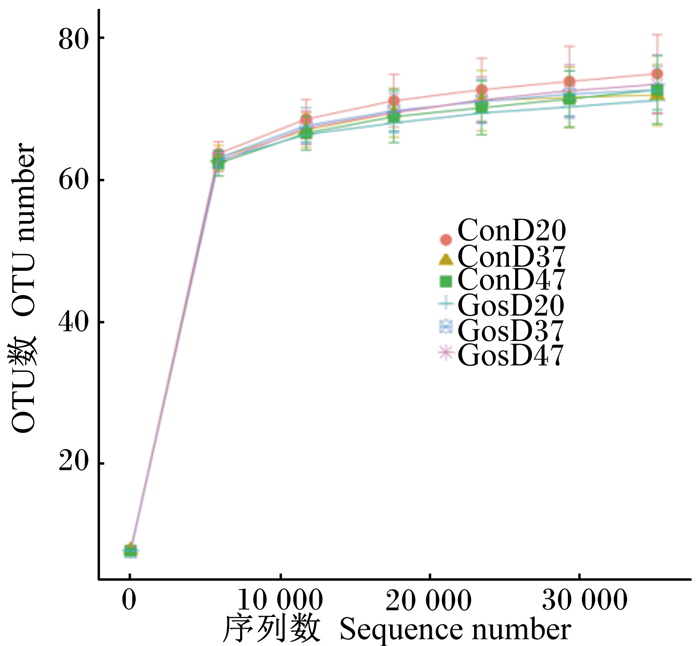
|
ConD20、ConD37和ConD47分别为对照组第20、37、47天样品;GosD20、GosD37和GosD47分别为试验组第20、37和47天样品。下表和图同。 ConD20, ConD37 and ConD47 were samples of control group at days 20, 37 and 47. GosD20, GosD37 and GosD47 were samples of trial group at days 20, 37 and 47. The same as below. 图 1 绵羊瘤胃液中原虫样品稀释曲线 Fig. 1 Rarefaction curve of protozoa samples in rumen fluid of sheep |
由表 3可知,第20、37和47天,试验组绵羊瘤胃液中原虫种群ACE、Chao1、Shannon和Simpson指数与对照组相比均无显著差异(P>0.05)。
|
|
表 3 醋酸棉酚对绵羊瘤胃液中原虫种群alpha多样性的影响 Table 3 Effects of gossypol acetic acid on alpha diversity of protozoa population in rumen fluid of sheep |
如图 2所示,第20天,试验组与对照组共享了74个OTU,试验组特有的OTU数为6个,低于对照组的19个(图 2-A);第37天,试验组与对照组共享了82个OTU,试验组特有的OUT数大于对照组,2组分别为14和5个(图 2-B);第47天,试验组与对照组共享了83个OTU,试验组特有的OTU数大于对照组,2组分别为12和6个(图 2-C)。
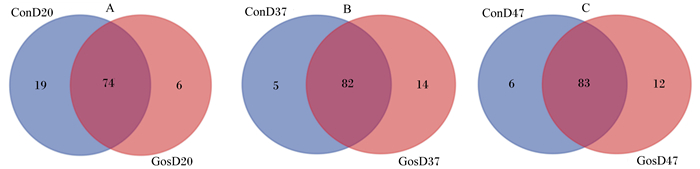
|
图 2 不同时间点绵羊瘤胃液中原虫韦恩图 Fig. 2 Venn diagram of protozoa in rumen fluid of sheep at different times |
如图 3所示,瘤胃液原虫样品第1主坐标(PC1)对于区分样品的贡献率为32.52%,第2主坐标(PC2)对于区分样品的贡献率为19.68%。试验组与对照组样品聚集在一起,试验组与对照组样品相似性较高,说明醋酸棉酚对绵羊瘤胃液中原虫种群结构无明显影响。
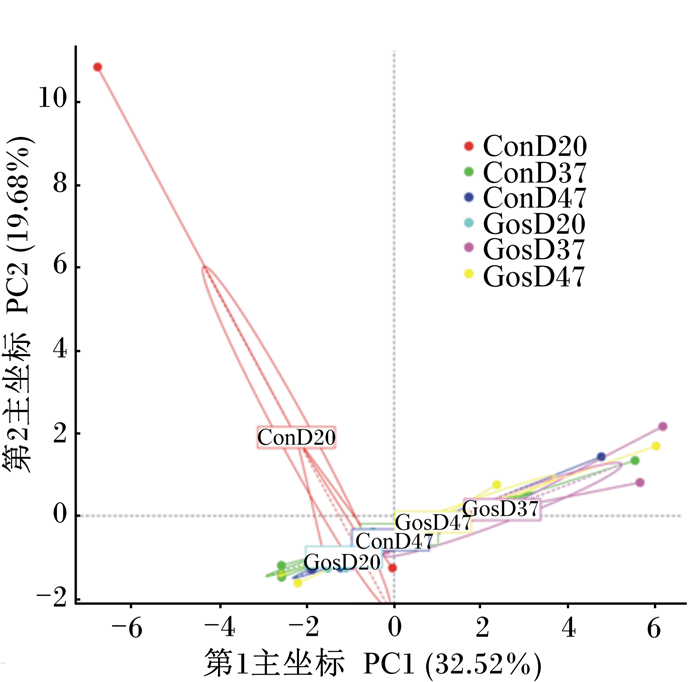
|
图 3 绵羊瘤胃液中原虫种群主成分分析图 Fig. 3 PCA diagram of protozoa population in rumen fluid of sheep |
由表 4可知,绵羊瘤胃液中主要原虫属为内毛属、多甲属、头毛属、刺甲双毛属、均毛属、复毛属、厚毛属、等毛属、后毛属、原始纤毛属,它们相对丰度之和占总原虫的比例超过90%。第37天,试验组绵羊瘤胃液中头毛属相对丰度显著高于对照组(P < 0.05),醋酸棉酚对瘤胃液其他原虫属相对丰度无显著影响(P>0.05)。第20和47天,试验组与对照组相比瘤胃液原虫在属水平上差异不显著(P>0.05)。
|
|
表 4 醋酸棉酚对绵羊瘤胃液中原虫属水平相对丰度的影响(占总原虫的比例大于1%) Table 4 Effects of gossypol acetic acid on relative abundance of protozoa at genus level in rumen fluid of sheep (proportion of total protozoa higher than 1%) |
绵羊瘤胃原虫是瘤胃微生物中体积最大的微生物,占总微生物体积的30%~80%[16]。本试验中,在每千克饲粮中添加醋酸棉酚361 mg时的第20天,显著降低了瘤胃液原虫数量;当醋酸棉酚添加量增加到722 mg时,对试验第37和47天(相当于每千克饲粮中添加722 mg醋酸棉酚的第10和20天)瘤胃液原虫数量无显著影响。有研究显示,在体外培养中,添加1~10 μmol/L棉酚时抑制了大部分原虫的生长[10]。在培养液中初次添加棉酚后导致了微生物数量下降,但是长期添加棉酚时微生物产生了适应性[11]。这与本试验第20天的试验结果一致。然而,也有体外试验发现醋酸棉酚添加量为0.50、0.10、0.05 mg/g(干物质基础)时原虫数量显著升高[12];在棉酚添加量为100 mg/kg饲粮时,试验第28天饲喂6 h后的绵羊瘤胃内容物中原虫数量显著高于对照组[13]。这种研究结果之间的不一致可能与试验动物的地域性、饲养环境、遗传背景、采样时间、棉酚添加量等不同有关。本试验中绵羊在摄入醋酸棉酚的初期显著降低了瘤胃液中原虫数量,并且在试验第37和47天(每千克饲粮中添加722 mg醋酸棉酚的第10天和第20天)瘤胃液中原虫数量处于动态平衡中,从生物对环境适应性的普遍原理而言,瘤胃液中的原虫可能对棉酚产生了一定的耐受性或者说是适应性。反刍动物瘤胃液中的原虫具有吞食细菌的作用,瘤胃液中原虫和细菌数量成反比[17],棉酚显著降低了瘤胃液中原虫的数量,对瘤胃液中细菌的数量有怎样的影响还有待于进一步研究。
3.2 醋酸棉酚对绵羊瘤胃液中原虫多样性的影响随着分子生物学技术的发展,第2代测序方法逐渐用来分析瘤胃液中原虫结构[18]。本试验结果显示醋酸棉酚对绵羊瘤胃液中原虫多样性无显著影响。值得注意的是瘤胃液中仍有许多真核微生物未鉴定分类,醋酸棉酚可能影响了瘤胃液中未鉴定原虫多样性,这部分原虫结构和功能有待于进一步的研究。从Venn图中可以看出,添加醋酸棉酚后的第37和47天,试验组特有OTU数高于对照组,而在第20天试验组特有OTU数低于对照组(显微镜计数方法测定也显示醋酸棉酚显著降低了瘤胃液中原虫数量),从另一方面也说明添加醋酸棉酚可能导致第20天瘤胃液原虫中的某些原虫数量降低,具体会影响到哪些原虫属有待进一步研究。
3.3 醋酸棉酚对绵羊瘤胃液中原虫种群结构的影响本试验中内毛属为绵羊瘤胃液优势菌属,占总原虫的47%~61%,这与藏羊瘤胃中内毛虫为优势原虫,占总原虫的72%~86%的结果[19]一致。从PCA图中也可以看出,醋酸棉酚对绵羊瘤胃液中原虫种群结构无明显影响。
在本试验的前期工作中,检测到绵羊瘤胃液中棉酚的浓度为2.37~5.63 μmol/L[20]。醋酸棉酚对于阴道滴虫(Trichomonas vaginalis)的半抑制浓度为24.39~38.77 μmol/L,平均半抑制浓度为31.9 μmol/L,并且未发现其对棉酚产生抗性[21]。20 μmol/L棉酚能通过抑制锥虫糖酵解从而影响其运动[22]。当培养液中棉酚浓度为0.01 μmol/L时显著抑制了克氏锥虫的生长速度[23]。本试验瘤胃液中棉酚浓度低于大多数原虫的抑制浓度,这可能是醋酸棉酚对绵羊瘤胃液中原虫种群结构无显著影响的原因。在第37天时试验组头毛属相对丰度显著高于对照组,可能头毛属对于棉酚具有降解作用或是棉酚促进其生长。目前,关于瘤胃原虫是否具有降解棉酚的作用仍未见报道,但是瘤胃中的原虫具有吞食细菌以及一些淀粉颗粒的作用,因此瘤胃液中的原虫可能间接与棉酚的降解有关,这一方面的问题值得进一步研究。
4 结论① 摄入醋酸棉酚的第20天,绵羊瘤胃液中原虫数量显著降低,但第37和47天瘤胃液中原虫数量无显著变化。
② 醋酸棉酚对绵羊瘤胃液中原虫alpha多样性无显著影响。
③ 除第37天头毛属相对丰度显著升高外,短时间低浓度和较长时间饲喂醋酸棉酚对绵羊瘤胃液原虫属水平相对丰度无显著影响。
| [1] |
JAGT D L V, DECK L M, ROYER R E. Gossypol prototype of inhibitors targeted to dinucleotide folds[J]. Current Medicinal Chemistry, 2000, 7(4): 479-498. DOI:10.2174/0929867003375119 |
| [2] |
CAMARA A C L, DO VALE A M, MATTOSO C R S, et al. Effects of gossypol from cottonseed cake on the blood profile in sheep[J]. Tropical Animal Health and Production, 2016, 48(5): 1037-1042. DOI:10.1007/s11250-016-1039-0 |
| [3] |
SMITH G S. Toxification and detoxification of plant compounds by ruminants:an overview[J]. Journal of Range Management, 1992, 45(1): 25-30. DOI:10.2307/4002521 |
| [4] |
王燕兵.瘤胃微生物对棉酚解毒能力的研究[D].硕士学位论文.北京: 北京农业大学, 1995: 19-20.
|
| [5] |
TANG C H, LIU J, ZHAO Q Y, et al. Pharmacokinetic comparison of gossypol isomers in cattle:transfer from diet to plasma and degradation by rumen microbes[J]. Journal of Zhejiang University:Science B, 2018, 19(6): 471-480. DOI:10.1631/jzus.B1700289 |
| [6] |
REISER R, FU H C. The mechanism of gossypol detoxification by ruminant animals[J]. The Journal of Nutrition, 1962, 76(2): 215-218. DOI:10.1093/jn/76.2.215 |
| [7] |
陈建军, 赵静, 李保华, 等. 高效降解棉酚菌株的分离、鉴定及发酵条件优化[J]. 饲料研究, 2016(9): 37-42, 46. |
| [8] |
杨霞.高效棉酚降解菌株的筛选鉴定及其差异蛋白质组学研究[D].博士学位论文.杭州: 浙江大学, 2010: 34-53. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1713837
|
| [9] |
ZHANG Y H, ZHANG Z Y, DAI L, et al. Isolation and characterization of a novel gossypol-degrading bacteria Bacillus subtilis strain rumen Bacillus subtilis[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(1): 63-70. DOI:10.5713/ajas.17.0018 |
| [10] |
ISMARTOYO I, STEWART C S, SHAND W J, et al.The effect of gossypol on the rumen protozoal degradation of grass hay (GH) in vitro[C]//Proceedings of the 8th International Symposium on Ruminant Physiology.Willigen: [s.n.], 1994: 25.
|
| [11] |
ISMARTOYO I, ACAMOVIC T, STEWART C S.The effect of gossypol on the rumen microbial degradation of grass hay under consecutive batch culture (CBS)[C]//Proceedings of 1993 Winter Meeting of the British Society of Animal Production.Scarborough: British Society of Animal Production, 1993: 171.
|
| [12] |
王海荣, 侯彩云, 杨金丽, 等. 体外发酵法研究游离棉酚对绵羊瘤胃微生物种群的影响[J]. 内蒙古农业大学学报, 2012, 33(5/6): 1-4. |
| [13] |
石彩霞, 侯彩云, 王海荣, 等. 游离棉酚对绵羊瘤胃发酵和微生物区系的影响[J]. 中国饲料, 2013(5): 16-19. DOI:10.3969/j.issn.1004-3314.2013.05.005 |
| [14] |
NSABIMANA E, KIŠIDAYOVÁ S, MACHEBOEUF D, et al. Two-step freezing procedure for cryopreservation of rumen ciliates, an effective tool for creation of a frozen rumen protozoa bank[J]. Applied and Environmental Microbiology, 2003, 69(7): 3826-3832. DOI:10.1128/AEM.69.7.3826-3832.2003 |
| [15] |
卢德勋, 谢崇文. 现代反刍动物营养研究方法和技术[M]. 北京: 农业出版社, 1991.
|
| [16] |
SYLVESTER J T, KARNATI S K R, YU Z T, et al. Development of an assay to quantify rumen ciliate protozoal biomass in cows using real-time PCR[J]. The Journal of Nutrition, 2004, 134(12): 3378-3384. DOI:10.1093/jn/134.12.3378 |
| [17] |
KURIHARA Y, EADIE J M, HOBSON P N, et al. Relationship between bacteria and ciliate protozoa in the sheep rumen[J]. Microbiology, 1968, 51(2): 267-288. |
| [18] |
KITTELMANN S, DEVENTE S R, KIRK M R, et al. Phylogeny of intestinal ciliates, including Charonina ventriculi, and comparison of microscopy and 18S rRNA gene pyrosequencing for rumen ciliate community structure analysis[J]. Applied and Environmental Microbiology, 2015, 81(7): 2433-2444. DOI:10.1128/AEM.03697-14 |
| [19] |
姚军, 郭健, 赵晋军, 等. 牦牛、藏羊瘤胃纤毛虫种群季节动态的研究[J]. 中国草食动物, 2002, 22(4): 17-18. DOI:10.3969/j.issn.2095-3887.2002.04.006 |
| [20] |
王彩蝶, 李钰琪, 屯妮萨·麦提赛伊迪, 等. 醋酸棉酚对绵羊瘤胃液真菌多样性的影响[J]. 动物营养学报, 2019, 31(7): 3374-3382. |
| [21] |
PACHECO L B, CASTRO-GARZA J, PEREZ-EGUÍA E, et al. Growth inhibitory activity of gossypol against several Trichomonas vaginalis isolates[J]. Pharmacy and Pharmacology Communications, 1996, 2(7): 333-334. |
| [22] |
EID J E, UENO H, WANG C C, et al. Gossypol-induced death of African trypanosomes[J]. Experimental Parasitology, 1988, 66(1): 140-142. DOI:10.1016/0014-4894(88)90059-8 |
| [23] |
MONTAMAT E E, BURGOS C, GEREZ DE BURGOS N M, et al. Inhibitory action of gossypol on enzymes and growth of Trypanosoma cruzi[J]. Science, 1982, 218(4569): 288-289. DOI:10.1126/science.6750791 |




