全世界约有25%的谷物被霉菌毒素污染,其中危害饲料最严重的是黄曲霉毒素,给畜牧业造成了巨大的经济损失[1]。黄曲霉毒素是一类由黄曲霉和寄生曲霉等产毒真菌通过聚酮途径所产生的次级代谢产物,所产生的黄曲霉毒素包括B1、B2、G1、G2、M1、M2等20种类型,其中黄曲霉毒素B1(AFB1)毒性最强,其主要生物学效应有致癌、致畸和致突变等作用,对人和畜禽健康危害极大[2]。目前,霉菌毒素脱毒常用的方法有物理、化学和生物脱毒法。物理和化学脱毒法除了脱毒效果差、成本高、易解离,还存在吸附饲料中营养物质、降低饲料营养价值和适口性差等弊端[3]。因此,寻找安全、高效的降解霉菌毒素的措施显得尤为重要。研究表明,AFB1在机体内主要经肠道吸收,转入肝脏代谢,诱导氧化应激,从而造成肝脏损伤和生长性能下降等中毒现象[4]。同时,肠道是消化吸收的主要器官,所面临的霉菌毒素浓度远高于其他组织,具有强脂溶性的AFB1会导致肠道氧化应激和肠道屏障功能受损,从而影响动物的生长性能[5]。本课题组前期研究表明,抗氧化复合添加剂(主要成分为酵母硒、维生素C和维生素E)和肠道健康复合添加剂(主要成分为丁酸钠、乳酸杆菌和黄芪多糖)能显著缓解AFB1对断奶仔猪产生的不利影响[6],能否缓解长期饲喂含AFB1饲粮对生长育肥猪产生的不利影响尚无报道。因此,本试验在含AFB1饲粮中分别添加抗氧化和肠道健康2种复合添加剂,考察它们对生长育肥猪生长性能、抗氧化能力、肝脏功能和毒素残留的影响。研究结果可为认识长期饲喂含AFB1饲粮对生长育肥猪的毒性作用提供试验依据,也可为实际生产中饲用霉菌毒素脱毒剂的研发提供方向。
1 材料与方法 1.1 AFB1的培养与检测AFB1的培养包括菌种活化、接种、发酵和收毒4个过程。1)活化:将黄曲霉菌(Aspergillus flavus 3.441,购于中科院生物所,主要代谢产物为AFB1)接种到马铃薯葡萄糖琼脂(PDA)培养基,待培养基上布满绿色孢子,加入到0.2%的吐温80溶液中,封口,摇床振荡15 min,悬浮液过8层擦镜纸,制得黄曲霉孢子悬浮液;2)接种:将制备好的孢子悬浮液稀释至106 CFU/mL,取10 mL接种至大米培养基;3)发酵:搅拌均匀,28 ℃培养箱中恒温培养5 d,待有绿色孢子若隐若现后再培养12 h,取出;4)收毒:在已经培养好的大米培养基中加入三氯甲烷淹没和湿润长满黄曲霉的培养基,4 ℃避光静止12 h,通风橱65 ℃蒸干三氯甲烷,培养基烘干、粉碎、装袋,避光保存。参照国标法(GB/T 17480—2008)检测培养的黄曲霉毒素,具体操作方法依照酶联免疫吸附试验(ELISA)试剂盒(购自江苏省苏微微生物研究有限公司)说明书进行。
1.2 试验动物与试验设计采用单因子试验设计,选取平均体重为(38.06±0.27) kg的健康“杜×长×大”生长育肥猪28头,按照体重相近原则随机分为4组,分别为对照组(基础饲粮)、AFB1组(预期含AFB1 280 μg/kg)、复合添加剂Ⅰ组(AFB1饲粮+0.3%抗氧化复合添加剂)和复合添加剂Ⅱ组(AFB1饲粮+0.3%肠道健康复合添加剂),每组7个重复,每个重复1头猪。试验期102 d。
1.3 试验饲粮试验采用玉米-豆粕型基础饲粮(表 1),营养需要参照NRC(2012)中25~50 kg、51~75 kg、76~100 kg和101~135 kg 4阶段推荐量配制。根据ELISA试剂盒测定的培养基中黄曲霉毒素含量,AFB1组饲粮使用含AFB1大米培养基等比例替代基础饲粮中的正常大米,使饲粮AFB1浓度至280 μg/kg左右;复合添加剂组饲粮是在AFB1组饲粮基础上分别用0.3%抗氧化复合添加剂(含维生素C、维生素E和酵母硒等)和0.3%肠道健康复合添加剂(含丁酸钠、乳酸杆菌、黄芪多糖等)等比例替代统糠。饲粮中黄曲霉毒素含量使用GB/T 30955—2014免疫亲和柱净化-高效液相色谱(HPLC)法测定。经检测,AFB1组、复合添加剂Ⅰ和Ⅱ组饲粮中AFB1含量分别为286.6、302.8和282.5 μg/kg。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验在四川农业大学动物营养研究所试验基地进行。试验前清洗料槽、水槽,彻底消毒猪舍。试验期间,猪只自由饮水,每日饲喂3次(08:00、14:00和20:00),少喂勤添,饲喂量以猪只吃饱后料槽内略有剩余为宜,各组饲养管理条件保持一致。保持圈舍通风,环境适宜,并于每日结算余料,记录采食量。
1.5 样品采集与处理在51~75 kg、76~100 kg和101~135 kg阶段结束时,猪只空腹12 h,前腔静脉采血20 mL,置于含肝素钠抗凝管中,室温下放置10 min,3 700 r/min离心15 min,分离血浆,置于-20 ℃保存待测。饲养试验结束,猪只采取常规电击放血屠宰,取肝脏、肾脏、脾脏、胰腺称重计算脏器指数;取背最长肌、肾脏及肝脏各20 g放入-20 ℃保存待测毒素残留。
1.6 检测指标与方法 1.6.1 生长性能试验期间准确记录每头试验猪的每日采食量,分别在猪只平均体重达到50、75、100和135 kg左右时空腹称重,计算猪的平均日增重(average daily gain,ADG)、平均日采食量(average daily feed intake,ADFI)和料重比(feed/gain,F/G)。
1.6.2 脏器指数猪只屠宰后立即取肝脏、脾脏、肾脏、胰腺,剥去表面薄膜和脂肪,称鲜重,计算脏器指数。计算公式为:
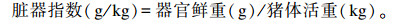
|
血浆总抗氧化能力(total antioxidant capability,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和总超氧化物歧化酶(total superoxide dismutase,T-SOD)活性及丙二醛(malondialdehyde,MDA)含量采用南京建成生物工程研究所试剂盒进行测定,操作均按说明书进行。
1.6.4 肝脏功能血浆谷草转氨酶(GOT)和谷丙转氨酶(GPT)活性采用南京建成生物工程研究所生产的试剂盒进行测定,操作均按说明书进行。
1.6.5 组织AFB1和黄曲霉毒素M1(AFM1)含量背最长肌、肾脏及肝脏组织AFB1和AFM1含量采用高效液相色谱法测定,具体操作参考Tavčar-Kalcher等[7]方法:将组织样品切成小块,绞碎,取3 g样品,加入30 mL二氯甲烷,超声10 min后摇床振荡1 h,过滤;滤液中加入3 g无水硫酸钠,再次过滤,取10 mL滤液至15 mL离心管中,50 ℃用氮吹仪吹干后,加入3 mL甲醇溶解,将3 mL甲醇用水稀释至15 mL,全部过柱。过柱方法:将上述15 mL稀释液(相当于1 g样品量)以1滴/s的速度全部通过黄曲霉六合一亲和柱;取10 mL纯水通过亲和柱,洗去杂质;加入1 mL甲醇洗脱,并收集全部洗脱液到玻璃小管中,上液相检测。以信噪比(S/N)为3计算检出限(LOD)为0.05 μg/kg。
1.7 数据统计分析试验数据先用Excel 2016初步整理,然后采用SAS 9.2软件中GLM程序进行单因素方差分析,并采用Duncan氏法进行多重比较。所有数据均以“平均值±标准误(SE)”表示,以P < 0.05为差异显著,0.05≤P≤0.10为差异有显著趋势。
2 结果 2.1 营养性复合添加剂对生长育肥猪生长性能的影响由表 2可知,38~50 kg阶段,各组生长育肥猪的ADG和ADFI无显著差异(P>0.05),复合添加剂Ⅰ组的F/G显著高于其他各组(P < 0.05)。51~75 kg阶段,与对照组相比,AFB1组的ADG显著降低(P < 0.05);与AFB1组相比,复合添加剂Ⅰ组的ADG显著升高(P < 0.05)。76~100 kg阶段,与对照组相比,AFB1组的ADG降低11.49%(P>0.05);与AFB1组相比,复合添加剂Ⅰ组的ADG升高10.69%(P>0.05)。101~135 kg阶段,各组的ADG、ADFI和F/G无显著差异(P>0.05)。
|
|
表 2 营养性复合添加剂对生长育肥猪生长性能的影响 Table 2 Effects of nutritional compound additive on growth performance of growing-finishing pigs |
由表 3可知,75 kg左右时,各组生长育肥猪的血浆T-SOD、GSH-Px活性及T-AOC无显著差异(P>0.05)。100 kg左右时,与对照组相比,AFB1组的血浆T-SOD和GSH-Px活性分别降低7.22%和16.93%(P>0.05),血浆MDA含量升高9.69%(P>0.05);与AFB1组相比,复合添加剂Ⅰ组的血浆T-SOD和GSH-Px活性分别提高23.29%和7.68% (P>0.05),血浆MDA含量显著降低(P < 0.05);复合添加剂Ⅱ组的血浆T-SOD和GSH-Px活性分别提高12.47%和19.28%(P>0.05),血浆MDA含量显著降低(P < 0.05)。135 kg左右时,与对照组相比,AFB1组的血浆T-SOD活性显著降低(P < 0.05),MDA含量显著升高(P < 0.05);与AFB1组相比,复合添加剂Ⅰ和Ⅱ组的血浆T-SOD活性显著升高(P < 0.05),复合添加剂Ⅱ组的血浆MDA含量显著降低(P < 0.05)。
|
|
表 3 营养性复合添加剂对生长育肥猪抗氧化能力的影响 Table 3 Effects of nutritional compound additive on antioxidant capacity of growing-finishing pigs |
由表 4可知,与对照组相比,AFB1组生长育肥猪的肝脏指数显著升高(P < 0.05);与AFB1组相比,复合添加剂Ⅰ和Ⅱ组的肝脏、肾脏、脾脏和胰腺指数均无显著差异(P>0.05)。
|
|
表 4 营养性复合添加剂对生长育肥猪脏器指数的影响 Table 4 Effects of nutritional compound additive on organ indexes of growing-finishing pigs |
由表 5可知,100 kg左右时,与对照组相比,AFB1组生长育肥猪的血浆GOT活性显著升高(P < 0.05);与AFB1组相比,复合添加剂Ⅰ和Ⅱ组的血浆GOT活性显著降低(P < 0.05)。135 kg左右时,与对照组相比,AFB1组的血浆GOT活性提高29.62%(P>0.05);与AFB1组相比,复合添加剂Ⅰ和Ⅱ组的血浆GOT活性分别降低28.49%和12.46%(P>0.05)。
|
|
表 5 营养性复合添加剂对生长育肥猪血浆GOT和GPT活性的影响 Table 5 Effects of nutritional compound additive on plasma GOT and GPT activities of growing-finishing pigs |
由表 6可知,与对照组相比,AFB1组生长育肥猪的肝脏和肾脏AFB1和AFM1含量显著升高(P < 0.05),背最长肌AFB1含量显著升高(P < 0.05);与AFB1组相比,复合添加剂Ⅰ组的肾脏AFM1和背最长肌AFB1含量显著降低(P < 0.05)。
|
|
表 6 营养性复合添加剂对生长育肥猪组织中AFB1和AFM1残留的影响 Table 6 Effects of nutritional compound additive on AFB1 and AFM1 residues in tissues of growing-finishing pigs |
AFB1作为一种剧毒物质,高剂量极易造成动物死亡,低剂量会因累积效应而致慢性中毒,阻碍动物的生长发育和对营养物质的吸收,造成经济损失[8]。研究报道,饲喂含84.4 μg/kg AFB1饲粮可以抑制断奶仔猪的生长性能,使ADG降低9.43%,ADFI显著降低16.87%[9];含250 μg/kg AFB1饲粮显著降低初始体重为14.2 kg的生长猪第9周的ADG[10]。本试验结果表明,饲喂AFB1含量为280 μg/kg饲粮使51~75 kg生长育肥猪的ADG显著降低,76~100 kg生长育肥猪的ADG降低11.49%,与以上试验结果相似,说明AFB1可以抑制生长育肥猪生长期的生长性能。然而,AFB1对101~135 kg生长育肥猪的生长性能几乎没有负面影响,可能是随着动物体重的增加,其免疫系统逐渐完善,对AFB1的耐受性增加,从而减弱了AFB1对猪生长性能的影响。本试验结果也表明,与AFB1组相比,抗氧化复合添加剂组生长育肥猪51~75 kg阶段的ADG显著升高,76~100 kg阶段的ADG升高10.69%,说明抗氧化复合添加剂在一定程度上可以缓解AFB1对猪生长性能的负面影响。这可能与抗氧化复合添加剂中含有维生素C、维生素E和酵母硒等成分有关,它们可通过提高机体抗氧化能力[11-12],缓解AFB1对机体产生的氧化损伤,从而改善猪的生长性能。
3.2 营养性复合添加剂对生长育肥猪抗氧化能力的影响为抵抗氧化损伤,机体内存在的酶类和非酶类抗氧化系统相互作用,共同维持机体自由基平衡,其中T-AOC、T-SOD、GSH-Px是酶类抗氧化系统的重要组成部分[13]。MDA则是脂质过氧化所产生的稳定终产物,其含量常常用来反映机体内的脂质过氧化程度和细胞损伤程度。通常AFB1的主要毒性体现在其导致过量活性氧(ROS)产生,引起脂质过氧化及相关酶活性降低[14]。研究表明,饲喂AFB1含量为372.8 μg/kg的饲粮可显著降低断奶仔猪的血清T-SOD活性[15]。本试验中,饲喂含AFB1饲粮降低生长育肥猪的血浆T-SOD和GSH-Px活性,升高MDA含量;而添加抗氧化复合添加剂或肠道健康复合添加剂均可有效缓解AFB1引起的血浆T-SOD和GSH-Px活性降低及MDA含量升高,表明2种添加剂均具有缓解AFB1引起机体抗氧化能力下降的功能。这可能与2种复合添加剂的组成有关,本试验抗氧化复合添加剂中包含维生素C和维生素E,能清除自由基,提高抗氧化酶活性,缓解AFB1引起的氧化应激[16];肠道健康复合添加剂中含有黄芪多糖,具有改善机体抗氧化的能力[17]。
3.3 营养性复合添加剂对生长育肥猪肝脏功能的影响AFB1是一种肝毒素,对动物肝脏具有较强的破坏作用。AFB1进入肝脏后,可与DNA结合,影响正常的转录和翻译,抑制蛋白质的合成,从而破坏细胞膜的稳定性并影响肝脏中脂类运输,使肝脏脂肪过量沉积,导致肝脏肥大和损伤[18]。血清GOT、GPT活性代表肝脏损伤程度。Shi等[19]研究报道,仔猪黄曲霉毒素中毒时,肝脏严重损伤,肝脏中GPT、GOT等酶类活性降低,而血清中这些酶活性显著升高。本试验中,AFB1组生长育肥猪的血浆GOT活性和肝脏指数高于对照组,表明AFB1的摄入导致生长育肥猪肝脏损伤;与AFB1组相比,2种复合添加剂均显著降低血浆GOT活性,表明复合添加剂在一定程度上缓解了AFB1对肝脏的损伤。但是添加剂的使用并未缓解由AFB1导致的肝脏指数增加,可能是猪长时间饲喂含AFB1饲粮,导致肝脏指数增高严重,虽然添加剂在一定程度上改善了肝脏功能,但不能完全使其恢复到正常状态。
3.4 营养性复合添加剂对生长育肥猪组织中AFB1和AFM1残留的影响AFB1不仅给动物和畜牧业造成了严重的危害,也可残留在动物的肝脏、肾脏、肌肉、血液及禽蛋等动物产品中,通过食物链危害人类健康[20]。黄曲霉毒素在生物体内的代谢较为复杂,动物摄入含AFB1的饲粮,约有50%在十二指肠被吸收,主要蓄积在肝脏、肾脏和肌肉中[21]。研究表明,家养动物如鸡、猪采食含AFB1的饲粮后,提高了肝脏、肾脏和肌肉组织中AFB1的残留量[22-23]。本试验结果表明,生长育肥猪长时间采食含AFB1饲粮,提高了肝脏及肾脏组织中AFB1及主要代谢产物AFM1残留量,提高了背最长肌中AFB1残留量。AFB1及AFM1在脏器中的残留伴随着机体氧化损伤或免疫抑制[15],这与本试验AFB1组生长育肥猪的血浆T-SOD活性显著降低、MDA含量显著升高的结果相符合。抗氧化复合添加剂可显著降低生长育肥猪的肾脏AFM1和背最长肌AFB1含量,表明抗氧化复合添加剂具有降低生长育肥猪组织毒素残留量的能力,提高猪肉食品的安全性。这些效果一方面可能是抗氧化复合添加剂能够清除氧化自由基,缓解肝脏氧化损伤,从而提高肝脏的解毒能力[24],减少AFB1在机体中的蓄积,降低AFB1在肌肉中的残留量;另一方面可能是抗氧化复合添加剂能分解体内过氧化物和环氧化物,抑制AFB1在体内的转化和分解,最终使AFB1以复合体的形式从粪便中排出体外,从而降低组织中毒素残留量[25]。
4 结论饲喂含280 μg/kg AFB1饲粮可导致猪生长性能和机体抗氧化能力下降、组织AFB1残留量增加、肝脏功能受损;添加0.3%抗氧化复合添加剂显著降低AFB1在猪组织中的残留量,提高机体抗氧化能力,缓解AFB1对猪生长性能和肝脏功能的不良影响;添加0.3%肠道健康复合添加剂显著提高机体抗氧化能力,缓解AFB1对猪肝脏的损伤。
| [1] |
MOSS M O. Risk assessment for aflatoxins in foodstuffs[J]. International Biodeterioration & Biodegradation, 2002, 50(3/4): 137-142. |
| [2] |
MISHRA H N, DAS C. A review on biological control and metabolism of aflatoxin[J]. Critical Reviews in Food Science and Nutrition, 2003, 43(3): 245-264. DOI:10.1080/10408690390826518 |
| [3] |
左瑞雨, 王秋文, 常娟, 等. AFB1降解剂对肉鸡生长性能、养分代谢及AFB1在体内残留的影响[J]. 中国畜牧兽医, 2017, 44(2): 432-439. |
| [4] |
ATHERSTONE C, GRACE D, LINDAHL J F, et al. Assessing the impact of aflatoxin consumption on animal health and productivity[J]. African Journal of Food, Agriculture, Nutrition and Development, 2016, 16(3): 10949-10966. DOI:10.18697/ajfand.75.ILRI01 |
| [5] |
毕小娟, 陈代文, 余冰, 等. 黄曲霉毒素B1对断奶仔猪生长性能, 肝脏组织及肠道健康的影响[J]. 动物营养学报, 2018, 30(8): 3276-3284. DOI:10.3969/j.issn.1006-267x.2018.08.047 |
| [6] |
高亿清.不同复合添加剂对采食含霉菌毒素饲粮断奶仔猪生长性能和肠道健康的影响[D].硕士学位论文.雅安: 四川农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10626-1016052923.htm
|
| [7] |
TAVČAR-KALCHER G, VRTAČ K, PESTEVŠEK U, et al. Validation of the procedure for the determination of aflatoxin B1 in animal liver using immunoaffinity columns and liquid chromatography with postcolumn derivatisation and fluorescence detection[J]. Food Control, 2007, 18(4): 333-337. DOI:10.1016/j.foodcont.2005.10.016 |
| [8] |
YUNUS A W, RAZZAZI-FAZELI E, BOHM J. Aflatoxin B1 in affecting broiler's performance, immunity, and gastrointestinal tract:a review of history and contemporary issues[J]. Toxins, 2011, 3(6): 566-590. DOI:10.3390/toxins3060566 |
| [9] |
黄能金.自然霉变玉米对断奶仔猪的毒性作用及添加剂的解毒效果研究[D].硕士学位论文.雅安: 四川农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10626-1016050879.htm
|
| [10] |
RUSTEMEYER S M, LAMBERSON W R, LEDOUX D R, et al. Effects of dietary aflatoxin on the health and performance of growing barrows[J]. Journal of Animal Science, 2010, 88(11): 3624-3630. DOI:10.2527/jas.2009-2663 |
| [11] |
NUNES G L, ROBINSON K, KALYNYCH A, et al. Vitamins C and E inhibit O2- production in the pig coronary artery[J]. Circulation, 1997, 96(10): 3593-3601. DOI:10.1161/01.CIR.96.10.3593 |
| [12] |
WANG X, SHEN Z, WANG C, et al. Dietary supplementation of selenium yeast enhances the antioxidant capacity and immune response of juvenile Eriocheir sinensis under nitrite stress[J]. Fish & Shellfish Immunology, 2019, 87: 22-31. |
| [13] |
LYKKESFELDT J, SVENDSEN O. Oxidants and antioxidants in disease:oxidative stress in farm animals[J]. The Veterinary Journal, 2007, 173(3): 502-511. DOI:10.1016/j.tvjl.2006.06.005 |
| [14] |
BEDARD L L, MASSEY T E. Aflatoxin B1-induced DNA damage and its repair[J]. Cancer Letters, 2006, 241(2): 174-183. DOI:10.1016/j.canlet.2005.11.018 |
| [15] |
FU J C, CHEN Q, DU J, et al. Effectiveness of maifanite in reducing the detrimental effects of aflatoxin B1 on hematology, aflatoxin B1 residues, and antioxidant enzymes activities of weanling piglets[J]. Livestock Science, 2013, 157(1): 218-224. DOI:10.1016/j.livsci.2013.06.032 |
| [16] |
ALPSOY L, YILDIRIM A, AGAR G. The antioxidant effects of vitamin A, C, and E on aflatoxin B1-induced oxidative stress in human lymphocytes[J]. Toxicology and Industrial Health, 2009, 25(2): 121-127. DOI:10.1177/0748233709103413 |
| [17] |
DANG S S, ZHANG X, JIA X L, et al. Protective effects of emodin and astragalus polysaccharides on chronic hepatic injury in rats[J]. Chinese Medical Journal, 2008, 121(11): 1010-1014. DOI:10.1097/00029330-200806010-00009 |
| [18] |
JEANNOT E, BOORMAN G A, KOSYK O, et al. Increased incidence of aflatoxin B1-induced liver tumors in hepatitis virus C transgenic mice[J]. International Journal of Cancer, 2012, 130(6): 1347-1356. DOI:10.1002/ijc.26140 |
| [19] |
SHI Y H, XU Z R, FENG J L, et al. Effects of modified montmorillonite nanocomposite on growing/finishing pigs during aflatoxicosis[J]. Asian-Australasian Journal of Animal Sciences, 2005, 18(9): 1305-1309. DOI:10.5713/ajas.2005.1305 |
| [20] |
CREPPY E E. Update of survey, regulation and toxic effects of mycotoxins in Europe[J]. Toxicology Letters, 2002, 127(1/2/3): 19-28. |
| [21] |
李娟娟, 苏晓鸥. 不同吸附剂对黄曲霉毒素B1吸附效果的研究[J]. 中国畜牧兽医, 2009, 36(8): 5-10. |
| [22] |
HUSSAIN Z, KHAN M Z, KHAN A, et al. Residues of aflatoxin B1 in broiler meat:effect of age and dietary aflatoxin B1 levels[J]. Food and Chemical Toxicology, 2010, 48(12): 3304-3307. DOI:10.1016/j.fct.2010.08.016 |
| [23] |
NEFF G L, EDDS G T. Aflatoxins B1 and M1:tissue residues and feed withdrawal profiles in young growing pigs[J]. Food and Cosmetics Toxicology, 1981, 19: 739-742. DOI:10.1016/0015-6264(81)90529-0 |
| [24] |
YILMAZ S, KAYA E, COMAKLI S. Vitamin E (α tocopherol) attenuates toxicity and oxidative stress induced by aflatoxin in rats[J]. Advances in Clinical and Experimental Medicine, 2017, 26(6): 907-917. DOI:10.17219/acem/66347 |
| [25] |
王钟翊.纳米硒对肉鸭日粮中黄曲霉毒素B1解毒效果的研究[D].硕士学位论文.重庆: 西南大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10635-2009103812.htm
|




