2. 北京农学院奶牛营养学北京市重点实验室, 北京 102206
2. Beijing Key Laboratory of Dairy Nutrition, Beijing Agricultural College, Beijing 102206, China
海藻是海洋中藻类的总称,它分布在低潮线以下的浅海地区,无花蕾、种子,生殖方式多样。世界上已知藻类有3万多种,人类开发利用的藻类主要分为四大类:红藻、褐藻、绿藻和蓝藻[1]。现阶段,随着常规饲料原料的供应紧张和价格上涨,开发优质非常规功能饲料已成为解决畜牧业饲料资源有效供应的长期任务。作为一种优良的非常规饲料资源,海藻具有分布广、产量大、适应能力强等特点,同时富含蛋白质、氨基酸、多不饱和脂肪酸、维生素、矿物质及多糖、多酚等功能性物质[2],兼有营养和提高免疫性能的双重功效,并有着来源广、产量大、无残留、无生物耐药性的独特优势[3-5],这些特性决定了其巨大的饲料经济开发价值,应用前景广阔。然而,海藻在动物饲粮中的应用效果受其种类和添加水平的影响较大,因此有必要对其营养功能及其在生产中的应用进行深入研究。
根据《2016中国渔业统计年鉴》[6],我国产量排在前3位的海藻分别为海带、裙带菜、紫菜,其占总藻类产量的比例分别为70%、10%、6%。本试验选择这3种国内典型海藻原料,通过体外发酵试验研究其对奶牛瘤胃发酵的潜在调节作用,为进一步开展动物饲用效果试验提供参考依据。
1 材料与方法 1.1 试验材料试验用海带、紫菜和裙带菜选购于西安万方生物有限公司,纯度均为100%,制成灰绿色粉末。试验材料为同一批次,密封保存,3种海藻的化学成分列于表 1。
|
|
表 1 3种海藻的化学成分(干物质基础) Table 1 Chemical constituents of three kinds of seaweeds (DM basis) |
试验采用单因素等间距梯度试验,在体外发酵条件下,全混合日粮(TMR)中每种海藻分别设计6个添加量[0(对照)、2%、4%、6%、8%、10%],每个添加量设置8个重复,试验共进行3个批次。测定体外发酵不同时间(0、1.5、3.0、6.0、12.0、24.0、48.0)时的产气量以及体外发酵48.0 h时的发酵参数。
1.3 试验动物及饲养管理在北京奶牛中心首农集团延庆良种场选用10头健康、体况相近、3胎次的荷斯坦奶牛作为瘤胃液供体动物。试验用牛采食该牛场正常棚区TMR,自由采食饮水,TMR组成及营养水平列于表 2。试验奶牛每天饲喂3次(07:00、13:00、18:00),每天用全自动管道式挤奶机挤奶3次(09:00、15:00、20:00)。牛舍地面每天自动刮粪机自动刮粪,每周彻底消毒1次,替换垫料1次,保证卫生清洁和动物福利健康。
|
|
表 2 TMR组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of the TMR (DM basis) |
|
|
表 3 发酵底物组成及营养水平(干物质基础) Table 3 Composition and nutrient levels of fermentation substrates (DM basis) |
参照Menke等[8]的方法配制发酵缓冲液,试验当天现用现配,溶液充分混合均匀后通入稳定的CO2气体,使得溶液粉红色消除,缓冲液pH=6.80。使用前39 ℃预热。
1.5 瘤胃液采集及发酵底物在晨饲前使用口腔瘤胃液采样器采集瘤胃液,用4层无菌纱布过滤至塑料烧杯中,然后迅速转移至39 ℃预热后的保温瓶内,充入CO2气体,迅速带回实验室置于39 ℃水浴锅中,并持续充入CO2气体待用。各组发酵底物组成及营养水平列于表 3。
1.6 体外发酵将各组TMR烘干并粉碎,过40目筛,准确称取0.5 g(干物质基础)于发酵瓶中(容积100 mL),按瘤胃液:缓冲液为1 : 2的比例加入混合培养液75 mL,混合均匀。通入CO2气体5 s以排出发酵瓶中的空气,迅速塞上橡胶塞并拧上旋钮盖,立即接种于AGRS-Ⅲ型微生物发酵微量产气自动记录仪(中国农业大学发明专利,专利号为ZL200610011301.X),39 ℃连续培养48 h,实时自动记录产气量,每隔12 h轻轻摇晃发酵瓶,使底物能充分发酵。每个添加量设8个平行,同时设置6个只加混合培养液的空白对照,重复3个批次。受试验条件限制,每种海藻单独进行试验,同一种海藻试验所用瘤胃液来源批次相同。参照文献[9],饲粮样品在105 ℃下烘至恒重测定干物质含量,通过凯氏定氮法测定粗蛋白质含量,使用Soxhlet装置测定粗脂肪含量;根据Van Soest等[10]描述的方法,使用热稳定淀粉酶(Sigma no.A3306,Sigma Chemical Co.,St.)测定饲粮样品中NDF和ADF的含量;饲粮样品中钙、磷含量测定使用实验室常规分析方法[11]进行。
1.7 样本采集及测定分别于发酵1.5、3.0、6.0、12.0、24.0、48.0 h时记录产气量数值,发酵48 h后立即将发酵罐从培养箱转移至冰水中冷却终止发酵。使用便携式pH计(Testo-205,Testo AG,Lenzkirch,美国)立即测定发酵液pH;将冷浴后的发酵液通过4层无菌纱布过滤,滤液部分分装至4支离心管内,按离心管中溶液比例计算添加25%的偏磷酸溶液,盖上盖子摇晃混匀置于-20 ℃冰箱中冷冻保存,用于氨态氮(NH3-N)和乳酸浓度的检测;余下滤液分装于2支离心管,用于微生物蛋白(MCP)浓度的检测。根据Broderick等[12]的方法测定发酵液中NH3-N和MCP浓度,使用乳酸试剂盒(A019-2,南京建成生物工程研究所)测定发酵液中乳酸浓度。
1.8 干物质消失率的测定干物质消失率采用尼龙袋法测定,尼龙袋规格为300目,8 cm×12 cm。用蒸馏水分别冲洗上述48 h的过滤降解残渣至水流澄清,将尼龙袋中的滤渣于65 ℃烘4 h至恒重,称重。按如下公式[13]计算待测饲粮的干物质消失率:
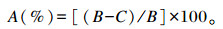
|
式中:A为待测饲粮的干物质消失率(%);B为待测饲粮降解前干物质量(g);C为待测饲粮降解后干物质量(g)。
1.9 产气动力学模型分析参照Groot等[14]的数学模型运用SAS 9.1软件的NLIN过程对各发酵时间(t,h)及对应累积产气量(GPt,mL)进行非线性拟合:
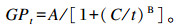
|
式中:A为理论最大产气量(mL);B为曲线平滑参数;C为达到1/2理论最大产气量的时间(h)。
1.10 数据处理与分析试验数据使用SAS 9.1软件的MIXED程序进行统计分析,并以P < 0.05作为差异显著标准。
2 结果与分析 2.1 3种海藻作为饲料原料对发酵液发酵参数和干物质消失率的影响3种海藻作为饲料原料对发酵液发酵参数和干物质消失率的影响列于表 4。
|
|
表 4 3种海藻作为饲料原料对发酵液发酵参数和干物质消失率的影响 Table 4 Effects of three kinds of seaweeds as feed raw materials on fermentation parameters and dry matter disappearance rate of fermentation fluid |
从海带的影响来看:2%、4%添加组的NH3-N浓度显著低于对照组(P < 0.05),8%、10%添加组的NH3-N浓度显著高于对照组(P < 0.05),而6%添加组的NH3-N浓度与对照组无显著差异(P>0.05);2%、4%添加组的MCP浓度显著高于对照组(P < 0.05),6%、8%、10%添加组的MCP浓度显著低于对照组(P < 0.05),6%、8%、10%添加组间MCP浓度无显著差异(P>0.05);不同添加量的海带对pH和乳酸浓度无显著影响(P>0.05)。干物质消失率以4%添加组最高,显著高于其他各组(P < 0.05)。
从紫菜的影响来看:8%添加组的pH显著低于对照组(P < 0.05),10%添加组的pH显著高于对照组(P < 0.05),其他添加组的pH与对照组无显著不显著(P> 0.05);2%、4%、8%、10%添加组的NH3-N浓度显著低于对照组(P < 0.05);2%、4%、6%、8%添加组的MCP浓度较对照组显著提高(P < 0.05),且以8%添加组的MCP浓度最高,10%添加组的MCP浓度最低,2组间差异显著(P < 0.05);不同添加量的紫菜对乳酸浓度的影响不显著(P>0.05)。干物质消失率以6%添加组最高,显著高于其他各组(P < 0.05)。
从裙带菜的影响来看:2%、4%添加组的NH3-N浓度较对照组显著降低(P < 0.05),8%、10%添加组的NH3-N浓度较对照组显著升高(P < 0.05),6%添加组的NH3-N浓度与对照组无显著差异(P>0.05);2%、4%添加组的MCP浓度显著高于对照组(P < 0.05),6%、8%、10%添加组的MCP浓度显著低于对照组(P < 0.05);不同添加量的裙带菜对pH和乳酸浓度无显著影响(P>0.05)。干物质消失率4%、6%添加组之间差异不显著(P>0.05),二者均显著高于其他各组(P < 0.05)。
2.2 3种海藻作为饲料原料对体外发酵产气量动态变化的影响3种海藻作为饲料原料对体外发酵产气量动态变化的影响列于表 5。对于海带来说,4%、6%、8%、10%添加组在3.0、6.0、12.0、24.0、48.0 h时的产气量均显著低于对照组(P < 0.05),2%添加组在各时间点的产气量与对照组均无显著差异(P>0.05),以6%添加组的48.0 h时的产气量最低;对于紫菜来说,2%、4%、6%、8%添加组在12.0、24.0、48.0 h时的产气量均显著高于对照组(P < 0.05),且2%、4%、6%添加组之间上述时间点的产气量无显著差异(P < 0.05),以8%添加组的产气量最高,10%添加组在各个时间点的产气量均显著低于对照组(P < 0.05);对于裙带菜来说,2%和4%添加组在6.0、12.0、24.0、48.0 h时的产气量显著高于对照组(P < 0.05),2组之间在3.0、6.0 h时的产气量无显著差异(P>0.05),而6.0 h后4%添加组的产气量显著高于2%添加组(P < 0.05),而6%、8%、10%添加组在各时间点的产气量均显著低于对照组(P < 0.05)。3种海藻预测的理论最大产气量与48.0 h时的产气量结果相近。
|
|
表 5 3种海藻作为饲料原料对体外发酵产气量动态变化的影响 Table 5 Effects of three kinds of seaweeds as feed raw materials on dynamic change of gas production in vitro fermentation |
瘤胃正常范围内的pH波动是瘤胃健康发酵的先决条件,影响瘤胃pH的因素主要有饲粮的种类和精粗比、唾液进入瘤胃的量、瘤胃中乳酸以及挥发性酸的生成、吸收及排泄的速率等[15]。本试验中3组发酵液pH均大于6.5,说明在饲粮中添加3种海藻均不会对微生物造成不利的酸性发酵环境,且试验条件下2%、4%、6%的海带、紫菜或裙带菜对体外发酵液pH无显著影响,原因可能是试验中3种海藻粉虽替代了饲粮中相应比例的粗饲料,但没有改变饲粮的精粗比和碳水化合物水平。
瘤胃中NH3-N的浓度变化反映了饲料中蛋白质的降解程度、瘤胃微生物对NH3-N的综合利用情况[16]以及饲料瘤胃降解率与NH3-N利用率之间的平衡关系[17]。Whitelaw等[18]指出,NH3-N的浓度变化受许多因素的影响,诸如饲粮蛋白质溶解度、瘤胃壁吸收程度、瘤胃液流出速度和食糜排空速率。由于试验中体外发酵瓶的NH3-N来源于微生物对反应底物中蛋白质和非蛋白质氮的降解,体外发酵过程不具有动物体的氮素循环机制,使得饲料分解产生的NH3-N累积在发酵瓶中,因而其浓度高于正常瘤胃中的浓度,但仍均在正常范围(6.3~27.5 mg/dL)内[19]。Abudabos等[20]发现海藻中的多糖、多酚等物质能促进消化道有益菌的增殖,而Kamra[21]研究发现藻类中的特殊成分可以减少细菌、古细菌、真菌等复杂瘤胃微生物群丰度,使瘤胃旁路蛋白质增加,MCP合成减少[22-23]。本试验中,部分海藻添加组中NH3-N浓度显著低于对照组,而其对应的MCP浓度显著高于对照组,可能是对应添加量海藻中的某些成分添加促进了微生物对氮的利用和微生物的生长繁殖,且其促进作用强于其中特殊物质对微生物的抑制。
在瘤胃微生物菌群发生紊乱时,乳酸产生菌与乳酸利用菌之间发生菌群失衡,导致瘤胃内乳酸积累,pH降低至5以下,引发瘤胃酸中毒[24]。本试验中,各添加量的海藻均未对乳酸浓度产生影显著响,表明试验中海藻的添加不会干扰乳酸的生成和消耗,对发酵液中乳酸相关菌群平衡没有产生影响。
体外发酵产气量是评价反刍动物瘤胃发酵的重要指标,它反映出饲料的可发酵水平和瘤胃微生物的分解利用情况,可用作饲料利用率的参考指标[25]。饲料的消化率与体外发酵产气量之间存在较高的相关性,即产气量越高,饲料在瘤胃内的发酵程度越高[8]。吕琴等[26]报道,给大鼠喂食添加5%紫菜的饲粮后,显著增加肠道中益生菌菌群的比例,促进其肠道菌群平衡,产生有益的活性作用;给大鼠喂食添加5%裙带菜的饲粮时却使双歧杆菌和乳酸杆菌的数量显著减少;给大鼠喂食添加5%海带的饲粮后,其消化道拟杆菌数量显著减少。本试验中,6%、8%、10%海带添加组在3.0、6.0、12.0、24.0、48.0 h时的产气量均显著低于对照组,产气量与MCP浓度呈正相关,表明高添加量的海带可能会抑制瘤胃微生物的增殖。本试验条件下4%的海带对MCP生成的促进效果最优,说明添加4%海带的饲粮可利用性最高;在紫菜的梯度试验中,相比对照组,2%~8%添加组在12.0、24.0、48.0 h时的产气量均显著提高,以8%添加量对MCP浓度和产气量的提升作用最为显著,表明本试验条件下8%是紫菜的最适添加量;在裙带菜的梯度试验中,4%添加组在6.0 h后的产气量和MCP浓度显著高于其他组,表明4%是试验梯度中裙带菜的最适添加量。3种海藻的干物质消失率均与产气量呈正相关性,此试验结果与Nsahlai等[27]研究指出的理论最大产气量与饲料粗蛋白质含量呈正相关性的结果一致,不同组间产气量的差异来源于菌群的作用,说明不同海藻添加量是通过调控体外发酵液中菌群的比例影响发酵产气量的变化。
横向比较试验中不同梯度的海藻对体外发酵参数和产气量的作用效果,8%的紫菜对体外发酵的促进作用为正向关系,而海带及裙带菜仅在4%添加量下促进体外发酵,高添加量下则抑制体外发酵,其原因可能是紫菜属红藻属,粗蛋白质含量高,其较高含量的优质蛋白质促进了菌群增殖[28],而其他2种海藻属褐藻属,粗蛋白质含量低,同时其含有较高浓度的褐藻多酚[29],抑制了菌群的增殖和合成利用,从而抑制瘤胃液的体外发酵水平。
4 结论在体外发酵条件下,添加海带、紫菜、裙带菜3种海藻均可以有效调节瘤胃发酵环境,改变发酵产气量;同添加量下,紫菜对瘤胃发酵的促进作用优于海带与裙带菜。根据不同海藻添加量与干物质消失率、发酵参数和产气量存在的一元线性、二次曲线效应的分析结果,得出3种海藻的最适添加量为:海带4%、紫菜8%、裙带菜4%。
| [1] |
丁兰平, 黄冰心, 谢艳齐. 中国大型海藻的研究现状及其存在的问题[J]. 生物多样性, 2011, 19(6): 798-804. |
| [2] |
韩杨, 孙慧武, 赵明军, 等. 中国海藻产业发展形势与对策[J]. 农业展望, 2017, 13(1): 32-37. DOI:10.3969/j.issn.1673-3908.2017.01.008 |
| [3] |
梁婉婷.以海藻残渣为发酵底物乳杆菌增殖条件的研究[D].硕士学位论文.哈尔滨: 东北农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10224-1015395810.htm
|
| [4] |
王晓楠, 王茂剑, 鞠文明. 我国海藻生物活性物质的研究及问题分析[J]. 齐鲁渔业, 2017(3): 50-55. |
| [5] |
MAKKAR H P S, TRAN G, HEUZÉ V, et al. Seaweeds for livestock diets:a review[J]. Animal Feed Science and Technology, 2016, 212: 1-17. DOI:10.1016/j.anifeedsci.2015.09.018 |
| [6] |
农业部渔业渔政管理局. 2016中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2017.
|
| [7] |
NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington, D.C.: National Academy of Sciences, 2001.
|
| [8] |
MENKE K H, RAAB L, SALEWSKI A, et al. The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science, 1979, 93(1): 217-222. DOI:10.1017/S0021859600086305 |
| [9] |
ANDREWS W H, ABEYTA C, FELDSINE P. AOAC international methods committee guidelines for validation of qualitative and quantitative food microbiological official methods of analysis[J]. Journal of AOAC International, 2002, 85(5): 1187-1200. |
| [10] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [11] |
李克广, 郭全奎. 饲料分析检测技术[M]. 北京: 中国农业大学出版社, 2015.
|
| [12] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [13] |
CHURCH D C. Livestock feeds and feeding[J]. American Journal of the Medical Sciences, 1998, 184(3): 113. |
| [14] |
GROOT J C J, CONE J W, WILLIAMS B A, et al. Multiphasic analysis of gas production kinetics for in vitro fermentation of ruminant feeds[J]. Animal Feed Science and Technology, 1996, 64(1): 77-89. DOI:10.1016/S0377-8401(96)01012-7 |
| [15] |
韩昊奇, 刘大程, 高民, 等. 不同NFC/NDF比对奶山羊瘤胃微生物及瘤胃pH值变化的影响[J]. 畜牧与饲料科学, 2011, 23(9/10): 54-58. |
| [16] |
唐志文, 蒋林树, 杨亮, 等. 金银花提取物对瘤胃体外发酵参数及产气量的影响[J]. 动物营养学报, 2018, 30(2): 790-796. DOI:10.3969/j.issn.1006-267x.2018.02.045 |
| [17] |
DEVANT M, FERRET A, GASA J, et al. Effects of protein concentration and degradability on performance, ruminal fermentation, and nitrogen metabolism in rapidly growing heifers fed high-concentrate diets from 100 to 230 kg body weight[J]. Journal of Animal Science, 2000, 78(6): 1667-1676. DOI:10.2527/2000.7861667x |
| [18] |
WHITELAW F G, MILNE J S, CHEN X B. The effect of a rumen microbial fermentation on urea and nitrogen metabolism of sheep nourished by intragastric infusion[J]. Experimental Physiology, 1991, 76(1): 91-101. DOI:10.1113/expphysiol.1991.sp003484 |
| [19] |
MURPHY J J, KENNELLY J J. Effect of protein concentration and protein source on the degradability of dry matter and protein in situ[J]. Journal of Dairy Science, 1987, 70(9): 1841-1849. DOI:10.3168/jds.S0022-0302(87)80223-0 |
| [20] |
ABUDABOS A M, OKAB A B, ALJUMAAH R S, et al. Nutritional value of green seaweed (Ulva Lactuca) for broiler chickens[J]. Italian Journal of Animal Science, 2013, 12(2): e28. DOI:10.4081/ijas.2013.e28 |
| [21] |
KAMRA D N. Rumen microbial ecosystem[J]. Current Science, 2005, 89(1): 124-135. |
| [22] |
MACHADO L, MAGNUSSON M, PAUL N A, et al. Effects of marine and freshwater macroalgae on in vitro total gas and methane production[J]. PLoS One, 2014, 9(1): e85289. DOI:10.1371/journal.pone.0085289 |
| [23] |
YANG C J, ROOKE J A, CABEZA I, et al. Nitrate and inhibition of ruminal methanogenesis:microbial ecology, obstacles, and opportunities for lowering methane emissions from ruminant livestock[J]. Frontiers in Microbiology, 2016, 7: 132. |
| [24] |
陈连民, 王洪荣. 瘤胃中乳酸的代谢及其调控机制[J]. 草业科学, 2016, 33(5): 972-980. |
| [25] |
唐志文, 蒋林树, 杨亮, 等. 体外法研究脂多糖对瘤胃发酵的影响[J]. 动物营养学报, 2017, 29(10): 3799-3806. DOI:10.3969/j.issn.1006-267X.2017.10.044 |
| [26] |
吕琴, 姜乃澄. 食用海藻对肠道菌群及肠道微环境影响的研究[J]. 东海海洋, 2002, 20(2): 58-64. DOI:10.3969/j.issn.1001-909X.2002.02.009 |
| [27] |
NSAHLAI I V, SIAW D, OSUJI P O. The relationships between gas production and chemical composition of 23 browses of the genus Sesbania[J]. Journal of the Science of Food & Agriculture, 1994, 65(1): 13-20. |
| [28] |
陈必链, 林跃鑫, 黄键. 坛紫菜的营养评价[J]. 中国海洋药物, 2001, 20(2): 51-53. DOI:10.3969/j.issn.1002-3461.2001.02.015 |
| [29] |
徐扬, 杨保伟, 柴博华, 等. 超声波-酶法提取海带多糖及其抑菌活性[J]. 农业工程学报, 2010, 26(13): 356-362. |




