食用菌因其独特的口感和丰富的营养成分,在世界范围内的种植种类和数量都在不断增加。中国作为食用菌主要生产国,全球食用菌生产占比从1978年的5.5%增长到2016年的70%,2016年全年出口份额占当年世界食用菌出口总份额的58%左右,成为继粮、菜、果、油之后的第五大类作物。杏鲍菇作为我国居民喜食的主导菌类,年产量可达70万~90万t,居工厂化生产的前3位[1-3]。伴随着食用菌生产和消费水平的不断提高,其生产副产品——菌糠(spent mushroom substrate,SMS)的产量也在不断增加。菌糠是指食用菌采摘完所剩的菌棒,主要由农业秸秆和玉米芯等高纤维原料所构成,每生产1 kg的食用菌大约会产生5倍体量的菌糠[4]。产量如此巨大的菌糠如果得不到合理利用,既会对环境造成压力,也是对潜在资源的浪费。目前对于菌糠利用的研究涉及有毒气体吸附、水体净化、土壤修复、动物垫料、农作物堆肥、二次栽培、病害治理等多个方面[5-11],但大部分方法经济价值不高。菌糠作为食用菌生产过程中的副产品,相对于其初始原料的营养成分发生了明显变化,通过食用菌菌体生长及酶解作用,其纤维成分得到一定程度的降解,氨基酸、微量元素、多糖含量都有所提高,营养价值得到改善,作为反刍动物饲料具有很大潜力[12]。制约菌糠饲料化利用的因素主要有2个方面:一是由于其本身原料的限制,虽然通过酶解作用纤维素有一定程度的降解,但仍然维持在较高水平,动物难以消化利用;二是新鲜菌糠含水量高(60%~70%),物料疏松多孔,易发霉变质。微生物发酵作为一种绿色的生物处理方式,为菌糠的饲料化利用提供了解决方案。通过混菌发酵,具有纤维素酶、蛋白酶等分泌功能的微生物可以对菌糠进行近一步分解利用,降低粗纤维含量,提高氨基酸含量,乳酸菌和酵母菌可以将可溶性糖转变为酸类、醇类、酯类等芳香物质,改善适口性,利于菌糠的长期保存。
本试验从杏鲍菇菌糠(Pleurotus eryngii spent mushroom substrate,PESMS)中分离筛选纤维素分解菌,与乳酸片球菌(Pediococcus acidilactici)和酿酒酵母(Saccharomyces cerevisiae)组成复合菌剂对杏鲍菇菌糠进行发酵,通过响应面法,以中性洗涤纤维(NDF)降解率为响应值优化发酵条件,提高其纤维素降解率,改善适口性和储存性,为杏鲍菇菌糠作为反刍动物饲料的应用提供技术方法。
1 材料与方法 1.1 试验菌种纤维素分解菌16株,乳酸片球菌1株,酿酒酵母1株,共18株。上述菌株均从杏鲍菇菌糠中分离,并与25%的无菌甘油1 : 1混合,-80 ℃冰箱中保存。
1.2 发酵原料杏鲍菇菌糠(出菇1茬)由宝鸡国人菌业提供,培养基组成见表 1,麸皮由杨陵富仕特生物科技公司提供,20 cm×30 cm专用单向排气阀微生物发酵塑料袋购自温州华冠包装。
|
|
表 1 杏鲍菇培养基组成 Table 1 Composition of Pleurotus eryngii medium |
ZEALWAY-G154DW型高压灭菌锅,EPOCH超微量分光光度仪,THERMO TECH-320型循环水浴锅,EPPENDORF-5810离心机,VORTEX-5型涡旋振荡器,THERMO FISHER超纯水仪,SARTORIOUS Pb-21型酸度计,AIRTECH超净工作台,SUKUN SKY-200B恒温培养摇床,BIO-RAD-C1000 PCR仪。
1.4 试验培养基LB液体培养基、马铃薯葡萄糖琼脂(PDA)液体培养基、MRS液体培养基、产酶培养基、羧甲基纤维素钠(CMC-Na)固体筛选培养基,以上培养基均参考高旭红等[13]的方法配制。
1.5 试验方法 1.5.1 纤维素分解菌的初筛将保存于-80 ℃的纤维素分解菌取出置于4 ℃冰箱内解冻,以4%比例接种于液体培养基,于160 r/min,37 ℃恒温培养摇床中活化2代,每代培养12 h。培养结束后用灭菌的生理盐水对纤维素分解菌进行梯度稀释,取3个适宜梯度涂布于相应固体培养基,37 ℃恒温培养48 h。培养结束后,挑取生长状态良好的单菌落,点接种至CMC-Na固体筛选培养基,37 ℃恒温培养48 h后,用1 mg/mL的刚果红溶液浸泡染色30 min,染色液应完全浸没菌落,再用1 mol/L的NaCl溶液脱色30 min,测量透明圈直径(d)与菌落直径(D),初筛出d/D大于3的菌株。
1.5.2 纤维素分解菌酶活性的测定测定初筛得到的纤维素分解菌的羧甲基纤维素酶(CMCase)和滤纸酶(FPA)活性,测定方法参考高旭红等[13]。酶活定义为每分钟与底物(CMC-Na或滤纸)反应生成1 μmol还原糖所需要的酶量,为1个酶活单位,以U表示。综合比较,筛选出3株纤维素分解菌(P12、L6、L8)。
1.5.3 纤维素分解菌的分子鉴定对复筛出的3株纤维素分解菌进行分子鉴定,P12的总DNA提取使用细菌基因组提取试剂盒(D3350-01,Omega,广州),使用细菌16S rDNA通用引物F27:5′-AGAGTTTGATCMTGGCTCAG-3′,R1492:5′-TACGYTACCTTGTTACGACT-3′,扩增目的片段;L6、L8的总DNA提取采用十六烷基三甲基溴化铵(CTAB)法[14],使用真菌18S rDNA通用引物ITS1:5′-TCCG TAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′,扩增目的片段。PCR产物送至奥科生物公司进行测序,测序结果在NCBI网站进行BLAST比对分析判定菌株种属。
1.5.4 Plackett-Burman主效应因子的筛选Plackett-Burman试验能够综合研究多个试验变量的影响权重,从中筛选出对试验结果影响显著的变量,极大减少试验工作量,以便进行后续优化试验。目前对于“粗纤维”含量的表示方法有很多,NDF因其包含了组成纤维素的绝大多数成分,常被作为表示粗纤维含量的常用指标[15]。通过设计试验次数Run=12的试验,发酵菌株活菌数控制在109 CFU/L,对与杏鲍菇菌糠发酵过程中纤维素降解相关的10个因素[枯草芽孢杆菌与黑曲霉体积比(X1)、枯草芽孢杆菌和黑曲霉添加量(X2)、乳酸片球菌添加量(X3)、酿酒酵母添加量(X4)、麸皮添加量(X5)、温度(X6)、硫酸铵添加量(X7)、含水量(X8)、时间(X9)、袋装量(X10)]进行筛选,其中各因素设高水平(+1)和低水平(-1)2个水平,试验水平的设置参考预试验结果。试验因素及水平如表 2所示。
|
|
表 2 Plackett-Burman试验因素及水平 Table 2 Plackett-Burman factors and levels |
最陡爬坡试验基于Plackett-Burman试验结果,根据筛选出的显著影响纤维素降解率的因子的正负效应进行下一步试验,以逼近最优解区域。若试验因子对响应值的影响为正效应,则爬坡方向设置为试验水平从低到高,反之,则爬坡方向相反[16]。
1.5.6 Box-Behnken试验Box-Behnken试验是响应面试验设计中的一种方法,其试验模型在设计时未考虑所有因素均取极值的情况,因此可以避免在极端因素条件下进行试验的结果误差[17]。综合Plackett-Burman试验和最陡爬坡试验结果,设置Box-Behnken试验中心点和各水平步长,以NDF降解率为响应值,使用Design-Export 10.0.4软件对试验数据进行处理,建立发酵拟合模型和响应面图,并对最优试验水平进行预测。
1.5.7 优化水平验证试验及常规养分含量的测定在最优水平条件下设置3组平行试验,将NDF降解率实测值与预测值进行对比验证,并测定原料组、不加菌液发酵组和混合菌液发酵组的常规营养、霉菌毒素含量及感官评价。常规营养成分含量的测定参考文献[18];黄曲霉毒素B1(aflatoxin B1,AFB1)、呕吐毒素(deoxynivalenol,DON)和玉米赤霉烯酮(zearalenone,ZEN)含量的测定使用相应的酶联免疫吸附(ELISA)试剂盒(Beacon,美国);发酵菌糠感官评价参考刘建新等[19]的方法;干物质回收率(DMR)计算公式如下:
干物质回收率(%)=100×(发酵后样品质量×发酵后样品干物质含量)/(发酵前样品质量×发酵前样品干物质含量)。
1.6 数据统计使用Excel 2016对试验数据进行初步整理,纤维素酶活性结果采用SPSS 20.0统计软件对数据进行单因子方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,结果以“平均值±标准差”表示;杏鲍菇菌糠优化部分结果采用Design-Export 10.0.4进行分析,均以“P < 0.05”为差异显著性判断标准。
2 结果与分析 2.1 纤维素分解菌的初筛采用刚果红染色法对前期从杏鲍菇菌糠中筛选分离的16株纤维素分解菌进行初筛,结果见表 3,部分菌株培养基脱色结果见图 1。选出6株d/D大于3的菌株,分别为P2、P7、P12、L6、L7、L8。
|
|
表 3 透明圈直径、菌落直径及二者比值 Table 3 Transparent circle diameter, colony diameter and their ratio |
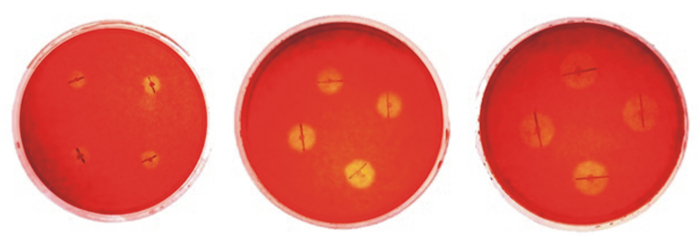
|
图 1 部分菌株在筛选培养基上形成的透明圈 Fig. 1 Transparent circle formed by some strains on selection medium |
对初筛得到的6株纤维素分降菌进行纤维素酶活性测定,结果见表 4。由表 4可以看出,P12、L6、L8的羧甲基纤维素酶和滤纸酶活性显著高于其他3株菌(P < 0.05),羧甲基纤维素酶活性最高的菌株为L8,达到1.31 U/mL,与L6差异不显著(P>0.05)。滤纸酶活性最高的菌株为L6,达到33.10 U/L,显著高于P12、L8(P < 0.05)。
|
|
表 4 纤维素分解菌酶活性 Table 4 Enzymatic activity of cellulose-decomposing bacteria |
通过在NCBI数据库中对菌株P12、L6、L8的基因序列进行BLAST相似性比对,鉴定出P12为枯草芽孢杆菌(Bacillus subtilis),L6为黑曲霉(Aspergillus niger),L8为里氏木霉(Trichoderma reesei),结果见表 5。根据中华人民共和国农业部发布的《饲料添加剂品种目录(2013)》,枯草芽孢杆菌和黑曲霉可以作为饲料添加剂,而里氏木霉未在目录内,因此后续只对枯草芽孢杆菌和黑曲霉菌株进行产酶特性及发酵试验研究。
|
|
表 5 细菌16S rDNA及真菌18S rDNA的基因序列同源性比较 Table 5 Bacterial 16S rDNA and fungal 18S rDNA gene sequences homology comparison |
Plackett-Burman试验设计及杏鲍菇菌糠NDF降解率结果见表 6。采用Design-Export 10.0.4软件对响应结果进行逐步回归分析,结果如表 7所示。经回归拟合后,得到各试验因素与响应值NDF降解率之间的回归方程:Y=15+2.23X1+1.4X2+0.53X3+0.14X4+1.64X5-0.75X6+0.84X7+1.17X8+1.9X9-0.2X10。
|
|
表 6 Plackett-Burman试验设计和NDF降解率 Table 6 Plackett-Burman experimental design and NDF degradation rate |
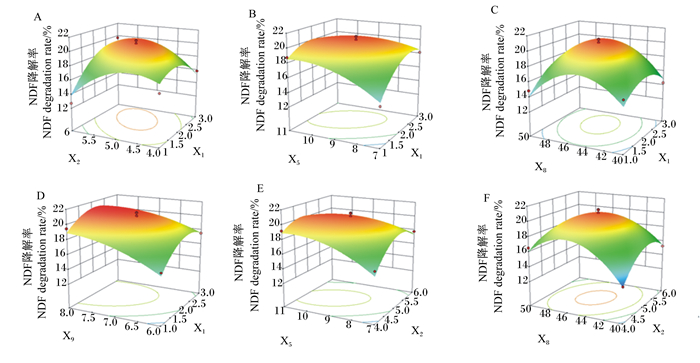
|
图 2 试验因子交互作用对NDF降解率的影响 Fig. 2 Effects of interaction of experimental factors on NDF degradation rate |
|
|
表 7 Plackett-Burman设计方差分析 Table 7 Variance analysis of Plackett-Burman design |
模型F值为301.81,P值为0.045,表明该模型回归显著。各试验因素对杏鲍菇菌糠NDF降解率的影响效果正效应从大到小依次为X1、X9、X5、X2、X8、X7、X6、X3、X10、X4,负效应为X6、X10,其中X1、X2、X5、X8、X9达到显著水平(P < 0.05)。因此,确定X1、X2、X5、X8、X9为后续优化试验的5个试验因子。
2.4.2 最陡爬坡试验对Plackett-Burman试验筛选出的5个对NDF降解率影响显著的试验因素进行最陡爬坡试验,试验设计及结果见表 8。由表 8可以看出,NDF降解率最优发酵条件在试验3组附近,因此以试验3组的试验条件为中心点进行Box-Behnken试验。
|
|
表 8 最陡爬坡试验设计及结果 Table 8 Experimental design and results of steepest climbing test |
将表 8中试验3组的试验条件设置为Box-Behnken试验中心点(0),试验2组的试验条件为低水平(-1),试验4组的试验条件为高水平(+1),NDF降解率为响应值,设计5因素3水平的Box-Behnken试验,试验组数为46组,试验设计见表 9。使用Design-Export 10.0.4软件对试验结果进行回归分析,得到响应变量与因变量之间的二阶多项式方程:
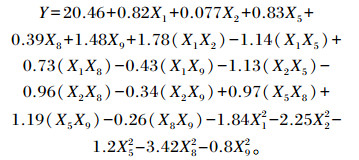
|
|
|
表 9 Box-Behnken试验设计 Table 9 Box-Behnken experimental design |
回归分析结果见表 10。
|
|
表 10 Box-Behnken试验回归模型方差分析 Table 10 Variance analysis of Box-Behnken regression model |
由表 10可以看出,模型P < 0.000 1,表明此回归模型达到极显著水平,可决系数R2=0.938 3,表明此回归模型拟合程度良好,变异系数为4.48%,表明试验数据离散程度较小。通过对回归方程分析可得,一次项X1、X5、X9,交互项X1X2、X1X5、X2X5、X5X9以及所有的二次项对响应值影响极显著(P < 0.01),交互项X2X8、X5X8对响应值影响显著(P < 0.05)。
使用Design-Export 10.0.4软件绘制两因素交互的3D响应面图及等高线图,可以清楚地观察两因素水平的交互作用对NDF降解率的影响,部分结果见图 2。响应面图斜率越大,对应的等高线越密(呈椭圆状),则表示两因素之间的交互作用越显著。由图 2可知,当固定除两交互作用因素外的其他2个变量时,图 2-A、图 2-B、图 2-C、图 2-D、图 2-E、图 2-F的NDF降解率随着两交互因子的增大,出现先增大后减小的趋势。
通过软件对预测模型进行分析,得到杏鲍菇菌糠发酵的最优条件为枯草芽孢杆菌:黑曲霉(X1)为1.94 : 1.00,枯草芽孢杆菌和黑曲霉添加量为4.7%,麸皮添加量为10.4%,含水量为46.1%,发酵时间为8 d,在此条件下发酵,模型预测的杏鲍菇菌糠NDF降解率为21.86%。
2.5 最优发酵条件试验结果验证在最优发酵条件下做3组平行试验,测定NDF降解率实测值为21.08%,与模型预测结果21.86%差异不显著(P>0.05),表明本试验得到的回归模型拟合较好,NDF降解率较优化前提高了15.33%。原料组、不加菌液发酵组与混合菌液发酵组的成分对比见表 11(表中3组试验数据均是在对应的干物质基础上测定)。从表 11中可以看出,混合菌液发酵组的干物质回收率、粗蛋白质、粗脂肪、还原糖含量和乳酸菌活菌数显著高于原料组和不加菌液发酵组(P < 0.05),NDF、ADF含量和pH显著低于原料组和不加菌液发酵组;混合菌液发酵显著降低AFB1的含量(P < 0.05),对DON和ZEN含量的影响不显著(P>0.05)。
|
|
表 11 杏鲍菇菌糠发酵前后成分对比 Table 11 Composition contrast of before and after fermentation of Pleurotus eryngii spent mushroom substrate |
食用菌的培养基大多是由锯末、玉米芯、秸秆等农业废弃物组成,因其纤维素、木质素含量高,粗蛋白质含量低,被认为不适合应用于动物饲料[20]。食用菌在生长过程中分泌的纤维素酶、蛋白酶等会对培养基进行酶解,将难以利用的大分子物质分解为小分子物质,利于菌体的消化、吸收、利用,为食用菌的生长提供必需的营养物质[21]。因此,培养基在种植食用菌后质地、营养成分会发生一定程度的改善,但其纤维素含量仍然较高,影响动物利用[20, 22-23]。
微生物发酵作为一种绿色、高效的纤维素处理方式,在改善饲用品质、提高动物采食量和饲料利用率等方面具有显著作用[24]。自然界中存在着许多能够分泌纤维素酶,并以纤维素为主要碳源的微生物。因此,筛选纤维素酶活性较高的微生物是降低杏鲍菇菌糠中纤维成分的第1步。目前,研究人员从自然界中筛选出的纤维素降解菌,主要分为细菌、真菌和放线菌[25]。贾辉等[26]使用筛选培养基从东祁连山高寒草甸土壤中分离筛选了3株纤维素分解菌,其中菌株X1-2酶活性最高,通过分子生物学鉴定,菌株X1-2为芽孢杆菌(Bacillus sp.)。李晓秀等[27]从不同环境的土壤中分离出2株高效降解玉米秸秆的真菌,发酵15 d,玉米秸秆降解率分别达到59.43%和59.13%,通过分子鉴定,2株菌均为尖孢镰刀菌。诸葛诚祥[28]从杏鲍菇菌糠堆肥中筛选出8株高效纤维素分解微生物,其中包括细菌4株(芽孢杆菌)、放线菌2株(1株链霉菌,1株小双孢菌)、真菌2株(1株为樟绒枝霉,1株小囊菌)。从本试验筛选结果可以看出,菌株L6和L8的d/D较大,其羧甲基纤维素酶和滤纸酶活性也相对较高,菌株P12的d/D在初筛的6株菌种最小,但其羧甲基纤维素酶和滤纸酶活性却相对较高。这表明在CMC-Na固体筛选培养基上d/D并不能准确反映羧甲基纤维素酶和滤纸酶活性大小,这与陈燕等[29]和李静等[30]的研究结果一致。因此,d/D在一定程度上可反映菌株对纤维素利用能力的强弱,但存在误差,还需进一步测定纤维素酶活性,综合评价菌株的纤维素分解能力。本试验通过纤维素分解菌在CMC-Na固体筛选培养基上形成的d/D大小,结合羧甲基纤维素酶和滤纸酶活性的测定,综合评定菌株纤维素酶活,从杏鲍菇菌糠中筛选出3株纤维素分解菌为枯草芽孢杆菌、黑曲霉、里氏木霉,其中菌株枯草芽孢杆菌和黑曲霉为中华人民共和国农业部发布的《饲料添加剂品种目录(2013)》中的菌种。
3.2 杏鲍菇菌糠混菌发酵纤维素酶是一组由内切β-1, 4-葡聚糖酶、外切β-1, 4-葡聚糖酶和β-葡萄糖苷酶构成的复合酶[31]。在降解纤维素时,首先由内切β-1, 4-葡聚糖酶在纤维素多糖链内部无定形位点区域对β-1, 4糖苷键进行随机切割,形成多条长度较小的寡糖链,并因此产生新的链端。随后,外切β-1, 4-葡聚糖酶作用于新产生的寡糖链的还原末端或非还原末端,依次裂解β-1, 4糖苷键,释放葡萄糖和纤维二糖。最后,纤维二糖在β-葡萄糖苷酶水解作用下生成葡萄糖[32]。由此可见,纤维素的降解需要上述3种酶协同作用。而对于大多数的纤维素分解菌来说,单菌发酵所产的纤维素酶并不均衡,因此越来越多的研究者开始将纤维素分解菌进行混菌发酵。混菌发酵可以利用复合菌种间的协同作用,通过菌种生长过程中产生的纤维素酶互补,来达到更好的发酵效果[33]。黄河清涛等[34]利用黑曲霉和康氏木霉发酵以啤酒糟为主的基质时发现,在适宜发酵条件下,混菌发酵对纤维素的降解效果优于单菌发酵;陈华[35]在发酵中草药药渣时,将黑曲霉和芽孢杆菌按1 : 2的体积比混合,发酵6 d后,纤维素酶活性明显高于单菌发酵。
除此之外,由于纤维素酶属于诱导酶,当纤维素分解终产物——葡萄糖产生过多时,会对β-葡萄糖苷酶产生终产物有抑制作用[36-37]。若添加的其他微生物能够以葡萄糖为底物,将生成的葡萄糖分解为乳酸、丙酮酸等小分子物质,可以减轻或消除终产物抑制作用。司美茹等[38]研究证实,当向接种有黑曲霉和烟曲霉发酵培养基中接入少量假丝酵母菌时,纤维素酶活性显著提高。韩立英等[39]发现,在对直穗鹅观草进行青贮时,纤维素酶+乳酸菌组对NDF和ADF的降解效果优于纤维素酶组。从本试验研究结果可以看出,当把酵母菌和乳酸菌的接种比例从1%提高到2%时,对杏鲍菇菌糠的NDF降解率影响不显著,这可能是由于1%添加量的酵母和乳酸菌已经满足消除终产物抑制作用的条件,再增加其添加量并不会显著提高NDF降解率。由图 2中的3D响应面图可以看出,随着枯草芽孢杆菌与黑曲霉的体积比在1~3内增大,NDF降解率出现先增大后减小的趋势,在枯草芽孢杆菌:黑曲霉=1.94 : 1.00时,NDF降解率达到最大值,这可能是因为此混合比例的2菌种所产的纤维素酶更加均衡,对杏鲍菇菌糠中的纤维素有更好的降解效果,适当提高枯草芽孢杆菌在混合菌中的比例有利于提高NDF降解率,这与陈华[35]的研究结果类似。
微生物生长需要经历滞后期、指数期、静止期和死亡期4个阶段,滞后期通常被认为是在指数生长开始之前微生物内部发生改变努力适应新环境的时期,此阶段几乎不发生细胞增殖,在随后的指数期,微生物以指数形式快速增殖,并在静止期末期菌体数量达到最大值[40]。适当增加纤维素分解菌的接种量,相当于扩大指数增长的基数,菌体可以实现快速增长,缩短菌体增殖所消耗的时间,进而可以迅速大量地产生纤维素酶,降低杏鲍菇菌糠中的纤维成分;若菌种接种量过大,微生物在发酵过程中生长活动过分剧烈,导致局部基质温度升高,发酵过程不易控制,反而会影响杏鲍菇菌糠发酵品质[41]。因此,只有接种合适数量的微生物,才会使发酵进程既高效又安全的进行。
含水量也会对饲料发酵品质产生重要影响,微生物的前期生长,纤维素酶的分泌、传递及作用均需要一定的水分参与。当水分含量较少时,发酵基质中的可溶性营养物质的溶解量下降,降低微生物对营养成分的利用,不利于微生物的生长和纤维素酶的分泌,影响杏鲍菇菌糠的发酵进程[34];当水分含量过高时,水分子侵占饲料中的过多的孔隙,基质中的氧气流通性变差,好氧微生物的呼吸强度减弱,延迟好氧微生物前期的生长,并且过多的水分也会影响发酵过程中产生的热量的散失,造成局部温度过高,进而影响微生物对杏鲍菇菌糠的利用[42]。
充足优质的碳源供给是微生物快速增殖的必备条件,杏鲍菇菌糠是采收杏鲍菇后的残留基质,营养成分不均衡,可被纤维素分解菌直接利用的可溶性碳源含量较低。因此,在配制发酵基质时需要额外添加适量可溶性碳源,以满足微生物前期快速增殖的营养需要,再者,由于麸皮本身蓬松多空,混入麸皮会增加发酵基质间的空气流动和散热,促进前期好氧纤维素分解菌的增殖[43]。适量添加麸皮,纤维素分解菌优先利用麸皮中的可溶性碳水化合物完成自身菌体数量的快速增殖,分解产生的还原糖可以被酵母和乳酸菌及时利用,在纤维素的诱导条件下分泌大量的纤维素酶,纤维素分解能力增强。但当麸皮添加量过多时,分解麸皮产生的还原糖的量超过了酵母和乳酸菌利用的量还原糖就会沉积,过量的还原糖会对β-葡萄糖苷酶产生强烈抑制作用,阻碍酶与底物的相互作用,降低纤维素的利用效率[36-37, 44]。
固态发酵基质中的营养物质及环境相对于液体发酵和培养瓶培养较为粗放,纤维素分解菌的生长速度和纤维素酶的分泌速度较为缓慢,因此,适当延长发酵时间可以增加纤维素分解菌的数量、纤维素酶的产量和纤维素酶的作用时间,提高纤维素降解率。并且,乳酸菌在发酵过程中分泌的乳酸会降低发酵基质的pH,酸性环境也有利于促进细胞壁组分的分解,达到降解纤维素的目的[45]。
经过复合菌剂发酵,枯草芽孢杆菌与黑曲霉中的纤维成分进行降解,降低基质中NDF和ADF的含量,并且由于粗纤维的降解使得发酵基质中干物质含量减少,粗蛋白质和粗脂肪含量发生相对浓缩,进而表现为含量的增加,试验结果与陆亚珍等[46]相似。AFB1作为霉菌毒素中毒性最强的毒素,主要由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)产生,动物长期摄入被AFB1污染的饲料会对肝脏组织和细胞造成严重损伤[47]。芽孢杆菌和黑曲霉已经被证明对AFB1具有降解作用[48-49],这可能是造成试验组AFB1含量显著下降的主要原因。ZEN和DON主要由镰刀菌属产生,分别攻击动物机体的生殖系统和消化系统[50-51]。混菌发酵使ZEN和DON的含量有下降趋势,但与原料组和不加菌液发酵组差异不显著,这可能是因为添加的菌株对ZEN和DON的降解能力较差。发酵前后3组菌糠的霉菌毒素含量均显著低于我国《饲料卫生标准》(GB 13078—2017)。
4 结论本试验将筛选得到的饲用纤维素分解菌为枯草芽孢杆菌、黑曲霉与乳酸片球菌、酿酒酵母组成复合菌剂,运用响应面法,以NDF降解率为响应值对杏鲍菇菌糠发酵条件进行优化,得到最佳发酵条件为枯草芽孢杆菌与黑曲霉体积比为1.94 : 1.00,枯草芽孢杆菌与黑曲霉添加量为4.7%,麸皮添加量为10.4%,含水量为46.1%,发酵时间为8 d。在最优条件下发酵,杏鲍菇菌糠感官品质良好,纤维素含量较优化前显著降低,营养价值显著提高,且发酵前后,霉菌毒素含量均符合《饲料卫生标准》。
| [1] |
李玉. 中国食用菌产业发展现状、机遇和挑战——走中国特色菇业发展之路, 实现食用菌产业强国之梦[J]. 菌物研究, 2018, 16(3): 125-131. |
| [2] |
李平, 何艳, 王维薇. 东亚国家食用菌贸易态势及竞争力分析——以中日韩为例[J]. 中国食用菌, 2018, 37(6): 72-78. |
| [3] |
李洪亮, 李瑞国, 韩广钧. 浅谈中国食用菌的工厂化生产[J]. 食用菌, 2014(3): 6-8. |
| [4] |
MOHD HANAFI F H, REZANIA S, MAT TAIB S M, et al. Environmentally sustainable applications of agro-based spent mushroom substrate (SMS):an overview[J]. Journal of Material Cycles and Waste Management, 2018, 20(3): 1383-1396. DOI:10.1007/s10163-018-0739-0 |
| [5] |
SHOJAOSADATI S A, ELYASI S. Removal of hydrogen sulfide by the compost biofilter with sludge of leather industry[J]. Resources, Conservation and Recycling, 1999, 27(1/2): 139-144. |
| [6] |
TAY C C, LIEW H H, REDZWAN G, et al. Pleurotus ostreatus spent mushroom compost as green biosorbent for nickel (Ⅱ) biosorption[J]. Water Science & Technology, 2011, 64(12): 2425-2432. |
| [7] |
GARCÍA-DELGADO C, D'ANNIBALE A, PESCIAROLI L, et al. Implications of polluted soil biostimulation and bioaugmentation with spent mushroom substrate (Agaricus bisporus) on the microbial community and polycyclic aromatic hydrocarbons biodegradation[J]. Science of the Total Environment, 2015, 508: 20-28. DOI:10.1016/j.scitotenv.2014.11.046 |
| [8] |
郭彤, 吴艳, 高巍, 等. 杏鲍菇菌糠作为发酵床垫料对断奶仔猪生长性能、肠道菌群及免疫功能的影响[J]. 畜牧与兽医, 2017, 49(5): 35-40. |
| [9] |
VAN TAM N, WANG C H. Use of spent mushroom substrate and manure compost for honeydew melon seedlings[J]. Journal of Plant Growth Regulation, 2015, 34(2): 417-424. DOI:10.1007/s00344-015-9478-9 |
| [10] |
DEMIR H. The effects of spent mushroom compost on growth and nutrient contents of pepper seedlings[J]. Mediterranean Agricultural Sciences, 2017, 30(2): 91-96. |
| [11] |
ASLAM S, SAIFULLAH. Organic management of root knot nematodes in tomato with spent mushroom compost[J]. Sarhad Journal of Agriculture, 2013, 29(1): 63-69. |
| [12] |
张颖, 曾艳, 张丽姣, 等. 不同食用菌菌糠多糖的组分分析与抗氧化活性评价[J]. 食品科学, 2015, 36(5): 18-23. |
| [13] |
高旭红, 曲星梅, 周雅婷, 等. 饲用微生物的分离鉴定及其对杏鲍菇菌糠发酵的效果[J]. 微生物学报, 2018, 58(12): 2110-2122. |
| [14] |
ZHANG Y J, ZHANG S, LIU X Z, et al. A simple method of genomic DNA extraction suitable for analysis of bulk fungal strains[J]. Letters in Applied Microbiology, 2010, 51(1): 114-118. |
| [15] |
吴秋珏, 徐廷生. 饲粮中中性洗涤纤维的研究进展[J]. 饲料工业, 2006, 27(7): 14-16. DOI:10.3969/j.issn.1001-991X.2006.07.006 |
| [16] |
JOYCE A P, LEUNG S S. Use of response surface methods and path of steepest ascent to optimize ligand-binding assay sensitivity[J]. Journal of Immunological Methods, 2013, 392(1/2): 12-23. |
| [17] |
ALAOUI A, EL KACEM K, EL ASS K, et al. Application of box-behnken design to determine the optimal conditions of reductive leaching of MnO2 from manganese mine tailings[J]. Russian Journal of Non-Ferrous Metals, 2015, 56(2): 134-141. DOI:10.3103/S1067821215020029 |
| [18] |
中国标准出版社第一室. 中国农业标准汇编:饲料检测方法卷[M]. 北京: 中国标准出版社, 2010.
|
| [19] |
刘建新, 杨振海, 叶均安, 等. 青贮饲料的合理调制与质量评定标准(续)[J]. 饲料工业, 1999, 20(4): 3-5. |
| [20] |
ZHU H J, SHENG K, YAN E F, et al. Extraction, purification and antibacterial activities of a polysaccharide from spent mushroom substrate[J]. International Journal of Biological Macromolecules, 2012, 50(3): 840-843. DOI:10.1016/j.ijbiomac.2011.11.016 |
| [21] |
顾雅君, 王瑛, 刘建荣, 等. 与食用菌相关主要酶的研究和应用[J]. 中国食用菌, 2006, 25(1): 40-42. DOI:10.3969/j.issn.1003-8310.2006.01.016 |
| [22] |
MEDINA E, PAREDES C, PÉREZ-MURCIA M D, et al. Spent mushroom substrates as component of growing media for germination and growth of horticultural plants[J]. Bioresource Technology, 2009, 100(18): 4227-4232. DOI:10.1016/j.biortech.2009.03.055 |
| [23] |
李天宇, 郑毅, 解盼盼, 等. 7种菌糠及其青贮饲料的营养价值和发酵品质[J]. 中国畜牧杂志, 2018, 54(1): 94-98. |
| [24] |
黄勤楼, 钟珍梅, 黄秀声, 等. 纤维素降解菌的筛选及在狼尾草青贮中使用效果评价[J]. 草业学报, 2016, 25(4): 197-203. |
| [25] |
文少白, 李勤奋, 侯宪文, 等. 微生物降解纤维素的研究概况[J]. 中国农学通报, 2010, 26(1): 231-236. |
| [26] |
贾辉, 陈秀蓉, 芦光新, 等. 纤维素降解细菌的筛选、生物学特性及降解效果[J]. 草业学报, 2016, 25(3): 60-66. |
| [27] |
李晓秀, 张盼, 刘琬瑜, 等. 玉米秸秆降解真菌的筛选及鉴定[J]. 饲料工业, 2017, 38(3): 37-42. |
| [28] |
诸葛诚祥.菌糠高效降解菌剂的研发及其在堆肥中的应用[D].硕士学位论文.杭州: 浙江大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10335-1017071478.htm
|
| [29] |
陈燕, 周孙全, 郑奇士, 等. 常温纤维素降解菌的分离与鉴定[J]. 上海交通大学学报:医学版, 2010, 30(8): 1018-1020. |
| [30] |
李静, 张瀚能, 赵翀, 等. 高效纤维素降解菌分离筛选、复合菌系构建及秸秆降解效果分析[J]. 应用与环境生物学报, 2016, 22(4): 689-696. |
| [31] |
SELVAM K, SENBAGAM D, SELVANKUMAR T, et al. Cellulase enzyme:homology modeling, binding site identification and molecular docking[J]. Journal of Molecular Structure, 2017, 1150: 61-67. DOI:10.1016/j.molstruc.2017.08.067 |
| [32] |
LYND L R, WEIMER P J, VAN ZYL W H, et al. Microbial cellulose utilization:fundamentals and biotechnology[J]. Microbiology and Molecular Biology Reviews, 2002, 66(3): 506-77. DOI:10.1128/MMBR.66.3.506-577.2002 |
| [33] |
赵华, 汤小朋, 汤加勇, 等. 复合生态菌固态发酵木薯渣工艺参数优化及混菌发酵对木薯渣营养品质的影响[J]. 中国畜牧杂志, 2016, 52(5): 55-59, 92. DOI:10.3969/j.issn.0258-7033.2016.05.012 |
| [34] |
黄河清涛, 宾冬梅, 易诚, 等. 啤酒糟单菌发酵与混菌发酵降解纤维素效果比较[J]. 粮食与饲料工业, 2016(1): 46-50. |
| [35] |
陈华.固体发酵黄芪药渣工艺条件优化[J].硕士学位论文.合肥: 安徽农业大学, 2016.
|
| [36] |
ATREYA M E, STROBEL K L, CLARK D S. Alleviating product inhibition in cellulase enzyme Cel7A[J]. Biotechnology and Bioengineering, 2016, 113(2): 330-338. DOI:10.1002/bit.25809 |
| [37] |
KUUSK S, VÄLJAMÄE P. When substrate inhibits and inhibitor activates:implications of β-glucosidases[J]. Biotechnology for Biofuels, 2017, 10: 7. DOI:10.1186/s13068-016-0690-z |
| [38] |
司美茹, 薛泉宏, 蔡艳. 混合发酵对纤维素酶和淀粉酶活性的影响[J]. 西北农林科技大学学报(自然科学版), 2002, 30(5): 69-73. DOI:10.3321/j.issn:1671-9387.2002.05.016 |
| [39] |
韩立英, 玉柱, 周禾. 乳酸菌和纤维素酶对直穗鹅观草青贮的改善效果[J]. 草业科学, 2013, 30(9): 1439-1444. |
| [40] |
YATES G T, SMOTZER T. On the lag phase and initial decline of microbial growth curves[J]. Journal of Theoretical Biology, 2007, 244(3): 511-517. DOI:10.1016/j.jtbi.2006.08.017 |
| [41] |
王晓力, 王帆, 孙尚琛, 等. 多菌种协同发酵啤酒糟渣和苹果渣生产蛋白饲料的研究[J]. 饲料工业, 2016, 37(3): 32-38. |
| [42] |
WANG J H, CAO F L, SU E Z, et al. Improvement of animal feed additives of ginkgo leaves through solid-state fermentation using Aspergillus niger[J]. International Journal of Biological Sciences, 2018, 14(7): 736-747. DOI:10.7150/ijbs.24523 |
| [43] |
张玉诚, 薛白, 达勒措, 等. 混菌固态发酵白酒糟开发为蛋白质饲料的条件优化及营养价值评定[J]. 动物营养学报, 2016, 28(11): 3711-3720. DOI:10.3969/j.issn.1006-267x.2016.11.042 |
| [44] |
张书敏, 徐凤花, 张蕴琦, 等. 玉米秸秆纤维素降解菌系的筛选及培养基碳氮源优化[J]. 安徽农业科学, 2016, 44(34): 82-84, 89. DOI:10.3969/j.issn.0517-6611.2016.34.029 |
| [45] |
董志浩, 原现军, 闻爱友, 等. 添加乳酸菌和发酵底物对桑叶青贮发酵品质的影响[J]. 草业学报, 2016, 25(6): 167-174. |
| [46] |
陆亚珍, 王恒昌, 申远航, 等. 杏鲍菇菌糠的营养价值评价及其在羊日粮中的应用效果[J]. 安徽农业科学, 2017, 45(3): 117-118, 166. DOI:10.3969/j.issn.0517-6611.2017.03.040 |
| [47] |
GHOLAMI-AHANGARAN M, RANGSAZ N, AZIZI S. Evaluation of turmeric (Curcuma longa) effect on biochemical and pathological parameters of liver and kidney in chicken aflatoxicosis[J]. Pharmaceutical Biology, 2016, 54(5): 780-787. DOI:10.3109/13880209.2015.1080731 |
| [48] |
VERHEECKE C, LIBOZ T, MATHIEU F. Microbial degradation of aflatoxin B1:current status and future advances[J]. International Journal of Food Microbiology, 2016, 237: 1-9. DOI:10.1016/j.ijfoodmicro.2016.07.028 |
| [49] |
ADEBO O A, NJOBEH P B, GBASHI S, et al. Review on microbial degradation of aflatoxins[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(15): 3208-3217. DOI:10.1080/10408398.2015.1106440 |
| [50] |
STOEV S D. Foodborne mycotoxicoses, risk assessment and underestimated hazard of masked mycotoxins and joint mycotoxin effects or interaction[J]. Environmental Toxicology and Pharmacology, 2015, 39(2): 794-809. DOI:10.1016/j.etap.2015.01.022 |
| [51] |
MARESCA M. From the gut to the brain:journey and pathophysiological effects of the food-associated trichothecene mycotoxin deoxynivalenol[J]. Toxins, 2013, 5(4): 784-820. DOI:10.3390/toxins5040784 |




