蛋白质是饲料中非常重要而成本最高的组分[1]。饲料蛋白质水平过低会造成鱼类生长缓慢,但饲料蛋白质水平过高,则较多的饲料蛋白质被用作能量,不仅经济上不合算,而且鱼类摄食饲料后还会排出过多的氨,影响养殖环境。为此,研究鱼类饲料适宜的蛋白质水平,对优化饲料成本、保持鱼类良好的生长、提高饲料蛋白质利用效率和保护养殖环境均具有重要的意义。太湖鲂鲌(Culter alburnus♀×Megalobrama terminalis♂)是经过对其父、母本分别选育后,通过属间远缘杂交获得的新品种(新品种登记号:GS-02-001-2017)。该新品种在池塘养殖试验中显现出良好的经济性状,而且商品鱼肌间刺少而简单,具良好的推广前景[2]。但该新品种的规模化养殖推广尚缺乏专用的饲料,而对其营养需求和饲料开发的研究还未见专门的报道。本试验通过评价不同饲料蛋白质水平对太湖鲂鲌幼鱼生长性能、体组成及消化酶活性的影响,以确定太湖鲂鲌幼鱼饲料中适宜的蛋白质水平,为研制专用配合饲料提供参考。
1 材料与方法 1.1 试验饲料以秘鲁鱼粉、棉籽粕、豆粕、血粉等为主要蛋白质源,调节鱼油添加量控制饲料脂肪水平,用沸石粉控制饲料粗灰分水平,配制蛋白质水平分别为33%(D33)、36%(D36)、39%(D39)、42%(D42)、45%(D45)、48%(D48)的6种等能实用试验饲料,其组成及营养水平见表 1。试验饲料制作时,先将原料粉碎,使原料能全部通过孔径为0.355 mm的试验筛,按配方比例称取各原料置于盆内,然后用DS32-Ⅱ双螺杆膨化机制作直径约为1.2 mm的颗粒,在50 ℃下风干至水分含量低于10%后,于4 ℃下保存。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of trial diets (DM basis) |
试验用太湖鲂鲌幼鱼为浙江省淡水水产研究所综合试验基地同塘培育的当年鱼种,平均尾重约为1.22 g。试验前用自制硬颗粒破碎料驯养2周,然后随机分养到6组(每组3个重复)的18只试验水箱中,每箱放鱼60尾。
1.3 饲养管理试验鱼饲养在由18只容积为500 L(盛水300 L)的圆柱形玻璃钢水箱组成的循环流水式养殖系统中。每个水箱均配备充气头,连续充气。试验期间每天08:00和16:00分别手工投饲1次,每次均投喂至接近饱食。饲养试验持续8周。饲养期间,水温26~28 ℃;水质指标如下:pH 7.20~7.41、溶解氧(DO)浓度5.31~6.20 mg/L、氨态氮(NH3-N)浓度0.09~0.21 mg/L、亚硝态氮(NO2-N)浓度0.02~0.08 mg/L、硝态氮(NO3-N)浓度0.14~0.35 mg/L。
1.4 生长性能和形体指标计算饲养试验结束后,对饥饿2 d的试验鱼逐箱群体称重和计数,统计总投饲量,计算成活率(survival rate,SR)、增重率(weight gain rate, WGR)、饲料效率(feed efficiency, FE)和蛋白质沉积率(protein retention rate,PRR);每个水箱随机取试验鱼20尾,进行逐鱼称重、测体长,并在麻醉后解剖取内脏和肝脏称重,计算每箱鱼的肥满度(condition factor, CF)、脏体指数(vicera-somatic index, VSI)和肝体指数(hepato-somatic index, HSI)。相关指标具体计算方法如下:

|
取制作完成的试验饲料和饲养试验完成后饥饿2 d的试验鱼(每箱6尾为1个混合样)供营养成分测定。参照AOAC(1995)[4],采用105 ℃常压干燥法测定水分含量;采用凯氏定氮法测定粗蛋白质含量;采用索氏抽提法(无水乙醚为溶剂)测定粗脂肪含量;采用箱式电阻炉550 ℃灼烧法测定粗灰分含量。
1.6 消化酶活性检测饲养试验结束后,取饥饿2 d的试验鱼,麻醉后解剖,取出内脏,置于冰盘上分离出全部肝脏和肠道,剔除肠表面的脂肪块和肠道内容物,用滤纸吸干水分后称重(每箱6尾为1个混合样),加入10倍体积的磷酸盐缓冲溶液(PBS,预置于冰浴中),用FSH-2A型高速匀浆机在冰浴中制作匀浆。随后用Eppendorf 5801R离心机离心10 min(4 ℃、10 000×g),获得的上清液为粗酶液,置于4 ℃冰箱中待用(不超过24 h)。
采用福林试剂法[5]测定蛋白酶活性,蛋白酶活性定义为:于pH 7.5、37 ℃条件下,每毫克组织蛋白质每分钟酶解酪蛋白生成酪氨酸的微克数。参照Bernfeld[6]的方法测定淀粉酶活性,淀粉酶活性定义为:于pH 6.9、25 ℃条件下,每毫克组织蛋白质每分钟酶解可溶性淀粉生成麦芽糖的微摩尔数。采用考马斯亮蓝法[7]测定粗酶液中蛋白质浓度,以牛血清白蛋白为基准物。
1.7 数据统计与分析数据以平均值±标准误(mean±SE)表示。采用SPSS 11.5统计软件进行单因素子方差分析(one-way ANOVA),以检验不同组间各指标平均值是否存在显著性差异。如有显著差异(P<0.05),则作Student’s Newman-Kuels(SNK)多重比较分析。分别以WGR和FE为指标,利用折线回归模型,求得突破点时的饲料蛋白质水平和蛋能比[8],即为饲料适宜蛋白质水平和蛋能比。
2 结果与分析 2.1 饲料蛋白质水平对太湖鲂鲌幼鱼生长性能的影响各组试验鱼的生长性能结果列于表 2中。试验鱼的初始体重各组间无显著差异(P>0.05)。试验鱼摄食试验饲料8周终末体重除D42、D45、D48组间差异不显著(P>0.05)外,其他组间差异显著(P<0.05)。各组试验鱼SR在97.33%~99.33%,各组间无显著差异(P>0.05);随饲料蛋白质水平从33%升高到42%,试验鱼的WGR和FE均显著提高(P<0.05),但饲料蛋白质水平进一步提高,WGR和FE不再有显著变化(P>0.05);PRR随饲料蛋白质水平的升高整体上呈降低趋势,饲料蛋白质水平为33%时PRR最高,饲料蛋白质水平为48%时PRR最低,二者差异显著(P<0.05)。
|
|
表 2 各组试验鱼的生长性能 Table 2 Growth performance of trial fish in each group |
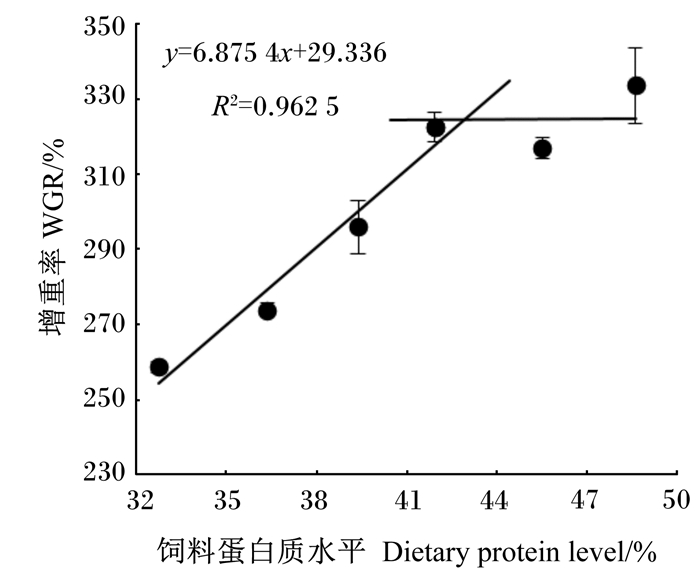
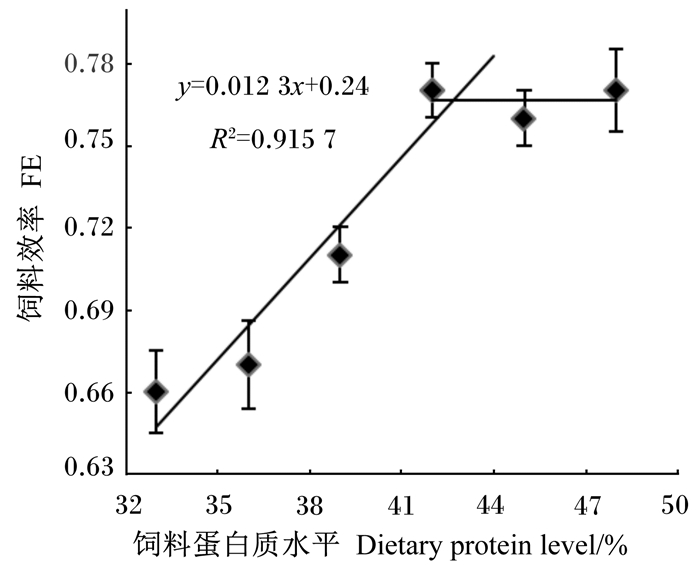
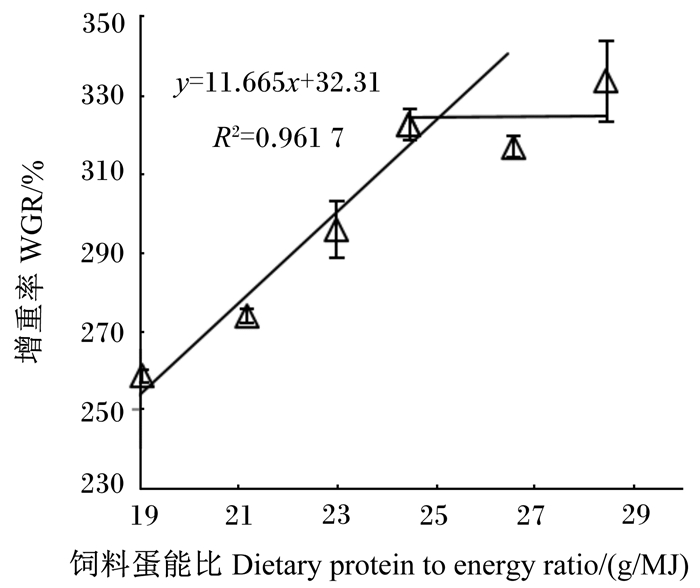
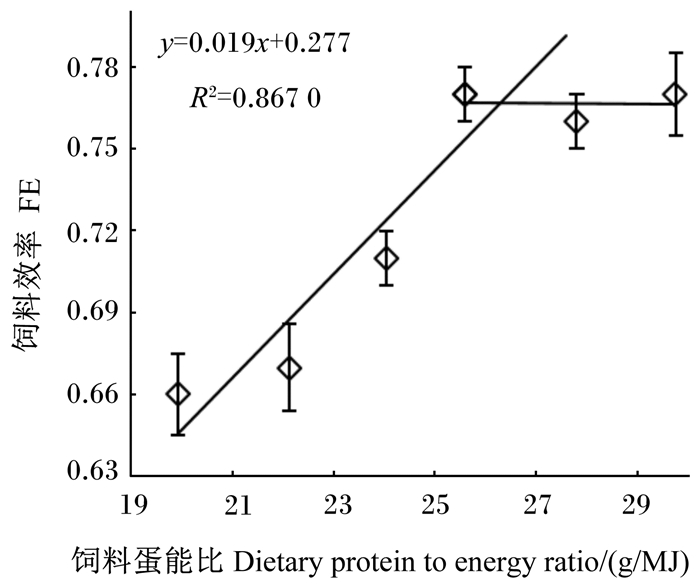
根据生长性能数据,分别以WGR和FE为指标,与饲料蛋白质水平拟合折线模型进行回归分析,并作回归图(图 1和图 2),估算出饲料适宜蛋白质水平分别为占饲料干物质的42.9%和43.8%。相应地,以WGR和FE为指标,与饲料蛋能比拟合折线模型进行回归分析,并作回归图(图 3和图 4),估算出饲料适宜蛋能比分别为25.1和25.7 g/MJ。
|
图 1 增重率与饲料蛋白质水平的回归分析 Fig. 1 Broken-line regresion analysis of WGR with dietary protein level |
|
图 2 饲料效率与饲料蛋白质水平的回归分析 Fig. 2 Broken-line regresion analysis of WGR with dietary protein to energy ratio |
|
图 3 增重率与饲料蛋能比的回归分析 Fig. 3 Broken-line regresion analysis of WGR with dietary protein to energy ratio |
|
图 4 饲料效率与饲料蛋能比的回归分析 Fig. 4 Broken-line regresion analysis of FE with dietary protein to energy ratio |
各组试验鱼的体组成和形体指标结果列于表 3中。饲料蛋白质水平对全鱼粗蛋白质和粗灰分含量无显著影响(P>0.05);D45和D48组全鱼水分含量显著高于其余各组(P<0.05);全鱼粗脂肪含量(yL)随饲料蛋白质水平的升高而降低,与饲料蛋白质水平(x)呈负相关(yL=-0.15x+15.78,R2=0.654,P<0.001)。试验鱼摄食蛋白质水平最低的饲料(D33)后,鱼体的CF显著低于摄食其余蛋白质水平饲料的试验鱼(P<0.05),而试验鱼摄食其他5种不同饲料(D36、D39、D42、D45和D48)后,其CF在不同组间无显著差异(P>0.05);试验鱼的VSI(yVSI)也与饲料蛋白质水平(x)呈负相关(yVSI=-0.12x+12.22, R2=0.737,P<0.001);饲料蛋白质水平对HSI无显著影响(P>0.05)。
|
|
表 3 各组试验鱼的体组成和形体指标 Table 3 Body composition and morphometrical parameters of trial fish in each groups |
各组试验鱼消化酶活性结果列于表 4中。试验鱼摄食含不同蛋白质水平的试验饲料8周后,肝脏蛋白酶活性在各组间无显著差异(P>0.05);肠道蛋白酶活性随饲料蛋白质水平提高先不断提高,但当饲料蛋白质水平超过42%后则不再有显著变化(P>0.05);肝脏淀粉酶活性随着饲料蛋白质水平的升高而呈现先逐渐升高然后逐渐下降的趋势,在D42组有最高值,显著高于其他各组(P<0.05);肠道淀粉酶活性(yA)与饲料蛋白质水平(x)呈负相关(yA=-1.73x+99.53,R2=0.997,P<0.001)。
|
|
表 4 各组试验鱼的消化酶活性 Table 4 Digestive enzyme activities of trial fish in each group |
本试验发现,太湖鲂鲌幼鱼摄食蛋白质水平较低的饲料时生长速度较慢,适当提高饲料蛋白质水平会改善试验鱼的生长,但当饲料蛋白质水平提高到某一水平后,鱼体生长不再有显著变化。这样的生长-剂量反应在对许多鱼类如杂交罗非鱼(Oreochromis nilotica×O. aureus)[9]、斑鳢(Channa striata)[10]、青鱼(Mylopharyngodon piceus)[11]、墨累鳕(Maccullochella peelii)[12]、马口鱼(Zacco barbata)[13]、银鲈(Bidyanus bidyanus)[14]、光倒刺鲃(Spinibarbus hollandi)[15]、刺鲃(S. caldwell)[16]和杂交鲌(C. alburnus♀×Ancherythroculter nigrocauda)[17]等的同类研究中均有发现。为此,折线模型回归分析被用于确定这些鱼类饲料的适宜蛋白质水平[8]。本试验以WGR为指标,确定太湖鲂鲌幼鱼饲料的适宜蛋白质水平为占饲料干物质的42.9%。在研究鱼类饲料适宜蛋白质水平时,除应用生长指标来评估外,也常饲料利用指标来对试验结果进行综合评价。因此本试验还以FE为指标估算得到试验鱼的饲料适宜蛋白质水平为占饲料干物质的43.8%。上述结果略低于其父本三角鲂幼鱼的饲料适宜蛋白质水平(44.2%)[18],而略高于其母本翘嘴鲌幼鱼的蛋白质需求量(41.0%)[19]。
本试验中,当饲料蛋白质不足时,鱼体生长较慢,并影响饲料转化效率,但有较高的PRR,表明摄入的饲料蛋白质有较高比例用于体蛋白质的合成。随着饲料蛋白质达到一定水平后,进一步提高饲料蛋白质水平对FE并无显著影响,而PRR则出现显著下降。这是因为鱼类的最大生长所需的蛋白质得到满足后,多余的蛋白质被分解用作能量物质消耗[20],此时饲料蛋白质被消化吸收后用于体蛋白质合成的比例出现下降。同时,试验鱼摄食过高蛋白质水平饲料还会造成鱼类氨氮排泄增多,但本试验在循环水系统条件下养殖,养殖水体中氨氮很快会通过硝化作用最终被氧化成硝态氮,而鱼类一般对硝态氮有一定耐受能力,在一定范围内不会对鱼体的生长和饲料利用产生不利影响。然而,在实际养殖生产过程中,使用蛋白质水平过高的饲料不仅会造成饲料成本升高,而且也会使养殖环境中有过多的氮积累,造成水体污染,这是应当避免的。因此,解决该问题的办法是在鱼类饲料配方中保持适宜的蛋能比[1]。本试验中,在基本等能的情况下,饲料蛋白质水平改变也相应改变了饲料蛋能比,根据本试验结果,以WGR和FE为指标,初步估算出太湖鲂鲌幼鱼饲料适宜的蛋能比的水为25.0~25.7 g/MJ。该结果与其父本三角鲂幼鱼(25.3 g/MJ)[18]接近,而高于其母本翘嘴鲌幼鱼(20.5 g/MJ)[19]。
太湖鲂鲌幼鱼摄食的饲料蛋白质水平越低,全鱼粗脂肪含量就越高。这是因为,本试验条件下,饲料中脂肪水平基本相同,而饲料蛋白质水平越低,则碳水化合物水平越高,而饲料中过多高水平的碳水化合物会造成脂肪合成量提高,引起脂肪在体内积累增加[14-15]。本研究中VSI与饲料蛋白质水平呈负相关也可能是与脂肪在腹腔内积累程度不同有关。全鱼水分含量随饲料蛋白质水平的上升而增加,被认为与全鱼粗脂肪含量受饲料蛋白质水平影响相关[14-15, 18-22]。饲料蛋白质水平升高会造全鱼或胴体粗蛋白质含量呈升高趋势[14-18], 但这种影响常表现为无显著差异[19, 22],本研究结果与此相同。有研究认为饲料蛋白质水平的改变引起全鱼粗灰分含量发生变化主要是由饲料粗灰分含量变化造成的[9, 14]。而本研究中6种试验饲料的粗灰分含量基本保持不变,因此,试验鱼的全鱼粗灰分含量不受饲料蛋白质水平变化的影响,与前人研究[18-22]有相同的结论。
本试验以及前人对杂交鲌[17]、刺鲃[16]和翘嘴红鲌[23]等的研究表明,饲料蛋白质水平在较大范围内变动对肝脏蛋白酶活性无显著影响。而饲料蛋白质水平从低到高变动会引起鱼类肠道蛋白酶活性提高的结果已有较多的报道[16-17, 23-25],只是当饲料蛋白质水平升高到一定程度后这种影响的持续性在不同鱼类上略有不同。例如,翘嘴红鲌[23]、杂交鲌[17]和宝石鲈(Scortum bacoo)[24]等的肠道蛋白酶活性随饲料蛋白质水平的升高而不断上升,而刺鲃[16]的肠道蛋白酶活性在饲料蛋白质水平超过40%后反而显著下降。本研究中饲料蛋白质水平在42%~48%,太湖鲂鲌幼鱼的肠道蛋白酶活性基本不变。造成这种差异的原因是否与试验鱼的食性或试验条件等因素有关尚待观察。太湖鲂鲌幼鱼肠道淀粉酶活性因饲料蛋白质水平升高而持续下降,这与对杂交鲌[17]、刺鲃[16]、草鱼(Ctenopharyngodon idella)[25]和遮目鱼(Chanos chanos)[26]的研究结果相同,表明这些鱼类的肠道淀粉酶活性高低与饲料中糖含量密切相关。此外,本研究观察到,肝脏淀粉酶活性对饲料蛋白质水平的变化引起的碳水化合物水平改变有适应性,即饲料蛋白质和碳水化合物水平适宜时,肝脏淀粉酶活性较高,而当饲料蛋白质超出适宜水平并引起碳水化合物水平过高或过低时,肝脏淀粉酶活性较低。相同的现象已见诸于多种鱼类[16, 22, 25-26]的研究中。
| [1] |
NRC.Nutrient requirements of fishes[S].Washington, D.C.: National Academy Press, 2011.
|
| [2] |
GUO H H, ZHENG G D, WU C B, et al. Comparative analysis of the growth performance and intermuscular bone traits in F1 hybrids of black bream (Megalobrama terminalis)(♀)×topmouth culter (Culter alburnus)(♂)[J]. Aquaculture, 2018, 492: 15-23. DOI:10.1016/j.aquaculture.2018.03.037 |
| [3] |
GARLING D L, WILSON R P. Effects of dietary carbohydrate-to-lipid ratios on growth and body composition of fingerling channel catfish[J]. The Progressive Fish-Culturist, 1977, 39(1): 43-47. DOI:10.1577/1548-8659(1977)39[43:EODCRO]2.0.CO;2 |
| [4] |
AOAC.Official methods of analysis[S].16th ed.Arlington, VA: AOAC International, 1995.
|
| [5] |
中山大学生物系生化微生物学教研室. 生化技术导论[M]. 北京: 人民教育出版社, 1978: 53-54.
|
| [6] |
BERNFELD P.Amylases α and β: colorimetric assay method[M]//COLOWICK S P, KAPLAN N O.Methods in enzymology.New York: Academy Press Inc., 1955, 1: 149-158.
|
| [7] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [8] |
ZEITOUN I H, ULLREY D E, MAGEE W T, GILL J L, et al. Quantifying nutrient requirements of fish[J]. Journal of the Fisheries Research Board of Canada, 1976, 33(1): 167-172. DOI:10.1139/f76-019 |
| [9] |
SHIAU S Y, HUANG S L. Optimal dietary protein level for hybrid tilapia Oreochromis niloticu×Oreochromis aureus) reared in seawater[J]. Aquaculture, 1989, 81(2): 119-127. DOI:10.1016/0044-8486(89)90237-8 |
| [10] |
MOHANTY S S, SAMANTARAY K. Effect of varying levels of dietary protein on the growth performance and feed conversion efficiency of snakehead Channa striata fry[J]. Aquaculture Nutrition, 1996, 2(2): 89-94. DOI:10.1111/j.1365-2095.1996.tb00013.x |
| [11] |
杨国华, 李军, 郭履骥, 等. 青鱼花夏饵料中的最适蛋白质含量[J]. 水产学报, 1981, 5(1): 49-55. |
| [12] |
GUNASEKERA R M, DE SILVA S S, COLLINS R A, et al. Effect of dietary protein level on growth and food utilization in juvenile Murray cod Maccullochella peelii peelii mitchell[J]. Aquaculture Research, 2000, 31(2): 181-187. DOI:10.1046/j.1365-2109.2000.00417.x |
| [13] |
SHYONG W J, HUANG C H, CHEN H C. Effects of dietary protein concentration on growth and muscle composition of juvenile Zacco barbata[J]. Aquaculture, 1998, 167(1/2): 35-42. |
| [14] |
YANG S D, LIOU C D, LIU F G. Effects of dietary protein level on growth performance, carcass composition and ammonia excretion in juvenile silver perch (Bidyanus Bidyanus)[J]. Aquaculture, 2002, 213(1/2/3/4): 363-372. |
| [15] |
YANG S D, LIN T S, LIOU C H, et al. Influence of dietary protein levels on growth performance, carcass composition and liver lipid classes of juvenile Spinibarbus hollandi (Oshima)[J]. Aquaculture Research, 2015, 34(8): 661-666. |
| [16] |
吕耀平, 陈建明, 叶金云, 等. 饲料蛋白质水平对刺鲃幼鱼的生长、胴体营养组成及消化酶活性的影响[J]. 农业生物技术学报, 2009, 17(2): 276-281. DOI:10.3969/j.issn.1674-7968.2009.02.016 |
| [17] |
吴凡, 文华, 李清, 等. 杂交鲌"先锋号"幼鱼蛋白质需求量的研究[J]. 动物营养学报, 2018, 30(12): 5052-5061. DOI:10.3969/j.issn.1006-267x.2018.12.033 |
| [18] |
YANG M, WANG J T, HAN T, et al. Dietary protein requirement of juvenile triangular bream Megalobrama terminalis (Richardson, 1846)[J]. Journal of Applied Ichthyology, 2017, 33(5): 971-977. DOI:10.1111/jai.13405 |
| [19] |
陈建明, 叶金云, 王友慧, 等. 翘嘴红鲌幼鱼对蛋白质的需要量[J]. 水产学报, 2005, 29(1): 83-86. |
| [20] |
KIM K, KAYES T B & AMUNDSON C H. Purified diet development and re-evaluation of the dietary protein requirements of Artic charr, Salvelinus alpines[J]. Journal of Fish Biology, 1991, 22(3): 705-712. |
| [21] |
DANIELS W H, ROBINSON E H. Protein and energy requirements of juvenile red drum (Sciaenops ocellatus)[J]. Aquaculture, 1986, 53(3/4): 243-252. |
| [22] |
BROWN M L, NEMATIPOUR G R, GATLIN D E. Dietary protein requirements of sunshine bass at different salinities[J]. Progresive Fish-Culturist, 1992, 54(2): 148-156. |
| [23] |
钱曦, 王桂芹, 周洪琪, 等. 饲料蛋白水平及豆粕替代鱼粉比例对翘嘴红鲌消化酶活性的影响[J]. 动物营养学报, 2007, 19(2): 182-187. DOI:10.3969/j.issn.1006-267X.2007.02.017 |
| [24] |
邵庆均, 苏小凤, 许梓荣. 饲料蛋白水平对宝石鲈增重和胃肠道消化酶活性影响[J]. 浙江大学学报(农业与生命科学版), 2004, 30(5): 553-556. DOI:10.3321/j.issn:1008-9209.2004.05.018 |
| [25] |
JANA S N, GARG S K, BANNAN U K, et al. Effect of varying dietary protein levels on growth and production of Chanos chanos (Forsskal) in inland saline groundwater:laboratory and field studies[J]. Aquaculture International, 2006, 14(5): 479-498. DOI:10.1007/s10499-006-9050-5 |
| [26] |
DAS K M, TRIPATHI S D. Studies on the digestive enzymes of grass carp Ctenopharyngodon idella (Val.)[J]. Aquaculture, 1991, 92: 21-32. DOI:10.1016/0044-8486(91)90005-R |



