在蜜蜂的生理代谢过程中,矿物元素的作用非常重要,不仅参与歧化反应,而且是调节血淋巴与组织液渗透压的重要因素[1]。锰(Mn)是动物体内重要的矿物元素之一,能促进动物体内的内分泌活动和提高机体免疫功能,还参与体内的氧化还原过程[2]。锰不仅仅参与构造动物体内的金属酶,还是许多酶的激活剂[3]。蜂蜜是蜜蜂主要的能量来源,含有丰富的矿物元素。蜂蜜中的矿物元素含量受蜂群所在的地理环境、当地植被生长特点和地质情况等的影响,其中钾(K)、钠(Na)、镁(Mg)、锌(Zn)、铁(Fe)和铜(Cu)等20多种微量元素含量丰富。曾志将等[4]测得油茶蜜中锰含量为0.62 mg/kg。Silva等[5]通过对葡萄牙地区的蜂蜜进行测定发现锰的含量较高,为0.133~9.471 mg/kg,占矿物元素总量的3%。花粉中富含多种矿物元素,已从花粉中发现了60多种矿物元素[6],且不同花粉中的矿物元素含量各不相同。据报道,花粉中的矿物元素,以钾(3 480 mg/kg)的含量最高,其次是磷(2 957 mg/kg)、镁、锰、铜、钙(Ca)、铁和锌等[7]。前人研究表明,我国不同植物的花粉中,锰的含量在999~4 431 mg/kg[8]。相比其他矿物元素,锰是一种对动物毒性较小的微量元素,是动物生长过程中所必需的物质,参与生物机体代谢以及某些酶的合成,还对生物中枢神经系统和免疫系统发生作用[9]。前人研究表明,随着蜜蜂日龄的增长,其体内锰的含量会逐渐增加,在饲粮中补充适量的锰会促进蜜蜂的生长发育[10]。因此,有必要按蜜蜂生长发育的需求在人工饲粮中添加微量元素锰。为了进一步探明锰对蜜蜂生长发育和生理机能的影响,本试验以意大利蜜蜂为研究对象,通过在成年工蜂饲粮中添加不同水平的锰,开展室内离群成年工蜂饲养试验,对寿命、机体生理生化指标以及锰相关基因表达量进行测定,力求探明锰对蜜蜂的营养作用及机制。
1 材料与方法 1.1 试验动物试验用意大利蜜蜂工蜂取自山东农业大学试验蜂场,于2018年4月采样。
1.2 试验试剂与仪器设备试剂及耗材:蔗糖(广西省大新县世纪飞龙有限公司)、葡萄糖酸锰(山东西亚化学有限公司)、去离子水(山东泰安普天生物有限公司)、浓硝酸(山东泰安普天生物有限公司)。
试剂盒:昆虫锰超氧化物歧化酶(MnSOD)酶联免疫吸附测定试剂盒(上海酶联生物研究所)、昆虫双核精氨酸酶(arginase)酶联免疫吸附测定试剂盒(上海酶联生物研究所)、昆虫锰过氧化氢酶(MnCAT)酶联免疫吸附测定试剂盒(上海酶联生物研究所)、二喹啉甲酸(BCA)蛋白定量试剂盒(北京康为世纪生物科技有限公司)、总RNA提取试剂盒Ⅱ(R6934-01,Omega公司)、反转录试剂盒(DRR037A,TaKaRa公司)、FastStart Universal SYBR Green Master (Roche公司)。
主要仪器:蜜蜂饲养装置(专利号:ZL 2014 2 0503643.3)、电子天平(上海精天电子仪器厂,精确到0.000 1 g)、Multiwave 3000型微波消解仪(奥地利Anton Paar公司)、离心机(德国Eppendorf公司)、X-Series Ⅱ型电感耦合等离子体质谱仪(美国Thermo公司)、ABI 7500型实时荧光定量PCR仪(美国Applied Biosystems公司)、T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.3 试验设计随机从蜂群中取刚出房的1日龄蜜蜂1 250只置于25个蜜蜂饲养装置内,每个饲养装置饲养50只蜜蜂,将25个蜜蜂饲养装置随机分为5组,每组5个饲养装置,用于机体生理生化指标以及锰相关基因表达量进行测定。其中,对照组蜜蜂供给不额外添加锰的糖浆饲粮;4个试验组蜜蜂供给添加不同水平葡萄糖酸锰的糖浆饲粮,使饲粮中锰添加水平分别为50、100、150、200 mg/kg。另随机从蜂群中取刚出房的1日龄蜜蜂1 250只,置于25个蜜蜂饲养装置内,每个饲养装置饲养50只蜜蜂,按照上述处理进行分组和饲喂,用于测定各组蜜蜂的平均寿命。离群饲养工蜂饲粮组成见表 1。
|
|
表 1 离群饲养工蜂饲粮组成 Table 1 Composition of diets for indoor-reared worker bees |
将蜜蜂置于恒温恒湿培养箱中,设置培养箱内的温度30 ℃,相对湿度(50±5)%,每天定时用注射器饲喂对应的糖浆饲粮3 mL,观察蜜蜂表现,清除死亡蜂体,饲喂至蜜蜂全部死亡。用于测定机体生理生化指标以及锰相关基因表达量的各组分别在蜜蜂生长到7、14、21日龄时取样。
1.5 测定指标及相关方法 1.5.1 成年工蜂平均寿命的测定试验期间观察用于测定平均寿命的各组蜜蜂的表现,每天定时清除死亡蜂体并记录死亡数,直至蜜蜂全部死亡,计算每组蜜蜂的平均寿命。
1.5.2 成年工蜂体内锰含量的测定各组分别取出离群饲养的21日龄意大利蜜蜂15只蜜蜂,每3只蜜蜂为1个重复,精密称定体重。将蜜蜂放置于洗好烘干的聚四氟乙烯消解罐底中,加入硝酸6.0 mL,将蜜蜂充分浸没。将聚四氟乙烯消解罐放入电加热恒温炉中,在130 ℃下加热30 min,然后放入微波消解仪中消解。消解后转移至25 mL容量瓶中,超纯水定容,然后用0.45 μm水系滤器过滤得到样品,同时做流程空白对照。所得样品采用X-Series Ⅱ型电感耦合等离子体质谱仪测定锰含量。
1.5.3 成年工蜂体内锰相关酶活性的测定在7、14、21日龄时,各组分别取出25只蜜蜂,每5只蜜蜂为1个重复,将各组样品按质量体积比1 : 9加预冷的磷酸盐缓冲液(PBS)于离心管中进行组织匀浆得10%匀浆液,10%匀浆液在4 ℃条件下5 000 r/min离心10 min后取上清,备测蜂体的蛋白质浓度以及MnSOD、MnCAT和精氨酸酶活性。采用双抗体一步夹心法酶联免疫吸附试验往预先包被昆虫MnSOD捕获抗体的包被微孔中一次加入样品、标准品、辣根过氧化物酶(HRP)标记的检测抗体,经过温育并彻底洗涤,用底物3, 3′, 5, 5′-四甲基联苯胺(TMB)显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的MnSOD活性呈正相关。用酶标仪在450 nm波长下分别测定标准品和样品的吸光度(OD)值,通过标准曲线计算样品中MnSOD活性。MnCAT和精氨酸酶活性测定原理同上。3种锰相关酶活性均用蜂体蛋白质浓度进行校准。
1.5.4 成年工蜂体内锰相关基因表达量的测定用实时荧光定量PCR(qRT-PCR)法检测各组成年工蜂锰相关基因表达量的表达量。在7、14、21日龄时,各组分别取出25只蜜蜂,每5只蜜蜂为1个重复,采用总RNA提取试剂盒Ⅱ提取样品总RNA。利用反转录试剂盒将总RNA立即反转录成cDNA,随后将cDNA样品浓度调节为相同水平后,-20 ℃保存待用。参照FastStart Universal SYBR Green Master操作指南配制20 μL体系,使用ABI 7500型实时荧光定量PCR仪检测锰相关基因相对表达量。以β-肌动蛋白(β-actin)为内参基因,目的基因引物设计参考序列来自于NCBI数据库,委托上海生工生物科技有限公司完成,引物序列如表 2所示。
|
|
表 2 引物序列 Table 2 Sequences of primers |
数据采用SAS 9.2软件进行单因素方差分析(one-way ANOVA),并用LSD法进行多重比较,P<0.05表示差异显著。结果表示为平均值±标准差。
2 结果 2.1 锰对成年工蜂寿命的影响由表 3可知,50和100 mg/kg锰添加组蜜蜂的平均寿命显著长于对照组以及150和200 mg/kg锰添加组(P < 0.05)。
|
|
表 3 锰对成年工蜂寿命的影响 Table 3 Effects of manganese on lifespan of adult worker bees |
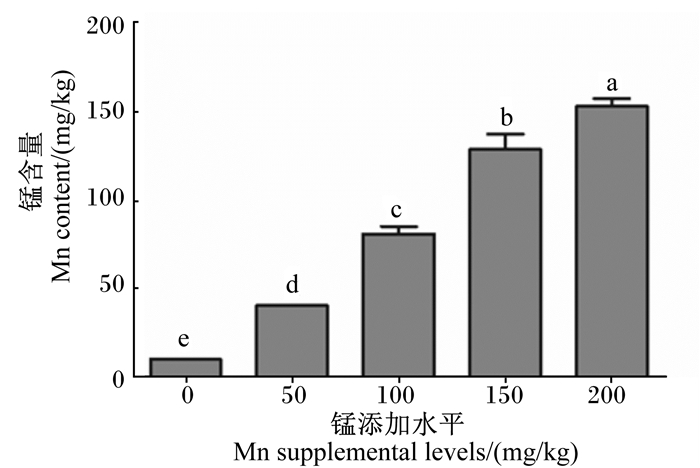
由图 1可知,21日龄成年工蜂体内锰含量随饲粮中锰添加水平的升高而显著上升(P < 0.05),对照组显著低于添加锰的各试验组(P < 0.05)。
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 锰对成年工蜂体内锰含量的影响 Fig. 1 Effects of manganese on manganese content in adult worker bee body |
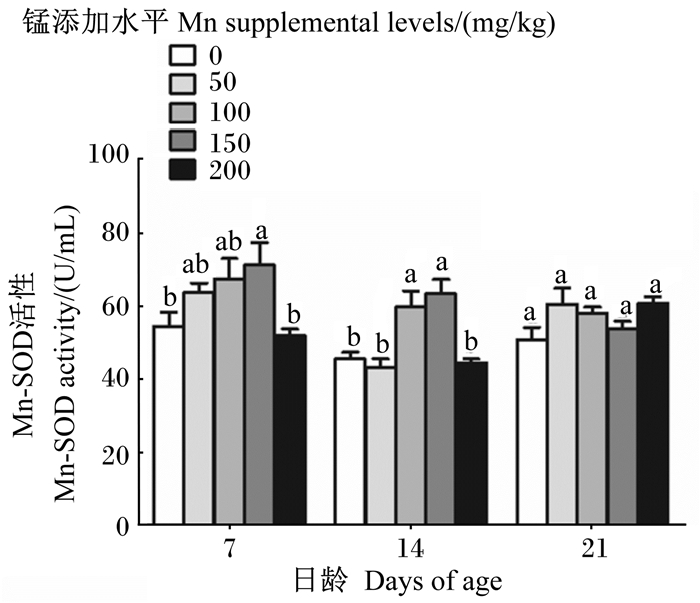
由图 2可知,随着饲粮中锰添加水平的升高,7和14日龄成年工蜂体内MnSOD活性总体呈先升高后下降的趋势,其中7日龄成年工蜂在锰添加水平为150 mg/kg时MnSOD活性达到最高且显著高于对照组和200 mg/kg锰添加组(P < 0.05),14日龄成年工蜂在锰添加水平为100、150 mg/kg时MnSOD活性较高且显著高于对照组和50、200 mg/kg锰添加组(P < 0.05);21日龄成年工蜂体内MnSOD活性各组之间无显著差异(P>0.05)。
|
图 2 锰对成年工蜂体内MnSOD活性的影响 Fig. 2 Effects of manganese on MnSOD activity in adult worker bee body |
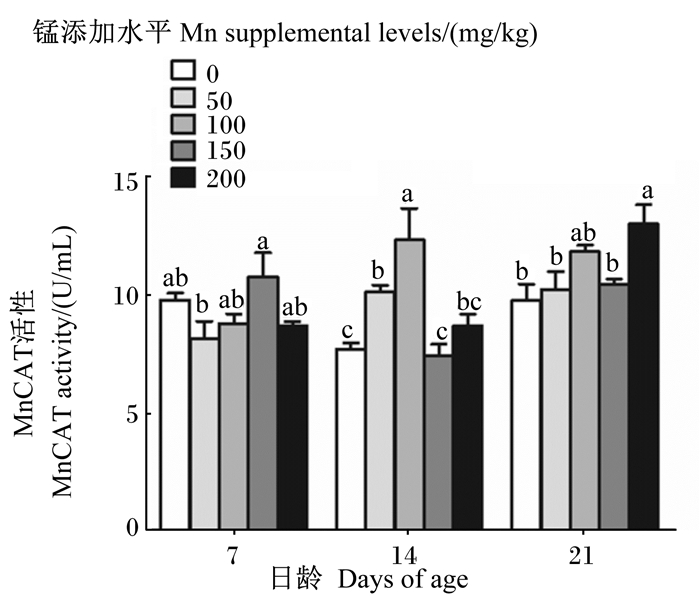
由图 3可知,7日龄成年工蜂体内MnCAT活性在锰添加水平为150 mg/kg时达到最高,与对照组差异不显著,但显著高于50 mg/kg锰添加组(P < 0.05);14日龄成年工蜂体内MnCAT活性在锰添加水平为100 mg/kg时达到最高且显著高于对照组以及其他试验组(P < 0.05);21日龄成年工蜂体内MnCAT活性在锰添加水平为200 mg/kg时达到最高且显著高于对照组和50、150 mg/kg锰添加组(P < 0.05)。
|
图 3 锰对成年工蜂体内MnCAT活性的影响 Fig. 3 Effects of manganese on MnCAT activity in adult worker bee body |
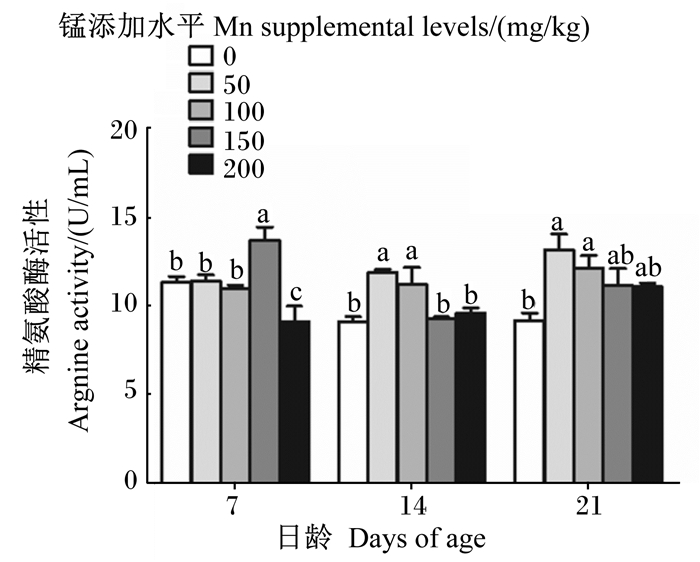
由图 4可知,随着饲粮中锰添加水平的升高,各日龄成年工蜂体内精氨酸酶活性总体呈先升高后下降趋势。7日龄成年工蜂体内精氨酸酶活性在锰添加水平为150 mg/kg时达到最高且显著高于对照组和其他试验组(P < 0.05);14日龄成年工蜂体内精氨酸酶活性在锰添加水平为50、100 mg/kg时较高且显著高于对照组和150、200 mg/kg锰添加组(P < 0.05);21日龄成年工蜂体内精氨酸酶活性在锰添加水平为50、100 mg/kg时较高且显著高于对照组(P < 0.05)。
|
图 4 锰对成年工蜂体内精氨酸酶活性的影响 Fig. 4 Effects of manganese on Argnine activity in adult worker bee body |
由图 5可知,随着饲粮中锰添加水平的升高,各日龄成年工蜂体内MnSOD基因的表达量先升高后下降,且均在锰添加水平为150 mg/kg时达到最高,在7和21日龄时显著高于其他各组(P < 0.05),在14日龄时显著高于200 mg/kg锰添加组(P < 0.05)。
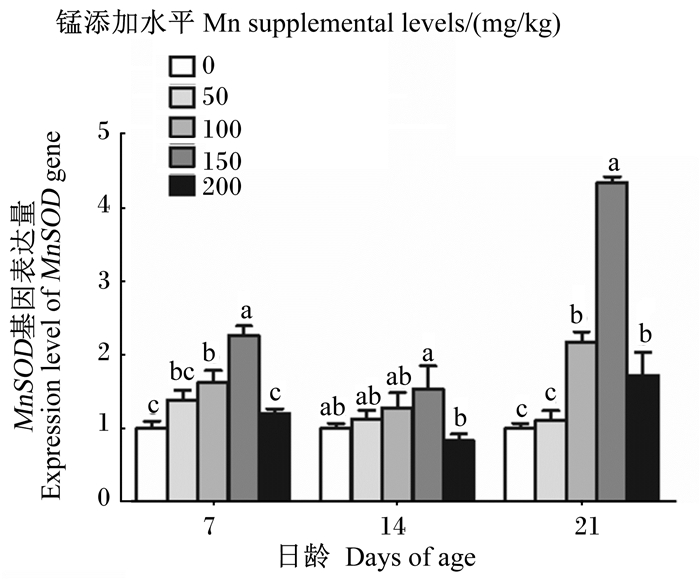
|
图 5 锰对成年工蜂体内MnSOD基因表达量的影响 Fig. 5 Effects of manganese on expression level of MnSOD gene in adult worker bee body |
由图 6可知,随着饲粮中锰添加水平的升高,14和21日龄成年工蜂体内MnCAT基因的表达量先升高后下降。14日龄时,100 mg/kg锰添加组成年工蜂体内MnCAT基因的表达量显著高于对照组和150、200 mg/kg锰添加组(P < 0.05);21日龄时,100、150 mg/kg锰添加组成年工蜂体内MnCAT基因的表达量显著高于对照组和50、200 mg/kg锰添加组(P < 0.05);7日龄成年工蜂体内MnCAT基因的表达量各组之间无显著差异(P>0.05)。
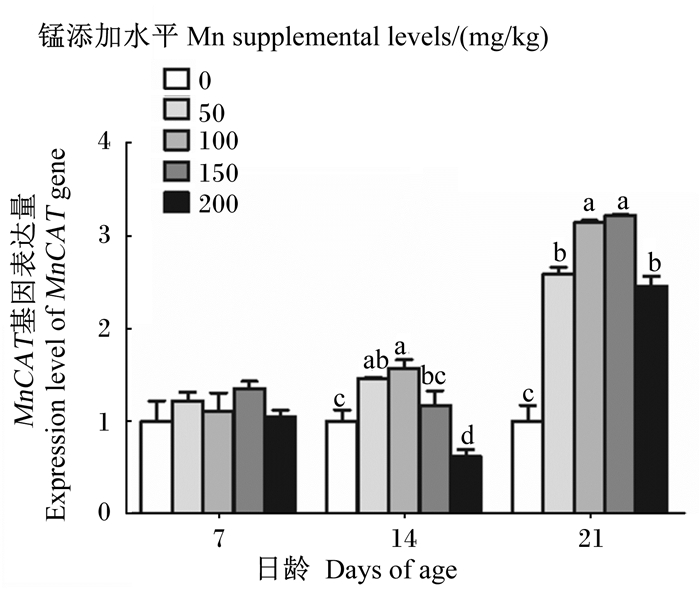
|
图 6 锰对成年工蜂体内MnCAT基因表达量的影响 Fig. 6 Effects of manganese on expression level of MnCAT gene in adult worker bee body |
由图 7可知,7日龄时,100 mg/kg锰添加组成年工蜂体内精氨酸酶基因的表达量显著高于150、200 mg/kg锰添加组(P < 0.05),但与对照组差异不显著(P>0.05);14日龄时,150 mg/kg锰添加组成年工蜂体内精氨酸酶基因的表达量显著高于对照组和200 mg/kg锰添加组(P < 0.05);21日龄时,200 mg/kg锰添加组成年工蜂体内精氨酸酶基因的表达量显著高于对照组和50、100 mg/kg锰添加组(P < 0.05)。
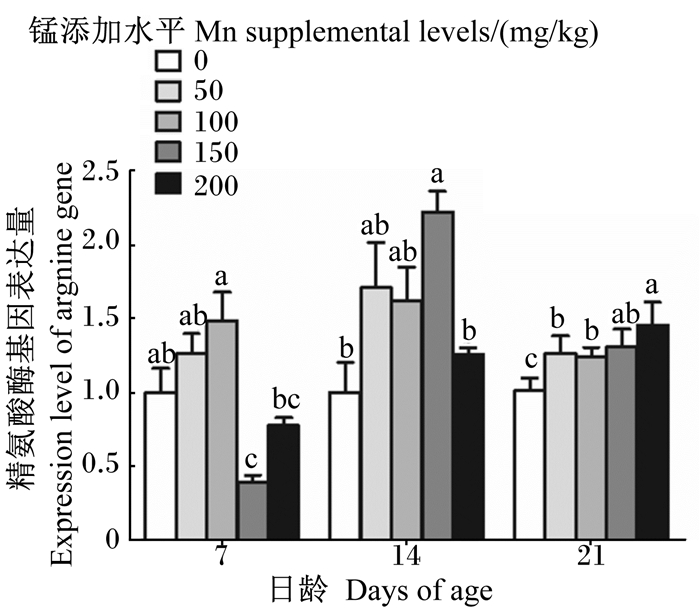
|
图 7 锰对成年工蜂体内精氨酸酶基因表达量的影响 Fig. 7 Effects of manganese on expression level of argnine gene in adult worker bee body |
已有氧化损伤理论证实动物机体自由基和活性氧类通过损伤蛋白质、脂质和DNA等生物大分子造成细胞损伤,动物无法修复,将会导致动物衰老[11]。有研究表明,给蜜蜂补充抗氧化剂,能够提高蜜蜂的抗氧化能力,降低自由基引发的损伤,从而延长蜜蜂寿命[12]。本试验结果表明,饲粮中锰添加水平为100 mg/kg时,能够满足成年工蜂维持基本生命活动的需要,最大地延长蜜蜂寿命。这可能是因为饲粮中添加适量的锰可提高各含锰抗氧化酶的活性,从而提高了机体的抗氧化能力,进而延长了蜜蜂的寿命。但是,相关研究表明饲粮中矿物质添加水平过高时,会严重损伤蜜蜂的围食膜结构,导致围食膜破裂,缩短蜜蜂的寿命[13],这也与本试验结果一致。
3.2 锰影响成年工蜂体内锰含量饲粮中的锰被蜜蜂消化后,将会经过其围食膜,通过主动吸收方式进入消化道细胞,通过Malvolio基因编码的一种Mn2+转运蛋白进行转运[14]。本试验结果表明,在成年工蜂饲粮中补充微量元素锰,将会导致蜜蜂体内锰含量显著增加,说明蜜蜂消化细胞内的锰含量受饲粮中锰添加水平的影响,在没有达到蜜蜂吸收极限时,随着饲粮中锰添加水平的升高,蜜蜂消化道细胞会吸收更多的锰元素。这与在牙鲆幼鱼上的研究结果[15]相似,即提高牙鲆幼鱼饲料中锰的添加水平,牙鲆幼鱼肌肉和骨骼中锰的含量会显著升高。
3.3 饲粮中补充适量锰可提高成年工蜂的抗氧化能力超氧化物歧化酶(SOD)活性的高低反映了机体清除超氧阴离子自由基(O2-·)的能力,即SOD活性越高,机体清除O2-·的能力越强[16]。迄今为止,已发现3种SOD,第1种是含Cu2+、Zn2+的铜锌超氧化物歧化酶(CuZnSOD),在真核生物的胞浆中均有发现[17];第2种是含Mn2+的MnSOD,主要存在于真核生物及原核生物的线粒体中;第3种是含Fe2+的铁超氧化物歧化酶(FeSOD),主要存在于原核生物中[18]。线粒体越多的组织中锰含量越丰富[19],这些组织正是摄取锰的重要部位,而MnSOD也正好存在于线粒体的内膜基质中。MnSOD的主要功能是催化细胞代谢产生的O2-·,将其歧化成过氧化氢(H2O2),从而维持线粒体等亚细胞器膜的完整性和正常功能[20]。研究发现动物饲粮中锰的添加水平直接影响体内MnSOD的活性[21]。
在饲料中锰含量对方格星虫稚虫抗氧化酶活性影响的研究中发现,饲料中锰含量对方格星虫稚虫体腔液中MnSOD活性有显著影响,当饲料中锰添加水平为28.67 mg/kg时,方格星虫稚虫体腔液中MnSOD活性最高,但锰添加水平过高时方格星虫稚虫体腔液中MnSOD活性则会减弱[22]。本研究与上述研究结果相似,随着饲粮中锰添加水平的升高,7和14日龄成年工蜂体内MnSOD活性总体呈先升高后下降的趋势,且均在锰添加水平为150 mg/kg时有最高值。分析其原因可能是,成年工蜂从对照组饲粮中吸收的锰较少,锰的减少会使MnSOD结构不稳定,锰作为MnSOD的活性中心的作用减弱,从而使MnSOD的活性降低[23]。当成年工蜂摄入适量的锰时,会加强体内脂质过氧化作用,使这一过程的产物丙二醛(MDA)含量升高,机体的内自稳机制使成年工蜂体内抗氧化作用代偿性加强,锰充分发挥作为MnSOD活性中心的作用,体内MnSOD活性升高。
生物体内存在的过氧化氢酶(CAT)可分解蜜蜂体内歧化反应所积存的H2O2(2H2O2→O2+2H2O),减少体内生化代谢所生成的有害物质。目前已知的CAT有2类:一类含血红素基(heme);另一类不含血红素基(nonheme),但含有锰,称为MnCAT[24]。人工饲粮育蚕比桑叶育蚕的CAT活性高2%~10%,说明不同饲粮对CAT活性有一定的影响[25]。本试验结果显示,饲粮中锰添加水平对成年工蜂体内MnCAT活性有显著影响,7日龄成年工蜂体内MnCAT活性在锰添加水平为150 mg/kg时达到最高,14日龄成年工蜂体内MnCAT活性在锰添加水平为100 mg/kg时达到最高,21日龄成年工蜂体内MnCAT活性在锰添加水平为200 mg/kg时达到最高。这可能是成年工蜂从饲粮中吸收适量的锰,而锰作为MnCAT活性中心[24],促进了MnCAT的合成,所以MnCAT活性提高。然而,成年工蜂从饲粮中吸收过量的锰会影响蜜蜂对其他矿物元素的吸收,破坏蜜蜂内环境平衡,最终造成MnCAT活性下降。
3.4 饲粮中补充适量锰可增强成年工蜂的免疫性能精氨酸能够促进动物蛋白质合成,提高动物机体免疫功能[26]。在昆虫营养中,精氨酸是一种必需氨基酸,大多养殖者都会在昆虫的人工饲粮中补充精氨酸[27]。动物食入的精氨酸,经消化系统吸收后,参与体内的氨基酸代谢,构成体内所需的蛋白质[28]。有研究表明,精氨酸酶在蓖麻蚕和家蚕精氨酸分解代谢中有重要作用[29]。本研究结果显示,7、14、21日龄成年工蜂体内精氨酸酶活性均呈现先上升后下降的趋势。这可能是成年工蜂从饲粮中吸收适量的锰,而锰作为精氨酸酶的组成成分[2],促进了精氨酸酶的合成,所以精氨酸酶活性提高。然而,成年工蜂从饲粮中吸收过量的锰会破坏蜜蜂体内的矿物质平衡,最终造成精氨酸酶活性下降,但蜜蜂体内的具体生化反应过程还需进一步探讨。
3.5 锰影响成年工蜂体内锰相关基因表达酶相关基因的表达量和翻译后的剪切修饰影响酶活性的高低,锰能够影响机体的锰依赖性酶,该类酶可调节DNA和RNA的合成与分解,进而影响基因的表达量和翻译后的剪切修饰[30],从而影响该酶的活性。MnSOD活性与MnSOD基因的表达量密切相关,成年工蜂体内MnSOD活性与其MnSOD基因表达量受到饲粮中锰添加水平的影响,锰相关酶基因表达量与锰相关酶活性呈正相关关系,成年工蜂体内MnSOD活性出现与MnSOD基因表达量相同的变化趋势,150 mg/kg锰添加组成年蜜蜂体内MnSOD基因表达量最高时,MnSOD活性也达到最高。这可能是由于饲粮中添加适量的锰使成年工蜂体内MnSOD基因的表达量升高,造成MnSOD活性增高,最终表现出酶相关基因表达量与酶活性一致的效果,说明锰对于蜜蜂MnSOD基因表达量的影响与锰对MnSOD活性的影响有一致的作用。同样,饲粮添加适量的锰也会使成年工蜂体内MnCAT基因表达量升高。例如,14日龄成年工蜂体内MnCAT基因表达量表现出MnCAT活性相同的变化趋势,100 mg/kg锰添加组成年工蜂体内MnCAT基因表达量最高时,MnCAT活性也达到最高。这可能是由于糖浆饲粮中缺少锰元素,适量的补充锰元素,蜜蜂吸收锰后会促进MnCAT基因表达,造成MnCAT活性增加。但补充过量的锰,则会下调该基因的表达,降低MnCAT活性。本研究结果还显示,随着饲粮中锰添加水平的升高,7和14日龄成年工蜂体内精氨酸酶基因的表达量总体上表现为先升高后下降,可能是由于糖浆饲粮中缺少锰元素,适量的补充锰元素,蜜蜂吸收锰后会促进精氨酸酶基因表达,但补充过量的锰,会造成蜜蜂体内矿物元素不平衡,营养失调,导致内环境紊乱,则会下调该基因的表达,降低精氨酸酶活性。
4 结论饲粮中补充适量的锰能延长意大利蜜蜂成年工蜂的寿命,提高机体抗氧化能力、免疫能力等生理机能。
| [1] |
王荫长. 昆虫生理学[M]. 北京: 中国农业出版社, 2004: 65.
|
| [2] |
井明艳, 孙建义, 许梓荣. 锰的生物学功能及有机态锰的应用研究[J]. 饲料博览, 2004(1): 7-9. DOI:10.3969/j.issn.1001-0084.2004.01.003 |
| [3] |
张景涛, 任海英, 戚融冰. 锰在家禽生产中的应用[J]. 饲料博览, 2004(12): 34-36. DOI:10.3969/j.issn.1001-0084.2004.12.021 |
| [4] |
曾志将, 周利华. 油茶蜜的成分分析[J]. 养蜂科技, 1997(2): 24. |
| [5] |
SILVA L R, VIDEIRA R, MONTEIRO A P, et al. Honey from Luso region (Portugal):physicochemical characteristics and mineral contents[J]. Microchemical Journal, 2009, 93(1): 73-77. DOI:10.1016/j.microc.2009.05.005 |
| [6] |
曾志将, 谢国秀, 樊兆斌. 蜜蜂花粉中矿物质元素形态研究[J]. 蜜蜂杂志, 2004(8): 3-4. DOI:10.3969/j.issn.1003-9139.2004.08.001 |
| [7] |
邓子龙, 付桂明, 谢明勇, 等. 雄蜂蜂体主要营养成分分析与评价[J]. 食品科学, 2008, 29(9): 560-563. DOI:10.3321/j.issn:1002-6630.2008.09.134 |
| [8] |
徐景耀, 庄元忠. 蜜蜂花粉研究与利用[M]. 北京: 中国医药科技出版社, 1991.
|
| [9] |
冯建东, 李雨来. 锰的生理功能及应用与一起猪锰缺乏症的诊治[J]. 养殖技术顾问, 2011(1): 145. DOI:10.3969/j.issn.1673-1921.2011.01.145 |
| [10] |
KUTERBACH D A, WALCOTT B, REEDER R J, et al. Iron-containing cells in the honey bee (Apis mellifera)[J]. Journal of Experimental Biology, 1982, 218(4573): 695-697. |
| [11] |
吴奇, 朱晨星, 樊晓兰, 等. 抗氧化剂与延长寿命的相关性研究进展[J]. 中国药理学与毒理学杂志, 2016, 30(5): 588-597. DOI:10.3867/j.issn.1000-3002.2016.05.017 |
| [12] |
RASCN B, HUBBARD B P, SINCLAIR D A, et al. The lifespan extension effects of resveratrol are conserved in the honey bee and may be driven by a mechanism related to caloric restriction[J]. Aging, 2012, 4(7): 499-508. DOI:10.18632/aging.100474 |
| [13] |
田学军. 蜜蜂食物矿物质成分分析[J]. 昆虫知识, 1994, 31(3): 173-175. |
| [14] |
BEN-SHAHAR Y, DUDEK N L, ROBINSON G E. Phenotypic deconstruction reveals involvement of manganese transporter malvolio in honey bee division of labor[J]. Journal of Experimental Biology, 2004, 207(19): 3281-3288. DOI:10.1242/jeb.01151 |
| [15] |
魏万权, 李爱杰, 李德尚. 牙鲆幼鱼饲料中锰、钴适宜添加量的初步研究[J]. 浙江海洋学院学报(自然科学版), 2001, 20(增刊): 83-87. |
| [16] |
张俊艳, 贺阳. 超氧化物歧化酶研究与应用[J]. 食品工业, 2012(3): 119-122. |
| [17] |
潘玉武, 史祝延, 王兆宏. 超氧化物歧化酶的测定及临床应用[J]. 哈尔滨医药, 1995, 15(4): 81-82. |
| [18] |
王宁, 王秋英, 张小培, 等. 大鼠急性羰基镍中毒肺脏SOD活性及Cu-Zn SOD基因表达的实验观察[J]. 毒理学杂志, 2011, 25(3): 180-183. |
| [19] |
唐洪鹏, 徐世文, 林洪金.亚慢性锰中毒对公鸡肝脏的毒性作用[C]//中国畜牧兽医学会家畜内科学分会2009年学术研讨会论文集.青岛: 中国畜牧兽医学会, 2009.
|
| [20] |
李素芬.有机锰源的化学特性及其对肉仔鸡的相对生物学利用率研究[D].博士学位论文.北京: 中国农业科学院, 2002. http://cdmd.cnki.com.cn/Article/CDMD-82101-2002120379.htm
|
| [21] |
FRIDOVICH I. Superoxide dismutases[J]. Annual review of biochemistry, 1975, 44(1): 147-159. DOI:10.1146/annurev.bi.44.070175.001051 |
| [22] |
许明珠, 张琴, 童潼, 等. 饲料中锰含量对方格星虫稚虫生长性能、体成分、体腔液中锰超氧化物歧化酶活性及组织锰含量的影响[J]. 动物营养学报, 2015, 27(10): 3077-3083. DOI:10.3969/j.issn.1006-267x.2015.10.012 |
| [23] |
王宏伟, 曹向可, 钱庆增, 等. 饲料中锰对日本沼虾抗氧化酶活性的影响[J]. 河北大学学报(自然科学版), 2008, 28(3): 300-304. DOI:10.3969/j.issn.1000-1565.2008.03.019 |
| [24] |
CORONA M, ROBINSON G E. Genes of the antioxidant system of the honey bee:annotation and phylogeny[J]. Insect Molecular Biology, 2006, 15(5): 687-701. DOI:10.1111/j.1365-2583.2006.00695.x |
| [25] |
张闻, 罗勤慧. 锰过氧化氢酶及其模型物研究进展[J]. 化学通报, 2000, 63(10): 7-14. DOI:10.3969/j.issn.0441-3776.2000.10.002 |
| [26] |
叶婷, 田科雄. 精氨酸对机体免疫系统的影响及相关机理[J]. 饲料博览, 2010(7): 11-14. DOI:10.3969/j.issn.1001-0084.2010.07.004 |
| [27] |
DADD R H. Insect nutrition:current developments and metabolic implications[J]. Annual Review of Entomology, 2003, 18: 381-420. |
| [28] |
CANDY D J, KILBY B A. Insect biochemistry and function[M]. London: Chapman and Hall, 1975.
|
| [29] |
许廷森, 朱菊红, 林浩, 等. 蚕氨基酸代谢的研究:精氨酸酶、鸟氨酸-δ转氨酶和支链氨基酸转氨酶[J]. 昆虫学报, 1980, 23(1): 1-8. |
| [30] |
EISLER R. Tin hazards to fish, wildlife, and invertebrates:a synoptic review[J]. Contaminant Hazard Reviews, 1989, 85(25): 1-15. |




