2. 河南省食品加工与流通安全控制工程技术研究中心, 郑州 450002
2. Henan Engineering and Technology Research Center of Safety Control of Food Processing and Circulation, Zhengzhou 450002, China
铅在自然界分布范围广,作为一种重金属元素,能够造成中枢和外周神经系统、造血系统、心血管系统、肾脏、肝脏和生殖系统等发生多种生理、生物化学和行为功能障碍[1]。肝脏在体内起着抗氧化、清除自由基、维持机体正常代谢、维持全身脂质平衡等功能,并且具有强大的解毒作用,但是容易受到活性氧(ROS)的损伤[2-3]。
有研究表明,肝细胞在铅的作用下会生成大量自由基和ROS[4],ROS会参与肝纤维化反应,参与肝缺血再灌注、坏死和凋亡,这些修饰导致基因表达改变而造成肝损伤[5]。铅对肝脏产生毒性作用的另一个重要机制就是引起氧化应激和脂质过氧化(LP)[6]。核因子E2相关因子(Nrf2)是与氧化应激相关的转录因子,能与抗氧化反应元件(ARAS)协调结合,发挥抗氧化作用,而且可以诱导一种重要的抗氧化酶——血红素氧合酶-1(HO-1)转录,减少氧化应激损伤,从而维持氧化还原平衡[7-8]。脂质过氧化的主要表现被认为是还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)含量或活性的变化。
叶酸作为一种水溶性维生素,属于抗氧化剂的一种,在机体内可以提高内源性抗氧化酶活性,清除自由基[9]。本试验通过测定肝脏SOD、GSH、MDA、GSH-Px含量或活性以及Nrf2及HO-1蛋白表达的变化来探究叶酸对铅暴露大鼠肝脏氧化损伤的影响,以便进一步研究叶酸对铅暴露大鼠各组织脏器功能的影响。
1 材料与方法 1.1 试验材料醋酸铅,北京化工厂产品;叶酸,纯度>96%,Abcam公司产品。
1.2 试验方法 1.2.1 动物分组与铅暴露模型建立选择2月龄无特定病原体(SPF)级SD雄性大鼠[购自河南省实验动物中心,合格证号:SYXK(豫)2018-0005]40只,体质量180~220 g,将大鼠置于温度为18~22 ℃、相对湿度为50%~60%、光照与黑暗分别为12 h的清洁无菌的环境下进行饲养(所喂饲粮为河南省实验动物中心提供的辐照灭菌颗粒饲料)。将40只大鼠随机平均分为4组(n=10),进行如下处理:对照组,自由饮水+灌胃1 mL去离子水;染铅组,自由饮0.2%的醋酸铅溶液+灌胃1 mL去离子水;干预组,自由饮0.2%的醋酸铅溶液+灌胃1 mL叶酸悬浊液(按照0.4 mg/kg BW叶酸的剂量配制);叶酸组,自由饮水+灌胃1 mL叶酸悬浊液(按照0.4 mg/kg BW叶酸的剂量配制)。根据大鼠体重,将叶酸称重后溶于去离子水中制成悬浊液,现用现配,避光保存,每天15:00—17:00灌胃,灌胃前摇匀,每天1次,连续灌胃14 d。
1.2.2 样品采集试验结束后,采用10%的水合氯醛1~2 mL腹腔注射将大鼠麻醉,腹部朝上固定完成后进行解剖,首先静脉采血,然后取出肝脏,将组织放在装有预冷生理盐水的无菌培养皿中,冲洗称重后将其置于无菌冻存管中,于-80 ℃的冰箱冻存。每组随机挑选1只健康大鼠,在冰上取出肝脏后,放入4%多聚甲醛溶液中固定。
1.2.3 血清中铅含量(血铅含量)的测定将采集好的血液在4 ℃、3 500 r/min下离心10 min分离血清。血清经消化后用Z-5000石墨炉原子吸收光谱仪(日本日立公司)测定血铅含量,参数设定如下:波长283.3 nm,通带0.5 nm,灯电流9 mA,95 ℃ 15 s,105 ℃ 15 s,800 ℃ 15 s,2 500 ℃ 3 s。
1.2.4 肝脏氧化损伤指标的测定按照大鼠组织重量(g) : 0.86%的生理盐水体积(mL)=1 : 9的比例制备10%组织匀浆,将制备好的10%组织匀浆在冰水浴条件下进行机械匀浆,采用4 000 r/min,4 ℃下离心10 min,将离心好的组织匀浆弃下部沉淀,根据试验的需要,取适量上清液用生理盐水稀释成合适的浓度进行测定。
采用南京建成生物工程研究所生产的相应试剂盒测定肝脏中SOD(WST-1法)、GSH-Px(比色法)活性与GSH(分光光度法)、MDA[硫代巴比妥酸(TBA)法]含量。
1.2.5 肝脏Nrf2及HO-1蛋白表达的测定将用4%多聚甲醛溶液固定好的肝脏组织包埋切片后,通过二甲苯脱蜡和梯度酒精脱水后,消除内源性过氧化物酶活性;再用0.01 mol/L柠檬酸三钠溶液(pH=6.0)微波炉抗原热修复10 min,冷却,0.01 mol/L磷酸盐缓冲液(PBS,pH=7.2~7.4)洗涤以后,10%血清封闭30 min,甩干,分别加一抗(鼠单克隆一抗HO-1和Nrf2,稀释倍数为1 : 200,Cell Signaling Technology公司)过夜;甩去一抗,PBS冲洗,甩干,加二抗[辣根过氧化物酶(HRP)标记羊抗鼠抗体,稀释倍数为1 : 1 000,Cell Signaling Technology公司],湿盒孵育2 h,二氨基苯联胺(DAB)显色,苏木素复染,冲洗返蓝,常规脱水,透明,封片,最后镜检拍照。光镜下观察,棕色颗粒染色表示待测蛋白呈阳性。
1.3 数据统计与分析采用Image Pro plus图像处理软件处理免疫组织化学染色图片和半定量分析,采用SPSS 23.0软件的单因素方差分析程序处理数据,以P < 0.05表示差异显著。数据用平均值±标准差表示。
2 结果与分析 2.1 叶酸对铅暴露大鼠血铅含量的影响由表 1可知,与对照组相比,染铅组和干预组血铅含量均显著升高(P < 0.05),叶酸组血铅含量则有所下降但差异不具有统计学意义(P>0.05);与染铅组相比,干预组血铅含量有所下降但差异不具有统计学意义(P>0.05),叶酸组血铅含量则显著降低(P < 0.05)。
|
|
表 1 叶酸对铅暴露大鼠血铅含量的影响 Table 1 Effects of folic acid on serum lead content of lead-exposed rats (n=10) |
由表 2可知,与对照组相比较,染铅组肝脏中GSH、MDA含量及GSH-Px活性均存在显著差异(P < 0.05),其中GSH含量和GSH-Px活性显著降低(P < 0.05),MDA含量显著增加(P < 0.05);染铅组肝脏中SOD活性虽有所降低但差异不具有统计学意义(P>0.05)。与染铅组相比,干预组肝脏中MDA含量显著降低(P < 0.05),GSH含量及SOD、GSH-Px活性虽均有所增加但差异不具有统计学意义(P>0.05);与对照组相比,干预组肝脏中GSH含量、SOD活性有所降低但差异不具有统计学意义(P>0.05),GSH-Px活性显著降低(P < 0.05),MDA含量略有增加但差异不具有统计学意义(P>0.05)。与对照组相比,叶酸组肝脏中GSH-Px活性显著增加(P < 0.05),MDA含量显著降低(P < 0.05),GSH含量、SOD活性略有增加但差异不具有统计学意义(P>0.05)。
|
|
表 2 叶酸对铅暴露大鼠肝脏中SOD、GSH-Px活性与GSH、MDA含量的影响 Table 2 Effects of folic acid on SOD, GSH-Px activities and GSH, MDA contents in liver of lead-exposed rats (n=10) |
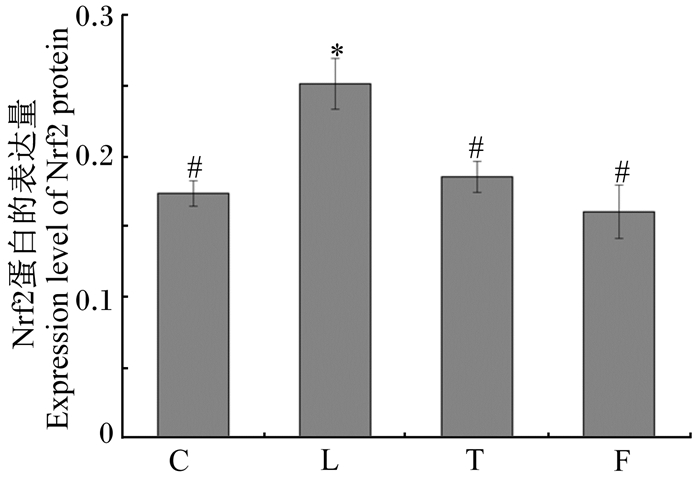
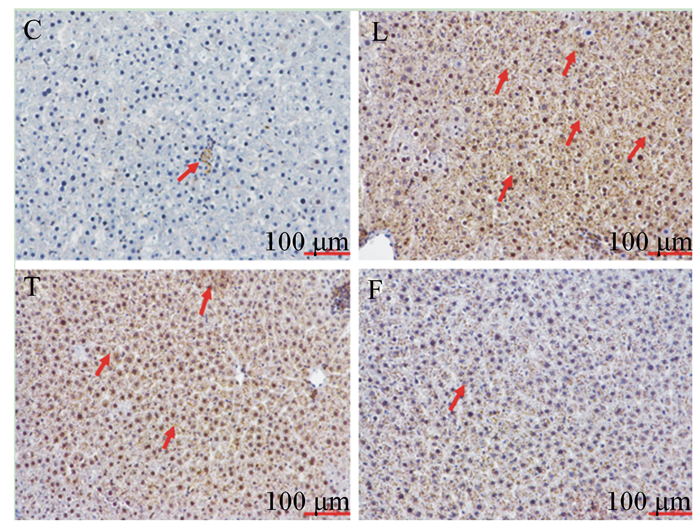
图 1表示肝脏中Nrf2蛋白表达的免疫组织化学结果,棕色颗粒为阳性蛋白表达。由图可知,与对照组相比,染铅组、干预组棕色颗粒明显增多,说明Nrf2蛋白表达量提高,但干预组与染铅组相比棕色颗粒明显减少。叶酸组棕色颗粒与对照组相比没有明显变化,与干预组相比明显减少。根据肝脏中Nrf2蛋白表达定量结果(图 3)可知,与对照组相比,染铅组肝脏中Nrf2蛋白的表达量显著升高(P < 0.05),叶酸组肝脏中Nrf2蛋白的表达量有所减少但差异不具有统计学意义(P>0.05);干预组肝脏中Nrf2蛋白的表达量与染铅组相比显著降低(P < 0.05),与对照组相比略有增加,但差异不具有统计学意义(P>0.05)。

|
C:对照组control group;L:染铅组lead-exposed group;T:干预组intervention group;F:叶酸组folic acid group。下图同The same as below。 图 1 各组肝脏中Nrf2蛋白的免疫组织化学染色 Fig. 1 Immunohistochemical staining of Nrf2 protein in liver of each group (200×) |
|
*表示与对照组相比差异显著(P < 0.05),#表示与染铅组相比差异显著(P < 0.05)。图 3同。 * mean significant difference compared with the control group (P < 0.05), # mean significant difference compared with the lead-exposed group (P < 0.05). The same as Fig. 3. 图 2 各组肝脏中Nrf2蛋白的表达量(以阳性蛋白平均积分光密度值表示) Fig. 2 Expression level of Nrf2 protein in liver of each group (expressed as the average integrated optical density value of the positive protein) |
|
图 3 各组肝脏中HO-1蛋白的免疫组织化学染色 Fig. 3 Immunohistochemical staining of HO-1 protein in liver of each group (200×). |
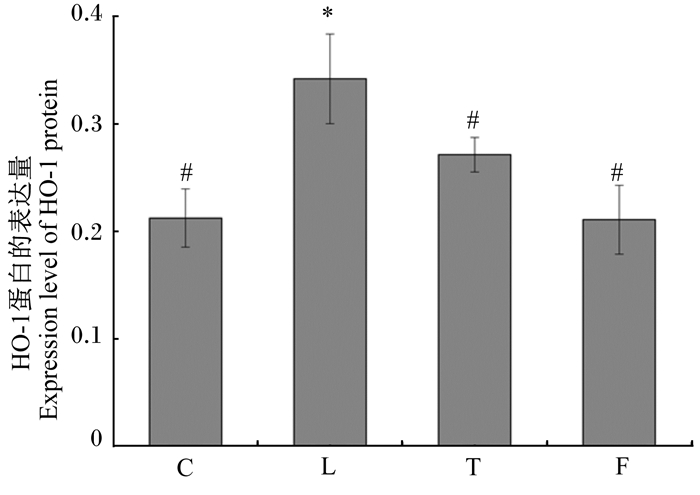
图 3表示肝脏中HO-1蛋白表达的免疫组织化学结果,棕色颗粒为阳性蛋白表达。由图可知,与Nrf2蛋白的表达类似,染铅组、干预组与对照组相比棕色颗粒明显增加,说明HO-1蛋白表达量提高,但干预组与染铅组相比有所减少。与对照组相比,叶酸组中棕色颗粒无明显变化,但与干预组相比明显减少。根据肝脏中HO-1蛋白表达定量结果(图 4)可知,染铅组肝脏中HO-1蛋白的表达量与对照组相比显著升高(P < 0.05);干预组肝脏中HO-1蛋白的表达量与染铅组相比显著降低(P < 0.05),与对照组相比有所增加,但差异不具有统计学意义(P>0.05);叶酸组肝脏中HO-1蛋白的表达量与对照组相比有所增加,但差异不具有统计学意义(P>0.05)。
|
图 4 各组肝脏中HO-1蛋白的表达量(以阳性蛋白平均积分光密度值表示) Fig. 4 Expression level of HO-1 protein in liver of each group (expressed as the average integrated optical density value of the positive protein) |
已有研究表明,铅对很多器官和组织均有毒性,会造成认知、运动、协调、视觉等障碍[10-11],影响体内的非酶抗氧化系统和酶抗氧化系统。一方面,铅能够抑制大鼠肝脏中GSH的含量和SOD、GSH-Px的活性,同时加快自由基和ROS的产生,促进大鼠肝脏中的脂质过氧化进程,使得大量的MDA生成[12]。另一方面,铅暴露使ROS增加,破坏机体内氧化还原平衡,促使作为细胞氧化还原状态的传感器——Nrf2释放到细胞核中,以激活细胞保护基因的转录[13]。HO-1是抵抗细胞氧化损伤的重要防御酶,其表达受Nrf2/抗氧化反应元件(ARE)信号传导控制,与谷胱甘肽GSH、SOD、GSH-Px等形成了一道机体内抗氧化防线[14]。
叶酸又称维生素B9,有较强的抗氧化能力。有研究表明,叶酸不仅能够通过降低机体内血浆同型半胱氨酸的含量来改善脂质过氧化水平,清除体内的自由基和超氧阴离子,而且它还作为一种营养因子保护神经系统,能够通过降低核因子-κB(NF-κB)、白细胞介素-1β(IL-1β)的生成和脂质过氧化介导的细胞损伤,对醋酸铅所致的肝脏毒性有保护作用[15]。Alférez等[16]研究表明,在过量牛奶导致的肝细胞损伤中,叶酸能够保护细胞免受自由基损伤,提高抗氧化酶的活性和限制脂质过氧化。本研究结果显示,铅暴露造成肝脏中MDA含量上升,SOD活性和GSH含量下降,Nrf2和HO-1蛋白的表达量显著上升,证明当肝细胞发生氧化损伤时,为了保持细胞的氧化还原平衡,避免有害的氧化条件,相关指标的变化作为氧化应激的信号激活了由Nrf2组成的内源性防御途径,进而激活HO-1蛋白的表达,增强抗氧化防御,减轻氧化应激造成的机体损伤[17-18];叶酸干预后,Nrf2和HO-1蛋白的表达量与染铅组相比显著减少,与对照组相比没有显著差异。Nrf2、HO-1在机体健康情况下都处于低水平表达,只有在机体受到外界刺激发生氧化损伤时Nrf2、HO-1才会大量表达来抑制氧化损伤的发生,上述结果表明叶酸对铅诱导的大鼠肝脏氧化损伤能够起到保护作用。
4 结论叶酸对铅暴露大鼠的肝脏氧化损伤有一定程度的保护作用。
| [1] |
MATOVIĆ V, BUHA A, DUKIĆ-ĆOSIĆ D, et al. Insight into the oxidative stress induced by lead and/or cadmium in blood, liver and kidneys[J]. Food and Chemical Toxicology, 2015, 78: 130-140. DOI:10.1016/j.fct.2015.02.011 |
| [2] |
赵志行.醋酸铅对母鼠生长发育和主要脏器毒性作用的研究[D].硕士学位论文.郑州: 河南农业大学, 2017.
|
| [3] |
SIENER R. Dietary treatment of metabolic acidosis in chronic kidney disease[J]. Nutrients, 2018, 10(4): 512. DOI:10.3390/nu10040512 |
| [4] |
梁建成, 邓树嵩, 马迎教, 等. 铅对小鼠肝脏超氧化物歧化酶活性及CuZn-SOD mRNA表达的影响[J]. 现代预防医学, 2011, 38(7): 1220-1222. |
| [5] |
FARZAEI M H, ZOBEIRI M, PARVIZI F, et al. Curcumin in liver diseases:a systematic review of the cellular mechanisms of oxidative stress and clinical perspective[J]. Nutrients, 2018, 10(7): 855. DOI:10.3390/nu10070855 |
| [6] |
WANG J C, ZHU H L, YANG Z J, et al. Antioxidative effects of hesperetin against lead acetate-induced oxidative stress in rats[J]. Indian Journal of Pharmacology, 2013, 45(4): 395. DOI:10.4103/0253-7613.115015 |
| [7] |
CUI Y J, AMARSANAA K, LEE J H, et al. Neuroprotective mechanisms of dieckol against glutamate toxicity through reactive oxygen species scavenging and nuclear factor-like 2/heme oxygenase-1 pathway[J]. The Korean Journal of Physiology & Pharmacology, 2019, 23(2): 121-130. |
| [8] |
FAN J H, LV H, LI J, et al. Roles of Nrf2/HO-1 and HIF-1α/VEGF in lung tissue injury and repair following cerebral ischemia/reperfusion injury[J]. Journal of Cellular Physiology, 2019, 234(6): 7695-7707. DOI:10.1002/jcp.27767 |
| [9] |
权福实, 钟原, 孙权, 等. 叶酸对铅中毒幼年大鼠中枢神经系统的保护作用[J]. 中国兽医学报, 2012, 32(12): 1882-1885. |
| [10] |
QUAN F S, YU X F, GAO Y, et al. Protective effects of folic acid against central nervous system neurotoxicity induced by lead exposure in rat pups[J]. Genetics and Molecular Research, 2015, 14(4): 12466-12471. DOI:10.4238/2015.October.16.13 |
| [11] |
SUN H L, WANG N J, NIE X M, et al. Lead exposure induces weight gain in adult rats, accompanied by DNA hypermethylation[J]. PLoS One, 2017, 12(1): e0169958. DOI:10.1371/journal.pone.0169958 |
| [12] |
RAHMAN S, SULTANA S. Chemopreventive activity of glycyrrhizin on lead acetate mediated hepatic oxidative stress and its hyperproliferative activity in Wistar rats[J]. Chemico-Biological Interactions, 2006, 160(1): 61-69. DOI:10.1016/j.cbi.2005.12.003 |
| [13] |
ZHANG C, WANG N, XU Y, et al. Molecular mechanisms involved in oxidative stress-associated liver injury induced by Chinese herbal medicine:an experimental evidence-based literature review and network pharmacology study[J]. International Journal of Molecular Sciences, 2018, 19(9): 2745. DOI:10.3390/ijms19092745 |
| [14] |
PARK J S, LEEM Y H, PARK J E, et al. Neuroprotective effect of β-lapachone in MPTP-induced Parkinson's disease mouse model:involvement of astroglial p-AMPK/Nrf2/HO-1 signaling pathways[J]. Biomolecules & Therapeutics, 2019, 27(2): 178-184. |
| [15] |
ALLAH E S H A, BADARY D M. Folic acid protects against lead acetate-induced hepatotoxicity by decreasing NF-κB, IL-1β production and lipid peroxidation mediataed cell injury[J]. Pathophysiology, 2017, 24(1): 39-44. DOI:10.1016/j.pathophys.2017.02.002 |
| [16] |
ALFÉREZ M J M, RIVAS E, DÍAZ-CASTRO J, et al. Folic acid supplemented goat milk has beneficial effects on hepatic physiology, haematological status and antioxidant defence during chronic Fe repletion[J]. Journal of Dairy Research, 2015, 82(1): 86-94. DOI:10.1017/S0022029914000624 |
| [17] |
HAFEZ H M, IBRAHIM M A, ZEDAN M Z, et al. Nephroprotective effect of cilostazol and verapamil against thioacetamide-induced toxicity in rats may involve Nrf2/HO-1/NQO-1 signaling pathway[J]. Toxicology Mechanisms and Methods, 2019, 29(2): 146-152. DOI:10.1080/15376516.2018.1528648 |
| [18] |
ALHAITHLOUL H A S, ALOTAIBI M F, BIN-JUMAH M, et al. Olea europaea leaf extract up-regulates Nrf2/ARE/HO-1 signaling and attenuates cyclophosphamide-induced oxidative stress, inflammation and apoptosis in rat kidney[J]. Biomedicine & Pharmacotherapy, 2019, 111: 676-685. |



