山梨酸,化学名为2, 4-己二烯酸,是一种共轭双烯键不饱和脂肪酸。由于含有不饱和共轭双烯键,因此作为防腐剂和保鲜剂被广泛应用于食品生产中[1-2]。近年来,山梨酸作为饲料添加剂酸化剂的主要成分,在动物养殖生产中发挥了重要作用[3-4]。同时也有试验表明,饲粮中添加一定剂量的山梨酸具有促进动物的生长和改善胴体品质的作用[5-7]。
家畜的生长发育包含2个部分,骨骼的发育和肌肉的生长。幼年时骨骼的发育先于肌肉的生长[8]。成年以后,体尺性状直接反映家畜的生长和发育情况,间接反映家畜的生长性能、繁殖性能和健康状况,而体尺性状主要取决于骨骼的生长[9]。在育肥猪的养殖和选育过程中,肌肉的产量与育肥猪自身骨骼大小有密切的关系,骨骼的生长、瘦肉率和背膘厚与体重的增加呈线性相关[10]。
骨骼生长发育的过程受到许多因素的调控,而生长激素(growth hormone,GH)在调节动物生长和骨骼发育中发挥关键的作用。Kennedy等[11]研究发现,腹腔注射GH可显著增加小鼠体重和体长。大豆发酵制品可通过提高血清中GH的含量显著提高大鼠的体重和促进股骨生长板的生长,增加静止区和肥大区的细胞数量[12],而GH的上述作用都是由其靶腺-肝脏分泌的胰岛素样生长因子-Ⅰ(insulin-like growth factor-Ⅰ,IGF-Ⅰ)所介导。IGF-Ⅰ在介导GH对骨骼生长发育调控中具有重要作用,通过提高肝脏对IGF-Ⅰ的分泌可促进骨骼的生长发育。研究表明,IGF-Ⅰ缺失型小鼠(IGF-Ⅰ-/-小鼠),在18.5日龄时骨化不完全,胚胎骨架和胫骨长度均小于正常小鼠胚胎(IGF-Ⅰ+/+小鼠),胚胎表型为侏儒[13]。同时有文献表明,在断奶仔猪饲粮中添加0.5 g/kg山梨酸可显著增加血清中IGF-Ⅰ含量,提高断奶仔猪的增重,促进断奶仔猪的生长发育[14]。但是饲粮中添加山梨酸能否提高小鼠血清中IGF-Ⅰ含量和促进小鼠生长及骨骼的发育尚不清楚。因此,本试验以昆明小鼠作为研究模型,通过在昆明小鼠饲粮中添加不同剂量的山梨酸,探讨山梨酸对昆明小鼠生长性能和骨骼发育的影响,为山梨酸作为促进骨骼发育的新型添加剂用于养殖生产提供理论研究依据。
1 材料与方法 1.1 试验设计和方法选取48只3~4周龄的无特定病原体(SPF)级雌性昆明小鼠(购自广东省医学实验动物中心),按体重[(25.07±0.14) g]差异不显著(P>0.05)的原则平均分为4个组,每组4个重复,每个重复3只,每个重复在同一鼠笼中饲养。对照组饲喂基础饲粮(购自广东省医学实验动物中心),基础饲粮组成及营养水平见表 1;试验组(Ⅰ、Ⅱ、Ⅲ组)分别饲喂在基础饲粮中添加10、15和20 g/kg山梨酸的饲粮(山梨酸纯度>99%,购自天津市科密欧化学试剂有限公司),山梨酸与基础饲粮混匀后重新制粒,37 ℃烘干。小鼠在室温22~25 ℃,相对湿度65%~70%条件下饲养。试验阶段自由采食,每日记录采食量,试验期为4周。试验结束后称重。眼眶静脉采血,制备血清备用,同时屠宰取小鼠胫骨和股骨样备用。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
准确记录小鼠每日采食量,每周进行称重,计算平均日采食量(average daily food intake,ADFI)和体增重。
1.2.2 骨骼相关指标的测定骨长与骨重的测定:胫骨/股骨近端关节面和远端关节面之间的距离即为胫骨/股骨长。同一人员,使用游标卡尺测量3次,取其平均值进行统计并称其重量。
骨指数的测定[15]:取骨样去除附着的肌肉组织等,无水乙醚浸泡12 h脱脂,放置105 ℃烘干箱72 h,室温平衡24 h后称骨重。

|
生长板长度、增殖区、静止区、肥大区长度测量:取骨样放入4%多聚甲醛进行组织固定,然后放入10%乙二胺四乙酸(EDTA)脱钙液脱钙,常规制备骨组织石蜡切片5 μm,苏木精-伊红(HE)染色,光学显微镜观察组织切片,置于20倍物镜下选取5个视野拍照,用Image-Pro Plus对胫骨近端和股骨远端生长板各区域(图 1)进行形态统计[16]。
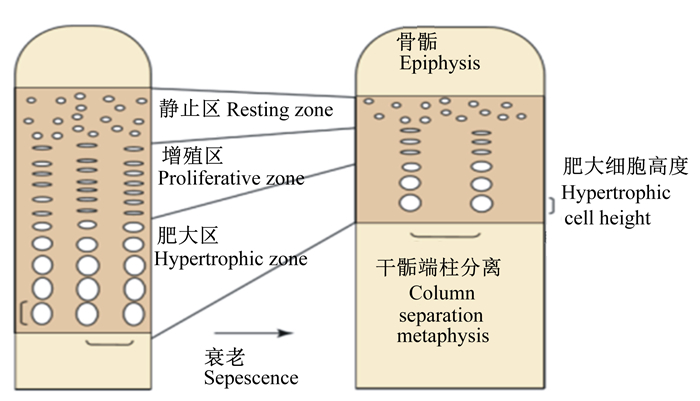
|
图 1 生长板示意图 Fig. 1 Schematic of growth plate |
血清总IGF-Ⅰ和游离IGF-Ⅰ的含量采用天津九鼎生物医学工程有限公司生产的放射性免疫试剂盒检测。血清中骨特异性碱性磷酸酶(bone-specific alkaline phosphatase,BAP)活性及骨钙素(osteocalcin,OCN)、钙含量采用南京建成生物工程研究所生产的试剂盒检测。
1.3 数据统计与分析试验数据利用SPSS 17.0软件中的单因素方差分析(one-way ANOVA)程序进行方差分析,结果以“平均值±标准误”表示,P < 0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析 2.1 饲粮中添加山梨酸对昆明小鼠生长性能的影响由表 2可知,各组的初始体重无显著差异(P>0.05)。与对照组相比,Ⅰ组的终末体重、体增重和平均日采食量无显著差异(P>0.05);Ⅱ组的终末体重、体增重和平均日采食量显著提高(P < 0.05);Ⅲ组的平均日采食量显著提高(P < 0.05),终末体重和体增重无显著差异(P>0.05)。上述结果表明,饲粮中添加15 g/kg的山梨酸可显著提高昆明小鼠的生长性能,作用效果优于饲粮中添加10和20 g/kg的山梨酸。
|
|
表 2 饲粮中添加山梨酸对小鼠生长性能的影响 Table 2 Effects of dietary sorbic acid on growth performance of mice |
骨骼HE染色结果(图 2)显示,饲粮中添加10、15和20 g/kg的山梨酸均可促进骨骼生长板的发育,提高小鼠股骨远端和胫骨近端生长板的长度,增加骨骼生长板内静止区和肥大区的长度。
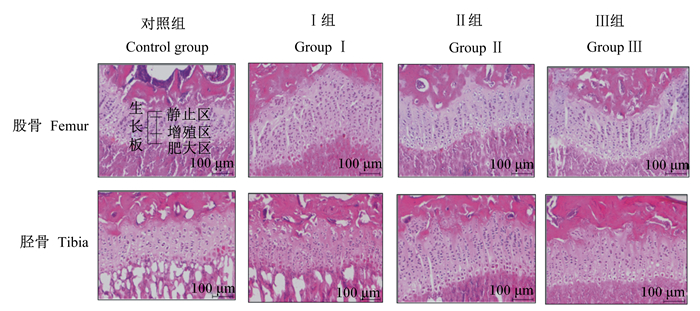
|
图 2 饲粮中添加山梨酸对小鼠股骨和胫骨生长板的影响 Fig. 2 Effects of dietary sorbic acid on growth plates of femur and tibia of mice |
由表 3可知,与对照组相比,Ⅱ组的股骨重量及生长板中静止区、肥大区长度显著提高(P < 0.05);而Ⅲ组的股骨重量及生长板中静止区、肥大区长度虽有所提高,但差异不显著(P>0.05);Ⅰ组的生长板中肥大区长度显著提高(P < 0.05)。上述结果表明,饲粮中添加山梨酸可提高小鼠股骨重量和生长板长度,对股骨的生长发育有明显促进作用。
|
|
表 3 饲粮中添加山梨酸对小鼠股骨发育的影响 Table 3 Effects of dietary sorbic acid on femur development of mice |
由表 4可知,与对照组相比,除Ⅲ组的胫骨生长板静止区的长度显著提高(P < 0.05)外,Ⅰ、Ⅱ和Ⅲ组的其他胫骨发育指标均无显著差异(P> 0.05)。上述结果表明,饲粮中添加山梨酸对小鼠胫骨的发育无明显促进作用。
|
|
表 4 饲粮中添加山梨酸对小鼠胫骨发育的影响 Table 4 Effects of dietary sorbic acid on tibia development of mice |
由表 5可知,与对照组相比,Ⅲ组血清钙含量显著提高(P < 0.05)。各组血清BAP活性及OCN、总IGF-Ⅰ、游离IGF-Ⅰ含量均无显著差异(P>0.05)。上述结果表明,饲粮中添加山梨酸对小鼠血清生化指标无明显作用。
|
|
表 5 饲粮中添加山梨酸对小鼠血清生化指标的影响 Table 5 Effects of dietary sorbic acid on serum biochemical indexes of mice |
动物早期生长过程中骨骼的快速生长发育与中、后期骨骼肌的生长发育有密切相关。骨骼的生长包括膜内成骨和软骨内成骨两大部分,躯干的骨骼主要是软骨内成骨,即通过生长板中软骨细胞的生长发育成骨[17-18]。软骨细胞体积增加是骨骼纵向生长速率的主要决定因素,静止区软骨细胞作为祖细胞在增生区产生新的软骨细胞克隆,这些克隆以列的形式排列,对骨骼纵向发育极为重要[19-20]。肥大区细胞的生长速率也与骨的纵向高度相关(相关系数为大鼠0.98、猪0.83),肥大软骨细胞被毛细血管和由骨髓分化形成的软骨细胞/破骨细胞侵入,诱导骨骼的矿化钙、磷等沉积,促进成骨的形成[21-22]。此外,钙也是维持骨骼生长的重要物质,血清中钙离子在相关激素的作用下一方面能沉积在骨中促进骨骼的钙化,增加骨骼的重量,骨重则能反映出骨骼强度的60%[23];另一方面可以促进钙离子从骨骼中游离,使骨盐不断更新[24]。
Banerjee等[25]研究表明,小鼠饲喂山梨酸可通过作用纺锤体增加小鼠骨髓细胞的有丝分裂,促进细胞的增殖和生长。本试验的研究同样发现,饲粮添加山梨酸能提高小鼠股骨生长板的长度(提高率分别为25.5%、24.9%和19.03%),且饲粮中添加15 g/kg山梨酸能显著促进小鼠的生长性能,显著提高股骨的生长板中肥大区的长度以及股骨重量,提高生长板中静止区的长度。山梨酸可促进小鼠的生长和骨骼生长板细胞的增殖与生长,这对后期骨骼的纵向生长有极重要的意义。在对评价小鼠胫骨生长发育的相关指标分析中我们发现,饲粮中添加20 mg/kg山梨酸可提高生长板静止区的长度和血清钙含量,其他剂量的山梨酸对胫骨的生长发育无显著影响。分析其中可能存在的原因是:在所有长骨中胫骨近端软骨细胞细胞周期最短,生长板的生长和成骨速率快于股骨[26-27]。在采样时小鼠接近体成熟,胫骨生长板已经开始成熟稳定并可能衰退,难以观察到山梨酸对胫骨形态学的特征。同样,王娜等[28]在脱脂鳕鱼卵对小鼠长骨的影响试验中发现了股骨生长板结构的变化,无胫骨生长板结构的变化。上述结果显示,饲粮中添加适宜剂量的山梨酸能显著促进小鼠股骨的生长发育。骨骼的生长是哺乳动物体格发育的基础,且体格的大小与体重呈正相关[29-32]。山梨酸在动物养殖生产中可促进家畜骨骼的发育,提高肌肉的生长。
饲粮中添加山梨酸对小鼠血清中骨骼发育相关代谢指标的影响目前几乎无研究,但是在哺乳动物促生长饲养试验过程中高萍等[33]发现,饲粮中添加0.2%山梨酸能显著提高断奶仔猪56和76日龄血清中IGF-Ⅰ的含量。本试验发现,饲粮中添加山梨酸对小鼠血清中IGF-Ⅰ含量无显著影响,这可能是与我们的检测时间有关。IGF-Ⅰ是GH的靶腺肝脏分泌的激素,其在血液中的含量受腺垂体分泌的GH影响,而GH的分泌量随着动物向体成熟的发育过程中逐渐减少[34]。由于骨骼发育在动物幼年时期,试验中对骨发育各项指标的检测接近于小鼠的体成熟,后期测定的血清IGF-Ⅰ含量不一定能充分反映在小鼠骨生长阶段的真实含量。此外,小鼠血液样本量极少,不能进行大量的重复检测,也对最终结果的分析存在一定的影响。同时,较少的血样限制了钙代谢相关血液指标的检测和分析,这也是小鼠作为模式动物的一个局限。
4 结论饲粮中添加一定剂量的山梨酸可以显著提高小鼠的生长性能,通过增加小鼠骨重和生长板软骨细胞的增殖,促进小鼠骨骼的生长发育。在本试验条件下,饲粮中添加15 g/kg山梨酸的效果最好。
| [1] |
王捍东, 肖功年. 山梨酸及其盐在我国食品工业应用中存在的问题及建议[J]. 安徽农业科学, 2012, 40(26): 13102-13104. DOI:10.3969/j.issn.0517-6611.2012.26.133 |
| [2] |
陈彦玲, 高丽娟, 王敬平, 等. 山梨酸的应用与制取[J]. 长春师范学院学报, 2002, 21(2): 31-34. |
| [3] |
廖阳华, 韩君. 山梨酸型高效酸化剂在断奶仔猪日粮中的应用[J]. 饲料博览, 2005(6): 46-48. DOI:10.3969/j.issn.1001-0084.2005.06.019 |
| [4] |
PIRGOZLIEV V.延胡索酸和山梨酸作为饲料添加剂在肉鸡饲养中的应用[J].王广民, 黄彪, 译.饲料与畜牧, 2009(7): 44-49.
|
| [5] |
SMITH R.山梨酸及山梨酸盐改善肉用仔鸡的性能[J].陈聪, 译.国外畜牧学(猪与禽), 1981: 45-46.
|
| [6] |
户陆女, 王松波, 朱晓彤, 等. 二甲酸钾、苯甲酸和山梨酸对黄羽肉鸡生长性能与胴体品质的影响[J]. 华南农业大学学报, 2009, 30(3): 72-75. DOI:10.3969/j.issn.1001-411X.2009.03.017 |
| [7] |
刘连燕, 方心灵. 母猪日粮中添加山梨酸对哺乳仔猪生产性能及母猪繁殖性能的影响[J]. 畜牧与兽医, 2012, 44(增刊): 127-128. |
| [8] |
王继华. 仔猪体型发育的测定[J]. 猪业科学, 2013(4): 102. DOI:10.3969/j.issn.1673-5358.2013.04.025 |
| [9] |
吴慧, 黄瑞华, 李平华, 等. RasGRP1基因多态与苏淮猪体尺性状关联分析[J]. 猪业科学, 2017, 34(1): 112-114. DOI:10.3969/j.issn.1673-5358.2017.01.044 |
| [10] |
GU Y, SCHINCKEL A P, MARTIN T G. Growth, development, and carcass composition in five genotypes of swine[J]. Journal of Animal Science, 1992, 70(6): 1719-1729. DOI:10.2527/1992.7061719x |
| [11] |
KENNEDY O D, SUN H, WU Y J, et al. Skeletal response of male mice to anabolic hormone therapy in the absence of the Igfals gene[J]. Endocrinology, 2014, 155(3): 987-999. DOI:10.1210/en.2013-1819 |
| [12] |
HWANG I S, KIM J E, LEE Y J, et al. Growth sensitivity in the epiphyseal growth plate, liver and muscle of SD rats is significantly enhanced by treatment with a fermented soybean product (cheonggukjang) through stimulation of growth hormone secretion[J]. Molecular Medicine Reports, 2014, 9(1): 166-172. DOI:10.3892/mmr.2013.1757 |
| [13] |
WANG Y M, NISHIDA S, SAKATA T, et al. Insulin-like growth factor-Ⅰ is essential for embryonic bone development[J]. Endocrinology, 2006, 147(10): 4753-4761. DOI:10.1210/en.2006-0196 |
| [14] |
LUO Z F, FANG X L, SHU G, et al. Sorbic acid improves growth performance and regulates insulin-like growth factor system gene expression in swine[J]. Journal of Animal Science, 2011, 89(8): 2356-2364. DOI:10.2527/jas.2010-3677 |
| [15] |
赵琰.蛋氨酸羟基类似物对肉鸡肠道氧化还原状态和骨骼发育的影响[D].硕士学位论文.无锡: 江南大学, 2013: 11. http://cdmd.cnki.com.cn/Article/CDMD-10295-1013309394.htm
|
| [16] |
NILSSON O, BARON J. Fundamental limits on longitudinal bone growth:growth plate senescence and epiphyseal fusion[J]. Trends in Endocrinology & Metabolism, 2004, 15(8): 370-374. |
| [17] |
NAKAO K, OSAWA K, YASODA A, et al. The Local CNP/GC-B system in growth plate is responsible for physiological endochondral bone growth[J]. Scientific Reports, 2015, 5: 10554. DOI:10.1038/srep10554 |
| [18] |
MINEGISHI Y, SAKAI Y, YAHARA Y, et al. Cyp26b1 within the growth plate regulates bone growth in juvenile mice[J]. Biochemical and Biophysical Research Communications, 2014, 454(1): 12-18. DOI:10.1016/j.bbrc.2014.10.001 |
| [19] |
NILSSON O, WEISE M, LANDMAN E B M, et al. Evidence that estrogen hastens epiphyseal fusion and cessation of longitudinal bone growth by irreversibly depleting the number of resting zone progenitor cells in female rabbits[J]. Endocrinology, 2014, 155(8): 2892-2899. DOI:10.1210/en.2013-2175 |
| [20] |
BREUR G J, VANENKEVORT B A, FARNUM C E, et al. Linear relationship between the volume of hypertrophic chondrocytes and the rate of longitudinal bone growth in growth plates[J]. Journal of Orthopaedic Research, 1991, 9(3): 348-359. DOI:10.1002/jor.1100090306 |
| [21] |
KIRSCH T, NAH H D, SHAPIRO I M, et al. Regulated production of mineralization-competent matrix vesicles in hypertrophic chondrocytes[J]. The Journal of Cell Biology, 1997, 137(5): 1149-1160. DOI:10.1083/jcb.137.5.1149 |
| [22] |
ENISHI T, YUKATA K, TAKAHASHI M, et al. Hypertrophic chondrocytes in the rabbit growth plate can proliferate and differentiate into osteogenic cells when capillary invasion is interposed by a membrane filter[J]. PLoS One, 2014, 9(8): e104638. DOI:10.1371/journal.pone.0104638 |
| [23] |
黄淑纾, 林华, 朱秀芬, 等. 骨质量与骨质疏松性骨折[J]. 中华骨质疏松和骨矿盐疾病杂志, 2012, 5(4): 285-291. DOI:10.3969/j.issn.1674-2591.2012.04.009 |
| [24] |
冯永淼.过量维生素A对肉仔鸡骨骼钙磷代谢影响及机理的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2007: 6-15. http://cdmd.cnki.com.cn/article/cdmd-10129-2007219173.htm
|
| [25] |
BANERJEE T S, GIRI A K. Effects of sorbic acid and sorbic acid-nitrite in vivo on bone marrow chromosomes of mice[J]. Toxicology Letters, 1986, 31(2): 101-106. DOI:10.1016/0378-4274(86)90002-0 |
| [26] |
RAIMANN A, JAVANMARDI A, EGERBACHER M, et al. A journey through growth plates:tracking differences in morphology and regulation between the spine and the long bones in a pig model[J]. The Spine Journal, 2017, 17(11): 1674-1684. DOI:10.1016/j.spinee.2017.06.001 |
| [27] |
WILSMAN N J, LEIFERMAN E M, FRY M, et al. Differential growth by growth plates as a function of multiple parameters of chondrocytic kinetics[J]. Journal of Orthopaedic Research, 1996, 14(6): 927-936. DOI:10.1002/jor.1100140613 |
| [28] |
王娜, 李媛媛, 戴宇峰, 等. 脱脂鳕鱼卵促进生长期小鼠长骨生长[J]. 中国海洋药物, 2018, 37(1): 40-46. |
| [29] |
王乐乐.体尺外貌表型测定在种猪生产中的应用研究[D].硕士学位论文.保定: 河北农业大学, 2015: 21. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGXJ201509001062.htm
|
| [30] |
JERLAUG-ENGER E, KONGSRO J, ØDEGÅRD J, et al. Genetic parameters between slaughter pig efficiency and growth rate of different body tissues estimated by computed tomography in live boars of Landrace and Duroc[J]. Animal, 2012, 6(1): 9-18. DOI:10.1017/S1751731111001455 |
| [31] |
HIFZAN R M, IDRIS I, YAAKUB H. Growth pattern for body weight, height at withers and body length of kalahari red goats[J]. Pakistan Journal of Biological Sciences, 2015, 18(4): 200-203. DOI:10.3923/pjbs.2015.200.203 |
| [32] |
HAFIZ A W M, IDRIS I, YAAKUB H. Growth pattern for body weight, hip height and body length of Brakmas cattle[J]. Pakistan Journal of Biological Sciences, 2014, 17(7): 952-955. DOI:10.3923/pjbs.2014.952.955 |
| [33] |
高萍, 王海峰, 方心灵, 等. 饲粮中添加山梨酸对断奶仔猪生长性能、血清生化指标及相关基因mRNA表达的影响[J]. 动物营养学报, 2012, 24(11): 2195-2202. DOI:10.3969/j.issn.1006-267x.2012.11.018 |
| [34] |
ASHPOLE N M, HERRON J C, ESTEP P N, et al. Differential effects of IGF-1 deficiency during the life span on structural and biomechanical properties in the tibia of aged mice[J]. AGE, 2016, 38(2): 38. DOI:10.1007/s11357-016-9902-5 |




