2. 商丘师范学院生物与食品学院动物科学系, 商丘 476000;
3. 宜兰大学生物技术与动物科学系, 宜兰 26047
2. Department of Animal Science, College of Biology and Food, Shangqiu Normal University, Shangqiu 476000, China;
3. Department of Biotechnology and Animal Science, National Ilan University, Yilan 26047, China
维生素D是一种脂溶性维生素,它可以调节动物体内钙、磷代谢。在集约化饲养条件下,家禽无法通过光照合成足量1, 25-二羟基维生素D3[1, 25-(OH)2-D3]用以维持生长和骨骼发育的需要。因此,必须给家禽添加外源性的维生素D3。维生素D3经肝脏25-羟化酶和肾脏1α-羟化酶的羟化作用,转化为最终活性产物1, 25-(OH)2-D3。1, 25-(OH)2-D3与肠道维生素D受体结合后,通过基因和非基因途径调节动物体内钙和磷的代谢[1-2]。有研究显示,在基础饲粮中添加适量1, 25-(OH)2-D3能降低肉鸡胫骨软骨发育不良症(TD)发病率[3],促进肉鸡生长,增加骨骼灰分及钙、磷含量[4-6],提高肉鸡肠道钙磷吸收相关基因表达水平[7-9]。但是,1, 25-(OH)2-D3与VDR结合后,通过基因途径调节肉鸡小肠钙和磷吸收的分子机制尚未明确,有待进一步研究。
随着高通量测序技术的不断发展,转录组测序技术(RNA-seq)在家禽生长发育、繁殖性状、肠道微生物功能、物质代谢分子机制分析以及家禽疾病相关基因筛选方面的应用越来越多。转录组测序技术首先对基因进行注释,然后定量基因或转录本的表达量,进而筛选差异表达基因,最后对差异表达基因进行功能注释和富集分析,寻找相关信号通路,为研究相关分子机制提供依据[10-11]。因此,本试验以1~16日龄肉鸡为试验对象,在饲粮中添加不同水平1, 25-(OH)2-D3,收集肉鸡十二指肠黏膜,进行转录组测序,分析调控肉鸡小肠钙和磷吸收的关键基因和信号通路,为有效调控钙磷代谢、提高钙磷利用率提供理论依据。
1 材料与方法 1.1 试验材料1, 25-(OH)2-D3结晶体购自常州布克化工有限公司,纯度98%。准确称量1, 25-(OH)2-D3结晶体,将1, 25-(OH)2-D3溶于无水乙醇,待溶解后加入丙二醇,使最终溶液中乙醇与丙二醇比例为5 : 95(V/V),1, 25-(OH)2-D3浓度为10 mg/L。
1.2 试验设计与饲粮选取45只1日龄健康、体重相近的罗斯308肉鸡公雏为试验对象,随机分为3组,每组3个重复,每个重复5只鸡。试验期为16 d。设计3种饲粮,在基础饲粮中(不含维生素D)分别添加0(对照)、5(适量剂量)和10 μg/kg(高剂量)的1, 25-(OH)2-D3。基础饲粮参考NRC(1994)和《鸡饲养标准》(NY/T 33—2004)中营养需要推荐值配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
16日龄饲养试验结束后,肉鸡空腹12 h,称重,每个重复随机取出3只,每组取出9只肉鸡进行屠宰。统计试验期采食量和体增重,计算料重比。肉鸡屠宰后,取股骨和胫骨,放入自封袋中,-20 ℃冷冻保存。
1.4 骨骼指标测定将腿骨在105 ℃下烘干24 h,然后用分析天平称重。用游标卡尺测量股骨和胫骨的长度和直径(骨长度的1/2处)。将骨头压碎,放入坩埚,在茂福炉中600 ℃下灰化48 h。骨骼灰分百分比为骨骼灰分重量与烘干骨骼重量的比值。用乙二胺四乙酸(EDTA)滴定法测定骨骼钙含量,钼黄比色法测定骨骼磷含量。
1.5 RNA提取、cDNA文库构建及测序16日龄时,每个重复随机取出1只肉鸡,处死,解剖,刮取十二指肠黏膜,放入1.5 mL离心管中,立即在液氮中冷冻,然后放入-80 ℃超低温冰箱中保存。
取出-80 ℃保存的十二指肠黏膜样品,用Trizol法提取十二指肠黏膜样品总RNA,使用Fragment Analyzer检测总RNA浓度,计算完整性指数(RNA integrity number,RIN)和28S/18S。用mRNA富集法和rRNA去除法对总RNA进行处理,获得的RNA用于cDNA文库构建。cDNA文库构建完成后,分别利用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System(TaqMan Probe)检测cDNA文库浓度和插入片段大小(insert size),以保证文库质量符合标准,本试验的插入片段大小是100~500 bp。用BGISEQ-500平台文库测序。
1.6 参考基因组比对BGISEQ-500测序所得的原始数据称为raw data或raw reads,以FASTAQ文件格式存储。使用过滤软件SOAPnuke[12]过滤掉raw reads中低质量、接头污染及未知碱基N含量过高的reads,过滤之后所得的reads称为clean reads。使用鸡基因组Gallus_gallus-5.0作为参考序列,用HISAT[13]和Bowtie2[14-15]将clean reads比对到参考基因组,比对之后,统计reads在参考序列的分布情况。
1.7 基因表达量分析和差异表达基因筛选基因比对后,用RSEM[14-15]软件包计算各个样品的基因以及转录本亚型表达量水平。使用DEGseq[16]方法比较不同组中同一个Unigene基因差异性,根据差异倍数和P值矫正后得到的Q值进行筛选。筛选出差异表达基因,默认筛选显著差异的条件为Q≤0.001。
1.8 GO和KEGG分类与通路富集分析利用GO(gene ontology)分析差异表达基因的主要生物学功能,包括生物学过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)。利用KEGG(kyoto encyclopedia of genes and genomes)进行代谢通路分类。根据GO和KEGG注释结果以及官方分类,将差异表达基因进行分类,同时使用R软件中的phyper函数进行富集分析,计算P值;然后对P值进行FDR校正,通常FDR≤0.01视为显著富集,矫正之后的值为Q值。
1.9 引物设计根据GenBank上公布的鸡小肠上皮细胞中细胞核维生素D受体(VDR)、细胞膜维生素D受体(PDIA3)、钠依赖性磷转运蛋白(SLC34A2)、钙结合蛋白D28k(CALB1)和磷酸甘油醛脱氢酶(GAPDH)基因mRNA序列,使用Primer 5.0软件设计引物。由上海生工生物工程技术服务有限公司合成引物,PCR引物序列见表 2。按照说明书要求加缓冲液配成贮存液,-20 ℃保存备用。
|
|
表 2 PCR引物序列 Table 2 PCR primer sequences |
用实时荧光定量PCR验证转录组测序分析结果。利用Trizol法提取组织总RNA,以RNA为模板反转录合成cDNA。cDNA合成20 μL反应体系:5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,5×PrimeScript Buffer 2反应液4 μL,PrimeScript RT Enzyme Mix I 1 μL,RT prime Mix 1 μL,总RNA 1 μL,RNase Free H2O补足至20 μL。反应条件:42 ℃ 2 min,37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。PCR扩增:以cDNA为模板,实时荧光定量荧光染料为SYBR Green Ⅰ(TaKaRa),PCR反应体系为10 μL:cDNA 1 μL,上、下游引物各0.4 μL,TB Green Premix Ex Taq Ⅱ (2×) 5 μL,RNase Free H2O 3.2 μL。反应条件:95 ℃预变性60 s;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。扩增后进行熔解曲线分析。用GAPDH作为内参基因,采用相对定量2-ΔΔCt法计算基因表达量,其中,△Ct=目的基因的平均Ct值-内参基因的平均Ct值,△△Ct=△Ct-每组平均△Ct。参考Grenier等[17]的方法,用RNA-seq log2FC和qPCR ddCt的值进行转录组测序结果与实时荧光定量PCR结果比较,对转录组测序数据的准确性进行评估。
1.11 统计分析采用SAS 9.0统计软件对肉鸡生长性能和骨骼矿化数据进行GLM分析,Tukey法进行多重比较,用多项式比较法分析1, 25-(OH)2-D3添加量与肉鸡生长性能、骨骼矿化的线性和二次曲线关系,P < 0.05为差异显著。
2 结果与分析 2.1 1, 25-(OH)2-D3添加量对肉鸡生长性能和骨骼矿化的影响由表 3可知,与对照组(0 μg/kg)相比,添加5和10 μg/kg 1, 25-(OH)2-D3后,肉鸡1~16日龄体增重和采食量显著增加(P < 0.05),料重比呈现降低趋势(P=0.071 8)。
|
|
表 3 1, 25-(OH)2-D3添加量对1~16日龄肉鸡生长性能的影响 Table 3 Effects of 1, 25-(OH)2-D3 additive amount on growth performance of broiler chickens from 1 to 16 days of age |
由表 4和表 5可知,与对照组相比,添加5和10 μg/kg 1, 25-(OH)2-D3均显著提高肉鸡股骨和胫骨的重量和长度、灰分重量和含量、钙和磷含量(P < 0.05)。10 μg/kg 1, 25-(OH)2-D3组肉鸡股骨和胫骨的重量、长度和灰分重量显著低于5 μg/kg 1, 25-(OH)2-D3组(P < 0.05)。胫骨和股骨灰分、钙和磷含量在5和10 μg/kg 1, 25-(OH)2-D3组间没有显著差异(P>0.05)。
|
|
表 4 1, 25-(OH)2-D3添加量对16日龄肉鸡股骨矿化指标的影响 Table 4 Effects of 1, 25-(OH)2-D3 additive amount on femur mineralization indexes of broiler chickens at 16 days of age |
|
|
表 5 1, 25-(OH)2-D3添加量对16日龄肉鸡胫骨矿化指标的影响 Table 5 Effects of 1, 25-(OH)2-D3 additive amount on tibia mineralization indexes of broiler chickens at 16 days of age |
将测序获得的数据与参考基因组进行比对,与参考基因组的比对率为89.98%~91.08%,与参考基因组唯一位置的比对率为68.54%~71.09%(表 6),说明数据利用率较高,所选参考基因组能够满足后续分析的需求。
|
|
表 6 转录组数据与参考基因组序列比对分析 Table 6 Comparative analysis of transcriptome data and reference genome sequences |
以Q≤0.001和│log2(fold change)│≥1为筛选差异表达基因的条件,比较不同1, 25-(OH)2-D3添加量组肉鸡十二指肠差异表达基因数量(表 7)。表 7显示,随1, 25-(OH)2-D3添加量的增加,差异表达基因数量逐渐减少。0和5 μg/kg 1, 25-(OH)2-D3组间比较,有1 029个差异表达基因,其中上调基因380个,下调基因649个;0和10 μg/kg 1, 25-(OH)2-D3组间比较,有939个差异表达基因,其中上调基因274个,下调基因665个;5和10 μg/kg 1, 25-(OH)2-D3组间比较,有642个差异表达基因,其中上调基因323个,下调基因319个。另外,与对照组相比,添加5和10 μg/kg 1, 25-(OH)2-D3,上调基因数量由380个减少到274个;下调基因数量相当,分别为649和665个。
|
|
表 7 不同1, 25-(OH)2-D3添加量组间差异表达基因数量 Table 7 Number of differentially expressed genes between different 1, 25-(OH)2-D3 additive amount groups |
以Q≤0.001为标准,调整差异倍数大小,筛选差异表达基因,进行GO功能注释并分类,发现有363个基因与物质吸收代谢相关,这些基因参与物质运输和生物代谢过程。对这363个基因进行GO功能富集分析,结果显示,44个基因富集到钙离子结合和钙信号调节等钙吸收代谢相关过程,71个基因富集到磷酸根离子转运、磷代谢、磷酸盐代谢等磷吸收代谢有关的过程中(图 1)。
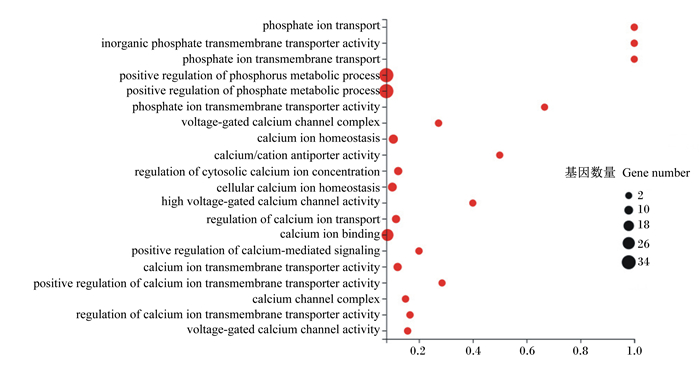
|
X轴为富集比例,Y轴为GO term,气泡的大小表示注释到某个GO Term上的差异表达基因数量,图中显示的是Q值最小的前20个GO term。X-axis is enrichment ratio, Y-axis is GO term. Bubble size indicates the number of differentially expressed genes annotated on a GO term. The figure shows the top 20 GO terms with the smallest Q-value. phosphate ion transport:磷酸根离子转运;inorganic phosphate transmembrane transporter activity:无机磷酸盐跨膜转运蛋白活性;phosphate ion transmembrane transport:磷酸根离子跨膜转运;positive regulation of phosphorus metabolic process磷代谢过程的正调控;positive regulation of phosphate metabolic process:磷酸盐代谢过程的正调控;phosphate ion transmembrane transporter activity:磷酸根离子跨膜转运蛋白活性;voltage-gated calcium channel complex:电压门控钙通道复合物;calcium ion homeostasis:钙离子稳态;calcium/cation antiporter activity:钙/阳离子反向转运蛋白活性;regulation of cytosolic calcium ion concentration细胞溶质钙离子浓度调节;cellular calcium ion homeostasis细胞钙离子稳态;high voltage-gated calcium channel activity:高电压门控钙通道活性;regulation of calcium ion transport:钙离子转运的调节;calcium ion binding:钙离子结合;positive regulation of calcium-mediated signaling:钙介导信号的正调控;calcium ion transmembrane transporter activity:钙离子跨膜转运蛋白活性;positive regulation of calcium ion transmembrane transporter activity:钙离子跨膜转运蛋白活性的正调控;calcium channel complex:钙通道复合物;regulation of calcium ion transmembrane transporter activity:钙离子跨膜转运蛋白活性的调控;voltage-gated calcium channel activity:电压门控钙通道活性。 图 1 GO功能富集分析 Fig. 1 GO functional enrichment analysis |
结合GO分析结果,进行KEGG信号通路富集分析,结果显示,41个基因富集到14条与钙吸收代谢有关的代谢通路,43个基因富集到13条与磷吸收代谢有关的代谢通路(表 8和表 9)。经GO功能注释和KEGG信号通路分析,筛选出PDIA3、VDR、SLC34A2、无机磷转运载体蛋白2(SLC20A2)、CALB1、钙离子转运ATP酶B1(ATP2B1)、钙离子转运ATP酶B2(ATP2B2)、钠钙交换蛋白1(SLC8A1)、成纤维细胞因子1(FGF1)和成纤维细胞因子19(FGF19)等调节钙和磷吸收代谢的重要基因。
|
|
表 8 钙吸收代谢相关的信号通路分析 Table 8 Analysis of signal pathways related to calcium absorption and metabolism |
|
|
表 9 磷吸收代谢相关的信号通路分析 Table 9 Analysis of signal pathways related to phosphorus absorption and metabolism |
转录组分析结果(表 10)显示,与对照组相比,添加5 μg/kg 1, 25-(OH)2-D3后,VDR、SLC34A2、SLC20A2、CALB1、ATP2B1、ATP2B2和SLC8A1等基因的表达量显著升高(Q≤0.001);与5 μg/kg 1, 25-(OH)2-D3组相比,10 μg/kg 1, 25-(OH)2-D3组PDIA3、SLC34A2、ATP2B2和SLC8A1等基因的表达量显著下降(Q≤0.001)。1, 25-(OH)2-D3添加量由0增加到10 μg/kg,成纤维细胞生长因子FGF1和FGF19基因表达量持续降低,且各组间差异显著(Q≤0.001)。
|
|
表 10 转录组测序分析不同1, 25-(OH)2-D3添加量组差异表达基因的表达量 Table 10 Expressions of differentially expressed genes in 1, 25-(OH)2-D3 additive amount groups analyzed by transcriptome sequencing (RNA-seq) |
对4个肉鸡十二指肠黏膜钙和磷吸收相关的差异表达基因VDR、PDIA3、SLC34A2和CALB1进行实时定量PCR检测(图 2)。图 2显示,4个基因实时定量PCR检测的mRNA表达趋势与转录组RNA-seq结果基本一致, 表明测序结果可靠。
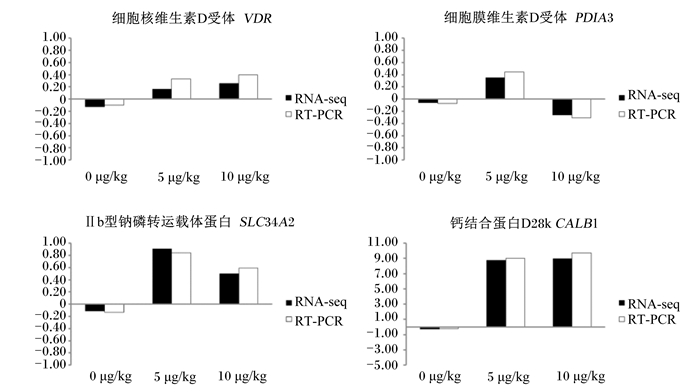
|
RT-PCR用ddCt值表示差异倍数值,RNA-seq用log2FC值表示差异倍数值。ddCt values were used in RT-PCR to indicate the difference fold, and log2 FC values were used in RNA-seq. 图 2 RT-PCR与RNA-seq表达分析比较 Fig. 2 Comparison of expression analysis between RT-PCR and RNA-seq |
小肠是动物对钙和磷吸收的主要场所。在小肠中,钙主要以钙离子的形式被吸收,磷主要以无机磷酸盐的形式被吸收。饲粮中添加维生素D3及其衍生物可以改善动物肠道对钙和磷的吸收,促进动物生长和骨骼发育。本试验在肉鸡基础饲粮(不含维生素D)中添加3个水平的1, 25-(OH)2-D3,分别为0、5、10 μg/kg。结果显示,与对照组相比,添加5 μg/kg 1, 25-(OH)2-D3显著提高肉鸡体增重和采食量,增强股骨和胫骨质量;但是与5 μg/kg 1, 25-(OH)2-D3组相比,10 μg/kg 1, 25-(OH)2-D3组肉鸡股骨和胫骨重量、长度与灰分重量显著降低。这与先前研究结果[4-5, 18]相似。这表明添加5 μg/kg 1, 25-(OH)2-D3改善肉鸡生长性能,但添加10 μg/kg 1, 25-(OH)2-D3抑制肉鸡生长和骨骼发育。高剂量1, 25-(OH)2-D3具有一定的毒副作用,直接作用于骨骼组织,影响肉鸡软骨细胞增殖、分化,使软骨基质钙化不良,骨密度降低,骨生长变慢;高剂量1, 25-(OH)2-D3也会抑制肉鸡肠道对钙和磷的吸收,降低血清钙和磷含量、骨骼钙和磷沉积以及骨密度,影响肉鸡股骨和胫骨重量、长度和灰分重量,最终抑制骨骼发育。
在测定肉鸡生长性能和骨骼发育基础上,利用转录组测序技术,分析不同1, 25-(OH)2-D3添加量组肉鸡十二指肠黏膜组织差异表达基因,进行GO功能注释和KEGG信号通路分析。发现14条与钙吸收代谢有关的信号通路,以及13条与磷吸收代谢有关的信号通路;筛选出VDR、PDIA3、SLC34A2、SLC20A2、CALB1、ATP2B1、ATP2B2、SLC8A1、FGF1、FGF19等调节钙和磷吸收代谢的重要基因。
VDR和PDIA3是家禽肠道上皮细胞2种维生素D受体。VDR是细胞核维生素受体,PDIA3为细胞膜维生素受体。1, 25-(OH)2-D3通过与维生素D受体结合,调节肠道钙和磷的吸收[19-21]。本试验显示,与对照组相比,饲粮中添加5 μg/kg 1, 25-(OH)2-D3后,VDR和PDIA3基因表达上调,这与张金龙等[22]的研究结果相似。综合先前研究报道和本次试验结果,说明1, 25-(OH)2-D3在转录水平调节肉鸡十二指肠2种维生素D受体基因表达。
SLC34A2和SLC20A2为钠依赖型无机磷协同转运蛋白。其中,SLC34A2为NaPi-Ⅱb基因,SLC20A2是PiT-2基因。它们都在肠道上皮细胞顶膜表达,且参与无机磷在家禽肠道上皮细胞顶膜的跨膜转运过程,在肠道磷吸收中起到重要作用[23]。成纤维细胞生长因子FGF1和FGF19也是在肠道细胞顶膜表达。本试验通过KEGG信号通路富集分析发现,FGF1和FGF19基因注释到MAPK信号通路。与对照组相比,添加1, 25-(OH)2-D3组肉鸡十二指肠VDR、SLC34A2和SLC20A2基因表达上调;而FGF1和FGF19基因表达显著下调。Pardo等[24-25]研究发现,1, 25-(OH)2-D3与VDR结合后,激活了鸡和大鼠肠道上皮细胞MAPK信号通路中细胞外信号调节激酶1/2(ERK1/2,即p44/42)和p38支路。综合以上结果,1, 25-(OH)2-D3与VDR结合后,可能作用于成纤维细胞生长因子FGF1和FGF19,通过MAPK信号通路调节SLC34A2和SLC20A2基因表达,进而调节肉鸡肠道上皮细胞顶膜对磷的吸收。
CALB1、ATP2B1、ATP2B2和SLC8A1是家禽肠道上皮细胞中与钙吸收相关的基因。CALB1是家禽肠道上皮细胞内的钙结合蛋白基因。CALB1是一种维生素D依赖性钙结合蛋白,受1, 25-(OH)2-D3水平的调节,对钙具有高度亲和力。CALB1负责将Ca2+从肠道细胞顶膜运输到底膜。钙转运ATP酶ATP2B1和ATP2B2基因属于细胞膜钙ATP酶(PMCAs)家族成员,位于肠道上皮细胞基底膜。有研究表明,PMCAs在鸡和哺乳动物肠道定位于上皮细胞的基底膜,将能量以ATP的形式存储起来,逆电化学梯度将Ca2+泵出细胞外,而且维生素D和钙磷含量可以调节蛋鸡和哺乳动物肠道PMCA转录水平表达[26-28]。SLC8A1是钠钙(Na+/Ca2+)交换蛋白(NCXs)家族中的一种编码基因,Na+/Ca2+交换蛋白的作用是将Ca2+泵出细胞基底膜外。研究显示,1, 25-(OH)2-D3通过cAMP信号通路促进鸡和大鼠肠细胞对钙的吸收[9, 29]。本试验通过KEGG信号通路富集分析,发现细胞膜钙转运基因ATP2B1、ATP2B2和SLC8A1富集到cAMP信号通路(或cAMP-PKA信号传导通路)和cGMP-PKG信号通路。与对照组相比,饲粮中添加1, 25-(OH)2-D3后,cAMP信号通路和cGMP信号通路中ATP2B1、ATP2B2、SLC8A1基因表达均上调。据此推测:1, 25-(OH)2-D3与细胞基底膜维生素D受体(PDIA3)结合后,可能作用于细胞膜AC和GC催化亚基,促使产生更多cAMP和cGMP信号因子,作用于蛋白激酶A和蛋白激酶G靶分子,进而调控ATP2B1、ATP2B2和SLC8A1基因表达,最终调节肠道上皮细胞底膜泵出钙离子。
4 结论① 在基础饲粮(不含维生素D)中,添加5 μg/kg 1, 25-(OH)2-D3改善肉鸡生长性能和骨骼质量,但添加10 μg/kg 1, 25-(OH)2-D3则抑制肉鸡骨骼发育。
② 利用转录组测序技术,经GO功能注释,筛选出VDR、PDIA3、SLC34A2、SLC20A2、CALB1、ATP2B1、ATP2B2、SLC8A1、FGF1和FGF19等差异表达基因,这些基因富集到1, 25-(OH)2-D3调节肉鸡十二指肠钙和磷吸收代谢过程。
③ 经KEGG代谢通路富集分析显示,差异表达基因富集到MAPK信号通路、cAMP信号通路(或cAMP-PKA信号传导通路)和cGMP-PKG信号通路,这些信号通路可能参与1, 25-(OH)2-D3调节肉鸡十二指肠钙和磷吸收过程。
| [1] |
GOLTZMAN D. Functions of vitamin D in bone[J]. Histochemistry and Cell Biology, 2018, 149(4): 305-312. |
| [2] |
YASUTAKE Y, FUJⅡ Y, NISHIOKA T, et al. Structural evidence for enhancement of sequential vitamin D3 hydroxylation activities by directed evolution of cytochrome P450 vitamin D3 hydroxylase[J]. Journal of Biological Chemistry, 2010, 285(41): 31193-31201. DOI:10.1074/jbc.M110.147009 |
| [3] |
EDWARDS H M Jr. Studies on the efficacy of cholecalciferol and derivatives for stimulating phytate utilization in broilers[J]. Poultry Science, 2002, 81(7): 1026-1031. DOI:10.1093/ps/81.7.1026 |
| [4] |
MITCHELL R D, EDWARDS H M Jr. Effects of phytase and 1, 25-dihydroxycholecalciferol on phytate utilization and the quantitative requirement for calcium and phosphorus in young broiler chickens[J]. Poultry Science, 1996, 75(1): 95-110. DOI:10.3382/ps.0750095 |
| [5] |
ELLIOT M A, EDWARDS H M, J r. Effect of 1, 25-dihydroxycholecalciferol, cholecalciferol, and fluorescent lights on the development of tibial dyschondroplasia and rickets in broiler chickens[J]. Poultry Science, 1997, 76(4): 570-580. DOI:10.1093/ps/76.4.570 |
| [6] |
ELLIOT M A, ROBERSON K D, ROWLAND G N, et al. Effects of dietary calcium and 1, 25-dihydroxycholecalciferol on the development of tibial dyschondroplasia in broilers during the starter and grower periods[J]. Poultry Science, 1995, 74(9): 1495-1505. DOI:10.3382/ps.0741495 |
| [7] |
LIAO X D, SUO H Q, LU L, et al. Effects of sodium, 1, 25-dihydroxyvitamin D3 and parathyroid hormone fragment on inorganic P absorption and type Ⅱb sodium-phosphate cotransporter expression in ligated duodenal loops of broilers[J]. Poultry Science, 2017, 96(7): 2344-2350. DOI:10.3382/ps/pex033 |
| [8] |
NEMERE I. Apparent nonnuclear regulation of intestinal phosphate transport:effects of 1, 25-dihydroxyvitamin D3, 24, 25-dihydroxyvitamin D3, and 25-hydroxyvitamin D3[J]. Endocrinology, 1996, 137(6): 2254-2261. DOI:10.1210/endo.137.6.8641173 |
| [9] |
CENTENO V, PICOTTO G, PÉREZ A, et al. Intestinal Na+/Ca2+ exchanger protein and gene expression are regulated by 1, 25(OH)2D3 in vitamin D-deficient chicks[J]. Archives of Biochemistry and Biophysics, 2011, 509(2): 191-196. DOI:10.1016/j.abb.2011.03.011 |
| [10] |
ZHANG Q L, ZHU Q H, XIE Z Q, et al. Genome-wide gene expression analysis of amphioxus (Branchiostoma belcheri) following lipopolysaccharide challenge using strand-specific RNA-seq[J]. RNA Biology, 2017, 14(12): 1799-1809. DOI:10.1080/15476286.2017.1367890 |
| [11] |
ZHANG Q L, ZHU Q H, LIANG M Z, et al. Comparative transcriptomic analysis provides insights into antibacterial mechanisms of Branchiostoma belcheri under Vibrio parahaemolyticus infection[J]. Fish & Shellfish Immunology, 2018, 76: 196-205. |
| [12] |
COCK P J A, FIELDS C J, GOTO N, et al. The sanger FASTQ file format for sequences with quality scores, and the Solexa/Illumina FASTQ variants[J]. Nucleic Acids Research, 2010, 38(6): 1767-1771. DOI:10.1093/nar/gkp1137 |
| [13] |
KIM D, LANGMEAD B, SALZBERG S L. HISAT:a fast spliced aligner with low memory requirements[J]. Nature Methods, 2015, 12(4): 357-360. DOI:10.1038/nmeth.3317 |
| [14] |
LANGMEAD B, SALZBERG S L. Fast gapped-read alignment with Bowtie 2[J]. Nature Methods, 2012, 9(4): 357-359. DOI:10.1038/nmeth.1923 |
| [15] |
LI B, DEWEY C N. RSEM:accurate transcript quantification from RNA-Seq data with or without a reference genome[J]. BMC Bioinformatics, 2011, 12: 323. DOI:10.1186/1471-2105-12-323 |
| [16] |
WANG L K, FENG Z X, WANG X, et al. DEGseq:an R package for identifying differentially expressed genes from RNA-seq data[J]. Bioinformatics, 2010, 26(1): 136-138. |
| [17] |
GRENIER J K, FOUREMAN P A, SLOMA E A, et al. RNA-seq transcriptome analysis of formalin fixed, paraffin-embedded canine meningioma[J]. PLoS One, 2017, 12(10): e0187150. DOI:10.1371/journal.pone.0187150 |
| [18] |
GALLAGHER J A, BENETON M, HARVEY L, et al. Response of rachitic rat bones to 1, 25-dihydroxyvitamin D3:biphasic effects on mineralization and lack of effect on bone resorption[J]. Endocrinology, 1986, 119(4): 1603-1609. DOI:10.1210/endo-119-4-1603 |
| [19] |
HAUSSLER M R, JURUTKA P W, MIZWICKI M, et al. Vitamin D receptor (VDR)-mediated actions of 1α, 25(OH)2vitamin D3:genomic and non-genomic mechanisms[J]. Best Practice & Research Clinical Endocrinology & Metabolism, 2011, 25(4): 543-559. |
| [20] |
NEMERE I, GARBI N, HAMMERLING G, et al. Role of the 1, 25D3-MARRS receptor in the 1, 25(OH)2D3-stimulated uptake of calcium and phosphate in intestinal cells[J]. Steroids, 2012, 77(10): 897-902. DOI:10.1016/j.steroids.2012.04.002 |
| [21] |
NORMAN A W, OLIVERA C J, SILVA F R M B, et al. A specific binding protein/receptor for 1α, 25-dihydroxyvitamin D3 is present in an intestinal caveolae membrane fraction[J]. Biochemical and Biophysical Research Communications, 2002, 298(3): 414-419. DOI:10.1016/S0006-291X(02)02482-8 |
| [22] |
张金龙, 张宁, 杨雪, 等. 25-羟基维生素D3对肉鸡生长性能、骨骼矿化及肠道维生素D受体基因表达的影响[J]. 中国饲料, 2017, 28(24): 24-29. |
| [23] |
FORSTER I C, HERNANDO N, BIBER J, et al. Phosphate transporters of the SLC20 and SLC34 families[J]. Molecular Aspects of Medicine, 2013, 34(2/3): 386-395. |
| [24] |
PARDO V G, BOLAND A R. Tyrosine phosphorylation signalling dependent on 1α, 25(OH)2-vitamin D3 in rat intestinal cells:effect of ageing[J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(3): 489-504. |
| [25] |
PARDO V G, FACCHINETTI M M, CURINO A, et al. Age-related alteration of 1α, 25(OH)2-vitamin D3-dependent activation of p38 MAPK in rat intestinal cells[J]. Biogerontology, 2007, 8(1): 13-24. DOI:10.1007/s10522-006-9031-0 |
| [26] |
CHRISTAKOS S. Mechanism of action of 1, 25-dihydroxyvitamin D3 on intestinal calcium absorption[J]. Reviews in Endocrine and Metabolic Disorders, 2012, 13(1): 39-44. DOI:10.1007/s11154-011-9197-x |
| [27] |
WASSERMAN R H, SMITH C A, BRINDAK M E, et al. Vitamin D and mineral deficiencies increase the plasma membrane calcium pump of chicken intestine[J]. Gastroenterology, 1992, 102(3): 886-894. DOI:10.1016/0016-5085(92)90174-W |
| [28] |
CEHAK A, WILKENS M R, GUSCHLBAUER M, et al. In vitro studies on intestinal calcium and phosphate transport in horses[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2012, 161(2): 259-264. |
| [29] |
MASSHEIMER V, BOLAND R, DE BOLAND A R. Rapid 1, 25(OH)2-vitamin D3 stimulation of calcium uptake by rat intestinal cells involves a dihydropyridine-sensitive cAMP-dependent pathway[J]. Cellular Signalling, 1994, 6(3): 299-304. |




