下丘脑是中枢神经系统的重要组成部分,拥有涉及广泛的稳态控制系统。下丘脑被分成许多区域,其中腹内侧核(ventromedial nucleus, VMH)和下丘脑外侧(lateral hypothalamic area, LHA)分别控制饱腹感和饥饿[1-3]。下丘脑中的不同区域通过神经通路联系在一起,形成一个复杂的促食欲(刺激食欲)以及厌食欲(抑制食欲)网络回路,调控采食以及能量支出来维持体重[4]。因而,阐明热处理影响下丘脑食欲调控通路的机制对揭示热应激降低家禽食欲的机理、制定防控策略意义重大。参与中枢能量食欲调控的因子主要有神经肽Y(neuropeptide Y, NPY)、刺鼠色蛋白相关蛋白(agouti-related protein, AgRP)、促肾上腺皮质激素释放激素(corticotrophin releasing hormone, CRH)、阿黑皮素原(proopiomelanocortin, POMC)和可卡因与安非他明调节转录因子(cocaine amphetamine regulated transcript peptide, CART)等。Suzuki等[5]研究显示AgRP和NPY共表达于下丘脑弓状核(hypothalamic arcuate nucleus, ARC),发挥刺激食欲的功能。CRH在动物下丘脑室旁核(paraventricular nucleus of hypothalamus, PVN)内大量表达,Denbow等[6]证实哺乳动物中枢神经系统中注射CRH能够抑制采食,并且促使动物体重下降。POMC主要分布在下丘脑ARC及其邻近核区,Gerets等[7]发现α-黑素细胞刺激素(α-melanocyte-stimulating hormone, α-MSH)是POMC衍生的厌食肽,作用于家禽中枢神经系统抑制采食。CART已被证明能够调节NPY及瘦素的行动,注射CART抑制NPY诱导采食,当注射瘦素时增加ARC中的CART mRNA表达[8]。下丘脑食欲调控的主要信号通路有2条:一条是由哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)调控的信号通路,另一条是由腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)调控的信号通路。AMPK在哺乳动物的食欲调节和能量平衡中起着重要作用,研究发现,当下丘脑中的AMPK被激活时,显著增加采食和体重,当抑制其活性时,显著降低采食和体重[9-12]。本试验通过建立肉鸡下丘脑神经元体外模型,利用实时荧光定量PCR(real-time quantitative PCR, RT-qPCR)技术对下丘脑食欲调控和AMPK信号通路相关基因的表达进行定量,以揭示热处理对肉鸡中枢神经系统食欲调控及AMPK信号通路的影响,为深入研究热应激影响家禽食欲和能量代谢的机制提供依据。
1 材料与方法 1.1 试验材料本试验的主要材料为确定培养成功的肉鸡下丘脑神经元细胞。通过尼氏体染色可以鉴定所培养的细胞是否为神经元细胞。
1.2 试验设计试验选取19胚龄的无特定病原体(SPF)级鸡蛋,通过6孔板体外培养下丘脑神经元细胞,建立神经元体外培养模型。将体外培养的下丘脑神经元细胞以1×106~5×106个/mL的密度接种于6孔板中,每孔含2 mL细胞悬浊液,每孔作为1个重复,每组6个重复,于培养箱(37 ℃、5%CO2)中培养。当培养至第5天时,开始进行热处理,热处理组培养温度为43 ℃,对照组培养温度为37 ℃,热处理1.5 h后收集神经元细胞,提取mRNA进行分析,测定下丘脑神经元细胞中食欲调控相关基因NPY、AgRP、CART、POMC以及AMPK信号通路相关基因AMPKα2、肉碱棕榈酰转移酶-1(carnitine palmitoyl transferase-1, CPT-1)、瘦素受体(leptin receptor, LEPR)、肝激酶B1(liver kinase B1,LKB1)、乙酰辅酶A羧化酶(acetyl CoA carboxylase, ACC)、脂肪酸合成酶(fatty acid synthase,FAS)、丝氨酸/苏氨酸蛋白激酶1(serine/threonine protein kinase 1,AKT1)和mTOR mRNA相对表达量。
1.3 目的基因定量表达测定总RNA提取试剂Trizol购自Invitrogen公司;使用反转录试剂盒PrimeScriptTM RT Reagent Kit(Perfect Real Time, Code:DRR037A, TaKaRa)进行反转录,反转录条件为:55 ℃,30 min;85 ℃,5 min。各基因参照GenBank上已发表的序列,采用DNAMAN5.0设计(跨内含子),引物由上海生工生物工程有限公司合成,引物序列见表 1。RT-qPCR试剂盒(编号:DRR014A)SYBR Premix Ex TaqTM(Perfect Real Time)购自TaKaRa公司。两步法RT-qPCR反应条件为:95 ℃变性10 s,1个循环;95 ℃延伸5 s、60 ℃退火34 s,40个循环。以β-肌动蛋白(β-actin)作为内参基因,各个目的基因的相对表达水平以2-△△Ct法进行计算。
|
|
表 1 引物序列 Table 1 Primer sequences |
试验数据均采用SAS 9.1统计软件的ANOVA程序进行单因素方差分析,P < 0.05表示处理效应差异显著。
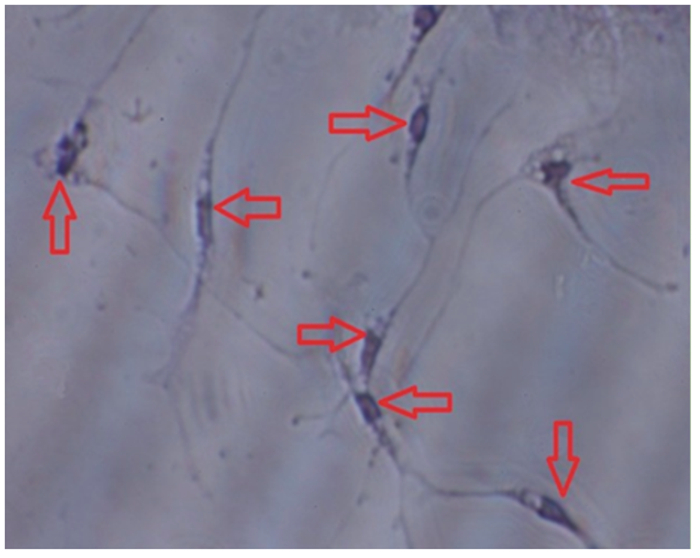
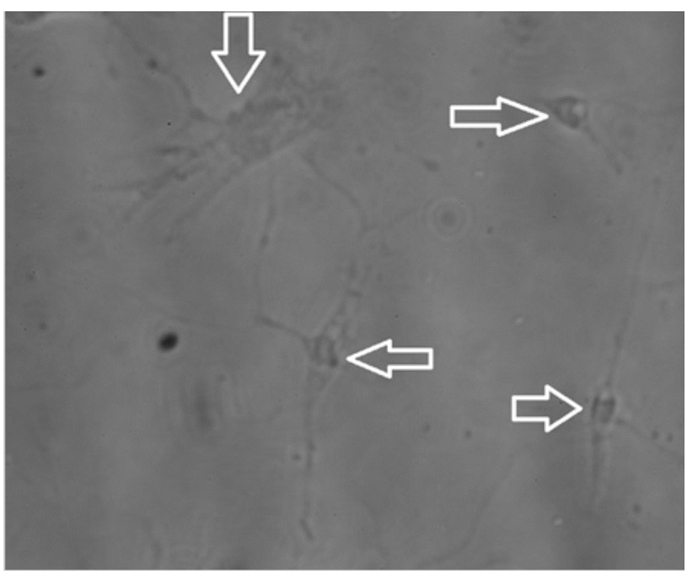
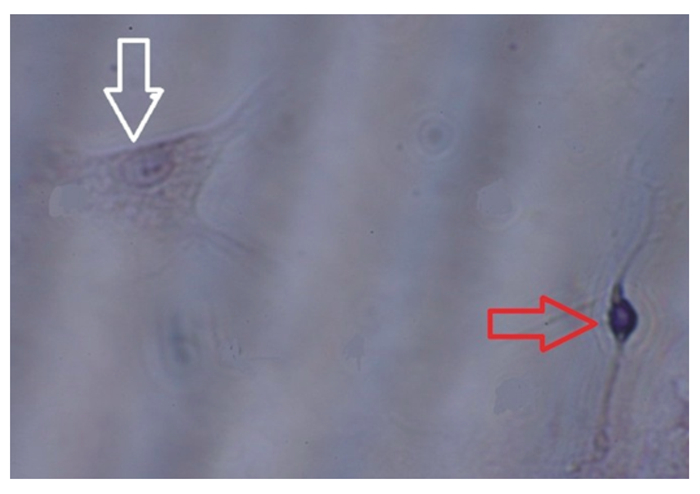
2 结果 2.1 下丘脑神经元细胞培养结果与鉴定通过观察,下丘脑神经元细胞在培养3 h后开始贴壁(图 1、图 2),起初都是圆形和梭形细胞,24 h后完全帖壁。接种后第2天开始生长突起,第5~6天生长状态为最佳(图 3、图 4)。下丘脑神经元细胞在无血清培养基下可以维持正常的生长15 d。以焦油紫(0.1%)进行尼氏体染色,观察到神经元细胞呈蓝紫色(图 5),以不加染色剂作为空白对照,观察到神经元细胞为无色透明状(图 6),神经胶质细胞也为无色透明状(图 7)。经过统计分析,尼氏体染色阳性的神经元细胞所占比例大于85%(试验开始阶段,神经元细胞与胶质细胞共存,神经元细胞比例超过85%,此后通过添加抑制剂抑制胶质细胞的增殖),满足于正常的研究需要。因此,本试验建立的下丘脑神经元体外培养模型是成功的。
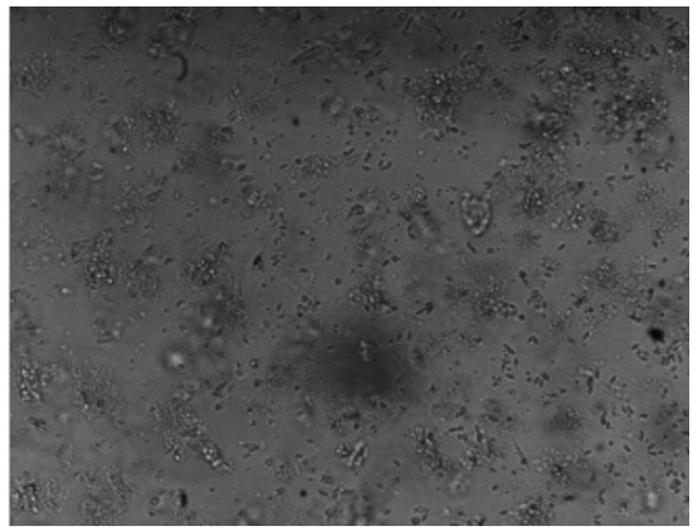
|
图中椭圆形和梭形细胞为目的细胞。图 2同。 Elliptical and spindle cells are the target cells in the figure. The same as Fig. 2. 图 1 接种后的细胞 Fig. 1 Cells after inoculation (100×) |
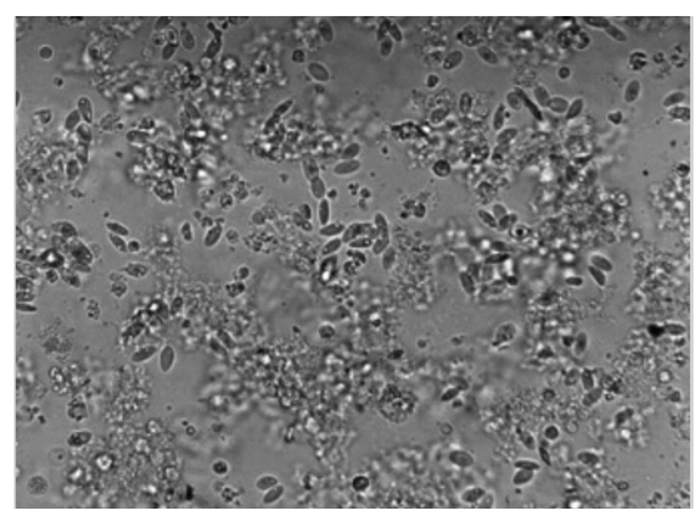
|
图 2 接种后的细胞 Fig. 2 Cells after inoculation (200×) |
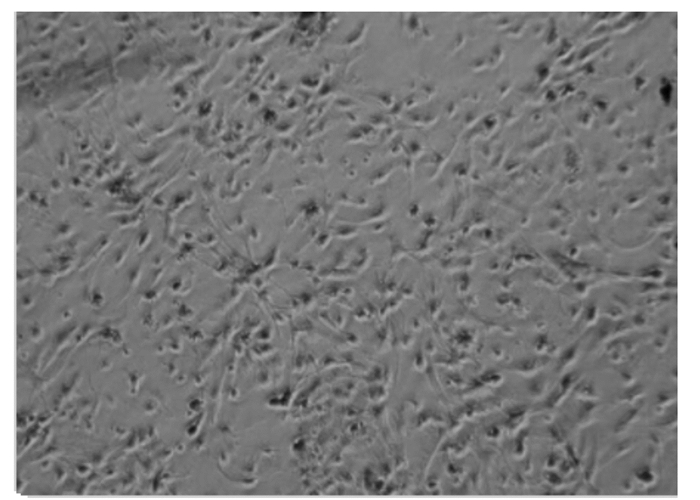
|
神经元胞体突起发达。图 4同。 The somatic processes of neurons are well developed. The same as Fig. 4. 图 3 细胞培养6 d Fig. 3 Cells cultured after 6 days (100×) |
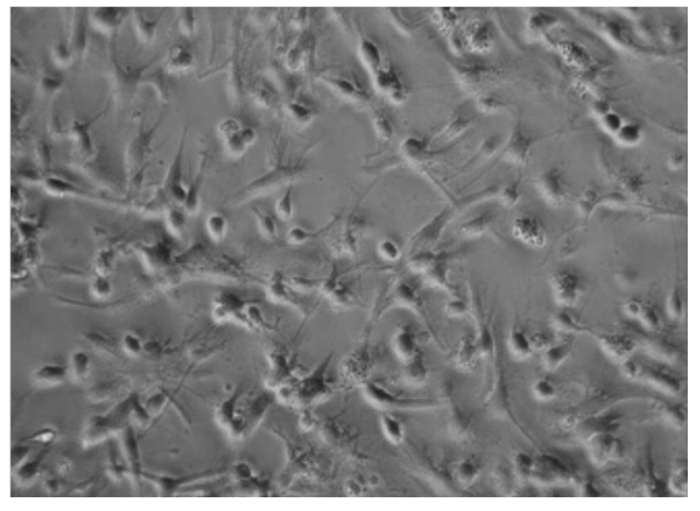
|
图 4 细胞培养6 d Fig. 4 Cells cultured after 6 days (200×) |
|
红色箭头指向尼氏体染色阳性的神经元细胞。 Red arrows pointed at Nissl staining positive neurons cells. 图 5 神经元细胞尼氏体染色 Fig. 5 Neurons cells of Nissl staining (400×) |
|
白色箭头指向无色透明状的神经元细胞。。 White arrows pointed at colourless clear foliated glial cells. 图 6 尼氏体染色空白对照 Fig. 6 Blank control of Nissl staining (400×) |
|
红色箭头指向尼氏体染色阳性的神经元细胞,白色箭头指向尼氏体染色阴性的神经胶质细胞。 Red arrows pointed at Nissl staining positive neurons cell, and white arrows pointed at Nissl-negative glial cells. 图 7 神经胶质细胞尼氏体染色 Fig. 7 Glial cells of Nissl staining (400×) |
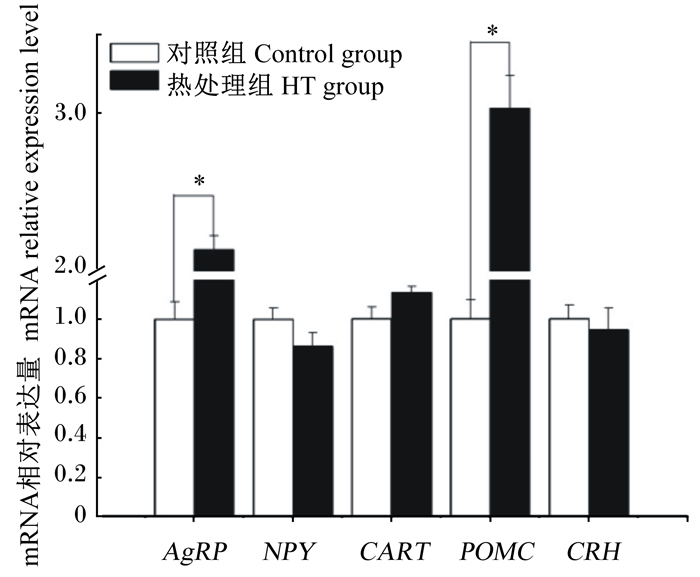
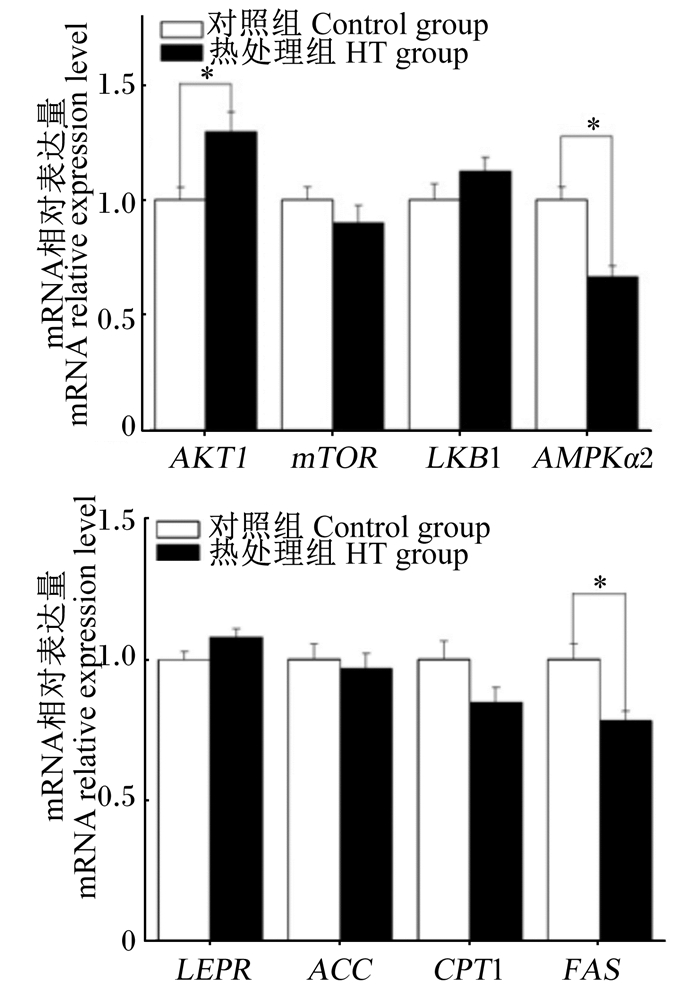
与对照组相比,热处理组神经元细胞中促食欲基因AgRP和厌食欲基因POMC mRNA相对表达量显著上调(P < 0.05),AMPK信号通路相关基因AMPKα2和FAS mRNA相对表达量显著下调(P < 0.05),AKT1 mRNA相对表达量显著上调(P < 0.05),其他食欲调控及AMPK信号通路相关基因mRNA相对表达量均无显著变化(图 8、图 9)。
|
AgRP:刺鼠色蛋白相关蛋白agouti-related protein;NPY:神经肽Y neuropeptide Y;CART:可卡因与安非他明调节转录因子cocaine amphetamine regulated transcript peptide;POMC:阿黑皮素原proopiomelanocortin;CRH:促肾上腺皮质激素释放激素corticotrophin releasing hormone。*表示差异显著(P < 0.05)。下图同。 * mean significant difference (P < 0.05). The same as below. 图 8 热处理对下丘脑食欲调控相关基因mRNA相对表达量的影响 Fig. 8 Effects of heat treatment on mRNA relative expression levels of hypothalamic appetite regulation-related genes |
|
AKT1:丝氨酸/苏氨酸蛋白激酶1 serine/threonine protein kinase 1;mTOR:雷帕霉素靶蛋白mammalian target of rapamycin;LKB1:肝激酶B1 liver kinase B1;AMPKα2:腺苷酸活化蛋白激酶α2 adenosine monophosphate activated protein kinase α2;LEPR:瘦素受体leptin receptor;ACC:乙酰辅酶A羧化酶acetyl CoA carboxylase;CPT-1:肉碱棕榈酰转移酶-1 carnitine palmitoyl transferase-1;FAS:脂肪酸合成酶fatty acid synthase。 图 9 热处理对下丘脑AMPK信号通路相关基因mRNA相对表达量的影响 Fig. 9 Effects of heat treatment on mRNA relative expression levels of hypothalamic AMPK signaling pathway-related genes |
本试验利用细胞体外培养技术优先建立下丘脑神经元体外培养模型,并在此基础上对培养的神经元细胞进行热处理分析相关基因表达的变化。优先建立下丘脑神经元体外培养模型,一方面是由于下丘脑神经元的神经肽和其受体基因表达、第二信使激活以及电生理和分泌的这些属性尚未完全明了,下丘脑的神经内分泌具有异质性和复杂的神经结构,从而使得进行体内研究具有挑战性[13-15];另一方面是因为神经元作为一种高度分化的细胞,很难在体外增殖,现在的神经元的培养主要是原代培养。胚胎动物神经元分化越低,其体外存活能力越强,所以选择胚胎动物的神经元组织进行细胞培养。并且,从供体直接取材并在体外分离培养获取的细胞,其生物学特性在培养期间不发生改变[16]。本试验利用下丘脑神经元体外培养模型来研究热处理对单个下丘脑神经元细胞相关基因表达变化的影响,相较于直接在动物体内进行研究排除了神经组织异质性和复杂性等不利因素的影响,有利于分析热处理对下丘脑生理机制的直接效应。
3.2 热处理对下丘脑食欲调控相关基因表达的影响通过研究发现,热处理导致下丘脑神经元促食欲基因AgRP和厌食欲基因POMC mRNA相对表达量均显著上调,这与Makimura等[17]对ob/ob小鼠进行肾上腺切除手术可以逆转肥胖的表型,同时在下丘脑中AgRP和POMC mRNA相对表达量下降的结果相类似,当热处理下丘脑细胞时,下丘脑-垂体-肾上腺(HPA)内分泌轴被激活,CRH从下丘脑中释放,触发垂体促肾上腺皮质激素的释放,接着肾上腺皮质释放糖皮质激素(glucocorticoid,GC)[18];GC进而影响下丘脑促食欲基因AgRP和厌食欲基因POMC的表达,而不是影响NPY、CART、CRH的表达来实现的。Jeong等[19]研究表明POMC神经元表达功能性瞬时受体电位香草酸亚型1 (transient receptor potential vanilloid 1,TRPV1)样受体,这些受体在温度升高时可增加POMC神经元活动,并且POMC神经元的功能性激活对于运动诱导的核心体温升高造成的食欲抑制是必要的。另有研究表明,当在肉鸡脑室注射大麻素受体拮抗剂利莫那班时,可以同时调低促食欲基因AgRP和厌食欲基因POMC的表达,同时对NPY和CRH基因的表达无显著影响[20],这与本研究的结果相似,推测AgRP与POMC在表达上存在一定的同向关联性。Levine等[21]在研究中发现采用不同时间或强度的应激处理既能增加采食又能降低采食,本研究结果显示热处理使得下丘脑促食欲基因AgRP和厌食欲基因POMC的表达均显著上调,为上述理论提供了支持。
3.3 热处理对下丘脑AMPK信号通路相关基因表达的影响下丘脑AMPK是细胞和系统能量稳态的调节器,当AMPK信号通路被激活时,可以提高机体食欲[22]。本研究发现,热处理显著下调了下丘脑AMPK信号通路相关基因AMPKα2和FAS的表达,AMPK能量通路活性受到抑制。余春莲[23]在研究中发现热应激会显著降低支持细胞内AMPK的磷酸化水平,这与本研究结果相似。本研究结果说明,当下丘脑AMPK能量通路活性被抑制时,会显著调高促食欲基因AgRP和厌食欲基因POMC的表达,说明下丘脑AMPK系统可能通过调节食欲调控相关基因AgRP和POMC的表达,进而参与机体的食欲调控。周华金等[20]在研究中发现肉仔鸡下丘脑AMPK系统可以影响AgRP的表达,为上述理论提供了支持。Lee-Young等[24]研究证实在胰岛素抵抗小鼠骨骼肌中,AMPKα2亚基功能性激活是胰岛素刺激肌糖原合成所必需的,推断AMPKα2可能在下丘脑中主要参与糖原的合成途径,进而增加ATP合成,维持能量平衡。FAS是脂肪酸合成途径的关键酶,已有研究显示,当机体由于热应激而激活AMPK能量通路时,会引起FAS活性升高,进而导致脂肪沉积[25-26]。所以,当AMPK能量通路的活性受到抑制时,FAS的表达量是降低的。CPT-1是促进长链脂肪酸进入线粒体进行脂肪酸β-氧化的酶[27],本试验中热处理未对肉鸡下丘脑CPT-1 mRNA相对表达量产生显著影响,推断热处理只是抑制了脂肪的合成而未引起脂肪的分解。同样,热处理也未对肉鸡下丘脑ACC mRNA相对表达量产生显著影响,这与秦玉辉[28]在蛋鸡肝脏中的研究成果存在一定的差异,可能与试验材料的选择不同有关,ACC基因的表达未发生显著变化的机制还需要进一步探讨。
AMPK和mTOR都是细胞的能量感受器,而且两者位于相同的神经细胞亚群,并在改变采食行为上呈负相关[29]。mTOR是AMPK的一个下游靶点,AMPK抑制mTORC1的活性[30-31]。AKT1是重要的抗凋亡调节因子,AKT1活性的升高可以促进mTOR的激活。下丘脑mTOR活性增加时,会导致动物采食量降低,并伴随着体重的减轻。本研究结果说明,AMPK活性被抑制时,AKT1基因的表达量是显著上调的,这与前人的研究结果相类似;但是mTOR基因的表达量未发生显著变化,可能与细胞间释放因子的相互作用有关,具体原因还需要进一步探讨。
4 结论① 热处理对肉鸡下丘脑中食欲调控相关基因的表达有一定的影响,能够显著上调促食欲基因AgRP和厌食欲基因POMC的表达。
② 热处理能够显著下调下丘脑AMPK信号通路中AMPKα2基因的表达,从而抑制AMPK能量通路的活性,并可显著下调FAS基因的表达,显著上调AKT1基因的表达。
| [1] |
GAO Q, HORVATH T L. Cross-talk between estrogen and leptin signaling in the hypothalamus[J]. American Journal of Physiology-Endocrinology and Metabolism, 2008, 294(5). |
| [2] |
徐彦博.芍药苷对离体大鼠下丘脑腹内侧核神经元电生理活动的影响[D].硕士学位论文.西安: 第四军医大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-90026-2008196755.htm
|
| [3] |
唐焰.下丘脑神经元在体活动参与摄食调控[D].博士学位论文.上海: 华东师范大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10269-1016145946.htm
|
| [4] |
ELMQUIST J K, MARCUS J N. Rethinking the central causes of diabetes[J]. Nature Medicine, 2003, 9(6): 645-647. DOI:10.1038/nm0603-645 |
| [5] |
SUZUKI K, JAYASENA C N, BLOOM S R. Obesity and appetite control[J]. Experimental Diabetes Research, 2012, 2012: 824305. |
| [6] |
DENBOW D M, MEADE S, ROBERTSON A, et al. Leptin-induced decrease in food intake in chickens[J]. Physiology & Behavior, 2000, 69(3): 359-362. |
| [7] |
GERETS H H J, PEETERS K, ARCKENS L, et al. Sequence and distribution of pro-opiomelanocortin in the pituitary and the brain of the chicken (Gallus gallus)[J]. Journal of Comparative Neurology, 2000, 417(2): 250-262. DOI:10.1002/(SICI)1096-9861(20000207)417:2<250::AID-CNE9>3.0.CO;2-Z |
| [8] |
KRISTENSEN P, JUDGE M E, THIM L, et al. Hypothalamic CART is a new anorectic peptide regulated by leptin[J]. Nature, 1998, 393(6680): 72-76. DOI:10.1038/29993 |
| [9] |
HARDIE D G, SCOTT J W, PAN D A, et al. Management of cellular energy by the AMP-activated protein kinase system[J]. FEBS Letters, 2003, 546(1): 113-120. DOI:10.1016/S0014-5793(03)00560-X |
| [10] |
DZAMKO N, VAN DENDEREN B J W, HEVENER A L, et al. AMPK β1 deletion reduces appetite, preventing obesity and hepatic insulin resistance[J]. Journal of Biological Chemistry, 2010, 285(1): 115-122. DOI:10.1074/jbc.M109.056762 |
| [11] |
XIAO B, SANDERS M J, UNDERWOOD E, et al. Structure of mammalian AMPK and its regulation by ADP[J]. Nature, 2011, 472(7342): 230-233. DOI:10.1038/nature09932 |
| [12] |
MINOKOSHI Y, ALQUIER T, FURUKAWA N, et al. AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus[J]. Nature, 2004, 428(6982): 569-574. DOI:10.1038/nature02440 |
| [13] |
AHIMA R S, OSEI S Y. Molecular regulation of eating behavior:new insights and prospects for therapeutic strategies[J]. Trends in Molecular Medicine, 2001, 7(5): 205-213. DOI:10.1016/S1471-4914(01)01989-X |
| [14] |
CEJAS P J, MARTINEZ M, KARMALLY S, et al. Lumbar transplant of neurons genetically modified to secrete brain-derived neurotrophic factor attenuates allodynia and hyperalgesia after sciatic nerve constriction[J]. Pain, 2000, 86(1/2): 195-210. |
| [15] |
BURDYGA G, DE LARTIGUE G, RAYBOULD H E, et al. Cholecystokinin regulates expression of Y2 receptors in vagal afferent neurons serving the stomach[J]. Journal of Neuroscience, 2008, 28(45): 11583-11592. DOI:10.1523/JNEUROSCI.2493-08.2008 |
| [16] |
魏凤, 郭广君, 吕素芳, 等. 猪原代神经细胞的体外培养与鉴定[J]. 中国兽医学报, 2016, 36(8): 1367-1370. |
| [17] |
MAKIMURA H, MIZUNO T M, ROBERTS J, et al. Adrenalectomy reverses obese phenotype and restores hypothalamic melanocortin tone in leptin-deficient ob/ob mice[J]. Diabetes, 2000, 49(11): 1917-1923. DOI:10.2337/diabetes.49.11.1917 |
| [18] |
TSIGOS C, CHROUSOS G P. Hypothalamic-pituitary-adrenal axis, neuroendocrine factors and stress[J]. Journal of Psychosomatic Research, 2002, 53(4): 865-871. DOI:10.1016/S0022-3999(02)00429-4 |
| [19] |
JEONG J H, LEE D K, LIU S M, et al. Activation of temperature-sensitive TRPV1-like receptors in ARC POMC neurons reduces food intake[J]. PLoS Biology, 2018, 16(4): e2004399. DOI:10.1371/journal.pbio.2004399 |
| [20] |
周华金, 孙晓蕾, 钟光, 等. 大麻素受体1拮抗剂利莫那班对肉仔鸡下丘脑食欲调控因子和腺苷酸激活蛋白激酶基因表达的影响[J]. 动物营养学报, 2019, 31(1): 258-265. DOI:10.3969/j.issn.1006-267x.2019.01.032 |
| [21] |
LEVINE A S, MORLEY J E. Stress-induced eating in rats[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 1981, 241(1). |
| [22] |
KOLA B, HUBINA E, TUCCI S A, et al. Cannabinoids and ghrelin have both central and peripheral metabolic and cardiac effects via AMP-activated protein kinase[J]. Journal of Biological Chemistry, 2005, 280(26): 25196-25201. DOI:10.1074/jbc.C500175200 |
| [23] |
余春莲.AMPK信号通路负向调节热应激诱导仔猪睾丸支持细胞乳酸分泌[D].硕士学位论文.重庆: 西南大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10635-1017847372.htm
|
| [24] |
LEE-YOUNG R S, BONNER J S, MAYES W H, et al. AMP-activated protein kinase (AMPK)α2 plays a role in determining the cellular fate of glucose in insulin-resistant mouse skeletal muscle[J]. Diabetologia, 2013, 56(3): 608-617. DOI:10.1007/s00125-012-2787-7 |
| [25] |
王启军.高温环境对不同生长阶段北京油鸡脂肪沉积及脂质代谢的影响[D].硕士学位论文.杨凌: 西北农林科技大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10712-2006179646.htm
|
| [26] |
BAZIZ H A, GERAERT P A, PADILHA J C F, et al. Chronic heat exposure enhances fat deposition and modifies muscle and fat partition in broiler carcasses[J]. Poultry Science, 1996, 75(4): 505-513. DOI:10.3382/ps.0750505 |
| [27] |
LÓPEZ M, LELLIOTT C J, VIDAL-PUIG A. Hypothalamic fatty acid metabolism:a housekeeping pathway that regulates food intake[J]. BioEssays, 2007, 29(3): 248-261. DOI:10.1002/bies.20539 |
| [28] |
秦玉辉.蛋鸡体内AMPK酶活分布及应激对AMPK酶活影响研究[D].硕士学位论文.雅安: 四川农业大学, 2003. http://cdmd.cnki.com.cn/Article/CDMD-10626-2003094362.htm
|
| [29] |
YANG C S, LAM C K L, CHARI M, et al. Hypothalamic AMP-activated protein kinase regulates glucose production[J]. Diabetes, 2010, 59(10): 2435-2443. DOI:10.2337/db10-0221 |
| [30] |
CHEN L, JIAO Z H, ZHENG L S, et al. Structural insight into the autoinhibition mechanism of AMP-activated protein kinase[J]. Nature, 2009, 459(7250): 1146-1149. DOI:10.1038/nature08075 |
| [31] |
YAMAUCHI T, KAMON J, MINOKOSHI Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase[J]. Nature Medicine, 2002, 8(11): 1288-1295. DOI:10.1038/nm788 |




