2. 河南科技学院动物科技学院, 新乡 453003
2. College of Animal Science and Veterinary Medicine, Henan Institute of Science and Technology, Xinxiang 453003, China
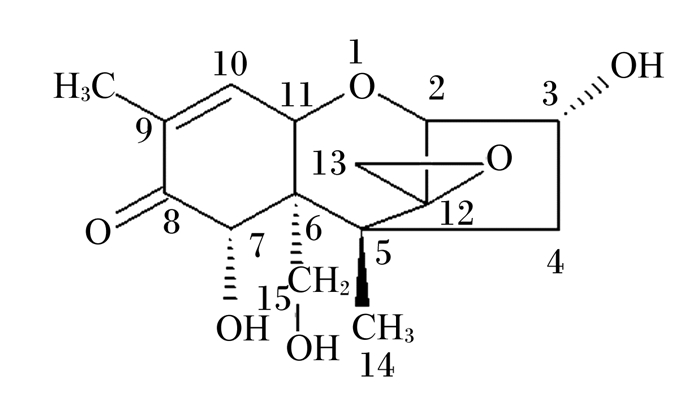
脱氧雪腐镰刀菌烯醇(DON)又称呕吐毒素,是一种高毒性的次级代谢产物,属于真菌毒素,主要由禾谷镰刀菌(Fusarium graminearum)和黄色镰刀菌(Fusarium culmorum)产生[1-2],其化学名为3α, 7α, 15-三羟基草镰孢菌-9-烯-8-酮,属B族单端孢霉烯族化合物[3-4],结构为四环倍半萜,分子式为C15H20O6,相对分子相对量为296.32[5]。DON的分子结构式如图 1所示。
|
图 1 DON的分子结构式 Fig. 1 Molecular structure of DON |
全球范围内的小麦、大麦和玉米等粮谷类农作物均受到DON污染[6]。它易引起动物拒食,可表现出免疫毒性、器官毒性、抑制蛋白质合成以及致畸性,且与免疫抑制、克山病、食管癌等疾病也有密切联系[7-9]。因此,DON污染饲料不仅带来动物健康的问题,而且能通过其在食品中的积累严重威胁人的健康[10]。鉴于其严重的毒性影响,欧盟委员会(EC)公布的人类对DON的每日最大可耐受摄入量为1 μg/kg BW,欧盟(EU)设置了未加工谷物和食品中DON含量最大值分别为1 250和750 ng/g,中国规定玉米、小麦及其制品中DON含量最大值为1 000 ng/g[11]。
目前,有多种理化分析方法可用于检测食品和饲料中DON污染,主要包括薄层色谱(TLC)、高效液相色谱(HPLC)、气相色谱(GC)、质谱(MS)、气相色谱-质谱联用(GC-MS)、高效液相色谱-串联质谱(HPLC-MS)等方法[12-14]。这些方法具有高精度和高灵敏度,但需要更多的时间和成本来达到可接受的分析精度,并且具有仪器设备昂贵、样品前处理复杂、需要熟练的技术人员、不适合筛选大量样品等缺点。相反,免疫分析方法,如传统的酶联免疫吸附测定(ELISA)[15]、化学发光酶免疫分析(CLEIA)[16]、荧光偏振免疫分析(FPIA)[17]、时间分辨荧光免疫分析(TRFIA)[18]、胶体金免疫层析法(GICA)[19]等,因具有简单、特异、低成本和能执行高通量筛选等优点,已被广泛应用于DON的检测。此外,有些ELISA快速检测技术也受到了越来越多的关注,它是一种已被消费者和检疫人员接受的替代或补充检测方法[20],如表面等离子体共振(SPR)免疫分析[21]、银染色-胶体金(GICA)[22]、纳米-ELISA[23]和免疫传感器等。由于真菌毒素污染的普遍性和大量的样品需要分析,ELISA试剂盒被认为是检测真菌毒素的一种合适的筛选工具。本试验拟组装并调试一种新的DON间接竞争酶联免疫吸附测定(icELISA)试剂盒,对其进行各项性能测定,并用HPLC法验证其正确性,为研制具有灵敏度高、特异性强、定量好、能筛选大量DON污染样品的ELISA试剂盒奠定基础。
1 材料与方法 1.1 试验材料 1.1.1 试剂DON(纯度≥98%)、3-乙酰基-脱氧雪腐镰刀菌烯醇(3-Ac-DON,96%)、15-乙酰基-脱氧雪腐镰刀菌烯醇(15-Ac-DON,96%)、雪腐镰刀菌烯醇(NIV,97%)、镰刀菌酮-X(fusarenon-X,95%)、T-2毒素(98%)、玉米赤霉醇(ZER,97%)、黄曲霉毒素B1(AFB1,98%)等标准品均为Sigma-Aldrich公司产品,牛血清白蛋白(BSA,96%)、鸡卵清蛋白(OVA,98%)、N, N'-羰基二咪唑(CDI,98%)、1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC,98%)、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)、单克隆抗体同种型鉴定试剂盒(mAb isotyping kit)均为Pierce公司产品,聚乙二醇1500(PEG-1500)为Roche公司产品,RPMI-1640细胞培养基,次黄嘌呤-氨基喋呤-胸腺嘧啶核苷(HAT)(50×)培养基、次黄嘌呤-胸腺嘧啶核苷(HT)(50×)培养基和8-杂氮鸟嘌呤(8-AG)培养基、透析袋(8 000~14 000 u)、秋水仙素、酚红(phenol red)为北京索莱宝公司产品,辣根过氧化物酶标记羊抗鼠免疫球蛋白G(GaM IgG-HRP)为华美生物技术公司产品,96孔可拆卸酶标板、24孔细胞培养板、96孔细胞培养板为Iwaki公司产品,3,3,5,5-四甲基联苯胺(TMB)、非那西丁、过氧化脲为Sigma公司产品,胎牛血清(FBS)为Gibco公司产品。除另有说明外,所有溶剂和试剂均为分析级或更高级别。雌性BALB/c小鼠(6~8周龄)由北京无特定病原体(SPF)级生物技术公司提供,在本实验室动物房严格控制条件下饲养。
1.1.2 溶液磷酸盐缓冲液(PBS)、碳酸盐缓冲液(CBS)、冲洗液(PBST,即PBS中加入0.05%吐温-20)、封闭液(SPBST,即PBST中加入5%山羊血清)、样品稀释液、底物显色液、终止液(即2 mol/L H2SO4)、葡萄糖氯化钠钾注射液(GNK)、完全培养基、HAT培养基、HT培养基等均为实验室自制。
DON梯度标准液:准确称取DON 5 mg,加入乙腈5 mL使其溶解,配制成浓度为1 mg/mL的母液。根据试验所需DON浓度,用PBS进行稀释配制成DON终浓度分别为0、1.0、2.0、4.0、8.0、16.0、32.0、64.0、128.0 μg/L的9个标准液。
1.1.3 仪器Galaxy S型CO2细胞培养箱,Biotech公司产品;Multiskan MK3酶标仪(用于450 nm处吸光度的测定),美国Thermo公司产品;MIC 00949型倒置显微镜,购于Nikon公司;DK-8D水浴锅,中国上海益恒仪器有限公司产品;BS124S电子天平,德国Sartorius集团产品;LDZX-30 KB型蒸汽灭菌器,由中国上海市申安医疗器械厂提供;Milli-Q净化系统(用于超纯水的制备,美国Millipore公司产品;A11 basic分析用研磨机,德国IKA公司产品;Legend Micro 17微型离心机;美国Thermo公司产品;玻璃微纤维滤纸,英国Whatman公司产品;HPLC Aglient 1260 DAD检测器(用于确认icELISA试剂盒的可靠性),美国Agilent Technologies公司产品。
1.2 试验方法 1.2.1 抗原和抗DON单克隆抗体(mAb)的制备根据DON的分子结构,参考Maragos等[5]的方法并加以改进,采用羰基二咪唑(CDI)法合成人工抗原DON-BSA。首先进行化学修饰,用DON与CDI反应引入活性基团羰基(—C=O—)合成半抗原。再将引入的羰基与载体蛋白BSA的氨基(—NH2)以单酰胺键(—CONH—)的形式实现偶联合成完全抗原。通过紫外和红外光谱鉴定人工抗原是否偶联成功。包被原DON-OVA的合成参考Li等[24]的方法并加以改进,先用马来酸酐对DON分子衍生化,引入活性基团羧基(—COOH)合成半抗原,再采用EDC法将半抗原与OVA偶联合成包被原DON-OVA。
应用经典的杂交瘤技术[25]制备抗DON mAb。获得DON mAb杂交瘤细胞株后,采纳体内诱生腹水法[26]大量生产抗DON mAb,并对收集后的腹水采用辛酸/硫酸铵沉淀法纯化。然后储存在-20 ℃直到用于组装DON icELISA试剂盒。
1.2.2 DON icELISA试剂盒的研制 1.2.2.1 包被原DON-OVA、抗DON mAb最佳工作浓度和酶标二抗最佳稀释度的确定采用方阵滴定法[27]确定DON-OVA、抗DON mAb的最佳工作浓度,并对酶标二抗最佳稀释度等进行优化选择,以确定最适反应条件。
1.2.2.2 试剂盒标准曲线的绘制与拟合根据icELISA试剂盒所测抑制效价,以不同浓度DON标准液对抗DON mAb的抑制率[加不同浓度DON标准液与不加DON标准液时的吸光度比值(B/B0)]为纵坐标,以标准液中DON浓度的对数为横坐标,绘制S型曲线并在曲线上得出线性回归方程,计算试剂盒理论上的检测范围和半抑制浓度(IC50)。
1.2.2.3 试剂盒条件的调整icELISA试剂盒优化条件对检测技术的完善至关重要。icELISA试剂盒的组成和参数见表 1。
|
|
表 1 icELISA试剂盒的组成和参数 Table 1 Composition and parameters of icELISA kit |
选取有代表性的样品如小麦、玉米、猪料、鸡料等20份饲料进行粉碎。然后,每种样品准确称取5 g(精确至0.01 g),分别添加到含有20%甲醇的25 mL超纯水中,再加2 g聚乙二醇,超声提取10 min,混合均匀,静置2 h,取其上清以4 000 r/min离心10 min。最后,将上清液用玻璃微纤维滤纸过滤至滤液澄清,此为待检样品提取液。在用作试剂盒分析前,用样品稀释液稀释即可。
1.2.2.5 试剂盒的操作1) 加标准品或样品:在标准品孔加入不同浓度的DON标准液(50 μL/孔)、样品孔加入样品提取液(25 μL/孔),并标记标准品孔和样品孔。随后加入工作浓度的抗DON mAb(25 μL/孔),设阴性和空白对照,然后在37 ℃恒温培养箱温育15 min,洗板。
2) 加酶标二抗:将GaM IgG-HRP稀释至优化工作浓度(1 : 2 500)后加入(50 μL/孔),37 ℃恒温培养箱温育25 min,洗板。
3) 显色:加入底物显色液(50 μL/孔),室温下避光静置5 min。
4) 终止:加入终止液(50 μL/孔)。
5) 酶标仪读数:在450 nm处时测量吸光度,计算抑制率。
1.2.3 DON icELISA试剂盒的性能测定 1.2.3.1 灵敏度测定按照Hayashi等[28]和刘智宏等[29]竞争ELISA灵敏度为(B/B0)%=83.3%的方法,根据标准曲线回归方程计算试剂盒的灵敏度,确定其检测限。
1.2.3.2 准确度与精密度测定采用添加回收试验,通过回收率和相对标准偏差(RSD)来测定试剂盒的准确度与精密度。在小麦、玉米、猪料、鸡料4个样品中添加3个浓度的DON标准液,使4个样品中DON浓度分别为100、500、1 000 ng/mL,并室温搅拌2 h。然后用DON icELISA试剂盒进行检测,每个样品做3次重复。根据结果计算回收率和RSD:

|
通过DON icELISA试剂盒与其他相关真菌毒素之间的交叉反应进行特异性评价,并计算交叉反应率(CR):
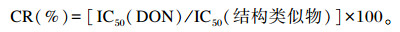
|
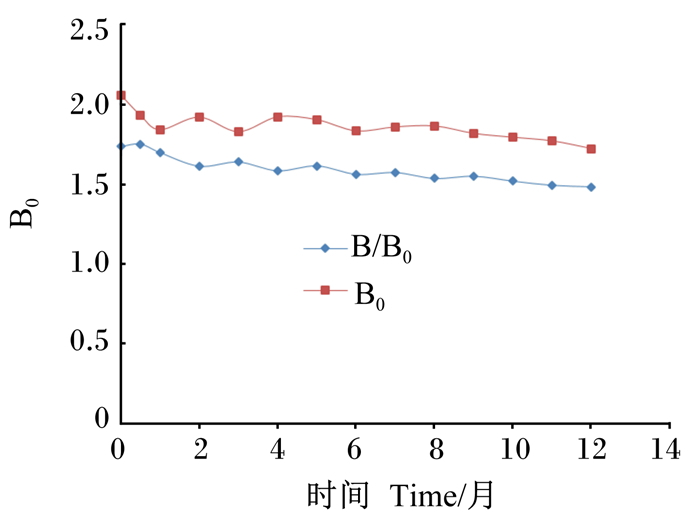
通过DON icELISA试剂盒在存放期间B0(不加DON标准液时的吸光度)和B/B0(%,加5 ng/mL DON标准液与不加DON标准液时的吸光度比值)的变化进行稳定性评价。
1.2.3.5 基质效应性测定为了分析样品基质对DON icELISA试剂盒敏感性的影响,将DON标准液分别溶于小麦、玉米、猪料、鸡料4个样品中,然后用样品稀释液稀释,按照试剂盒的方法操作绘制曲线进行基质效应性分析。
1.2.4 HPLC法对DON icELISA试剂盒的确认分别采用自主组装的DON icELISA试剂盒和HPLC法对20份饲料样品进行初筛,比较检测结果,判断该试剂盒与HPLC法检测结果的相关性。采用国家标准GB 5009.111—2016[30]中HPLC法对样品中DON进行检测。色谱条件:C18液相色谱柱(150 mm×4.6 mm×5 μm);流动相为甲醇-水(20 : 80,体积比),流速为0.8 mL/min,柱温为35 ℃,进样量为50 μL,检测波长为218 nm。
2 结果与分析 2.1 DON icELISA试剂盒的研制 2.1.1 包被原DON-OVA、抗DON mAb最佳工作浓度以及酶标二抗最佳稀释度的确定方阵滴定检测优化后,确定包被原DON-OVA的最佳工作浓度为1 μg/mL,抗DON mAb的最佳工作浓度为1 : 32 000,酶标二抗的最佳稀释度为1 : 2 500。
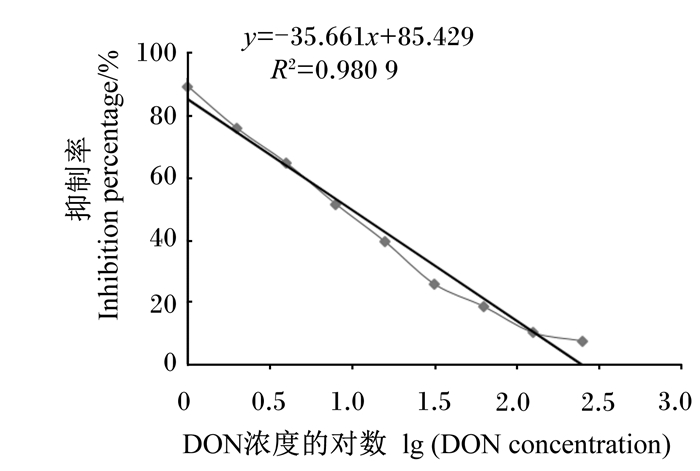
2.1.2 DON icELISA试剂盒标准曲线的绘制与拟合优化条件下DON icELISA试剂盒的标准曲线如图 2所示。通过对标准曲线进行分析,得到回归方程y=-35.661x+85.429,相关系数(R2)=0.980 9,IC50=9.84 ng/mL,检测范围为1.50~130.31 ng/mL。
|
图 2 DON icELISA试剂盒的标准曲线 Fig. 2 Standard curve of DON icELISA kit |
当B/B0=83.3%时,代入回归方程,求得所对应的DON浓度为1.147 ng/mL,即灵敏度为1.147 ng/mL,但考虑到实际检测工作的需要和用户操作方面的误差,将DON icELISA试剂盒的检测限确定为1.50 ng/mL。
2.2.2 准确度与精密度测定由表 2可知,对小麦、玉米、猪料、鸡料4个样品进行添加回收试验,回收率在77.1%~113.2%、RSD在4.2%~12.6%,符合国家标准中对准确度和精密度的要求,表明试剂盒可以用于实际样品的检测。
|
|
表 2 DON icELISA试剂盒对不同样品的DON回收率 Table 2 Recoveries of DON in different samples by icELISA kit (n=3) |
由表 3可知,DON icELISA试剂盒与其他相关真菌毒素的交叉反应是可以忽略不计的,除与3-AC-DON的交叉反应率为5.3%外,与其他真菌毒素交叉反应率低于0.2%,说明该试剂盒的特异性较高。
|
|
表 3 DON icELISA试剂盒与其他相关真菌毒素的交叉反应 Table 3 Cross-reactivity of DON icELISA kit with other related mycotoxins |
由图 3可知,DON icELISA试剂盒在存放期间,B0和B/B0显示出可接受的降低,说明该试剂盒具有很好的稳定性,有效使用寿命至少为12个月。
|
图 3 DON icELISA试剂盒的稳定性 Fig. 3 Stability of DON icELISA kit |
由图 4可知,小麦、玉米、猪料、鸡料4个样品提取液倍比稀释绘制的曲线接近DON标准曲线,所测标准曲线的IC50分别为8.81、11.64、13.06、7.59 ng/mL,表明基质干扰可以忽略不计。因此,DON icELISA试剂盒可在不同基质下操作检测。
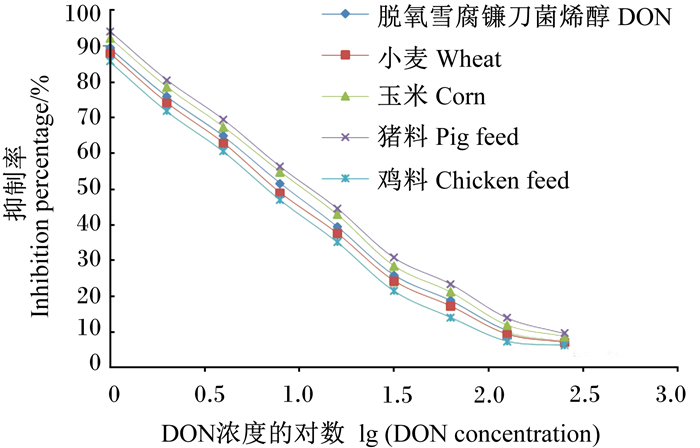
|
图 4 不同样品基质对DON icELISA试剂盒的影响 Fig. 4 Effects of different sample matrix on DON icELISA kit |
由表 4可知,用自主组装DON icELISA试剂盒和HPLC法分别对20份饲料样品进行初筛,其中HPLC法共筛出13份阳性样品,DON icELISA试剂盒共筛出12份阳性样品,未筛出的样品经HPLC法检测毒素含量为45 ng/g,已低于DON icELISA试剂盒的检测范围。因此,二者符合率为92.3%,说明DON icELISA试剂盒在其检测范围内与HPLC法检测结果一致性良好。
|
|
表 4 2种方法对20份饲料样品的检测结果比较 Table 4 Comparison of measured results of 20 feed samples detected by two different methods |
由于DON分子结构的特殊性,分别在C3、C7和C15位上有羟基及C8位上有酮基基团,理论上有4个位点可以引入桥结构,但由于C8位上酮基的影响,C7位上的羟基不活拨,一般较难发生衍生反应,因此,只有C3、C8和C15位上的羟基能作为活性位点。在多数报道制备DON抗体的文献中,大多对DON抗原合成进行位点选择,选择性利用其中一个羟基衍生后偶联蛋白。如Casale等[31]通过活化C8位上的酮基后制备人工抗原免疫小鼠获得的抗体特异性不好,而通过活化C3位上的羟基制备人工抗原免疫小鼠后,得到1株稳定分泌抗DON mAb的杂交瘤细胞株,并建立了免疫学检测方法。有些文献,如Li等[24]报道采用先封闭C7和C15位上的羟基,再利用C3位上的羟基衍生的方法也得到了较好的人工抗原,但这些方法制备过程较为复杂,操作繁琐。因此,在完全抗原偶联中,尝试采取多种方法来制备,分别免疫动物比较结果,从而筛选出最佳的完全抗原。本研究通过对比试验比较了多种偶联方法,试验结果表明,参照Maragos等[5]的CDI法并加以改进的方法效果最好,DON分子上的2个羟基可能都会发生反应。所以,本试验采取CDI法成功将DON分子C3和C15位上的羟基与载体蛋白BSA上的氨基共价偶联得到免疫原DON-BSA,而无封闭任何位点上的羟基,直接引入咪唑基实现与载体蛋白BSA的偶联。此方法合成的人工抗原与之前文献Lee等[32]报道合成的人工抗原没有明显的差异,免疫小鼠效果较好,但步骤简单利于操作,因此可以降低以后的应用成本。同时,我们利用EDC法合成了包被原,用马来酸酐直接对DON衍生,不需要封闭而得到了较好的检测抗DON抗体的包被原。然后,通过用人工抗原免疫小鼠,利用小鼠多抗进行ELISA检测,观察到既有较高的效价,DON分子又能对小鼠多抗产生抑制进行鉴定,结果证明人工抗原合成成功。
3.2 DON icELISA试剂盒性能的测定本试验用实验室自制高亲和力抗DON mAb组装icELISA试剂盒,其性能测定包括灵敏度、准确度和精密度、特异性、稳定性和基质效应性等方面。灵敏度测定可以按照Hayashi等[28]和刘智宏等[29]竞争ELISA灵敏度为(B/B0)%=83.3%的方法计算,也可根据公式检测限(%)=[(平均值-2×标准差)/平均值]×100计算。本试验采用(B/B0)%=83.3%的方法确定灵敏度为1.147 ng/mL,检测限为1.50 ng/mL,检测范围为1.50~130.31 ng/mL。我国卫生部建立的DON ELISA法的最低检出量为5 ng/mL,检测范围为5~1 000 ng/mL,被批准为国家推荐标准检测方法。因此,本实验室组装的DON icELISA试剂盒检测范围和灵敏度均能满足国内对食品及饲料中DON限量标准的检测要求。准确度和精密度通过样品添加回收率、RSD来衡量,一般要求回收率在70%~140%。本试验中,DON icELISA试剂盒对DON的回收率为76.3%~113.2%、RSD为3.9%~13.2%,符合国家标准中对准确度和精密度的要求,表明该试剂盒可以用于实际样品的检测。抗体是ELISA试剂盒检测方法的基础,可能会导致结果假阳性或假阴性,而HPLC法检测准确,常用做验证方法。利用本实验室组装的DON icELISA试剂盒与HPLC法对20份饲料样品中DON进行初筛,2种方法检测结果的符合率为92.3%,因此该试剂盒可以用于食品及饲料中DON的检测。
3.3 生物毒素样品的前期处理对样品进行前期处理可使HPLC法和ELISA法检测结果更加准确。样品经提取后对其进行DON检测,其中ELISA法的样品前处理较为简单,经提取后直接过滤即可用于检测,而HPLC法的样品前处理需过免疫亲和柱。有试验将ELISA法与HPLC法相比,提取后的样品直接过滤后进行ELISA法检测的回收率较高,在75%以上,RSD在4.7%~10.6%;而过柱后经HPLC法和ELISA法检测,在加标浓度较高的情况下两者回收率相当,分别为49.8%和49.7%,RSD分别为1.8%和5.6%[33]。这说明采用ELISA法检测样品毒素简化了样品预处理和纯化过程,其结果准确可靠,检测步骤简单,非常适用于大量样品的快速初筛;并且,ELISA法干扰小,特异性强,同时酶促反应时间短,缩短了整个检测的时间。
4 结论本试验在优化包被原、单抗工作浓度以及酶标二抗稀释度的基础上,利用自主研制的抗DON mAb建立检测了DON的icELISA试剂盒,该试剂盒具备与HPLC法同样的检测能力,对DON检测具有准确可靠、方便快捷、高通量大等特点,可以广泛应用于食品及饲料中DON的检测。
| [1] |
ZUO H G, ZHU J X, SHI L, et al. Development of a novel immunoaffinity column for the determination of deoxynivalenol and its acetylated derivatives in cereals[J]. Food Analytical Methods, 2018, 11(8): 2252-2260. DOI:10.1007/s12161-018-1211-4 |
| [2] |
朱金林. 呕吐毒素最新研究进展及发展趋势[J]. 国外畜牧学(猪与禽), 2013, 33(12): 102-104. |
| [3] |
JIANG D F, CHEN J D, LI F H, et al. Deoxynivalenol and its acetyl derivatives in bread and biscuits in Shandong province of China[J]. Food Additives and Contaminants:Part B Surveillance, 2017, 11(1): 43-48. |
| [4] |
KONG D Z, WU X L, LI Y, et al. Ultrasensitive and eco-friendly immunoassays based monoclonal antibody for detection of deoxynivalenol in cereal and feed samples[J]. Food Chemistry, 2019, 270: 130-137. DOI:10.1016/j.foodchem.2018.07.075 |
| [5] |
MARAGOS C M, MCCORMICK S P. Monoclonal antibodies for the mycotoxins deoxynivalenol and 3-acetyl-deoxynivalenol[J]. Food and Agricultural Immunology, 2000, 12(3): 181-192. DOI:10.1080/09540100050140722 |
| [6] |
ENNOUARI A, SANCHIS V, MARÍN S, et al. Occurrence of deoxynivalenol in durum wheat from Morocco[J]. Food Control, 2013, 32(1): 115-118. DOI:10.1016/j.foodcont.2012.10.036 |
| [7] |
PESTKA J J, SMOLINSKI A T. Deoxynivalenol:toxicology and potential effects on humans[J]. Journal of Toxicology and Environmental Health:Part B, 2005, 8(1): 39-69. DOI:10.1080/10937400590889458 |
| [8] |
JI F, LI H, XU J H, et al. Enzyme-linked immunosorbent-assay for deoxynivalenol (DON)[J]. Toxins, 2011, 3(12): 968-978. |
| [9] |
LIAO Y X, PENG Z, CHEN L K, et al. Deoxynivalenol, gut microbiota and immunotoxicity:a potential approach?[J]. Food and Chemical Toxicology, 2018, 112: 342-354. DOI:10.1016/j.fct.2018.01.013 |
| [10] |
TIMA H, BERKICS A, HANNIG Z, et al. Deoxynivalenol in wheat, maize, wheat flour and pasta:surveys in Hungary in 2008—2015[J]. Food Additives & Contaminants:Part B, 2018, 11(1): 37-42. |
| [11] |
LI M, SUN M N, HONG X, et al. Survey of deoxynivalenol contamination in agricultural products in the Chinese market using an ELISA kit[J]. Toxins, 2018, 11(1): 6. DOI:10.3390/toxins11010006 |
| [12] |
FANG S, ZHANG B, REN K W, et al. Development of a sensitive indirect competitive enzyme-linked immunosorbent assay (ic-ELISA) based on the monoclonal antibody for the detection of the imidaclothiz residue[J]. Journal of Agricultural and Food Chemistry, 2011, 59(5): 1594-1597. DOI:10.1021/jf104241n |
| [13] |
RIGHETTI L, GALAVERNA G, DALL'ASTA C. Group detection of DON and its modified forms by an ELISA kit[J]. Food Additives & Contaminants:Part A, 2017, 34(2): 248-254. |
| [14] |
ZHANG X, WANG X, SUN M J, et al. A magnetic nanoparticle based enzyme-linked immunosorbent assay for sensitive quantification of zearalenone in cereal and feed samples[J]. Toxins, 2015, 7(10): 4216-4231. DOI:10.3390/toxins7104216 |
| [15] |
DOS SANTOS J S, TAKABAYASHI C R, ONO E Y S, et al. Immunoassay based on monoclonal antibodies versus LC-MS:deoxynivalenol in wheat and flour in Southern Brazil[J]. Food Additives & Contaminants:Part A, 2011, 28(8): 1083-1090. |
| [16] |
丁丽华, 于斐, 张冠军, 等. 脱氧雪腐镰刀菌烯醇的高灵敏化学发光磁酶免疫法检测[J]. 郑州大学学报(医学版), 2017, 52(2): 134-137. |
| [17] |
LI C L, WEN K, MI T J, et al. A universal multi-wavelength fluorescence polarization immunoassay for multiplexed detection of mycotoxins in maize[J]. Biosensors and Bioelectronics, 2016, 79: 258-265. DOI:10.1016/j.bios.2015.12.033 |
| [18] |
ZHANG J, GAO L, ZHOU B, et al. Simultaneous detection of deoxynivalenol and zearalenone by dual-label time-resolved fluorescence immunoassay[J]. Journal of the Science of Food and Agriculture, 2011, 91(2): 193-197. DOI:10.1002/jsfa.4151 |
| [19] |
XU Y, HUANG Z B, HE Q H, et al. Development of an immunochromatographic strip test for the rapid detection of deoxynivalenol in wheat and maize[J]. Food Chemistry, 2010, 119(2): 834-839. DOI:10.1016/j.foodchem.2009.08.049 |
| [20] |
BURMISTROVA N A, RUSANOVA T Y, YURASOV N A, et al. Multi-detection of mycotoxins by membrane based flow-through immunoassay[J]. Food Control, 2014, 46: 462-469. DOI:10.1016/j.foodcont.2014.05.036 |
| [21] |
KADOTA T, TAKEZAWA Y, HIRANO S, et al. Rapid detection of nivalenol and deoxynivalenol in wheat using surface plasmon resonance immunoassay[J]. Analytica Chimica Acta, 2010, 673(2): 173-178. DOI:10.1016/j.aca.2010.05.028 |
| [22] |
YU Q, LI H, LI C L, et al. Gold nanoparticles-based lateral flow immunoassay with silver staining for simultaneous detection of fumonisin B1 and deoxynivalenol[J]. Food Control, 2015, 54: 347-352. DOI:10.1016/j.foodcont.2015.02.019 |
| [23] |
QIU Y L, HE Q H, XU Y, et al. Deoxynivalenol-mimic nanobody isolated from a naive phage display nanobody library and its application in immunoassay[J]. Analytica Chimica Acta, 2015, 887: 201-208. DOI:10.1016/j.aca.2015.06.033 |
| [24] |
LI Y S, SHI W M, SHEN J Z, et al. Development of a rapid competitive indirect ELISA procedure for the determination of deoxynivalenol in cereals[J]. Food and Agricultural Immunology, 2012, 23(1): 41-49. DOI:10.1080/09540105.2011.589046 |
| [25] |
ZENG K, ZOU Y M, LIU J X, et al. Enzyme-linked immunosorbent assay for triclocarban in aquatic environments[J]. Water Science and Technology, 2015, 72(10): 1682-1691. DOI:10.2166/wst.2015.366 |
| [26] |
肖智.高特异性黄曲霉毒素B1单克隆抗体的研制[D].硕士学位论文.北京: 中国农业科学院, 2010.
|
| [27] |
陈善真, 李春玲, 贾爱卿, 等. 副猪嗜血杆菌OMP5基因的克隆表达及间接ELISA检测方法的建立[J]. 中国农业科学, 2011, 44(14): 3036-3044. DOI:10.3864/j.issn.0578-1752.2011.14.021 |
| [28] |
HAYASHI Y, MATSUDA R, ITO K, et al. Detection limit estimated from slope of calibration curve:an application to competitive ELISA[J]. Analytical Sciences, 2005, 21(2): 167-169. DOI:10.2116/analsci.21.167 |
| [29] |
刘智宏, 陈慧珠, 赵轶先, 等. 鸡血清中磺胺二甲嘧啶残留的酶免疫法测定[J]. 中国兽医学报, 1998, 18(4): 375-377. |
| [30] |
国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.111—2016食品安全国家标准食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定[S].北京: 中国标准出版社, 2017.
|
| [31] |
CASALE W L, PESTKA J J, HART L P. Enzyme-linked immunosorbent assay employing monoclonal antibody specific for deoxynivalenol (vomitoxin) and several analogs[J]. Journal of Agricultural and Food Chemistry, 1988, 36(3): 663-668. DOI:10.1021/jf00081a064 |
| [32] |
LEE H M, SONG S O, CHA S H, et al. Development of a monoclonal antibody against deoxynivalenol for magnetic nanoparticle-based extraction and an enzyme-linked immunosorbent assay[J]. Journal of Veterinary Science, 2013, 14(2): 143-150. DOI:10.4142/jvs.2013.14.2.143 |
| [33] |
杨丹妮, 汪海峰. 小麦中呕吐毒素的ELISA和HPLC法检测[J]. 安徽农业科学, 2013, 41(3): 1269-1270. DOI:10.3969/j.issn.0517-6611.2013.03.126 |




