2. 湖南省畜禽安全生产协同创新中心, 长沙 410128
2. Hunan Co-Innovation Center of Animal Production Safety, Changsha 410128, China
哺乳期母猪采食量的降低直接影响其泌乳性能。母猪围产期胰岛素抵抗(insulin resistance,IR)的发生与机体的慢性炎症和进程性氧化应激密切相关[1],其中泌乳早期IR、慢性炎症和进程性氧化应激的程度最为严重。母猪妊娠85 d至分娩阶段胎儿的生长占整个宫内生长的80%,为了满足自身需求、胎儿快速生长、乳腺快速发育等的营养需求,机体会迅速调整其代谢状态,一方面机体出现IR,使母体肌肉、肝脏等组织对血液葡萄糖的摄取减少以保证胎儿的生长;另一方面,机体极易发生代谢性综合征,一是妊娠后期母猪肠道菌群紊乱导致机体发生氧化应激和炎症反应[2-3],二是随着妊娠的进行,母体IR加剧,导致母体产生炎症应激。产生的氧化应激和炎症反应进一步加重母猪IR[4],从而降低母猪生产性能。功能性寡糖是一类不可被动物机体消化吸收的、由3~10个单糖通过糖苷键连接形成直链或支链的低度聚合糖,包括低聚异麦芽糖、低聚果糖、低聚木糖、低聚壳寡糖等。有研究发现,功能性寡糖可通过调节肠道菌群稳态,提高机体抗氧化和免疫能力[5-7],进而改善机体IR[1]。本文主要就IR对母猪生产性能的影响、母猪发生IR的原因以及功能性寡糖在调控母猪IR中的作用及其机制作一综述。
1 IR对母猪生产性能的影响母猪围产期IR与泌乳期采食量降低密切相关,而母猪繁殖周期遭受的进程性氧化应激是导致胰岛素敏感性降低的主要原因[8]。一方面,妊娠后期母猪出现IR有利于胎儿的生长发育;另一方面,由于妊娠后期母猪进程性氧化应激和代谢性综合征的发生不断加重机体IR的程度,从而导致生理性IR向病理性IR发展,进而引起机体发生炎症反应[4]。IR与机体炎症反应和氧化应激具有正反馈的关系。母猪妊娠后期和哺乳期IR增加会影响母猪体况,并且在一定程度上会降低母猪产活仔数、延长母猪产程、降低哺乳期的采食量、泌乳力等,进而影响母猪在繁殖周期内的生产性能[8]。
2 导致母猪发生IR的因素 2.1 母猪发生生理性IRIR是指胰岛素作用的靶器官对胰岛素作用的敏感性下降,即正常剂量的胰岛素产生低于正常生物学效应的一种状态。妊娠期和哺乳期母猪极易发生IR,导致其出现生理性IR的因素主要有:1)机体为满足胎儿生长和乳腺发育。妊娠后期胎儿快速生长和乳腺迅速发育需要大量的营养物质,因此母体通过调整其自身的能量分配,降低自身对胰岛素的敏感性,从而导致胰岛素分泌增加,致使母猪出现IR。分娩后机体胰岛素分泌量恢复正常,但敏感性降低[9]。另外,由于胰岛素分泌增多,胰岛的结构和功能也会发生变化,例如β细胞明显肥大和增生、伴β细胞间裂隙连接增加、胰岛淀粉样多肽(IAPP)分泌明显升高等,这些均与IR的发生和发展有关[10]。2)母体激素发生变化。随着妊娠周的增加,胰岛素的对抗激素如皮质醇、雌激素、孕酮、抵抗素和肿瘤坏死因子-α(TNF-α)等分泌增加,进一步加重机体产生IR[11]。3)胎盘分解脂肪的激素分泌增多。妊娠后期,胎儿快速生长导致胎盘分解脂肪的激素分泌增多,母体血浆中游离脂肪酸(FFA)含量增加,子宫平滑肌产生的二酰甘油含量增多,激活蛋白激酶C,这导致酪氨酸激酶活性下降,抑制3-磷酸肌醇激酶活性,从而使机体不能利用胰岛素摄取葡萄糖,引起胰岛素代偿性增加,进而导致机体发生IR[12]。生理性IR是母猪在妊娠后期的正常生理过程,是对胎儿以及母猪繁殖性能均有利的生理过程,是导致妊娠后期母猪发生IR的主要因素之一。但是,妊娠后期母猪产生的生理性IR极易发展成病理性IR,影响胎儿的生长发育,从而降低母猪的繁殖性能和泌乳性能。
2.2 母猪发生病理性IR肥胖、炎症、氧化应激和肠道菌群紊乱等均是导致妊娠和哺乳母猪出现病理性IR的重要因素,如图 1所示。
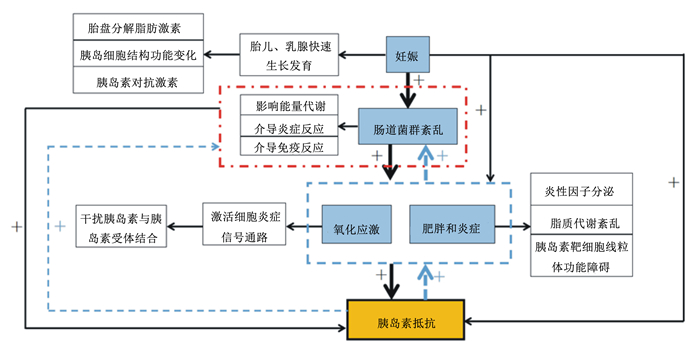
|
图 1 母猪发生胰岛素抵抗的因素 Fig. 1 Factors in development of insulin resistance in sows |
随着妊娠时间的推移,母猪的背膘厚度也不断增加。母猪妊娠时的背膘比配种前的背膘厚,尤其是在妊娠后期,母猪易出现肥胖现象。肥胖的实质是脂肪组织的扩大和增生,母猪过肥时脂肪组织分泌的促炎因子如游离脂肪酸(FFA)、TNF-α、白细胞介素-6(IL-6)、核因子-κB(NF-κB)等增多[13]。这些促炎因子通过诱导胰岛素反应性葡萄糖转运体(GLUT4)从细胞膜向细胞内膜转移,降低细胞对胰岛素刺激的葡萄糖的摄取能力而诱导系统性IR发生[14]。另外,药物激活肥胖小鼠体内过氧化物酶体增生物激活受体-γ(PPAR-γ)的表达可减少机体FFA的产生,进而缓解机体IR[15]。因此,PPAR-γ表达下降导致的FFA增多亦是肥胖导致IR的重要机制之一。
“肥胖-炎症-IR”间存在正反馈调节机制,由肥胖和炎症诱导的IR可加剧肥胖的发生进而使IR症状更为严重。在肥胖人群的研究中发现,机体IR促进前体脂肪细胞加速向成熟的脂肪细胞转化使脂肪组织增生[16]。同时,IR可诱导脂肪组织中单核细胞的浸润分化,后者分泌的炎性因子(单核细胞趋化蛋白-1,MCP-1)可刺激脂肪细胞分泌IL-6等细胞因子增加,这使IR进一步加剧而形成循环效应[17]。另外,肥胖导致机体出现的胰岛素靶细胞线粒体功能障碍、内质网应激等在机体IR的发生和发展中扮演着重要的角色[16-18]。
2.2.2 氧化应激在“妊娠后期-分娩-哺乳”这一过程中,母猪伴随着自身生理状态与外部环境的不断变化,机体分解与合成代谢状态旺盛,母猪受到的氧化应激加强。内源活性氧自由基(reactive oxidative species,ROS)和外源ROS均会导致母猪产生进程性氧化应激。母猪在妊娠后期为保证胎儿的正常发育,母体发生适应性变化,如子宫血流量增加[19],血液中甘油、FFA和丙氨酸含量增加[20],机体代谢增强,内源性ROS产生增加,导致机体发生氧化应激。有研究表明,在氧化应激的信号传导通路中被激活的核因子-κB抑制物激酶(IκB kinase,IKK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和蛋白激酶C(protein kinase C,PKC)可使胰岛素受体底物(IRS)的丝氨酸/苏氨酸磷酸化[21]。此外,其他因素如饲粮、环境因素[22]或抗氧化系统活性下降[23]等均可导致机体发生氧化应激。氧化应激主要通过激发细胞内的炎症信号传导途径和JNK通路, 干扰胰岛素与胰岛素受体结合后的信号传导,最终减弱胰岛素的生理作用,导致IR[24]。最新研究表明,核苷酸齐聚反应域蛋白2(NOD2)介导的氧化应激能促进胞壁酰二肽引起的骨骼肌细胞线粒体功能失调,造成细胞内活性氧增加,从而激活磷酸化的IRS1蛋白丝氨酸激酶,减少胰岛素受体信号传递,形成IR[25]。因此,抑制氧化应激反应、减少活性氧生成可能为改善IR的新靶点。
2.2.3 肠道菌群紊乱肠道菌群紊乱与代谢性综合征密切相关,IR是导致机体发生代谢性综合征的重要因素之一。母猪妊娠后期到哺乳期,尤其是分娩前后,机体出现代谢性综合征,从而导致肠道菌群紊乱加重[2]。2004年,美国Gordon研究组首次证明肠道菌群与IR有关[26]。肠道菌群失调引起IR的可能机制主要有3个:1)菌群代谢产物影响机体糖脂代谢。膳食纤维可被肠道菌群发酵利用产生短链脂肪酸(SCFAs)。SCFAs可与G蛋白耦连受体(GPR41、GPR43)结合,产生酪酪肽(PYY)或促进胰高血糖素样肽-1(GLP-1)分泌[27]。此外,丁酸盐治疗可改善糖尿病小鼠的胰岛细胞的功能,维持其血糖动态平衡,进而缓解其IR[28]。2)通过介导机体炎症反应影响机体IR。肠道菌群产生的脂多糖(LPS)与Toll样受体(Toll-like receptors,TLR)结合,通过激活NF-κB途径,或JNK和IκB激酶β(inhibitor kappa B kinase β,IKKβ)途径,导致炎症因子TNF-α、IL-6、白细胞介素-1β(IL-1β)的释放。炎症因子通过影响IRS磷酸化等胰岛素信号传导途径,导致机体IR[29-30]。3)影响机体免疫反应。肠道菌群平衡与宿主免疫系统形成和功能正常密切相关[31]。肠道菌群的成分如多聚糖可通过激活NOD1和NOD2蛋白,进而激活炎症途径,促进巨噬细胞释放炎症因子,如TNF-α和趋化因子CXCL1,二者均参与IR的形成[32]。肠道菌群紊乱在机体IR的发生和发展中扮演重要的角色,即肠道菌群紊乱是导致机体发生IR的主要因素之一。
3 功能性寡糖调控母猪IR的作用机制作为肠道菌群的“食物”,功能性寡糖可促进肠道中特异性的有益菌增殖、减少病原菌增殖、改善肠道屏障功能,进而提高机体免疫能力,肠道菌群及其代谢产物在此作用过程中具有关键性作用(图 2)。最近的研究发现,妊娠后期母猪饲粮中添加功能性寡糖可以改善母猪IR,提高母猪的生产性能[1]。一方面,功能性寡糖可以直接作用于肠道上皮细胞,通过激活TLR和NF-κB途径,调控机体黏膜免疫[6, 33];另一方面,通过调控肠道菌群及其代谢产物[34-35],进而改善机体免疫和氧化应激[36-37],从而改善机体IR。
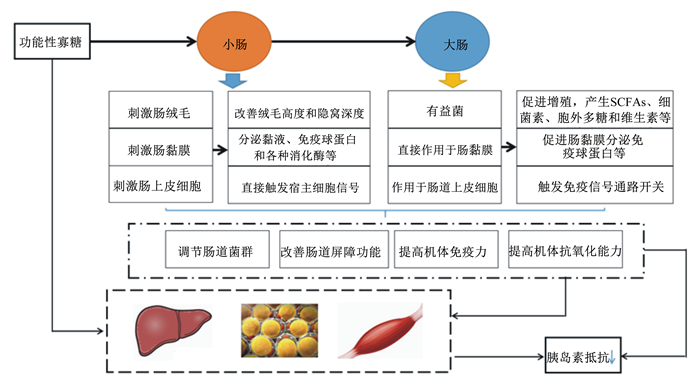
|
图 2 功能性寡糖改善机体胰岛素抵抗的作用机制 Fig. 2 Mechanism of functional oligosaccharides in improving insulin resistance |
功能性寡糖是由3~10个单糖组成,多由β糖苷键或α-1, 6等糖苷键连接,在消化道内不被动物自身分泌的消化酶所分解(表 1)。因此,功能性寡糖被母猪摄入后主要被肠道微生物所利用,发酵产生以SCFAs和乳酸为主的有机酸[38]。功能性寡糖可特异性地诱导肠道双歧杆菌、乳酸菌等有益菌增殖,通过竞争性抑制、产酸、占据定植位点和与宿主免疫的互作等途径抑制有害菌的增殖[6, 33-34]。同时,功能性寡糖的菌群代谢产物可被吸收的部分为SCFAs,主要为乙酸、丙酸和丁酸,其作为一种强有力的活性物质,可参与宿主能量代谢[39]。其中丙酸通过血液循环进入肝脏,在肝脏中分解代谢,参与丙酮酸逆转化为葡萄糖的过程;丁酸是上皮细胞的主要能量来源[40]。另外,壳寡糖可被部分吸收入血,其最终代谢产物氨基葡糖等可随血液循环到达各个靶器官、靶组织发挥作用,小分子质量的壳寡糖吸收入血的量明显大于大分子质量的壳寡糖[41]。
|
|
表 1 主要功能性寡糖组成成分 Table 1 Major functional oligosaccharide components[47] |
肠道菌群紊乱是导致母猪发生IR的重要因素之一[26],例如,Akkermansia muciniphila(Akk)菌属丰度降低与IR呈正相关[1]。功能性寡糖的主要作用就是在后肠被有益菌利用[42],进而提高肠道菌群稳态,这也是功能性寡糖改善机体IR的主要方式之一。Zhong等[43]研究发现,低聚半乳糖显著提高严重急性胰腺炎小鼠第4和7天粪中双歧杆菌的数量。另外,纤维寡糖显著提高空肠和结肠中乳酸杆菌的数量[34]。柒启恩等[5]的研究表明,围产期母猪饲粮中添加壳寡糖显著降低了母猪粪便中沙门氏菌的数量,并有降低粪便中大肠杆菌数量的趋势。便秘小鼠中添加果寡糖可使乳酸杆菌和双歧杆菌数量增加,Odoribacter、Alistipes和拟杆菌属数量降低[42]。功能性寡糖还可通过调节肠道菌群及其代谢产物SCFAs来改善机体IR。在小鼠和猕猴中分析与衰老相关IR有关的菌群和免疫因素试验中发现,当丁酸水平下降时,易位的菌群产物可激活化学趋化因子受体(CC chemokine receptors 2,CCR2)单核细胞,使网膜中的天然免疫细胞B1a转化为4BL细胞,后者表达的4-1BBL可激活其受体信号引发IR[44]。因此,功能性寡糖自身被肠道菌群利用后改善肠道菌群紊乱以及改变肠道菌群代谢产物的水平,肠道屏障、机体免疫和抗氧化功能得到了改善,进而缓解了机体代谢综合征,改善了IR[45-46]。
3.3 功能性寡糖及其肠道菌群代谢产物改善肠道屏障功能肠道屏障功能是指肠道上皮具有分隔肠腔内物质,防止致病性抗原侵入的功能。正常肠道黏膜屏障由机械屏障、化学屏障、免疫屏障与生物屏障共同构成。有研究表明,壳寡糖和纤维寡糖主要通过提高肠道紧密连接蛋白的表达,降低肠道通透性、提高肠道跨膜电阻、产生SCFAs促进肠上皮细胞生长或提高肠道绒毛高度降低隐窝深度来修复肠道机械屏障[34]。另外,低聚半乳糖可直接通过调节肠道杯状细胞分泌黏蛋白或相关酶以及调节肠道pH来修复肠道化学屏障功能,其主要作用部位在小肠段[35]。纤维寡糖还可以通过促进肠道中有益菌(双歧杆菌)的增殖,抑制有害菌的增殖影响肠道微生物屏障,其主要作用部位在结肠和盲肠,少量在小肠中[34]。果寡糖增强肠道屏障功能的效应与通过PKC依赖性机制,诱导选择紧密连接蛋白的表达相关[48]。功能性寡糖改善了肠道屏障的功能,减少了肠道中LPS在血液中的含量,降低了机体的炎症反应,从而改善了机体IR。
3.4 功能性寡糖及其肠道菌群代谢产物提高机体免疫力机体免疫细胞之间的信息传递是由糖链网完成的。壳寡糖能通过嵌合反应可直接修复人体各种免疫细胞的糖链功能,促进人体细胞表面的糖链网完整,提高免疫细胞的数量和活性,从根本上调节人体的免疫平衡[49]。菊粉和果寡糖等还可以直接作用于肠道上皮细胞,通过激活TLR和NF-κB途径,调控机体黏膜免疫[6, 33]。另外,功能性寡糖的代谢产物也可发挥提高机体免疫功能的作用。例如,壳寡糖的最终代谢产物—葡萄糖胺和乙酰葡萄糖胺,在机体免疫反应中起重要作用。SCFAs也是调节机体免疫的重要物质之一。SCFAs直接作用于肠道上皮细胞表面TLR,进而激活肠道上皮多种免疫细胞(如B细胞、树突状细胞等)调节肠道黏膜免疫,从而调控机体免疫功能[36]。柒启恩等[5]研究发现,妊娠后期母猪饲粮中添加30 mg/kg的壳寡糖显著提高了母猪血清中免疫球蛋白(IgG、IgA)和IL-6含量,并显著提高了母猪初乳中IgG、白细胞介素-2(IL-2)和IL-6含量,在一定程度上提高了母猪的免疫能力。机体免疫力的提高在一定程度上可预防IR的发生和缓解机体产生IR的程度。
3.5 功能性寡糖提高机体抗氧化能力围产期母猪常常发生进程性氧化应激,主要表现为ROS产生增多、抗氧化酶分泌减少等。功能性寡糖一方面可以通过降低ROS和脂质代谢产物丙二醛(MDA)的产生,缓解机体氧化应激反应,从而改善机体IR;另一方面,功能性寡糖可以通过促进机体产生抗氧化酶,如谷胱甘肽过氧化物酶(GSH-Px)等,提高机体的抗氧化能力,从而改善IR。龙次民等[7]研究发现,妊娠后期母猪饲粮中添加壳寡糖显著提高了母猪血液中总超氧化物歧化酶(T-SOD)活性,并有降低血液中MDA含量的趋势,另外还显著提高了新生仔猪血液中GSH-Px和过氧化氢酶(CAT)活性,并显著提高了新生仔猪回肠CAT、空肠谷胱甘肽过氧化物酶4(GPX4)的相对表达量,在一定程度上提高了母猪的生产性能。母猪繁殖周期添加壳寡糖能够显著增加妊娠35 d母猪血清中T-AOC活性,显著降低妊娠35和85 d母猪血清中MDA的含量[37]。另外,魔芋葡甘低聚糖对超氧阴离子自由基(O2-·)和羟自由基(·OH)有较好的清除能力,能有效地保护DNA免受羟自由基的损伤,并且能有效地降低肝脏中MDA含量, 提高肝脏和血浆中SOD和GSH-Px的活性[32]。功能性寡糖通过缓解母猪氧化应激,提高母猪的抗氧化能力,从而改善母猪IR。
4 小结综上所述,母猪围产期由于生理代谢状况的变化和肠道菌群紊乱导致母猪IR增强,从而降低了母猪的繁殖性能及哺乳期的采食量,进一步影响了母猪的泌乳性能和仔猪的生长发育。有研究发现,母猪妊娠后期发生IR以及肠道菌群多样性降低是必然发生的一种生理现象,这可能是母猪在为分娩做准备,但目前大多数研究在改善妊娠后期母猪代谢状况或肠道菌群时忽略了母猪自身的生理变化,因此导致许多功能物质在调控母猪健康时出现了负面或者无效果的情况。因此,在后续关于功能性寡糖的研究中,我们应该将母猪在妊娠后期的正常生理变化考虑到我们的调控中去,尤其是功能性寡糖在后肠被特异菌利用后所产生的特异代谢物在改善IR中的作用值得进一步研究。
| [1] |
TAN C Q, WEI H K, AO J T, et al. Inclusion of konjac flour in the gestation diet changes the gut microbiota, alleviates oxidative stress, and improves insulin sensitivity in sows[J]. Applied and Environmental Microbiology, 2016, 82(19): 5899-5909. DOI:10.1128/AEM.01374-16 |
| [2] |
CHENG C S, WEI H K, YU H C, et al. Metabolic syndrome during perinatal period in sows and the link with gut microbiota and metabolites[J]. Frontiers in Microbiology, 2018, 9: 1989. DOI:10.3389/fmicb.2018.01989 |
| [3] |
SHIMOBAYASHI M, ALBERT V, WOELNERHANSSEN B, et al. Insulin resistance causes inflammation in adipose tissue[J]. Journal of Clinical Investigation, 2018, 128(4): 1538-1550. DOI:10.1172/JCI96139 |
| [4] |
SUN H Q, TAN C Q, WEI H K, et al. Effects of different amounts of konjac flour inclusion in gestation diets on physio-chemical properties of diets, postprandial satiety in pregnant sows, lactation feed intake of sows and piglet performance[J]. Animal Reproduction Science, 2015, 152: 55-64. DOI:10.1016/j.anireprosci.2014.11.003 |
| [5] |
柒启恩, 肖俊峰, 张军, 等. 围产期母猪饲粮中添加壳寡糖对母猪、仔猪免疫功能及母猪肠道微生物的影响[J]. 动物营养学报, 2018, 30(10): 4105-4122. DOI:10.3969/j.issn.1006-267x.2018.10.036 |
| [6] |
WU R Y, MÄÄTTÄNEN P, NAPPER S, et al. Non-digestible oligosaccharides directly regulate host kinome to modulate host inflammatory responses without alterations in the gut microbiota[J]. Microbiome, 2017, 5(1): 135. DOI:10.1186/s40168-017-0357-4 |
| [7] |
龙次民, 谢春艳, 吴信, 等. 妊娠后期母猪饲粮中添加壳寡糖对新生仔猪抗氧化能力的影响[J]. 动物营养学报, 2015, 27(4): 1207-1213. DOI:10.3969/j.issn.1006-267x.2015.04.026 |
| [8] |
魏宏逵, 周远飞, 彭健.调控母猪繁殖周期中胰岛素敏感性提高繁殖性能的研究进展[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集.武汉: 中国畜牧兽医学会动物营养学分会, 2016. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGXJ201610007008.htm
|
| [9] |
马建华. 妊娠与胰岛素抵抗[J]. 国外医学妇产科学分册, 2005, 32(1): 19-22. |
| [10] |
王蕴慧, 吴惠华, 丁红, 等. 妊娠期胰岛素抵抗及胰岛β细胞功能与体重指数、血脂水平、C反应蛋白的关系探讨[J]. 中华临床医师杂志(电子版), 2011, 5(16): 4736-4740. DOI:10.3877/cma.j.issn.1674-0785.2011.16.087 |
| [11] |
JEFFERIES C A, HOFMAN P L, KEELAN J A, et al. Insulin resistance is not due to persistently elevated serum tumor necrosis-α levels in small for gestational age, premature, or twin children[J]. Pediatric Diabetes, 2004, 5(1): 20-25. |
| [12] |
SIVAN E, BODEN G. Free fatty acids, insulin resistance, and pregnancy[J]. Current Diabetes Reports, 2003, 3(4): 319-322. DOI:10.1007/s11892-003-0024-y |
| [13] |
WAKI H, TONTONOZ P. Endocrine functions of adipose tissue[J]. Annual Review of Pathology:Mechanisms of Disease, 2007, 2: 31-56. DOI:10.1146/annurev.pathol.2.010506.091859 |
| [14] |
YANG W S, LEE W J, FUNAHASHI T, et al. Weight reduction increases plasma levels of an adipose-derived anti-inflammatory protein, adiponectin[J]. The Journal of Clinical Endocrinology & Metabolism, 2001, 86(8): 3815-3819. |
| [15] |
OKUNO A, TAMEMOTO H, TOBE K, et al. Troglitazone increases the number of small adipocytes without the change of white adipose tissue mass in obese Zucker rats[J]. The Journal of Clinical Investigation, 1998, 101(6): 1354-1361. DOI:10.1172/JCI1235 |
| [16] |
HEILBRONN L K, GAN S K, TURNER N, et al. Markers of mitochondrial biogenesis and metabolism are lower in overweight and obese insulin-resistant subjects[J]. The Journal of Clinical Endocrinology & Metabolism, 2007, 92(4): 1467-1473. |
| [17] |
RITOV V B, MENSHIKOVA E V, HE J, et al. Deficiency of subsarcolemmal mitochondria in obesity and type 2 diabetes[J]. Diabetes, 2005, 54(1): 8-14. DOI:10.2337/diabetes.54.1.8 |
| [18] |
SHARMA N K, DAS S K, MONDAL A K, et al. Endoplasmic reticulum stress markers are associated with obesity in nondiabetic subjects[J]. The Journal of Clinical Endocrinology & Metabolism, 2008, 93(11): 4532-4541. |
| [19] |
CASTILLO C, HERNANDEZ J, BRAVO A, et al. Oxidative status during late pregnancy and early lactation in dairy cows[J]. The Veterinary Journal, 2005, 169(2): 286-292. DOI:10.1016/j.tvjl.2004.02.001 |
| [20] |
BURTON G J. The influence of the intrauterine environment on human placental development[J]. Journal of Reproductive Immunology, 2010, 86(2): 81-82. |
| [21] |
KANETO H, NAKATANI Y, KAWAMORI D, et al. Involvement of oxidative stress and the JNK pathway in glucose toxicity[J]. The Review of Diabetic Studies, 2004, 1(4): 165-174. DOI:10.1900/RDS.2004.1.165 |
| [22] |
SHEN Y B, CARROLL J A, YOON I, et al. Effects of supplementing Saccharomyces cerevisiae fermentation product in sow diets on performance of sows and nursing piglets[J]. Journal of Animal Science, 2011, 89(8): 2462-2471. DOI:10.2527/jas.2010-3642 |
| [23] |
TAN C Q, WEI H K, SUN H Q, et al. Effects of dietary supplementation of oregano essential oil to sows on oxidative stress status, lactation feed intake of sows, and piglet performance[J]. BioMed Research International, 2015, 2015: 525218. |
| [24] |
陈新龙, 夏照帆, 韦多, 等. c-Jun氨基末端激酶抑制剂减轻烫伤后胰岛素抵抗的实验研究[J]. 中华烧伤杂志, 2006, 22(6): 466-468. DOI:10.3760/cma.j.issn.1009-2587.2006.06.018 |
| [25] |
MAURYA C K, ARHA D, RAI A K, et al. NOD2 activation induces oxidative stress contributing to mitochondrial dysfunction and insulin resistance in skeletal muscle cells[J]. Free Radical Biology and Medicine, 2015, 89: 158-169. DOI:10.1016/j.freeradbiomed.2015.07.154 |
| [26] |
BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [27] |
XIONG Y M, MIYAMOTO N, SHIBATA K, et al. Short-chain fatty acids stimulate leptin production in adipocytes through the G protein-coupled receptor GPR41[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(4): 1045-1050. DOI:10.1073/pnas.2637002100 |
| [28] |
MATTACE RASO G, SIMEOLI R, RUSSO R, et al. Effects of sodium butyrate and its synthetic amide derivative on liver inflammation and glucose tolerance in an animal model of steatosis induced by high fat diet[J]. PLoS One, 2013, 8(7): e68626. DOI:10.1371/journal.pone.0068626 |
| [29] |
KUMAR H, KAWAI T, AKIRA S. Toll-like receptors and innate immunity[J]. Biochemical and Biophysical Research Communications, 2009, 388(4): 621-625. DOI:10.1016/j.bbrc.2009.08.062 |
| [30] |
CARICILLI A M, PICARDI P K, DE ABREU L L, et al. Retraction:gut microbiota is a key modulator of insulin resistance in TLR 2 knockout mice[J]. PLoS Biology, 2016, 14(5): e1002479. |
| [31] |
D'AVERSA F, TORTORA A, IANIRO G, et al. Gut microbiota and metabolic syndrome[J]. Internal and Emergency Medicine, 2013, 8(Suppl.1): 11-15. |
| [32] |
SCHERTZER J D, TAMRAKAR A K, MAGALHÃES J G, et al. NOD1 activators link innate immunity to insulin resistance[J]. Diabetes, 2011, 60(9): 2206-2215. DOI:10.2337/db11-0004 |
| [33] |
CAPITÁN-CAŇADAS F, ORTEGA-GONZÁLEZ M, GUADIX E, et al. Prebiotic oligosaccharides directly modulate proinflammatory cytokine production in monocytes via activation of TLR4[J]. Molecular Nutrition & Food Research, 2014, 58(5): 1098-1110. |
| [34] |
JIAO L F, KE Y L, XIAO K, et al. Effects of cello-oligosaccharide on intestinal microbiota and epithelial barrier function of weanling pigs[J]. Journal of Animal Science, 2015, 93(3): 1157-1164. DOI:10.2527/jas.2014-8248 |
| [35] |
BHATIA S, PRABHU P N, BENEFIEL A C, et al. Galacto-oligosaccharides may directly enhance intestinal barrier function through the modulation of goblet cells[J]. Molecular Nutrition & Food Research, 2015, 59(3): 566-573. |
| [36] |
SPILJAR M, MERKLER D, TRAJKOVSKI M. The immune system bridges the gut microbiota with systemic energy homeostasis:focus on TLRs, mucosal barrier, and SCFAs[J]. Frontiers in Immunology, 2017, 8: 1353. DOI:10.3389/fimmu.2017.01353 |
| [37] |
杨开云.壳寡糖对母猪早期胎儿生长和繁殖性能的影响及机理研究[D].硕士学位论文.雅安: 四川农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10626-1017013060.htm
|
| [38] |
FERNÁNDEZ J, REDONDO-BLANCO S, GUTIÉRREZ-DEL-RÍO I, et al. Colon microbiota fermentation of dietary prebiotics towards short-chain fatty acids and their roles as anti-inflammatory and antitumour agents:a review[J]. Journal of Functional Foods, 2016, 25: 511-522. DOI:10.1016/j.jff.2016.06.032 |
| [39] |
GOH Y J, KLAENHAMMER T R. Genetic mechanisms of prebiotic oligosaccharide metabolism in probiotic microbes[J]. Annual Review of Food Science and Technology, 2015, 6: 137-156. DOI:10.1146/annurev-food-022814-015706 |
| [40] |
王璐璇, 刘玥宏, 朱继开, 等. 短链脂肪酸在疾病治疗中的研究进展[J]. 世界华人消化杂志, 2017, 25(13): 1179-1186. |
| [41] |
王敏, 臧师竹, 辛毅, 等. 小鼠肠道对壳寡糖的吸收率及吸收成分的影响[J]. 中国微生态学杂志, 2013, 25(10): 1143-1144, 1148. |
| [42] |
MAO B Y, GU J Y, LI D Y, et al. Effects of different doses of fructooligosaccharides (FOS) on the composition of mice fecal microbiota, especially the Bifidobacterium composition[J]. Nutrients, 2018, 10(8): 1105. DOI:10.3390/nu10081105 |
| [43] |
ZHONG Y, CAI D L, CAI W, et al. Protective effect of galactooligosaccharide-supplemented enteral nutrition on intestinal barrier function in rats with severe acute pancreatitis[J]. Clinical Nutrition, 2009, 28(5): 575-580. DOI:10.1016/j.clnu.2009.04.026 |
| [44] |
BODOGAI M, CONNELL J, KIM K, et al. Commensal bacteria contribute to insulin resistance in aging by activating innate B1a cells[J]. Science Translational Medicine, 2018, 10(467): eaat4271. DOI:10.1126/scitranslmed.aat4271 |
| [45] |
RABIEI S, HEDAYATI M, RASHIDKHANI B, et al. The effects of synbiotic supplementation on body mass index, metabolic and inflammatory biomarkers, and appetite in patients with metabolic syndrome:a triple-blind randomized controlled trial[J]. Journal of Dietary Supplements, 2019, 16(3): 294-306. DOI:10.1080/19390211.2018.1455788 |
| [46] |
DE COSSÍO L F, FOURRIER C, SAUVANT J, et al. Impact of prebiotics on metabolic and behavioral alterations in a mouse model of metabolic syndrome[J]. Brain, Behavior, and Immunity, 2017, 64: 33-49. DOI:10.1016/j.bbi.2016.12.022 |
| [47] |
郑建仙. 功能性低聚糖[M]. 北京: 化学工业出版社, 2004.
|
| [48] |
WU R Y, ABDULLAH M, MÄÄTTÄNEN P, et al. Protein kinase C δ signaling is required for dietary prebiotic-induced strengthening of intestinal epithelial barrier function[J]. Scientific Reports, 2017, 7: 40820. DOI:10.1038/srep40820 |
| [49] |
马龙. 壳寡糖调节免疫力[J]. 家庭保健, 2012(1): 80-81. |




