仔猪早期断奶会出现采食量低、腹泻率高、肠道黏膜受损、营养代谢紊乱、肠道菌群失调等一系列问题,即“早期断奶综合征”。鱼粉是目前饲粮动物蛋白质的重要来源,其质量优劣严重影响动物健康,优质鱼粉能够提高仔猪生长性能,并在其后续生长过程中发挥有益作用,变质鱼粉会给断奶仔猪造成很大的负面影响[1]。如何解决断奶应激和变质鱼粉导致的仔猪腹泻,是一个值得研究的问题。Ravindran等[2]研究表明,乳酸的主要作用并不是降低胃肠道中的pH,更重要的是能够抑制胃肠道中的致病性大肠杆菌。Danielson等[3]研究表明,乳酸是乳酸菌的代谢产物,能够有效降低肠道内pH,促进肠道内有益菌的生长,抑制肠道内有害菌大肠杆菌的生长。目前也有研究表明,乳酸可下调肠上皮细胞和免疫细胞(如巨噬细胞和树突状细胞)中的促炎反应[4-5]。谷氨酰胺是哺乳动物血浆和母畜乳汁中常见的游离氨基酸,是淋巴细胞、纤维原细胞和网状细胞增殖更新的重要能量物质,对肠道营养及修复有着积极作用[6]。酶制剂不仅能促进断奶仔猪对营养物质的消化,提高生长性能,还能够改变肠道菌群,促进肠道健康[7]。研究发现,益生菌可以通过调控肠道黏膜免疫状态、改善肠道微生态、提升肠道黏膜屏障功能,其代谢物对宿主发挥着重要作用[8]。目前关于单一营养素对断奶仔猪肠道健康的研究很多,但如何通过复合添加各种营养素来修复仔猪肠道受损、提高其生长性能的研究很少。本研究旨在探究复合营养素是否对仔猪肠道受损有恢复作用,为抗病营养研究提供科学依据。
1 材料与方法 1.1 试验材料复合营养素由四川农业大学研制,主要成分为乳酸、谷氨酰胺、酶制剂和枯草芽孢杆菌等。
1.2 试验动物、分组与饲养管理参考黄丽[9]腹泻判定标准,从150头饲喂含有4%变质鱼粉(酸价为8.67 mg/g,挥发性盐基氮含量为1 446.7 g/kg)饲粮15 d的断奶仔猪中随机选取腹泻仔猪22头,平均体重为(7.23±0.89) kg,随机分为3组进行试验。腹泻对照组(DC组,n=6)直接进行屠宰采样,对照组(CT组,n=8)饲喂基础饲粮,复合营养素组(NUT组,n=8)饲喂以复合营养素替代3%基础饲粮的饲粮,试验期24 d。试验饲粮由成都旺江饲料有限公司提供,试验期基础饲粮为玉米-豆粕型饲粮,参照NRC(2012)7~11 kg和11~25 kg断奶仔猪营养需要标准并结合实际配制,所有饲粮均为粉状饲料。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
本试验于2018年6—8月在四川农业大学动物营养研究所教学科研基地保育舍进行。试验开始前对圈舍清洁消毒并清洗料槽,确保饲养环境无污染。仔猪自由采食与饮水,每日饲喂4次(08:00、12:00、16:00和20:00),少喂勤添,每次饲喂量以猪只吃饱后料槽内略有剩余为标准。猪舍内温度控制在25~28 ℃,相对湿度控制在55%~70%。每日定时清洁圈舍卫生,并用多种消毒液交替消毒,同时保持圈舍通风、干燥、清洁和卫生。
1.3 测定指标及方法 1.3.1 生长性能所有仔猪空腹12 h后,在试验起始、第15天和第25天08:00进行称重,计算第1~14天、第15~24天和第1~24天平均日增重(ADG);试验期间准确记录每头猪的日采食量,计算第1~14天、第15~24天和第1~24天平均日采食量(ADFI);根据ADG和ADFI计算料重比(F/G)。
1.3.2 腹泻指标试验期间,每天早晚2次由同一个人观察并记录各组仔猪腹泻程度和头数,并计算腹泻指数和腹泻率,粪便评分≥2即认定发生腹泻。腹泻评分参考谢全喜等[10]的方法,腹泻指数计算方法参照Yuan等[11],即:
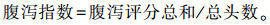
|
腹泻率计算方法参照廖波等[12],即:
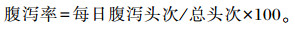
|
试验起始选取腹泻仔猪6头,空腹12 h后前腔静脉采血10 mL,置于离心管室温下放置30 min,3 500 r/min离心15 min,分离血清;饲养试验结束后所有仔猪空腹称重,前腔静脉采血10 mL,置于离心管室温下放置30 min,3 500 r/min离心15 min,分离血清,置于-20 ℃保存待测血清生化指标。
血清中二胺氧化酶(DAO)活性、D-乳酸(D-LA)和蛋白质羰基(PCO)含量采用酶联免疫吸附测定(ELISA)试剂盒(北京诚林生物科技有限公司)测定,血清中肌酐(Cr)、葡萄糖(Glu)、尿素氮(UN)和丙二醛(MDA)含量以及谷草转氨酶(AST)、谷丙转氨酶(ALT)活性使用相应试剂盒(南京建成生物工程研究所)测定,操作均按照试剂盒说明书进行。
1.3.4 空肠黏膜消化酶活性样品测定前需进行匀浆预处理,称取一定量(0.5~0.8 g)空肠黏膜样品,按照质量/体积=1/9(g/mL)加入匀浆介质,超声波粉碎,后将匀浆液于4 ℃、3 000 r/min离心10 min,取上清液,采用南京建成生物工程研究所相应试剂盒,结合紫外分光光度计,测定上清液中蛋白酶、脂肪酶、淀粉酶、蔗糖酶、乳糖酶和麦芽糖酶的活性。
1.3.5 空肠组织形态及病理切片肠绒毛测定方法:每组内每张切片随机挑选至少3个40倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件以40倍标尺为标准,每张切片选取12根完整的绒毛,分别测量绒毛高度和隐窝深度,并计算绒隐比。
杯状细胞测定方法:每组内每张切片随机挑选至少3个100倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件,每张照片随机选取5根绒毛,统计每根绒毛中紫色或淡紫色的杯状细胞数量。
1.4 数据统计分析数据使用Excel 2010初步整理,采用SAS 8.0软件中的GLM进行单因素方差分析,生长性能和腹泻指数采用t检验进行组间比较,其他指标采用Duncan氏法进行多重比较,分析各组间差异显著性。结果用平均值±标准误表示,0.05≤P<0.10表示有变化趋势,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析 2.1 复合营养素对仔猪生长性能的影响复合营养素对仔猪生长性能的影响见表 2。与对照组相比,复合营养素显著提高了仔猪在试验第15~24天的ADFI和ADG(P<0.05),有降低该阶段F/G的趋势(P=0.08),但对仔猪在试验第1~14天以及试验全期的体重、ADFI、ADG和F/G均无显著影响(P>0.05)。
|
|
表 2 复合营养素对仔猪生长性能的影响 Table 2 Effects of compound nutrients on growth performance of piglets |
复合营养素对仔猪腹泻指标的影响见表 3。与对照组相比,复合营养素极显著降低了仔猪在试验第15~24天的腹泻率和腹泻指数(P<0.01),显著降低了试验全期的腹泻率和腹泻指数(P<0.05)。
|
|
表 3 复合营养素对仔猪腹泻指标的影响 Table 3 Effects of compound nutrients on diarrhea indices of piglets |
复合营养素对仔猪血清指标的影响见表 4。与腹泻对照组相比,饲喂正常饲粮后,仔猪血清尿素氮含量和二胺氧化酶活性均显著降低(P<0.05),其中复合营养素组仔猪血清尿素氮含量极显著下降(P<0.01);对照组和复合营养素组仔猪血清肌酐和丙二醛含量以及谷丙转氨酶活性均有一定程度的降低,其中复合营养素组仔猪血清肌酐和丙二醛含量显著降低(P<0.05),而仔猪血清谷丙转氨酶活性却是对照组显著降低(P<0.05);对照组和复合营养素组仔猪血清葡萄糖含量有一定程度的升高,其中对照组显著升高(P<0.05)。与对照组相比,复合营养素显著降低了仔猪血清D-乳酸的含量(P<0.05),对其他血清指标均无显著影响(P>0.05)。
|
|
表 4 复合营养素对仔猪血清生化指标的影响 Table 4 Effects of compound nutrients on serum biochemical indices of piglets |
复合营养素对仔猪空肠黏膜消化酶活性的影响见表 5。与腹泻对照组相比,饲喂正常饲粮一段时间后,仔猪空肠黏膜蔗糖酶活性显著升高(P<0.05),其中对照组达到极显著水平(P<0.05),但麦芽糖酶活性却显著降低(P<0.05)。与对照组相比,复合营养素组仔猪空肠黏膜淀粉酶和胰蛋白酶活性分别提高了15.38%和22.91%(P>0.05)。
|
|
表 5 复合营养素对仔猪空肠黏膜消化酶活性的影响 Table 5 Effects of compound nutrients on digestive enzyme activities in jejunum of piglets |
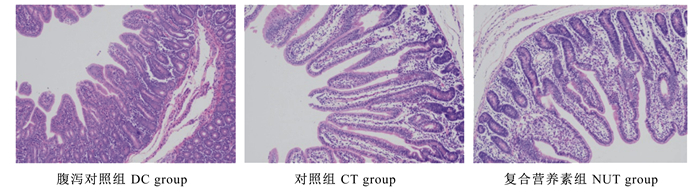
复合营养素对仔猪空肠组织形态的影响如图 1和表 6所示。由图 1可知,腹泻对照组仔猪空肠绒毛高度较低,绒毛顶端部分脱落;对照组仔猪经过一段时间正常饲粮饲喂后,空肠绒毛高度恢复,但绒毛顶端仍有少许脱落;复合营养素组仔猪空肠绒毛高度正常,且绒毛形态恢复。
|
图 1 复合营养素对仔猪空肠组织形态的影响(苏木精-伊红染色) Fig. 1 Effects of compound nutrients on jejunum morphology of piglets (HE staining, 100×) |
|
|
表 6 复合营养素对仔猪空肠组织形态的影响 Table 6 Effects of compound nutrients on jejunum morphology of piglets |
由表 6可知,与腹泻对照组相比,饲喂正常饲粮一段时间后,仔猪空肠绒毛高度和隐窝深度极显著升高(P<0.01);与对照组相比,复合营养素组仔猪空肠每根绒毛的杯状细胞数显著增加(P<0.05),绒毛高度数值上增加了11.48%(P>0.05)。
3 讨论 3.1 变质鱼粉对仔猪健康的影响有研究表明,肠道对饲粮抗原的短期过敏反应是仔猪腹泻的原发病因,微生物的感染和增殖是腹泻加剧的继发性病因。鱼粉贮存时间过长发生酸败变质,或者贮存不当出现病原微生物污染,会造成仔猪肠道消化吸收不良[13]。刘国庆等[1]报道,特级鱼粉有利于肠道发育,但普通鱼粉由于新鲜度差、有害微生物数量增加,不利于肠道健康。本试验使用的酸化变质鱼粉导致断奶仔猪腹泻,肠道健康受损,肠道消化酶活性有所降低,消化能力减弱。断奶仔猪腹泻肠道黏膜及上皮细胞受损,会影响仔猪的日增重[14]。
研究表明,腹泻仔猪的血清总蛋白和球蛋白含量显著高于未腹泻仔猪[9];也有研究显示,腹泻仔猪血清中的白蛋白含量略低于健康仔猪,可能是由于腹泻的病因和程度不同[15]。黄美州等[15]研究表明,腹泻仔猪血清球蛋白、尿素氮和肌酐含量以及谷丙转氨酶活性显著高于健康仔猪。血清D-乳酸含量和二胺氧化酶活性能够反映肠黏膜损伤和通透性的变化程度[16];丙二醛是脂质过氧化的产物,是评价机体氧化损伤的重要标志物之一[17];血清尿素氮是机体氮代谢的重要指标[18]。本试验结果显示,与饲喂正常饲粮一段时间的仔猪相比,试验起始的腹泻仔猪血清肌酐、尿素氮、D-乳酸和丙二醛含量以及谷丙转氨酶和二胺氧化酶活性表现出不同程度的升高,说明腹泻仔猪的肾小球滤过功能减弱,蛋白质代谢功能紊乱,肠道黏膜、肝功能和氧化还原系统受损。所以,酸化变质鱼粉导致的仔猪腹泻对机体肾脏、肝脏、肠道健康以及氧化还原系统都有一定的损伤,影响机体健康状态。
薛洋[19]研究表示,3~7日龄腹泻仔猪的十二指肠和空肠的绒毛高度显著低于未腹泻仔猪,与本试验结果相似,腹泻仔猪肠道萎缩,空肠绒毛高度显著低于恢复一段时间后仔猪的绒毛高度,且肠绒毛顶端部分脱落。但本试验发现,饲喂正常饲粮后,隐窝深度反而增加,且从数值上看,未添加营养素对于杯状细胞数的恢复反而有害。可能是由于前期的腹泻在饲喂正常饲粮之后仍然存在,短时间的营养素修复并未完全消除腹泻的持续影响。试验结果显示,腹泻仔猪的空肠黏膜蔗糖酶消化酶活性低,但麦芽糖酶的活性却显著高于后期饲喂正常饲粮的猪。可能是因为腹泻会导致肠道结构受损,降低了肠道消化酶活性;也有研究表明,仔猪35日龄后消化酶活性下降[20],所以,蔗糖酶与麦芽糖酶结果的不同可能是由仔猪日龄以及饲粮在体内消化成的二糖底物浓度不同造成的。
3.2 复合营养素对仔猪生长性能及肠道健康的影响本试验结果表明,饲粮添加复合营养素能够显著提高仔猪在试验第15~24天的ADFI和ADG,同时有降低仔猪在此期间F/G的趋势,且能显著降低试验全期和后期的腹泻率及腹泻指数。有研究表明,添加谷氨酰胺能够降低断奶仔猪的腹泻率和料重比,显著提高早期断奶仔猪的ADG和ADFI,降低腹泻率,且与葡萄糖、丁酸钠配合使用增重效果更好[21-23]。还有研究表明,乳酸菌发酵豆粕的添加能够显著地提高仔猪的ADG、ADFI,降低F/G;乳酸型酸化剂对仔猪的ADG有提高作用[24-25];同样,添加乳酸能够显著提高断奶仔猪的ADG和ADFI,显著改善仔猪断奶后腹泻的发生,但对F/G无显著影响[26-27]。另外,复合酶制剂可用作抗生素的替代物,用以改善仔猪的生长性能,提高仔猪ADG以及饲料转化率,显著降低F/G和腹泻率[28-30]。有研究表明,在饲粮或者饮水中补充不同种类的复合添加剂有增加ADG、降低F/G及腹泻率的功能,而发挥功能可能是其中的某一种或几种有效成分。前人的众多研究表明,谷氨酰胺、乳酸和酶制剂均有促生长、抗腹泻的功能[31-33],所以本试验发挥促生长、抗腹泻功能也可能是谷氨酰胺、乳酸和酶制剂中的1种或多种。复合营养素促进生长的机理可能是由于谷氨酰胺被肠道利用,产生大量的ATP,为许多代谢过程提供能量;而乳酸不仅可以作为酸化剂降低肠道内的pH,还能作为能量物质参与细胞能量代谢。此外,酶制剂可以提高饲粮养分消化率,对仔猪的受损肠道的消化吸收功能有促进作用。复合营养素抗腹泻一方面可能是因为复合营养素添加增强了饲粮的可消化性,减少饲粮在肠道内的发酵,有利于肠道黏膜的恢复;另一方面乳酸为肠道制造的酸性环境能够抑制有害菌的对肠道黏膜的侵害,降低仔猪腹泻。本试验添加复合营养素对试验期前2周的仔猪生长性能和腹泻率均无显著影响,可能是由于复合营养素发挥作用需要一定的时间累积,也可能是试验前期仔猪的肠道处于损伤阶段,营养素在这期间用于修复损伤而未能用于促生长。
试验结果显示,饲喂一段时间的正常饲粮对于仔猪机体健康恢复有一定作用,且复合营养素的添加对于仔猪健康恢复有促进作用,具体表现为降低血清尿素氮、丙二醛和D-乳酸含量。这说明复合营养素通过改善机体蛋白质代谢、缓解氧化损伤、促进肠道黏膜修复来改善仔猪的健康。前人研究表明,添加谷氨酰胺会降低血清中血糖含量,减少血清中丙二醛和D-乳酸的含量[34-36];乳酸可以加速小鼠上皮细胞的更新,利于肠道的修复[37],上述结果与本试验结果相似,再次验证了本试验的可靠性。
有研究表明,添加谷氨酰胺可不同程度地提高断奶仔猪十二指肠和空肠食糜糜蛋白酶、淀粉酶和脂肪酶的活性,显著提高仔猪空肠黏膜糖类相关消化酶的活性和分泌量[38-39];乳酸能够显著提高仔猪胃中胃蛋白酶、十二指肠胰蛋白酶和二糖酶、空肠二糖酶和胰蛋白酶的活性[40-41]。本试验复合营养素的添加使得空肠黏膜淀粉酶和胰蛋白酶活性均有所提高,但没有统计学意义。其原因可能是复合营养素虽然能够提高消化酶活性,有助于饲粮的消化吸收和生长性能的提高,然而由于饲喂仔猪的方式、生长环境以及生理状态不同,本试验并未表现出显著效果。前人研究指出,谷氨酰胺能够提高断奶仔猪十二指肠和空肠绒毛高度和绒毛高度/隐窝深度[42-43];添加乳酸14 d后,仔猪十二指肠和空肠绒毛高度有显著提高[40];另外,复合有机酸化剂能够提高断奶仔猪小肠绒毛高度[44-45]。而本试验研究发现,与基础饲粮相比,复合营养素添加对绒毛高度有一定的提高,但是并没有达到统计学上的差异;对杯状细胞数的恢复效果显著,但复合营养素组与腹泻对照组并未出现显著差异。推测可能的原因是试验前期仔猪严重腹泻对其肠道损伤过于严重,使得后期复合营养素添加对仔猪肠道修复的周期变长,在试验期内并没有反映出复合营养素的全部功能。研究表明,乳酸可下调肠上皮细胞炎症反应,谷氨酰胺可以减轻肠道炎症[5, 46],推测乳酸和谷氨酰胺能够减轻酸化变质鱼粉导致的肠道炎症,修复肠道损伤。切片结果显示,复合营养素添加后绒毛高度正常,且肠绒毛形态恢复,说明复合营养素对于变质鱼粉导致的腹泻引起的绒毛损伤有一定的修复作用。
4 结论综上所述,变质鱼粉引起仔猪腹泻,降低了仔猪肠道消化酶活性,抑制了仔猪肠道的正常发育,损伤了仔猪肠道结构;复合营养素的添加显著缓解了仔猪腹泻,降低了仔猪血清肌酐、尿素氮、丙二醛和D-乳酸的含量以及二胺氧化酶的活性,增加了小肠消化酶活性和绒毛高度,促进仔猪空肠杯状细胞数量的恢复,显著提高仔猪在试验第15~24天的生长性能。本研究结果说明,复合营养素有促进仔猪损伤肠道修复的作用。
| [1] |
刘国庆, 马秋刚, 简永军, 等. 不同等级鱼粉对断奶仔猪生长的影响及其持续效应[J]. 饲料研究, 2015(22): 33-37. |
| [2] |
RAVINDRAN V, KORNEGAY E T. Acidification of weaner pig diets:a review[J]. Journal of the Science of Food & Agriculture, 2010, 62(4): 313-322. DOI:10.1002/jsfa.2740620402 |
| [3] |
DANIELSON A D, PEO E R, Jr., SHAHANI K M, et al. Anticholesteremic property of Lactobacillus acidophilus yogurt fed to mature boars[J]. Journal of Animal Science, 1989, 67(4): 966-974. DOI:10.2527/jas1989.674966x |
| [4] |
IRAPORDA C, ROMANIN D E, RUMBO M, et al. The role of lactate on the immunomodulatory properties of the nonbacterial fraction of kefir[J]. Food Research International, 2014, 62: 247-253. DOI:10.1016/j.foodres.2014.03.003 |
| [5] |
IRAPORDA C, ERREA A, ROMANIN D E, et al. Lactate and short chain fatty acids produced by microbial fermentation downregulate proinflammatory responses in intestinal epithelial cells and myeloid cells[J]. Immunobiology, 2015, 220(10): 1161-1169. DOI:10.1016/j.imbio.2015.06.004 |
| [6] |
敖翔, 李元凤, 范明东, 等. 谷氨酰胺在断奶仔猪上的应用及其机理的研究[J]. 养猪, 2017(3): 33-38. DOI:10.3969/j.issn.1002-1957.2017.03.018 |
| [7] |
YI J Q, PIAO X S, LI Z C, et al. The effects of enzyme complex on performance, intestinal health and nutrient digestibility of weaned pigs[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(8): 1181-1188. DOI:10.5713/ajas.2013.13129 |
| [8] |
SHANAHAN F. Probiotics in perspective[J]. Gastroenterology, 2010, 139(6): 1808-1812. DOI:10.1053/j.gastro.2010.10.025 |
| [9] |
黄丽.腹泻仔猪生长性能和血液指标特征及灌服粪肠球菌对其影响[D].硕士学位论文.南京: 南京农业大学, 2015.
|
| [10] |
谢全喜, 亓秀晔, 陈振, 等. 复合微生态制剂对断奶仔猪生长性能、腹泻率、免疫性能和肠道菌群的影响[J]. 动物营养学报, 2017, 29(3): 850-858. DOI:10.3969/j.issn.1006-267x.2017.03.015 |
| [11] |
YUAN L J, KANG S Y, WARD L A, et al. Antibody-secreting cell responses and protective immunity assessed in gnotobiotic pigs inoculated orally or intramuscularly with inactivated human rotavirus[J]. Journal of Virology, 1998, 72(1): 330-338. |
| [12] |
廖波, 张克英, 丁雪梅, 等. 饲粮添加25-羟基维生素D3对轮状病毒攻毒和未攻毒断奶仔猪血清和肠内容物抗体和细胞因子水平的影响[J]. 动物营养学报, 2011, 23(1): 34-42. DOI:10.3969/j.issn.1006-267x.2011.01.007 |
| [13] |
王纯刚.鱼粉与丁酸钠对断奶仔猪生长、肠道发育和胰高血糖素样肽-2的影响[D].硕士学位论文.雅安: 四川农业大学, 2009.
|
| [14] |
舒邓群, 游金民, 曾球生. 断奶仔猪腹泻对其增重的影响[J]. 江西畜牧兽医杂志, 2004(6): 6-7. DOI:10.3969/j.issn.1004-2342.2004.06.004 |
| [15] |
黄美州, 刘永明, 王慧, 等. 用主成分分析法研究腹泻仔猪血清生化指标[J]. 中国兽医学报, 2015, 35(11): 1748-1751, 1758. |
| [16] |
POEZE M, FROON A H M, GREVE J W M, et al. D-lactate as an early marker of intestinal ischaemia after ruptured abdominal aortic aneurysm repair[J]. British Journal of Surgery, 1998, 85(9): 1221-1224. DOI:10.1046/j.1365-2168.1998.00837.x |
| [17] |
PANDEY K B, RIZVI S I. Markers of oxidative stress in erythrocytes and plasma during aging in humans[J]. Oxidative Medicine and Cellular Longevity, 2010, 3(1): 2-12. DOI:10.4161/oxim.3.1.10476 |
| [18] |
杨光波, 陈代文, 余冰. 叶酸水平对断奶仔猪生长性能及血清组织中蛋白质代谢的指标影响[J]. 中国畜牧杂志, 2011, 47(5): 24-28. |
| [19] |
薛洋.腹泻仔猪脏器指数、肠道形态和胃肠道内容物pH特征及灌服粪肠球菌对其影响[D].硕士学位论文.南京: 南京农业大学, 2015.
|
| [20] |
计成, 周庆, 田河山, 等. 断奶前后乳猪消化道(胰、小肠内容物)几种消化酶活性变化的研究[J]. 动物营养学报, 1987, 9(3): 712. |
| [21] |
HANCZAKOWSKA E, NIWIŃSKA B, GRELA E R, et al. Effect of dietary glutamine, glucose and/or sodium butyrate on piglet growth, intestinal environment, subsequent fattener performance, and meat quality[J]. Czech Journal of Animal Science, 2014, 59(10): 460-470. DOI:10.17221/7709-CJAS |
| [22] |
李宝成, 王蕾, 张俊梅, 等. 谷氨酰胺对断奶仔猪生长性能、血液生化指标及血浆氨基酸的影响[J]. 黑龙江畜牧兽医, 2017(5): 123-125. |
| [23] |
马娅君, 张小龙, 陈庆菊, 等. 牛磺酸对早期断奶仔猪生长性能和肠道健康的影响[J]. 动物营养学报, 2018, 30(10): 4121-4131. DOI:10.3969/j.issn.1006-267x.2018.10.038 |
| [24] |
穆勇攀, 李愫, 李新民. 乳酸型复合酸化剂饲喂效果试验[J]. 畜牧兽医杂志, 2011, 30(6): 7-8. DOI:10.3969/j.issn.1004-6704.2011.06.003 |
| [25] |
WANG N F, CHEN Q, LE G W, et al. Effect of lactic acid fermented soyabean meal on the growth performance, intestinal microflora and morphology of weaned piglets[J]. Journal of Animal and Feed Sciences, 2007, 16(1): 75-85. DOI:10.22358/jafs/66728/2007 |
| [26] |
冯尚连, 尚建钢, 孙玥滢, 等. 乳酸对仔猪肠道大肠杆菌和乳酸杆菌的影响[J]. 浙江农业学报, 2011, 23(3): 506-510. DOI:10.3969/j.issn.1004-1524.2011.03.013 |
| [27] |
姚继明, 孟秀丽, 吕锋, 等. 复合有机酸酸化剂对断奶仔猪生长性能及其肠道微生物菌群的影响[J]. 饲料工业, 2017, 38(2): 11-16. |
| [28] |
HAN X Y, YAN F Y, NIE X Z, et al. Effect of replacing antibiotics using multi-enzyme preparations on production performance and antioxidant activity in piglets[J]. Journal of Integrative Agriculture, 2017, 16(3): 640-647. DOI:10.1016/S2095-3119(16)61425-9 |
| [29] |
李兆勇.玉米-豆粕型日粮添加复合酶制剂对仔猪生产性能影响及其机理研究[D].硕士学位论文.泰安: 山东农业大学, 2007.
|
| [30] |
徐春生, 孙国君, 蒋新环, 等. 复合酶制剂对仔猪生产性能和日粮养分消化率的影响[J]. 石河子大学学报(自然科学版), 2004, 22(1): 60-62. DOI:10.3969/j.issn.1007-7383.2004.01.016 |
| [31] |
李梦云, 张清海, 赵武, 等. 液态复合添加剂对断奶1周内仔猪生长性能、养分消化率及血液指标的影响[J]. 中国畜牧杂志, 2018, 54(1): 89-93. |
| [32] |
巫丽娟, 陈代文, 毛湘冰, 等. 饮水中添加功能性复合添加剂对断奶仔猪生长性能、养分消化利用和血液指标的影响[J]. 畜牧兽医学报, 2017, 48(7): 1365-1372. |
| [33] |
巫丽娟, 毛湘冰, 余冰, 等. 饲粮添加功能性复合添加剂对生长猪生长性能和免疫功能的影响[J]. 动物营养学报, 2017, 29(5): 1716-1722. |
| [34] |
田辉, 王可富, 吴铁军. 谷氨酰胺对MODS患者肠黏膜屏障功能影响的研究[J]. 中国急救医学, 2006, 26(10): 708-709. DOI:10.3969/j.issn.1002-1949.2006.10.030 |
| [35] |
于新明, 李虎, 赵小刚, 等. 葡萄糖酸、谷氨酰胺及其组合物替代饲用抗生素对仔猪生产性能的影响[J]. 新疆农业科学, 2012, 49(1): 139-145. |
| [36] |
李欢, 黄牛, 何流琴, 等. 谷氨酰胺对脂多糖诱导的断奶仔猪氧化应激的影响[J]. 动物营养学报, 2017, 29(4): 1350-1358. DOI:10.3969/j.issn.1006-267x.2017.04.033 |
| [37] |
OKADA T, FUKUDA S, HASE K, et al. Microbiota-derived lactate accelerates colon epithelial cell turnover in starvation-refed mice[J]. Nature Communications, 2013, 4(3): 1654. |
| [38] |
杨彩梅. 谷氨酰胺和甘氨酰-谷氨酰胺对断奶仔猪小肠黏膜的影响[J]. 中国粮油学报, 2006, 21(4): 119-123. DOI:10.3321/j.issn:1003-0174.2006.04.026 |
| [39] |
杨彩梅, 陈安国. 谷氨酰胺对早期断奶仔猪生产性能和小肠消化酶活性的影响[J]. 中国畜牧杂志, 2005, 41(6): 21-22. DOI:10.3969/j.issn.0258-7033.2005.06.009 |
| [40] |
冯尚连, 朱建津, 孙玥莹, 等. 乳酸对仔猪消化酶发育的影响[J]. 浙江农业学报, 2013, 25(3): 475-479. DOI:10.3969/j.issn.1004-1524.2013.03.10 |
| [41] |
李瑞珍.日粮中添加不同水平乳酸对断奶仔猪生产性能和有关生化指标的影响研究[D].硕士学位论文.郑州: 河南农业大学, 2009.
|
| [42] |
HSU C B, HUANG H J, WANG C H, et al. The effect of glutamine supplement on small intestinal morphology and xylose absorptive ability of weaned piglets[J]. African Journal of Biotechnology, 2010, 9(41): 7003-7008. |
| [43] |
ZHONG X, ZHANG X H, LI X M, et al. Intestinal growth and morphology is associated with the increase in heat shock protein 70 expression in weaning piglets through supplementation with glutamine[J]. Journal of Animal Science, 2011, 89(11): 3634-3642. DOI:10.2527/jas.2010-3751 |
| [44] |
晏家友.缓释复合酸化剂对断奶仔猪消化道酸度及肠道形态和功能的影响[D].硕士学位论文.雅安: 四川农业大学, 2009.
|
| [45] |
LI S, ZHENG J, DENG K, et al. Supplementation with organic acids showing different effects on growth performance, gut morphology, and microbiota of weaned pigs fed with highly or less digestible diets[J]. Journal of Animal Science, 2018, 96(8): 3302-3318. |
| [46] |
GONG Z Y, YUAN Z Q, DONG Z W, et al. Glutamine with probiotics attenuates intestinal inflammation and oxidative stress in a rat burn injury model through altered iNOS gene aberrant methylation[J]. American Journal of Translational Research, 2017, 9(5): 2535-2547. |




