反刍动物的主要能量来自于饲粮经瘤胃发酵所产生的挥发性脂肪酸(volatile fatty acids,VFA),其中乙酸占到整个VFA总量的75%左右,因而成为反刍动物的主要能量来源[1],除提供能量之外,乙酸和丁酸还用于脂肪组织和乳腺组织的脂肪酸合成,此利用效率可达80%以上[2],而丙酸则是葡萄糖合成的主要前体物[3]。鉴于VFA对反刍动物的巨大贡献,定量研究VFA已成为反刍动物能量研究中的重要内容,因此我们必须知道VFA能在瘤胃中产生多少,通过瘤胃壁吸收多少,未吸收向后消化道流通的有多少,此定量研究对于我们更清楚地认识反刍动物能量供应机制、更好地调控反刍动物能量代谢具有重要意义。VFA中的3种主要成分即乙酸﹑丙酸和丁酸,由于各自的营养代谢特点不同,乙酸和丁酸作为一个整体即C2+C4能;丙酸和葡萄糖作为C3+C6能,二者相辅相成共同组成反刍动物的主要能量来源[4]。由于动物体内物质代谢和能量代谢的复杂性,单纯用能量指标只能说明利用率的差别,但很难说清不同能量来源之间的关系及其转化利用的效率,无法有针对性地对能量转化进行调控。因此,在反刍动物方面提出了将能量指标与能量载体指标相结合的发展趋势,美国的康奈尔净碳水化合物—蛋白质体系(CNCPS)、Preston等[4]提出的生葡萄糖能(glucogenic energy)和卢德勋[5]提出的代谢葡萄糖(metabolizable glucose,MG)都是这方面的一些可贵尝试。伴随着系统科学思维方式向动物营养学的大力渗透以及动物营养学研究技术的现代化,其他方面对动物营养状况整体评价指标也应运而生。比如在矿物质营养方面提出的阴阳离子差(dietary cation-anion difference,DCAD)[6]、在蛋白质营养方面提出的代谢蛋白质(metabolizable protein,MP)[7-8]以及衡量饲草的分级指数(grading index,GI)[9-10]都是一些整体性营养评价指标。这些指标不仅充分考虑了饲粮营养物质的相互作用,特别是瘤胃微生物发酵的影响,而且还把机体消化道层次和组织代谢层次放在一起考虑,有鲜明的整体性和系统性[11]。由于传统能量指标的能量与能量载体物质相脱节的缺陷,卢德勋[11]继MG之后提出又一新指标即可代谢生脂物质(metabolizable lipogenic substances,MLS),MLS是指饲料或饲粮经动物消化吸收后,可以给动物本身提供的﹑可利用的生脂物质(折合成乙酸总量)。MLS克服了传统营养指标的众多局限性,具有鲜明的整体性、系统性和实用性。这一新指标可用来评定饲料的营养价值以及不同年龄和生理阶段的动物对生脂物质的需要量,也可作为调控饲粮中C2+C4能占代谢能比例的重要技术指标。本试验的目的就是研究1.0 M能量水平条件下,绵羊瘤胃乙酸和丁酸的产生﹑吸收和流通规律及MLS的提供总量。
1 材料与方法 1.1 试验动物选用6只体况良好、体重相近、1.5岁左右的内蒙古半细毛羯羊,安装有永久性瘤胃瘘管和十二指肠瘘管。随机分为2组,每组3只,一组为乙酸灌注组,另一组为丁酸灌注组。
1.2 试验饲粮及饲养管理试验饲粮配制参照NRC(1985)[12]绵羊饲养标准,代谢能供给量为1.0倍的维持需要。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the experimental diet (DM basis) |
试验羊每隔3 h给予等量混和饲粮,日喂8次,预试期和试验期内均单笼饲养,预试期15 d,试验期10 d,预试期内试验羊自由饮水,试验期停止供水,取而代之用灌注液满足水的需要。
1.3 试验原理瘤胃内VFA的产生速率计算公式采用Bergman[1]的方法,该方法的前提是瘤胃VFA的产生速率与它们从瘤胃的消失保持平衡,然后通过启动灌注和连续灌注VFA的方法,打破瘤胃的稳态使其浓度发生变化,经过一段时间又达到新的瘤胃VFA浓度的相对稳衡状态,通过瘤胃某VFA浓度的变化,计算VFA的基本产生速率(mmol/h),计算公式如下:
P=I/(C’V’/CV-1)。
式中:P为VFA的基本产生速率;I为灌注的连续恒定速率;浓度C﹑C’可以测定,连续灌注前后瘤胃液相体积V﹑V’可用液相标记物乙二胺四乙酸钴(Co-EDTA)测定。因此可用上述公式计算乙酸和丁酸的基本产生速率。Co-EDTA的制备根据Udén等[13]方法进行。
1.4 试验设计连续饲喂15 d后,第16天06:00采集20 mL瘤胃液后将1 g Co-EDTA溶于50 mL蒸馏水中,经采样管通过瘤胃瘘管灌入绵羊瘤胃内不同位点,灌注完毕再抽取瘤胃液反复冲洗采样管3次,并将冲洗瘤胃液回灌瘤胃内。此后,2、4、6、9、12、18和24 h分别抽取瘤胃液20 mL,用以测定钴(Co)、VFA浓度和pH。上述Co-EDTA投放后继续连续饲喂1周,第8天06:00开始启动灌注,将100 mL启动灌注液通过注射器经采样管迅速注入瘤胃内不同位点,灌注完毕用采样管尽量充分搅匀瘤胃液,并抽取瘤胃液反复冲洗采样管和注射器,冲洗瘤胃液应及时回灌瘤胃内,紧接着进行连续灌注(表 2)。连续灌注3 h后从09:00开始从瘤胃取样,每2 h采1次,直至18:00结束, 用以测定Co、VFA浓度和pH;连续灌注在18:00采样后结束。紧接着灌注水溶液,灌注速率不变,持续至21:00结束,灌水中间每1 h采瘤胃液1次,结束后羊自由采食,自由饮水。
|
|
表 2 乙酸、丁酸灌注液配制 Table 2 Formulation of acetate and butyrate infusion solutions |
采集的瘤胃液立即用4层纱布过滤,取4 mL瘤胃液和1 mL(25%)的偏磷酸,静置30 min,3 000 r/min下离心10 min,直接上机测定或-20 ℃冰箱保存。VFA浓度用日本岛津GC-7A气相色谱仪进行测定,Co浓度采用原子吸收法测定,pH用pH酸度计直接测定。
1.6 计算公式(以乙酸为例)灌注前后的瘤胃液相小时稀释速率K和K’(/h)计算公式如下:
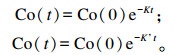
|
式中:Co(t)为t时间点Co浓度;Co(0)为投放时间Co浓度;t为采样不同时间点。
灌注前后的瘤胃液相流通速率F和F’(L/h)计算公式如下:
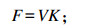
|
F’=Co连续灌注速率(mg/h)/连续灌注后稳态下液相Co浓度(mg/L)。
式中:V为灌注前瘤胃液相体积;K为灌注前瘤胃液相小时稀释速率。
灌注前后的瘤胃液相体积V和V’(L)计算公式如下:
V=一次投放的Co量(mg)/Co(0)(mg/L);
V’=F’/K’。
式中:Co(0)为上述公式回归出的投放时间点Co浓度;F’为灌注后的瘤胃液相流通速率;K’为灌注后瘤胃液相小时稀释速率。
灌注前后的瘤胃乙酸流通速率AFR和AFR’(mmol/h)计算公式如下:
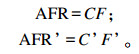
|
式中:C和C’分别为灌注前后的瘤胃乙酸浓度;F和F’分别为灌注前后的瘤胃液相流通速率。
灌注前后的瘤胃乙酸产生速率P和P’(mmol/h)计算公式如下:
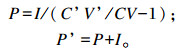
|
式中:C’V’和CV为灌注前后的瘤胃乙酸浓度与瘤胃液相体积分别相乘;I为乙酸连续灌注速率。
灌注前后的瘤胃乙酸吸收速率AAR和AAR’(mmol/h)计算公式如下:
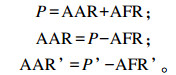
|
式中:P和P’分别为灌注前后的瘤胃乙酸产生速率;AFR和AFR’分别为灌注前后的瘤胃乙酸流通速率。
灌注前后的瘤胃乙酸吸收率A和A’(%)计算公式如下:
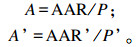
|
式中:AAR和AAR’分别为灌注前后的瘤胃乙酸吸收速率;P和P’分别为灌注前后的瘤胃乙酸产生速率。
MLS的计算公式如下:
MLS=0.72k1Ac+1.8k2Bu+1.14k3Fat。
式中:k1为乙酸瘤胃吸收率;k2为丁酸瘤胃吸收率;k3为过瘤胃脂肪的小肠吸收率;Ac为乙酸瘤胃产生量(mmol/d);Bu为丁酸瘤胃产生量(mmol/d);Fat为过瘤胃脂肪数量(以总脂肪酸数量表示,mmol/d)。0.72为乙酸合成脂肪酸的效率,1.8为丁酸和乙酸的能值之比2.50再乘以0.72所得,1.14为脂肪酸和乙酸能值之比。
1.7 数据统计分析试验数据采用SAS 6.12统计软件的ANOVA程序进行方差分析。
2 结果与分析 2.1 灌注前后瘤胃pH和乙酸、丁酸及Co浓度的变化规律从表 3得知,通过日喂8次模拟连续饲喂后,各试验羊的瘤胃pH始终比较稳定,动物个体间不同时间点瘤胃pH的变异系数小于1%,这说明瘤胃具有较强的缓冲能力,一次性灌入50 mL溶有1 g Co-EDTA的水溶液对瘤胃pH影响不大,也说明模拟连续饲喂15 d后,瘤胃内的pH基本处于稳态。同时从表 3可知,一次性投Co-EDTA后,动物个体间不同时间点乙酸浓度的变异系数小于7%;丁酸浓度的变异系数小于3%,乙酸、丁酸浓度始终比较稳定,这与Peters等[3]、熊本海[14]、孙海洲[15]、程茂基[16]﹑韩飞[17]的研究结果是一致的,符合上述学者提出的牛和羊瘤胃达到稳态条件所规定的变异系数范围。
|
|
表 3 灌注前瘤胃pH和乙酸、丁酸浓度变化规律 Table 3 Changes in ruminal pH and concentration of acetate and butyrate before infusion |
从表 4可知,启动灌注后,瘤胃内pH短时间内必然会出现一定程度的降低,其后随着连续灌注时间的延续,瘤胃pH会趋于稳定。大约在启动灌注后5 h,瘤胃pH开始稳定,动物个体间在不同时间点pH变异系数小于1%;同时启动灌注后仍出现短时间的Co浓度的升高,而后在连续灌注的推动下,Co浓度也逐渐趋于稳定,达到预期目的。另外由表 4可看出,大约在启动灌注5 h后,瘤胃内乙酸、丁酸浓度逐渐趋于稳定,动物个体间变异系数小于6%。由此看来,获得瘤胃的绝对稳态是不可能的,这些结果与Peters等[3]、熊本海[14]、孙海洲[15]、程茂基[16]﹑韩飞[17]的研究报道一致。
|
|
表 4 灌注后瘤胃pH和乙酸、丁酸及Co浓度变化规律 Table 4 Changes in ruminal pH and concentration of acetate, butyrate and cobalt after infusion |
将灌注前后各时间点取样后测得的瘤胃内Co浓度的变化数据作指数方程:
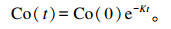
|
式中:Co(t)为t时间点Co浓度,Co(0)为投放时间点Co浓度,K为瘤胃液相小时稀释速率。
从表 5可以得知各试验羊的瘤胃液相小时稀释速率K及投放时间点的Co浓度,根据K值可以计算灌注前瘤胃液相体积V和液相流通速率F。
|
|
表 5 灌注前后不同时间点试验羊瘤胃Co浓度模拟的指数方程 Table 5 Exponential equation for simulating ruminal Co concentration before and after infusion at different time points |
从表 6可知,模拟连续饲喂和启动-连续灌注乙酸、丁酸溶液从而获得瘤胃稳态条件下,乙酸﹑丁酸基本产生速率分别为61.66和23.04 mmol/h,此结果比Bergman等[18]、Leng等[19]、Martin等[20]测得的结果要低,但与熊本海[14]测得的乙酸基本产生速率与吸收率基本吻合,比Nozière等[21]报道的乙酸基本产生速率值低,但比其丁酸产生速率要高。由于国外研究者试验羊品种、年龄和体重及试验饲粮与本试验差异较大,因此从结果的绝对数值上很难进行比较,只能从整个产生、吸收、流通及代谢利用规律以及试验原理方法和计算公式的合理性上加以探讨。前面的基本产生速率加上连续灌注速率,乙酸、丁酸总的产生速率分别为121.66和33.04 mmol/h。其中灌注前每小时有47.15 mmol乙酸和17.86 mmol丁酸经瘤胃壁被吸收掉,吸收率达76.33%和77.52%。同时每小时有14.52 mmol的乙酸和5.19 mmol的丁酸向后消化道流通。而灌注后每小时有83.31 mmol乙酸和20.91 mmol丁酸经瘤胃壁被吸收掉,吸收率分别为68.65%和63.29%,同时每小时有38.35 mmol乙酸和12.13 mmol丁酸向后消化道流通。乙酸和丁酸产生速率增加后,吸收和流通的绝对数量也线性增加,但吸收率有所下降,这与Peters等[22]﹑López等[23]报道的趋势一致,Peters等[22]以肉牛为研究对象得出有87%的乙酸从瘤胃吸收掉,而López等[23]则是82.2%和91%的乙酸和丁酸经瘤胃壁吸收,本试验结果76.33%比之要低,主要原因可能是1)试验动物及饲喂饲粮不同;2)采用方法不同,绝大多数学者采用同位素标记灌注,有的采用全营养灌注,这些都会造成试验系统误差。此外,乙酸组和丁酸组的瘤胃基本液相体积分别为4.32和4.28 L,灌注后提高至5.15和4.69 L,这与前面几位学者的研究规律相一致。
|
|
表 6 瘤胃稳态条件下瘤胃乙酸、丁酸的产生、吸收和流通规律 Table 6 Changes in production, absorption and passage of acetate and butyrate under ruminal steady state |
表 6中还涉及到一个概念即瘤胃库容量CV和C’V’,它指稳态条件下瘤胃通常存留的乙酸或丁酸数量,其值大小反映的是瘤胃内某种酸的产生、外流和吸收等代谢环节动态平衡后的残存值,虽然某种酸的产生量与库容量密切相关,但一般情况下产生量要远远大于库容量,本试验的研究结果也验证了这一点。
表 7为2个灌注组灌注前后乙酸和丁酸的产生速率(X,mmol/h)与对应瘤胃浓度(Y1,mmol/L),产生速率(X,mmol/h)与吸收速率(Y2,mmol/h)建立的回归方程。把上述回归方程2边同除以X,可得乙酸和丁酸的吸收率Y3(%)与2种酸产生速率X(mmol/h)的回归方程。Peters等[22]建立了瘤胃乙酸产生速率与瘤胃乙酸吸收速率的良好线性关系(R2>0.95);而在此之前,Leng等[19]建立了乙酸、丙酸、丁酸三者的产生速率与对应瘤胃浓度的线性回归方程。本研究也对乙酸和丁酸的产生速率与吸收速率及乙酸和丁酸的产生速率与瘤胃浓度建立了回归方程,从表 7可知回归线性程度较高。
|
|
表 7 瘤胃乙酸、丁酸产生速率与其吸收速率、吸收率及瘤胃浓度的回归关系 Table 7 Regression equation between production rate and absorption rate, concentration and fractional absorption rate of ruminal acetate and butyrate |
由表 8可知,本研究饲粮每日提供MLS约为135.69 g,需要交代一下的是:由于本研究采用的饲粮为常规设计,不添加任何脂肪物质,因此所用饲粮脂肪含量仅为2%左右,过瘤胃脂肪更是少之又少,因此公式中的第3部分在常规饲粮条件下可忽略不计,所得135.69 g为瘤胃乙酸部分和丁酸部分提供。如果饲粮添加了脂肪或脂肪含量丰富,则需测定过瘤胃脂肪量,需取小肠液先进行水解,将残余脂肪先水解为脂肪酸,然后再测定总脂肪酸含量。
|
|
表 8 饲粮MLS的计算值 Table 8 Calculated value of dietary MLS |
另外从表 8可知,本研究所设计的饲粮经瘤胃发酵生成的乙酸、丁酸(C2+C4能)占饲粮代谢能的89.24%,这也再次验证了从Phillipson等[24]、Barcroft等[25]至今诸多学者们的研究报道:VFA可提供反刍动物70%以上的能量,而乙酸加丁酸占到总VFA的75%以上,因而乙酸是反刍动物的主要能量来源。同时也说明本研究所采用的基础饲粮属乙酸发酵型。
从VFA 3种主要组成酸的整体来讲,由于乙酸、丙酸、丁酸的比例对饲粮能量转化效率影响很大,所以一直是国内外反刍动物科研和生产领域关注的问题,在我国这样的发展中国家,牛羊饲养中不得不大量饲用低质粗饲料,因此调控好C3+C6能与C2+C4能在代谢能中的比例,最终提高低质粗饲料利用率至关重要。本研究试验结果旨在为上述调控提供理论和技术数据。
3 讨论 3.1 瘤胃VFA产生速率测定方法评定由于不同组织对VFA具有选择性的代谢,决定瘤胃液中VFA的摩尔比例与外周血液中的摩尔比例很少一致,同时伴随有产生的VFA不断向后消化道的流通,所以测定瘤胃VFA的产生量是极其复杂的。研究者测定VFA产生量的方法包括最简单的化学成分发酵系数法[26-27]、同位素稀释技术法[28]、门脉系统VFA测定法[29]、体外零点时间法(Zero-Time)法[30]和启动-连续灌注法[1],每一种方法都有自己的优缺点,甚至像化学成分发酵系数法现已证明是错误的。
本研究测定乙酸、丁酸基本产生速率采用的就是最后一种方法,即利用启动-连续灌注非标记的乙酸和丁酸溶液,打破通过连续饲喂已获得的瘤胃发酵的稳态平衡,经过大约5 h后,重新达到新的稳态,使灌注前后稳态下瘤胃中的乙酸和丁酸浓度产生一定差异,然后依据假设:稳态下,瘤胃内乙酸或丁酸的产生与消失保持平衡,而且VFA的灌注不改变瘤胃基本发酵模式。并通过这种假设推导出的公式计算出乙酸、丁酸的基本产生速率。应用此方法的前提是必须获得瘤胃稳态。从字面意思上理解,稳态是一种无变化的生物内环境,实际上,它是一种连续的、均匀变化的、变异可量化规定的生物状态。Peters等[3]首次规定了稳态条件,随后熊本海[14]、孙海洲[15]、韩飞[17]研究者陆续提出了自己的稳态条件。从本研究的测定结果看,这种方法是可行的,稳态规定指标的变异系数在前人规定的范围之内(表 9)。
|
|
表 9 瘤胃稳态规定条件一览表 Table 9 Summary of ruminal steady state conditions |
关于VFA的产生、吸收和流通很多研究者都做了报道,但是由于采用方法不同,加上试验动物、饲粮等的不同,报道结果差异很大。Bergman等[18]采用同位素标记VFA灌注测得的乙酸和丁酸产生速率分别为154.17和29.17 mmol/h,由于乙酸和丁酸在代谢循环中存在C原子交换现象,因此在他的报道中涉及到2个概念:总产生速率(gross production rate)和净产生速率(net production rate)。总产生速率不考虑2种酸的C原子交换,而净产生速率需要在总产生速率的基础上校正C原子交换速率后才能得到。按照这个提法,本研究所测定的产生速率应为总产生速率。随后Leng等[19]也采用同位素标记灌注同步测定了VFA的产生速率,并建立了产生速率与瘤胃VFA浓度之间的回归关系,他也对乙酸和丁酸之间的原子交换进行了校正,但他把校正后的产生速率称为有效产生速率(effective production rate),这与Bergman等[18]的净产生速率是同义的。Leng等[19]测得的乙酸产生速率为80.4~248.4 mmol/h,丁酸为15~27 mmol/h,校正后的有效乙酸产生速率占总产生速率的85%~91%,有效丁酸产生速率占总产生速率的53%~73%。其后的诸多学者如Peters等[3, 22]、熊本海[14]、孙海洲[15]、Martin等[20]、López等[23]都在这一方面做了报道,国外学者由于试验方法、试验动物和饲粮与本研究差异太大,因此报道结果的绝对数值一般要高的多,本研究的条件接近熊本海[14]的研究,因此乙酸基本产生速率与之(60.42 mmol/h)基本接近。从吸收情况来看,López等[23]采用全营养灌注报道的的乙酸、丁酸瘤胃吸收率分别为产生量的82.2%和91.0%,比本研究所得数值要高,这可能与灌注方法不同有关;Peters等[22]测定的乙酸吸收率介于67%~87%,熊本海[14]的报道为75.2%,本研究乙酸吸收率(76.34%)接近这2位学者的范围。
3.3 传统能量指标的局限性及MLS指标的优越性反刍动物目前的饲养体系所采用代谢能或净能体系和其他的传统能量指标一样,都将能量作为一个单独的营养指标加以讨论和使用。但在动物体内,能量代谢和物质代谢是一个过程的2个方面。能量载体物质(主要指碳水化合物、蛋白质和脂肪)的消化、吸收和利用、合成和分解,必然同时伴随着能量的转化和利用,两者始终相互依存、不可脱离。由于动物体内物质代谢和能量代谢的复杂性,单纯用能量指标只能说明利用率的差别,但很难说清不同能量来源之间的关系及其转化利用的效率,无法有针对性地对能量转化进行调控。近年来,在反刍动物方面提出了将能量指标与能量载体指标相结合的发展趋势,如Preston等[4]提出的生葡萄糖能和卢德勋[5]提出的MG。卢德勋研究员针对传统能量指标与能量载体物质相脱节的缺陷,于2004年继MG之后又提出了MLS新指标,这一指标的优越性在于:1)克服了传统营养指标体系能量与能量载体相互脱节的缺陷,成为反刍动物物质代谢和能量代谢之间联系的桥梁,为能量代谢和物质代谢整体调控创造了条件。具体来说,MLS可用来作为调控饲粮中C2+C4能占代谢能比例的重要技术指标。2)利用MLS和MG指标结合而建立的MLS/MG新体系,可为反刍动物能量利用整体调控提供有力工具。3)MLS这一指标可用来评定饲料的营养价值以及不同年龄和生理阶段的动物对生脂物质的需要量。本研究正是根据MLS这一新指标,测定了1.0 M能量水平条件下饲粮的MLS为135.69 g/d,C2+C4能占饲粮代谢能的89.24%,这些数据旨在为C3+C6能与C2+C4能在反刍动物饲粮代谢能中的调控提供理论和技术支持。
4 结论① 本研究条件下,试验羊瘤胃乙酸﹑丁酸基本产生速率分别为61.66和23.04 mmol/h,吸收速率为47.15和17.86 mmol/h,流通速率为14.52和5.19 mmol/h,吸收率达76.33%和77.52%。
② 本研究饲粮每日提供MLS为135.69 g,C2+C4能占饲粮代谢能的89.24%。
| [1] |
BERGMAN E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J]. Physiological Reviews, 1990, 70(2): 567-590. DOI:10.1152/physrev.1990.70.2.567 |
| [2] |
THOMAS K D. Molecular biology and archaeology:a prospectus for inter-disciplinary research[J]. World Archaeology, 1993, 25(1): 1-17. |
| [3] |
PETERS J P, SHEN R Y W, ROBINSON J A, et al. Disappearance and passage of propionic acid from the rumen of the beef steer[J]. Journal of Animal Science, 1990, 68(10): 3337-3349. DOI:10.2527/1990.68103337x |
| [4] |
PRESTON T R, LENG R A. Matching ruminant production systems with available resources in the tropics and sub-tropics[M]. Armidale, NSW: Renambul Books, 1987.
|
| [5] |
卢德勋. 在动物营养领域应用系统科学的初步探索[M]. 北京: 中国农业大学出版社, 1996: 14-22.
|
| [6] |
RIOND J L. Animal nutrition and acid-base balance[J]. European Journal of Nutrition, 2001, 40(5): 245-254. DOI:10.1007/s394-001-8352-2 |
| [7] |
BURROUGHS W, NELSON D K, MERTENS D R. Protein physiology and its application in the lactating cow:the metabolizable protein feeding standard[J]. Journal of Animal Science, 1975, 41(3): 933-944. DOI:10.2527/jas1975.413933x |
| [8] |
NRC.Nutrient requirements of small ruminants: sheep, goats, cervids, and new world camelids[S].Washington, D.C.: National Academy Press, 2007.
|
| [9] |
卢德勋.乳牛营养技术精要[C]//2001年动物营养学术研讨会论文集.成都: 华西希望集团, 2001.
|
| [10] |
红敏.奶牛粗饲料品质评定新一代GI(GI2008)的建立及在奶牛养殖应用中的研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2009: 14-16. http://cdmd.cnki.com.cn/Article/CDMD-10129-2009131251.htm
|
| [11] |
卢德勋. 系统动物营养学导论[M]. 北京: 中国农业出版社, 2004: 364-371.
|
| [12] |
NRC.Nutrient requirements of sheep[S].6th ed.Washington, D.C.: National Academy Press, 1985.
|
| [13] |
UDÉN P, COLUCCI P E, VAN SOEST P J. Investigation of chromium, cerium and cobalt as markers in digesta.Rate of passage studies[J]. Journal of the Science of Food and Agriculture, 1980, 31(7): 625-632. DOI:10.1002/jsfa.2740310702 |
| [14] |
熊本海.生长肥育羊瘤胃内VFA产生、吸收规律及模型参数研究[D].博士学位论文.北京: 中国农业科学院, 1998.
|
| [15] |
孙海洲.生长肥育羊葡萄糖营养整体优化规律的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 1999. http://www.cnki.com.cn/Article/CJFDTotal-NMXK199901007.htm
|
| [16] |
程茂基.绵羊瘤胃内寡肽的产生、降解、吸收、流通与微生物摄取规律的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2000. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y336124
|
| [17] |
韩飞.反刍动物常用饲料丙酸产量和吸收率的测定及其模型化的研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2001. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y382436
|
| [18] |
BERGMAN E N, REID R S, MURRAY M G, et al. Interconversions and production of volatile fatty acids in the sheep rumen[J]. Biochemical Journal, 1965, 97(1): 53-58. |
| [19] |
LENG R A, BRETT D J. Simultaneous measurements of the rates of production of acetic, propionic and butyric acids in the rumen of sheep on different diets and the correlation between production rates and concentrations of these acids in the rumen[J]. British Journal of Nutrition, 1966, 20(3): 541-552. DOI:10.1079/BJN19660053 |
| [20] |
MARTIN C, KIRSTENSEN N B, HUHTANEN P. Comparison of non-tracer and tracer methods for determination of volatile fatty acid production rate in the rumen of sheep fed on two levels of intake[J]. British Journal of Nutrition, 2001, 86(3): 331-340. DOI:10.1079/BJN2001386 |
| [21] |
NOZIÈRE P, MARTIN C, RÉMOND D, et al. Effect of composition of ruminally-infused short-chain fatty acids on net fluxes of nutrients across portal-drained viscera in underfed ewes[J]. British Journal of Nutrition, 2000, 83(5): 521-531. DOI:10.1017/S0007114500000660 |
| [22] |
PETERS J P, SHEN R Y, ROBINSON J A. Disappearance of acetic acid from the bovine reticulorumen at basal and elevated concentrations of acetic acid[J]. Journal of Animal Science, 1992, 70(5): 1509-1517. DOI:10.2527/1992.7051509x |
| [23] |
LÓPEZ S, HOVELL F D D, DIJKSTRA J, et al. Effects of volatile fatty acid supply on their absorption and on water kinetics in the rumen of sheep sustained by intragastric infusions[J]. Journal of Animal Science, 2003, 81(10): 2609-2616. DOI:10.2527/2003.81102609x |
| [24] |
PHILLIPSON A T, MCANALLY R A. Studies on the fate of carbohydrates in the rumen of the sheep[J]. Journal of Experimental Biology, 1942, 19(2): 199-214. |
| [25] |
BARCROFT J, MCANALLY R A, PHILLIPSON A T. Absorption of volatile acids from the alimentary tract of the sheep and other animals[J]. Journal of Experimental Biology, 1944, 20(2): 120-129. |
| [26] |
MURPHY M R, BALDWIN R L, KOONG L J. Estimation of stoichiometric parameters for rumen fermentation of roughage and concentrate diets[J]. Journal of Animal Science, 1982, 55(2): 411-421. DOI:10.2527/jas1982.552411x |
| [27] |
MURPHY M R.Modelling production of volatile fatty acids in ruminants[M]//BALDWIN R L, BYWATER A C.Modelling ruminant digestion and metabolism.Davis, USA: University of California, 1984: 59-62.
|
| [28] |
SUTTON J D. Digestion and absorption of energy substrates in the lactating cow[J]. Journal of Dairy Science, 1985, 68(12): 3376-3393. DOI:10.3168/jds.S0022-0302(85)81251-0 |
| [29] |
KRISTENSEN N B, HARMON D L. Splanchnic metabolism of volatile fatty acids absorbed from the washed reticulorumen of steers[J]. Journal of Animal Science, 2004, 82(7): 2033-2042. DOI:10.2527/2004.8272033x |
| [30] |
HUNGATE R E. The rumen and its microbes[M]. New York: Academic Press, 1966.
|
| [31] |
苏鹏程.不同代谢葡萄糖水平日粮条件下白绒山羊体内蛋白质(氨基酸)分配规律的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10129-2004076624.htm
|




