2. 内蒙古农牧业科学院动物营养与饲料研究所, 呼和浩特 010031;
3. 乌拉特前旗家畜改良工作站, 巴彦淖尔 014400
2. Animal Nutrition and Feed Research Institution of Inner Mongolia Academy of Agriculture and Animal Husbandry Academy, Hohhot 010031, China;
3. Urat Front Banner Livestock Improvement Station, Bayannur 014400, China
围产期是母羊生产周期中最为关键的时期。在围产期,母羊最大的代谢特点是能量的需求急剧增大,而供给严重不足,由此而引发的能量负平衡极易导致各种营养代谢病的发生。目前,通过应用营养素来促进母羊肝脏糖异生,提高母羊的葡萄糖(GLU)供给,降低母羊体内非酯化脂肪酸(NEFA)的含量,是改善围产期母羊能量负平衡、保障母羊机体健康、促进胎儿生长发育和提高母羊泌乳力的有效途径之一。
5-羟色胺(5-HT)是由必需氨基酸——色氨酸(Trp)经2步反应合成的内源活性物质,5-羟基色氨酸(5-HTP)和Trp是其2步合成反应的前体物。Laporta等[1]研究报道,给雌性大鼠饲喂5-HT前体物5-HTP和Trp,能够调节其围产期的肝脏糖代谢,促进肝脏糖异生关键酶的mRNA表达;给泌乳后期奶牛颈静脉灌注5-HTP,可以降低其血液中β-羟基丁酸浓度,改善围产期奶牛的能量代谢[2]。Zabala等[3]研究表明,5-HT可促进大鼠肝脏细胞糖异生关键酶磷酸烯醇式丙酮酸羧激酶(PEPCK)的mRNA表达。因此,研究5-HT对于母羊围产期泌乳性能及血浆生化指标的影响,可以很直观地反映5-HT对母羊围产期复杂的神经-内分泌-营养网络的调控作用,为缓解围产期母羊能量负平衡、更好地发挥母羊的生产性能、保证母体及胎儿的健康提供基础生产数据,也可为深入开展5-HT对围产期母羊肝脏糖代谢的深层次机理研究提供数据支持。
1 材料与方法 1.1 试验设计选择体况良好、体重(64.52±4.11) kg、处于同一围产期、经同期发情配种的3岁经产巴美肉羊母羊30只,按体重随机分为3组,即对照组(灌注生理盐水)、5-HTP组(灌注5-HTP)和Trp组(灌注Trp),每组10只。5-HTP组和Trp组在母羊产前第7天至产后当天(第0天)的每日08:00进行颈静脉灌注,5-HTP和Trp的灌注剂量均为0.178 mg/kg BW,浓度为0.1 mg/mL;对照组灌注同等剂量的生理盐水,灌注剂量的设定参照文献[2]。试验期为产前第14天至产后第30天,其中,预试期为产前第14天至产前第8天,正试期为产前第7天至产后第30天。试验饲粮参照NRC(2007)绵羊营养需要配制,基础饲粮组成及营养水平见表 1。每日在08:00和17:00各饲喂1次基础饲粮。试验期间所有母羊自由饮水,羊舍环境条件及饲养管理均保持一致,由专人饲养并记录采食量。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
饲粮代谢能为计算值,参考《中国饲料成分及营养价值表(2018年第29版)》[4]中各原料的代谢能值,根据NRC(2007)绵羊营养需要量,通过各原料组成比例进行计算。粗蛋白质含量的测定使用凯氏定氮法,参考GB/T 6432—1994[5]的方法。钙含量的测定使用乙二胺四乙酸二钠络合滴定法,参考GB/T 6436—2002[6]的方法。磷含量的测定使用分光光度法,参考GB/T 6437—2002[7]的方法。酸性洗涤纤维(NDF)含量的测定使用范式法,参考GB/T 20806—2006[8]的方法。非纤维性碳水化合物(NFC)含量根据下列公式计算:
非纤维性碳水化合物=100-(粗蛋白质+粗脂肪+酸性洗涤纤维+粗灰分)[9]。
1.2.2 母羊泌乳量测定在母羊产后第6、9、12和15天,采用羔羊体重之差法测定母羊泌乳量[10]。将羔羊与母羊隔离4 h后放回到母羊身边,30 min后对羔羊进行体重称量,每日早、中、晚各测定1次,泌乳量为3次测定的总和。
1.2.3 乳样的收集与测定于母羊产后第1~15天每隔3 d和产后第30天,每个试验组于每个重复中随机选6只母羊,记录耳号,并在每次采乳样时选择同一只母羊采集乳样50 mL装于离心管中,-20 ℃冷冻保存,并使用FOSS乳品成分快速分析仪(MilkoScan FT120)进行乳脂、乳糖、乳蛋白和乳中非脂固体含量检测。
1.2.4 血样的收集与测定于母羊产前第7天及产后第0、3、6、9、15和30天,采集其颈静脉血10 mL并放入含有肝素纳的离心管中,在4 ℃、3 500×g条件下离心15 min,将上清液吸出并于-20 ℃冷冻保存,用于血浆胰岛素(INS)、胰岛素样生长因子-1(IGF-1)、葡萄糖、NEFA和5-HT浓度的测定。
用紫外分光光度计(UV-2600,岛津,日本)使用酶联免疫吸附测定(ELISA)法测定血浆INS、IGF-1和5-HT浓度,试剂盒购自南京建成生物工程研究所,测定步骤严格按照说明书进行。用紫外分光光度计使用葡萄糖氧化酶法测定血浆葡萄糖浓度,试剂盒购自南京建成生物工程研究所,测定步骤严格按照说明书进行。用可见光分光光度计(上海光学仪器厂)使用比色法测定血浆NEFA浓度,试剂盒购自南京建成生物工程研究所,测定步骤严格按照说明书进行。
1.3 数据统计分析试验有关数据处理采用Excel 2010进行计算,并采用SAS 9.2软件进行单因素方差分析,不同组间差异显著性采用SNK法进行多重比较。试验结果均以平均值和均值标准误(SEM)表示,P < 0.05为差异显著。
2 结果 2.1 母羊产羔数统计由表 2可知,对照组产双羔母羊7只,产单羔母羊3只;Trp组产双羔母羊5只,产单羔母羊5只;5-HTP组产双羔母羊6只,产单羔母羊4只。
|
|
表 2 母羊产羔数统计 Table 2 Statistics of lambing number of ewes |
由表 3可知,产前第7天至产后第3天,3组母羊平均干物质采食量整体较低,各组间无显著差异(P>0.05);产后第3~15天,3组母羊平均干物质采食量整体提高80%以上,各组间无显著差异(P>0.05);产后第15~30天,5-HTP组母羊平均干物质采食量显著高于对照组和Trp组(P<0.05)。
|
|
表 3 母羊平均干物质采食量 Table 3 Average dry matter intake of ewes |
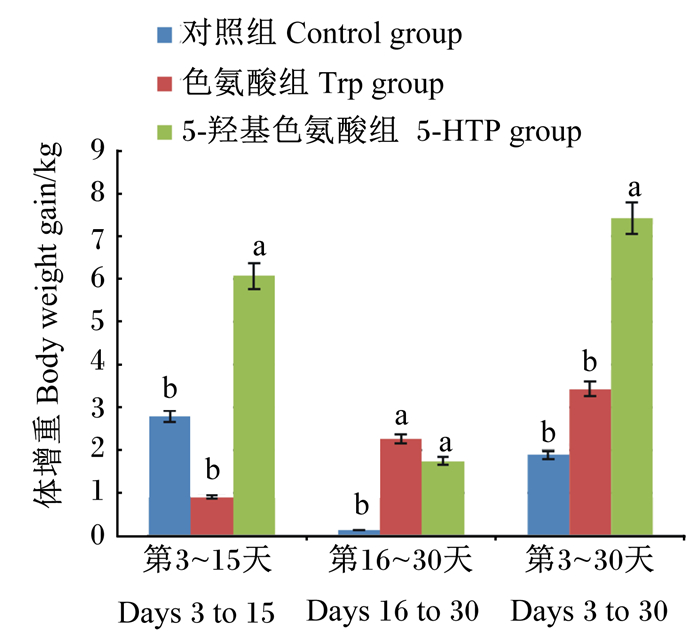
由图 1可知,产后第3~15天,5-HTP组母羊体增重显著高于对照组和Trp组(P<0.05),对照组和Trp组之间差异不显著(P>0.05);产后第15~30天,5-HTP组和Trp组母羊体增重显著高于对照组(P<0.05),5-HTP组和Trp组之间差异不显著(P>0.05);产后第3~30天,5-HTP组母羊体增重显著高于对照组和Trp组(P<0.05),对照组和Trp组之间差异不显著(P>0.05)。
|
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。 Value columns with the same small letter mean no significant difference (P>0.05), while with different small letters mean significant difference (P<0.05). 图 1 5-羟色胺前体物对母羊产后体增重的影响 Fig. 1 Effects of 5-HT precursor on postpartum body weight gain of ewes |
由表 4可知,产后第6天,各组间母羊泌乳量差异不显著(P>0.05);产后第9、12、15天,母羊泌乳量相比产后第6天均有升高趋势,各组间母羊泌乳量差异不显著(P>0.05)。
|
|
表 4 5-羟色胺前体物对母羊泌乳量的影响 Table 4 Effects of 5-HT precursor on milk yield of ewes |
由表 5可知,产后第3天,5-HTP组母羊乳脂含量为5.97%,Trp组为5.88%,对照组为6.26%;5-HTP组和Trp组母羊乳脂含量显著低于对照组(P < 0.05),5-HTP组与Trp组之间无显著差异(P>0.05)。产后第3、6、9、12、15天,各组母羊乳脂含量呈现降低-升高-降低的趋势,在产后第12、15天较低。产后第6、9、12天,5-HTP组母羊乳脂含量均低于对照组,但差异不显著(P>0.05)。
|
|
表 5 5-羟色胺前体物对母羊乳脂含量的影响 Table 5 Effects of 5-HT precursor on milk fat content of ewes |
由表 6可知,产后第3、6、9、12、15、30天,5-HTP组和Trp组母羊乳蛋白含量均低于对照组,但差异不显著(P>0.05)。
|
|
表 6 5-羟色胺前体物对母羊乳蛋白含量的影响 Table 6 Effects of 5-HT precursor on milk protein content of ewes |
由表 7可知,产后第3天,5-HTP组母羊乳糖含量为4.08%,Trp组为4.64%,对照组为3.74%;Trp组母羊乳糖含量显著高于对照组(P < 0.05),Trp组与5-HTP组之间无显著差异(P>0.05)。产后第3、6、9、12天,各组母羊乳糖含量均呈现逐渐升高的趋势,在母羊产后第9天后趋于稳定;产后第6、9、12、15、30天,各组之间乳糖含量差异不显著(P>0.05)。
|
|
表 7 5-羟色胺前体物对母羊乳糖含量的影响 Table 7 Effects of 5-HT precursor on lactose content of ewes |
由表 8可知,产后第3天,5-HTP组母羊乳中非脂固体含量为10.59%,Trp组为11.10%,对照组为12.81%;对照组母羊乳中非脂固体含量显著高于5-HTP组和Trp组(P < 0.05),Trp组与5-HTP组之间无显著差异(P>0.05)。产后第6、9天,各组母羊乳中非脂固体含量呈现逐渐降低趋势,并在产后第9天之后略有升高并趋于稳定。产后第6、9、12、15、30天,5-HTP组和Trp组母羊乳中非脂固体含量均低于对照组,但差异不显著(P>0.05)。
|
|
表 8 5-羟色胺前体物对母羊乳中非脂固体含量的影响 Table 8 Effects of 5-HT precursor on milk non-fat solid content of ewes |
由表 9可知,灌注前(产前第7天),各组之间血浆5-HT浓度差异不显著(P>0.05)。临近分娩(产前第0天),各组血浆5-HT浓度降低至最低值,对照组血浆5-HT浓度下降较为明显,Trp组和5-HTP组下降幅度较小,Trp组和5-HTP组血浆5-HT浓度显著高于对照组(P < 0.05);5-HTP组血浆5-HT浓度略高于Trp组,但差异不显著(P>0.05)。产后第3、6、9天,5-HTP组和Trp组血浆5-HT浓度显著高于对照组(P < 0.05);且5-HTP组血浆5-HT浓度略高于Trp组,但差异不显著(P>0.05);产后第15、30天,各组血浆5-HT浓度趋于稳定,各组之间差异不显著(P>0.05)。
|
|
表 9 5-羟色胺前体物对母羊血浆5-羟色胺浓度的影响 Table 9 Effects of 5-HT precursor on plasma 5-HT concentration of ewes |
由表 10可知,灌注前,各组之间血浆葡萄糖浓度差异不显著(P>0.05)。临近分娩,各组血浆葡萄糖浓度升高至最大值,Trp组和5-HTP组血浆葡萄糖浓度显著高于对照组(P < 0.05)。产后第3、6、9天,5-HTP组和Trp组血浆葡萄糖浓度显著高于对照组(P < 0.05),5-HTP组与Trp组之间差异不显著(P>0.05)。产后第15~30天,各组血浆葡萄糖浓度趋于稳定,各组之间差异不显著(P>0.05)。
|
|
表 10 5-羟色胺前体物对母羊血浆葡萄糖浓度的影响 Table 10 Effects of 5-HT precursor on plasma glucose concentration of ewes |
由表 11可知,灌注前,各组血浆INS浓度差异不显著(P>0.05)。临近分娩,各组血浆INS浓度降低至最低点,Trp组和5-HTP组血浆INS浓度显著低于对照组(P < 0.05)。产后第3、6天,各组血浆INS浓度上升,5-HTP组和Trp组血浆INS浓度显著低于对照组(P < 0.05),5-HTP组与Trp组之间差异不显著(P>0.05)。产后第9、15、30天,各组血浆INS浓度升高,各组之间差异不显著(P>0.05)。
|
|
表 11 5-羟色胺前体物对母羊血浆胰岛素浓度的影响 Table 11 Effects of 5-HT precursor on plasma INS concentration of ewes |
由表 12可知,灌注前,各组血浆NEFA浓度差异不显著(P>0.05)。分娩后,各组血浆NEFA浓度逐渐上升,至产后第6天达到最高值。产前第0天河和产后第3天,Trp组和5-HTP组血浆NEFA浓度显著低于对照组(P < 0.05);产后第6天,对照组血浆NEFA浓度显著高于5-HTP组(P < 0.05),对照组与Trp组及5-HTP组与Trp组之间差异不显著(P>0.05)。产后第9天,对照组血浆NEFA浓度显著高于Trp组和5-HTP组(P < 0.05),5-HTP组与Trp组之间差异不显著(P>0.05)。产后第15、30天,各组血浆NEFA浓度下降,各组之间差异不显著(P>0.05)。
|
|
表 12 5-羟色胺前体物对母羊血浆非酯化脂肪酸浓度的影响 Table 12 Effects of 5-HT precursor on plasma NEFA concentration of ewes |
由表 13可知,灌注前,各组血浆IGF-1浓度差异不显著(P>0.05)。临近分娩,各组血浆IGF-1浓度迅速降低,产后第3、6、9、15、30天呈波动性,虽有升高趋势,但仍低于产前第7天。产前第0天,对照组血浆IGF-1浓度显著高于5-HTP组(P < 0.05),5-HTP组与Trp组之间差异不显著(P>0.05)。产后第3天,对照组血浆IGF-1浓度显著高于5-HTP组和Trp组(P < 0.05),5-HTP组与Trp组之间差异不显著(P>0.05)。产后第6、9、15、30天,各组之间血浆IGF-1浓度差异不显著(P>0.05)。
|
|
表 13 5-羟色胺前体物对母羊血浆胰岛素样生长因子-1浓度的影响 Table 13 Effects of 5-HT precursor on plasma IGF-1 concentration of ewes |
围产期母畜的干物质采食量会受到饲粮能量水平、环境因素、体重的变化及饲粮饲喂方式等多种因素的影响。在妊娠后期母畜干物质采食量会逐渐降低。以奶牛为例,其干物质采食量从干奶初期开始呈下降趋势,至分娩前3周降低10%~20%[11],在分娩前1周降低约30%[12]。产犊后采食量逐渐恢复,产后第1周可恢复至最大干物质采食量的65%,在产后第9~13周达到高峰[13]。同时,在妊娠后期,由于胎儿体积增大,瘤胃空间减少,也直接影响了干物质采食量。Grummer等[14]报道,在产前3周奶牛平均干物质采食量逐渐下降,在分娩前急剧下降,这与奶牛在妊娠后期体内胎儿逐渐增大挤压瘤胃以及奶牛自身激素代谢变化有关[15]。本研究表明,在产前第7天至产后第3天,各组母羊平均干物质采食量整体较低,母羊体增重呈下降趋势,在产后第3~15天,各组母羊平均干物质采食量逐渐提高80%以上,母羊体增重逐渐提升,在产后第15~30天,5-HTP组母羊平均干物质采食量显著高于对照组和Trp组。产后第15~30天,5-HTP组母羊体增重的显著提高可能是由于5-HTP的添加改善了母羊围产期的能量负平衡,母羊体况恢复,饲料转化率高导致的。
在母畜分娩前,其体内内分泌发生急剧变化,INS浓度升高,IGF-1浓度降低,机体出现INS抵抗和免疫抑制,使得干物质采食量下降的更为明显。由于围产期母畜为了满足母体及胎儿的营养需要、乳腺组织恢复、乳汁的合成和分泌,机体对营养物质的需求,特别是对葡萄糖需求急剧增加,而干物质采食量的不足直接导致了葡萄糖供需的不平衡。据报道,在肝脏中,5-HT可通过5-羟色胺受体2B(HTR2B)来促进糖异生,抑制葡萄糖摄取[16-17]。而血清素对动物进食行为的影响取决于特定的血清素受体的靶向性,以及动物是否受到禁食或所食食物的美味性影响[18]。因此,通过添加5-HT来促进母羊肝脏糖异生,最大程度地减少能量负平衡就成为一种可能的有效途径。
3.2 5-HT前体物对母羊泌乳性能的影响泌乳量是衡量母畜产后生产性能的重要指标之一。李胜利等[19]研究表明,在产后奶牛的饲粮中添加高能补充料,可以缓解奶牛在泌乳早期形成的能量负平衡,使体况得到恢复,产乳量增加且不会引起乳成分的改变。其他研究也表明,在奶牛泌乳初期改善奶牛机体能量代谢,可显著提高泌乳量[20-21]。
本试验结果表明,产后第9天各组泌乳量均有升高趋势,各组间泌乳量差异不显著,但对照组和5-HTP组的泌乳量在母羊产后第12天,与Trp组比较提升幅度较大,这可能与这2组试验羊产双羔数多于Trp组有关。产后第3天,5-HTP组和Trp组母羊乳脂含量显著低于对照组。Janovick等[22]研究认为,由于奶牛在产乳早期处于能量负平衡加剧的阶段,机体会动用更多的脂肪,这会导致奶牛在泌乳早期出现乳脂含量较高情况的发生。也有研究表明,在泌乳第4天,乳中40%的乳脂是由血液中NEFA提供的[23]。本试验研究发现,对照组在泌乳第3天的NEFA含量也高于5-HTP组和Trp组,这也说明了母羊在泌乳初期动用了更多的体脂,使乳脂含量升高。
本试验中,乳蛋白含量在母羊产后各时间点未见明显变化,仅在母羊产后第3~9天,各组乳蛋白含量略有降低趋势,而后逐渐升高,各组之间差异不显著。乳糖含量在母羊产后第3天,5-HTP组为4.08%,Trp组为4.64%,对照组为3.74%,Trp组乳糖含量显著高于对照组。Laporta等[24]研究发现,给小鼠饲粮中添加5-HTP和L-Trp,L-Trp组直到哺乳期的第9天才增加母体血液中5-HT浓度,L-Trp组在所有时间点血液中葡萄糖浓度都较低,但乳糖浓度没有下降,说明机体有足够的葡萄糖合成乳糖。似乎5-HT并不是最终导致血液和牛奶中葡萄糖浓度的降低,一种可能的解释是L-Trp参与了许多其他代谢合成途径[25]。
3.3 5-HT前体物对母羊血浆生化指标的影响围产期是反刍母畜在整个繁殖周期中,生理代谢、免疫应答以及营养代谢最为重要的转换阶段。在此阶段,母畜胎儿的生长以及泌乳后乳腺合成乳糖都需要大量的葡萄糖供给。因此,葡萄糖浓度的变化可以直接地反映出母畜机体对于葡萄糖利用的动态,也能够很好地体现出机体能量平衡的状态[26]。本试验围产期母羊血浆葡萄糖浓度在灌注前各组间差异不显著,临近分娩时各组血浆葡萄糖浓度升高至峰值,这可能是由于母羊产羔应激造成的结果。当母羊在分娩时,体内内分泌急剧变化,活动增强,大脑神经中枢兴奋,心率、血压及葡萄糖浓度迅速升高[27]。产后第3~9天血浆葡萄糖浓度下降,并在产后第15~30天趋于稳定,各组产后血浆葡萄糖浓度均低于产前第7天,这与母羊产后泌乳机制启动密切相关。泌乳时,乳糖合成需要乳腺组织动员增加对葡萄糖的摄入,从而导致葡萄糖浓度降低[28]。本试验中,试验组灌注5-HTP和Trp后,母羊血浆5-HT浓度显著升高,同时显著提高了产后第3~9天母羊血浆葡萄糖浓度,可能是母羊体内葡萄糖主要来自于肝脏糖异生,而5-HT有促进肝脏糖异生的作用,灌注5-HTP和Trp使母羊肝脏糖异生作用增强,体内循环葡萄糖浓度升高。产后第15天以后,灌注的5-HTP和Trp已经不能显著提高母羊血浆5-HT浓度,因此,各组血浆葡萄糖浓度差异不显著。
INS是由胰岛β细胞合成并分泌,在肝脏、脂肪和肌肉组织中调控营养物质的代谢。INS能够促进葡萄糖由细胞外向细胞内的转运,提高对葡萄糖的利用,降低糖异生作用,抑制糖原分解为葡萄糖进入血液,以控制机体葡萄糖浓度。母羊在围产期由于胎盘分泌的生乳素和生长激素会刺激IGF-1的产生,IGF-1在脂肪细胞中具有与INS相似的作用,可抑制脂肪分解,增强脂肪组织对葡萄糖的利用,促进脂肪合成,减少血液中NEFA的浓度。Rukkwamsuk等[29]报道,IGF-1也能够增强肝脏对外源性葡萄糖的摄取,促进葡萄糖氧化,降低血浆葡萄糖浓度。本试验结果表明,临近分娩时,各组血浆INS和IGF-1浓度均降至最低点,血浆INS和IGF-1浓度的急剧下降与母羊产羔时内分泌的变化有关。同时,Rukkwamsuk等[29]研究表明,胰岛β细胞会随着葡萄糖浓度的上升而加速对INS的分泌,低水平的INS可以促进肝脏糖异生,减少肌肉和脂肪组织等外周组织对葡萄糖的利用,升高机体葡萄糖浓度[30]。本试验中,产后Trp组和5-HTP组血浆INS和IGF-1浓度均高于对照组,可能是由于5-HT启动了肝脏糖异生机制,降低了INS敏感性,提高了血浆葡萄糖浓度。同时,产后第3~9天,各组血浆INS浓度虽有回升,但对照组仍低于产前水平。据Gong等[30]报道,血浆INS浓度的低水平与能量负平衡有关。母羊产后由于泌乳使得能量负平衡加重,葡萄糖优先供给乳腺组织合成乳糖,使得葡萄糖浓度降低,5-HT的灌注使母羊产后葡萄糖降低幅度减小,一定程度上保障了母体葡萄糖的供给。
母羊血浆NEFA浓度是衡量机体是否处于能量负平衡的标志之一,机体血浆NEFA浓度升高主要是由于母羊围产期需要大量的能量供于胎儿生长、分娩和泌乳,能量供给不足就会使机体动员脂肪分解功能,而产生大量的NEFA[31]。特别是对于多胎母羊来说,围产期能量的需要较于单胎羊更大,处于能量负平衡的风险也更大,血浆NEFA浓度较高会直接导致母羊产后产乳热症、产后瘫痪及酮病的发生,严重地威胁着多胎母羊的健康[32]。Watanabe等[33]报道,对禁食小鼠腹腔注射血清素在30 min后,血浆甘油三酯、NEFA和胆固醇浓度下降。血浆甘油三酯、NEFA和胆固醇浓度的下降,都是由血清素通过不同的5-HT受体作用而引起的。血清素通过不同的5-HT受体发挥作用,这表明血清素在每个组织中的反应活性不同。肝脏通过血清素刺激从血液中摄取胆固醇,可能导致血浆胆固醇浓度降低,这与血清素和葡萄糖代谢之间的关系类似[34]。本试验研究发现,各组血浆NEFA浓度分娩后均逐渐上升,至产后第6天达到最高值。Trp组和5-HTP组血浆NEFA浓度在产后第0、3、9天显著低于对照组。这说明5-HT或许是通过促进肝脏糖异生的作用,增加了机体葡萄糖的供给,从而减少游离脂肪酸的产生,但具体的机制有待于进一步研究与验证。Janovick等[34]报道,血液中低浓度的INS更有利于母羊体脂的动员,脂肪组织动员产生NEFA进入血液,同时增加了乳脂的含量[26],这与本试验的研究结果也是相一致的。
4 结论灌注5-HT前体物可以影响围产期母羊乳脂和乳中非脂固体含量,提高血浆葡萄糖浓度,降低血浆NEFA和INS浓度,对于缓解围产期母羊的能量负平衡具有促进作用。
| [1] |
LAPORTA J, PETERS T L, MERRIMAN K E, et al. Serotonin (5-HT) affects expression of liver metabolic enzymes and mammary gland glucose transporters during the transition from pregnancy to lactation[J]. PLoS One, 2013, 8(2): e57847. DOI:10.1371/journal.pone.0057847 |
| [2] |
LAPORTA J, MOORE S A E, WEAVER S R, et al. Increasing serotonin concentrations alter calcium and energy metabolism in dairy cows[J]. Journal of Endocrinology, 2015, 226: 43-55. DOI:10.1530/JOE-14-0693 |
| [3] |
ZABALA M T, LORENZO P, ALVAREZ L, et al. Serotonin increases the cAMP concentration and the phosphoenolpyruvate carboxykinase mRNA in rat kidney, small intestine, and liver[J]. Cellular Physiology, 1992, 150(3): 451-455. |
| [4] |
中国饲料数据库. 中国饲料成分及营养价值表(2018年第29版)[J]. 中国饲料, 2018(21): 64-73. |
| [5] |
国家技术监督局.GB/T 6432-1994饲料中粗蛋白测定方法[S].北京: 中国标准出版社, 1994.
|
| [6] |
中华人民共和国国家质量监督检验检疫总局.GB/T 6436-2002饲料中钙的测定[S].北京: 中国标准出版社, 2002.
|
| [7] |
中华人民共和国国家质量监督检验检疫总局.GB/T 6437-2002饲料中总磷的测定分光光度法[S].北京: 中国标准出版社, 2002.
|
| [8] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 20806-2006饲料中中性洗涤纤维(NDF)的测定[S].北京: 中国标准出版社, 2007.
|
| [9] |
艳城, 孙海洲, 李胜利, 等. 不同品种苜蓿蛋白质和碳水化合物组分、体外降解率及能值评定[J]. 中国奶牛, 2015(5): 5-10. |
| [10] |
高康.甘肃高山细毛羊泌乳规律及哺乳期羔羊体重生长规律研究[D].硕士学位论文.杨凌: 西北农林科技大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10712-1015331966.htm
|
| [11] |
DRACKLEY J K, DANN H M, DOUGLAS N, et al. Physiological and pathological adaptations in dairy cows that may increase susceptibility to periparturient diseases and disorders[J]. Italian Journal of Animal Science, 2005, 4(4): 323-344. DOI:10.4081/ijas.2005.323 |
| [12] |
BERTICS S J, GRUMMER R R, CADORNIGA-VALINO C, et al. Effect of prepartum dry matter intake on liver triglyceride concentration and early lactation[J]. Journal of Dairy Science, 1992, 75(7): 1914-1922. DOI:10.3168/jds.S0022-0302(92)77951-X |
| [13] |
KERTZ A F, FREUTZEL L, THOMSON G M. Dry matter intake from parturition to midlactation[J]. Journal of Dairy Science, 1991, 74(7): 2290-2295. DOI:10.3168/jds.S0022-0302(91)78401-4 |
| [14] |
GRUMMER R R. Impact of changes in organic nutrient metabolism on feeding the transition dairy cow[J]. Journal of Animal Science, 1995, 73(9): 2820-2833. DOI:10.2527/1995.7392820x |
| [15] |
GRUMMER R R, BERTICS S J, LACOUNT D W, et al. Estrogen induction of fatty liver in dairy cattle[J]. Journal of Dairy Science, 1990, 73(6): 1537-1543. DOI:10.3168/jds.S0022-0302(90)78822-4 |
| [16] |
KIM H, TOYOFUKU Y, LYNN F C, et al. Serotonin regulates pancreatic beta cell mass during pregnancy[J]. Nature Medicine, 2010, 16(7): 804-808. DOI:10.1038/nm.2173 |
| [17] |
PAULMANN N, GROHMANN M, VOIGT J P, et al. Intracellular serotonin modulates insulin secretion from pancreatic β-cells by protein serotonylation[J]. PLoS Biology, 2009, 7(10): e1000229. DOI:10.1371/journal.pbio.1000229 |
| [18] |
PRATT W E, CLISSOLD K A, LIN P G, et al. A systematic investigation of the differential roles for ventral tegmentum serotonin 1- and 2-type receptors on food intake in the rat[J]. Brain Research, 2016, 1648: 54-68. DOI:10.1016/j.brainres.2016.07.016 |
| [19] |
李胜利, 张兴隆, 王亚庆, 等. 高能高蛋白补充料对奶牛产奶性能的影响[J]. 中国畜牧杂志, 2003, 39(6): 34-35. |
| [20] |
SUHANFF D J, CLARK J H. Effects of Feeding diets containing calcium salts of long-chain fatty acids to lactating dairy cows[J]. Journal of Dairy Science, 1992, 75(11): 2990-3002. DOI:10.3168/jds.S0022-0302(92)78063-1 |
| [21] |
GRUMMER R R. Effect of feed on the composition of milk fat[J]. Journal of Dairy Science, 1991, 74(9): 3244-3257. DOI:10.3168/jds.S0022-0302(91)78510-X |
| [22] |
JANOVICK N A, DRACKLEY J K. Prepartum dietary management of energy intake affects postpartum intake and lactation performance by primiparous and multiparous Holstein cows[J]. Journal of Dairy Science, 2010, 93(7): 3086-3102. DOI:10.3168/jds.2009-2656 |
| [23] |
WAHREN J, EKBERG K. Splanchnic regulation of glucose production[J]. Annual Review of Nutrition, 2007, 27: 329-345. DOI:10.1146/annurev.nutr.27.061406.093806 |
| [24] |
LAPORTA J.The role of serotonin in calcium and energy homeostasis: new opportunities for the management of transition-related metabolic disorders[D].Ph.D.Thesis.Madison, U.S.A.: University of Wiscons in Madison, 2014.
|
| [25] |
LE FLOC'H N, OTTEN W, MERLOT E. Tryptophan metabolism, from nutrition to potential therapeutic applications[J]. Amino Acids, 2011, 41(5): 1195-1205. DOI:10.1007/s00726-010-0752-7 |
| [26] |
艾晓杰, 吴晓林, 朱勇琪, 等. 初胎奶牛围产期某些血液生化成分的特点[J]. 中国奶牛, 2004, 12(1): 23-25. |
| [27] |
李志强. 奶牛生产瘫痪发病机理与防治[J]. 中国奶牛, 2006(2): 33-35. |
| [28] |
SUGIURA T, TASHIRO T, YAMAMORI H, et al. Effects of insulin-like growth factor-1 on endotoxin translocation in burned rats receiving total parenteral nutrition[J]. Nutrition, 1997, 13(9): 783-787. DOI:10.1016/S0899-9007(97)00189-5 |
| [29] |
RUKKWAMSUK T, WENSING T, GEELEN M J H. Effect of overfeeding during the dry period on regulation of adipose tissue metabolism in dairy cows during the periparturient period[J]. Journal of Dairy Science, 1998, 81(11): 2904-2911. DOI:10.3168/jds.S0022-0302(98)75851-5 |
| [30] |
GONG J G, LEE W J, GARNSWORTHY P C, et al. Effect of dietary-induced increases in circulating insulin concentrations during the early postpartum period on reproductive function in dairy cows[J]. Reproduction, 2002, 123(3): 419-427. DOI:10.1530/rep.0.1230419 |
| [31] |
LEROY J L M R, VANHOLDER T, VAN KNEGSEL A T M, et al. Nutrient prioritization in dairy cows early postpartum:mismatch between metabolism and fertility?[J]. Reproduction in Domestic Animals, 2008, 43: 96-103. |
| [32] |
刘艳琴, 李建国, 江富华, 等. 奶牛泌乳早期能量负平衡的危害及解决措施[J]. 中国奶牛, 2000(1): 31-32. |
| [33] |
WATANABE H, AKASAKA D, OGASAWARA H, et al. Peripheral serotonin enhances lipid metabolism by accelerating bile acid turnover[J]. Endocrinology, 2010, 151(10): 4776-4786. DOI:10.1210/en.2009-1349 |
| [34] |
JANOVICK N A, BOISCLAIR Y R, DRACKLEY J K. Prepartum dietary energy intake affects metabolism and health during the periparturient period in primiparous and multiparous Holstein cows[J]. Journal of Dairy Science, 2011, 94(3): 1385-1400. DOI:10.3168/jds.2010-3303 |




