2. 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业与种质资源利用重点实验室, 无锡 214081
2. Key Laboratory of Freshwater Fishes and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wu'xi 214081, China
近年来规模化、集约化水产养殖业迅速发展,高密度的养殖容易造成水体环境恶化,水产动物免疫力下降,感染疾病的概率大大增加[1-2]。大量抗生素和化学药品的使用不仅导致病原菌耐药性增强,而且药物的富集作用不利于水产品食用健康,在水体中的残留甚至造成了整个水体生态环境的进一步破坏[1-3]。随着人们健康和环保意识的不断加强,进行绿色养殖成为新时代的产业要求,寻找无污染、无残留和多功能的饲料添加剂是推进养殖业可持续发展的必要途径。
刺五加(Acanthopanax senticosus,AS)是五加科植物的根和根茎,它含有动物体所需的微量元素和氨基酸等营养成分以及多种活性成分,如皂苷、多糖和黄酮类化合物,可以主动地调节动物机体免疫功能,可用于治疗和预防多种疾病[4-5]。研究表明,刺五加在增强免疫力、抵御病菌入侵、提高抗氧化能力[6-8]、改善肠道微生物菌群[9]和治疗炎症[10]等方面发挥着重要作用。刺五加具有来源广泛、毒副作用小,并且促进生长和抵抗疾病效果显著等优点[11-12],因此可以作为一种优质的动物营养饲料添加剂。
刺五加作为动物营养饲料添加剂的应用研究已有一些报道。Yoon等[13]研究发现,注射刺五加水提物(500 μg/mL)小鼠的巨噬细胞显现出更高的杀肿瘤活性,有较好的抗肿瘤活性,可以抑制肿瘤转移;Kong等[14]给断奶仔猪饲喂添加1g/kg刺五加提取物的饲粮,发现刺五加可以通过调节免疫细胞、细胞因子和抗体的产生来改变断奶仔猪的细胞核体液免疫;阮国良等[15]用茯苓、五加皮和黄芪作为饲料添加剂,以黄鳝(Monopterus albus)为养殖对象进行试验,结果发现五加皮能明显促进黄鳝生长;王永玲等[16]在饲料中添加1%的刺五加饲喂银鲫(Carassius auratus gibelio Bloch),刺五加组增重率比对照组要高出7.29%,说明刺五加有明显的促生长作用。然而,传统粗粉碎工艺获取的刺五加有效成分吸收率低,使用剂量普遍偏大,不仅增加了产品成本,造成浪费,而且影响了饲料的营养配比,这种简单的制作工艺极大地影响了刺五加在水产养殖业上的推广应用[17]。超微粉碎是近年来迅速发展起来的高新技术,能把原材料加工成微米甚至纳米级的微粉,该制作工艺可以大大地增加加工材料微粒的表面积,提高破壁率,加快有效成分在体内的释放[17]。利用超微技术制取刺五加超微粉,可提高刺五加中有效成分的吸收率,降低刺五加在饲料中的添加量,从而降低饲料成本。
罗非鱼具有生长快、产量高、繁殖能力强、对环境适应性强等特点,已成为我国主要养殖品种之一。但高密度养殖、逐渐恶化的水体环境以及质量良莠不齐的饲料等,都容易导致罗非鱼肝脏脂肪沉积和机体免疫应答减弱,感染疾病的概率大大提升,对养殖业造成了巨大的经济损失[18]。本试验以刺五加超微粉为试验材料,通过对不同添加量之间的比较,分析饲料中添加刺五加超微粉对罗非鱼生长、脂肪沉积以及非特异性免疫能力的影响,进而探明刺五加超微粉对罗非鱼生长和免疫等方面的作用以及在饲料中最适添加量,以期为刺五加营养与免疫方面的研究提供参考,也为刺五加在罗非鱼饲料中的应用与推广提供理论依据。
1 材料与方法 1.1 试验用鱼试验用鱼为取自中国水产科学研究院淡水渔业研究中心宜兴基地的吉富罗非鱼,所选个体活力良好且无病无伤。将试验鱼放置在室内可控温流水循环系统的圆形蓄养槽[水温(28±1) ℃]内暂养7 d。暂养期间使用循环水养殖,并用增氧机持续充气,每天08:00和16:00各投喂商品饲料1次,每次投喂量为体重的5%。
1.2 试验饲料的制备首先配制基础饲料,然后将刺五加超微粉(购自北京渔经生物技术有限责任公司)分别按照0(对照)、0.5‰、1.0‰、2.0‰、4.0‰和8.0‰的添加量添加到基础饲料中并替代等量的微晶纤维素,配制成6种试验饲料。试验饲料组成及营养水平如表 1所示。
|
|
表 1 试验饲料组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of experimental diets (as-fed basis) |
饲养试验在循环水系统中进行,将平均体重为(6.50±0.02) g的吉富罗非鱼随机分成6组,每组设置4个重复,每个重复30尾鱼,以重复为单位饲养在600 L的养殖桶中,试验共使用24个养殖桶。每组试验鱼随机饲喂1种试验饲料,饲喂56 d。试验期间,试验鱼每日投喂2次(08:00和16:00),饱食投喂,以不留残饵为度。试验期间,试验水体持续供氧,保持溶氧浓度在5 mg/L以上,并每隔3 d换注1/3清水。
1.4 样品采集养殖试验结束后,测量每个养殖桶中所有试验鱼的总重,统计尾数,并计算增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)和饲料转化率(feed conversion rate,FCR)。
饲养56 d后采集样品,取样前禁食24 h。从每个养殖桶中随机选取3尾鱼,用100 mg/L MS-222预先麻醉,称重后尾静脉采集血液,血样根据Ma等[19]的方法4 ℃、5 000 r/min离心15 min收集血清,-20 ℃保存;随后解剖取出肝脏,样品在液氮中冷冻后再置于-80 ℃冰箱低温保存,以便进行后续操作。再从每个养殖桶中随机取3尾鱼,解剖取出内脏,分离肝脏,计算脏体比(viscerasomatic index,VSI)和肝体比(hepatosomatic index,HSI)。
1.5 指标测定 1.5.1 生长性能指标根据以下公式计算WGR、SGR、FCR、HSI、VSI:
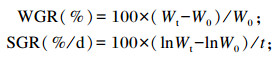
|
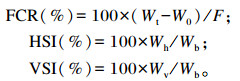
|
式中:W0为试验鱼的平均初重(g);Wt为试验鱼的平均末重(g);t为饲养天数(d);F为试验鱼的平均总摄食量(g);Wh为每尾鱼的终末肝脏重(g);Wv为每尾鱼的终末内脏重(g);Wb为每尾鱼的终末体重(g)。
1.5.2 血常规指标红细胞计数(red blood cell count,RBC)、白细胞计数(white blood cell count,WBC)、血红蛋白浓度(haemoglobin concentration,HGB)与血细胞压积(haematocrit,HCT)按照试剂盒说明,在迈瑞BC-5300Vet全自动五分类动物血液细胞分析仪上进行测定,试剂盒均购自深圳迈瑞生物医疗电子股份有限公司。
1.5.3 血清生化指标血清溶菌酶(lysozyme,LZM)活性、补体3(complement 3,C3)、免疫球蛋白M(immunoglobulin M,IgM)、免疫球蛋白A(immunoglobulin A,IgA)和免疫球蛋白G(immunoglobulin G,IgG)含量采用上海朗顿生物有限公司生产的酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒,通过全波段酶标仪(BioTek EonTM)测定。血清总蛋白(total protein,TP)、葡萄糖(glucose,Glu)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)含量及谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspertate aminotransferase,AST)活性使用迈瑞BS-400全自动生化分析仪进行测定,所用试剂盒均来自迈瑞生物医疗电子股份有限公司。
1.5.4 肝脏生化指标用预冷生理盐水冲洗解冻的肝脏样品,滤纸吸干水分后称取肝脏样品0.1 g左右,加入9倍体积(m/V)的预冷磷酸缓冲盐溶液(phosphate buffer saline,PBS),振荡研磨后制成组织匀浆。根据ELISA试剂盒(购自上海朗顿生物科技有限公司)中的方法测定肝脏丙二醛(malondialdehyde)MDA、C3、TG、TC、糖原(glycogen, Gly)含量以及超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和LZM活性,所有指标在24 h内测定完毕,试验结果通过全波段酶标仪(BioTek EonTM)进行读数。
1.5.5 肝脏中免疫相关基因的定量表达根据GenBank中罗非鱼补体3、白细胞介素-1β(interleukin-1β,IL-1β)、γ-干扰素(interferon-γ,INF-γ)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的序列,设计这4个目的基因的特异性引物,由苏州金唯智生物科技有限公司合成,引物序列如表 2所示。取试验鱼肝脏样品10 mg左右,使用Trizol试剂(Invitrogen)提取总RNA。将提取的肝脏总RNA按照PrimeScriptTM RT Master Mix试剂盒(TaKaRa)说明书要求进行mRNA反转录。反转录PCR的反应溶液包括PrimeScriptTM RT Master Mix 2.0 μL和RNA样品(≤500 ng),加入RNase Free ddH2O至10 μL。将反应溶液在37 ℃孵育15 min,并在85 ℃下反应5 min后终止反应,置于-20 ℃保存。将反转录产生的cDNA按照PrimeScriptTM RT reagent Kit Perfect Real Time (TaKaRa)要求进行实时荧光定量PCR(qRT-PCR)检测。qRT-PCR反应体系(25 μL)[20]包括:SYBR Premix Ex Tap Ⅱ (2×) 12.5 μL、ROX染料0.5 μL、PCR正向和反向引物(10 μmol/L)各1 μL、cDNA模板2 μL和RNase free ddH2O 8 μL。qRT-PCR反应方案如下:95 ℃持续30 s,然后是40个循环(95 ℃ 5 s,60 ℃ 30 s)。
|
|
表 2 引物序列 Table 2 Primer sequences |
以β-肌动蛋白(β-actin)作为内参基因,通过2-ΔΔCt法[21]确定不同刺五加超微粉添加量下各目的基因mRNA的相对表达量,并且将对照组中的值指定为1作为参考。
1.6 数据处理与分析采用SPSS 22.0软件处理所得数据,先使用Shapiro-Wilk和Levene检验对数据的正态性和方差同质性进行分析,然后使用单因素方差分析(one-way ANOVA)进行显著性分析,当差异显著时,再用Duncan氏法进行多重比较,P < 0.05为差异显著。结果以平均值±标准误(mean±SE)来表示。
2 结果与分析 2.1 刺五加超微粉对吉富罗非鱼生长性能的影响刺五加超微粉对吉富罗非鱼生长性能的影响如表 3所示。与对照组相比,各添加组的WGR和SGR均显著升高(P < 0.05),其中以2.0‰组的WGR和SGR最高。0.5‰和1.0‰的HSI与对照组相比显著降低(P < 0.05),各添加组的VSI虽与对照组相比有下降的趋势,但差异均未达显著水平(P>0.05)。饲料中添加不同水平的刺五加超微粉后FCR均有所升高,以添加量为1.0‰时最高,且1.0‰、2.0‰、4.0‰、8.0‰组均显著高于对照组(P < 0.05)。
|
|
表 3 刺五加超微粉对吉富罗非鱼生长性能的影响 Table 3 Effects of AS ultrafine powder on growth performance of GIFT |
刺五加超微粉对吉富罗非鱼血常规指标的影响如表 4所示。各组鱼的WBC、RBC、HGB和HCT均随刺五加超微粉添加量的增加而升高,其中2.0‰、4.0‰、8.0‰组的WBC与8.0‰组RBC均显著高于对照组(P < 0.05),但在HGB和HCT上各组间均没有显著差异(P>0.05)。
|
|
表 4 刺五加超微粉对吉富罗非鱼血常规指标的影响 Table 4 Effects of AS ultrafine powder on blood routine indexes of GIFT |
刺五加超微粉对吉富罗非鱼血清生化指标的影响如表 5所示。血清Glu含量随刺五加添加量的增加呈先下降后上升的趋势,8.0‰组最高,显著高于其他组(P < 0.05),0.5‰和1.0‰组较低,显著低于其他组(P < 0.05)。刺五加超微粉添加量为1.0‰时,血清ALT、AST活性以及TG含量均最低,显著低于对照组(P < 0.05)。血清C3含量随饲料中刺五加超微粉添加量的增加先上升后下降,以1.0‰组最高,显著高于对照组(P < 0.05)。血清LZM活性以1.0‰组最高,与对照组差异不显著(P>0.05),但显著高于8.0‰组(P < 0.05)。饲料中添加不同水平的刺五加超微粉对吉富罗非鱼血清TG、TP、IgA、IgG及IgM含量均无显著影响(P>0.05)。
|
|
表 5 刺五加超微粉对吉富罗非鱼血清生化指标的影响 Table 5 Effects of AS ultrafine powder on serum biochemical indexes of GIFT |
刺五加超微粉对吉富罗非鱼肝脏生化指标的影响如表 6所示。饲料中添加不同水平的刺五加超微粉对吉富罗非鱼肝脏C3含量以及CAT活性均无显著影响(P>0.05)。与对照组相比,饲料中添加2.0‰的刺五加超微粉对肝脏SOD和LZM活性有显著的提高作用(P < 0.05);同时,该组肝脏MDA含量最低,显著低于对照组(P < 0.05)。肝脏TC、Gly和TG含量随饲料中刺五加超微粉添加量的增加呈先下降后上升的趋势,在添加量为1.0‰时这3个指标均处在较低水平,且显著低于对照组(P < 0.05)。
|
|
表 6 刺五加超微粉对吉富罗非鱼肝脏生化指标的影响 Table 6 Effects of AS ultrafine powder on liver biochemical indexes of GIFT |
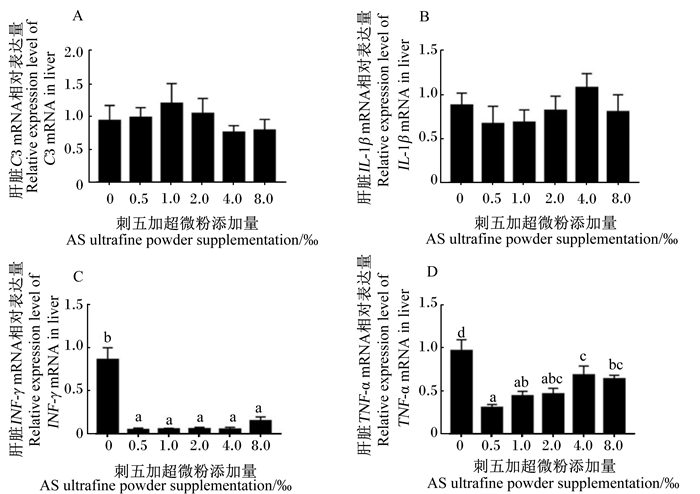
由图 1可知,刺五加超微粉对肝脏中C3 mRNA在低剂量时促进其表达,高剂量时抑制其表达,但C3 mRNA相对表达量各组之间不存在显著差异(P>0.05)。肝脏中IL-1β mRNA相对表达量各组之间差异不显著(P>0.05)。与对照组相比,各添加组肝脏中TNF-α与INF-γ mRNA相对表达量均显著降低(P < 0.05)。
|
数据柱标注不同小写字母表示显著差异(P < 0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 1 刺五加超微粉对吉富罗非鱼肝脏免疫相关基因表达的影响 Fig. 1 Effects of AS ultrafine powder on mRNA relative expression levels of immune related genes in liver of GIFT |
中草药中有多种天然的营养成分和生物活性物质,有利于动物机体的代谢和蛋白质以及酶的合成,促进营养物质的吸收利用,加快动物的生长发育[22-23]。阮国良等[15]用茯苓、五加皮和黄芪作为饲料添加剂,以黄鳝为养殖对象进行试验,结果发现五加皮能明显促进黄鳝生长。王永玲等[16]在饲料中添加1%的刺五加饲养银鲫,其中刺五加组WGR比对照组要高7.29%,有明显的促生长作用。在本试验中,饲料中添加0.5‰~8.0‰的刺五加超微粉后,吉富罗非鱼的WGR和SGR显著升高,且添加1.0‰~8.0‰的刺五加超微粉还显著提高了FCR,以添加量为2.0‰时WGR和SGR最高,添加量为1.0‰时FCR最高。这可能是因为刺五加促进了消化酶分泌并增强了机体的消化吸收能力[15]。由此可知,添加0.5‰~8.0‰的刺五加可以加快吉富罗非鱼的生长,促进营养物质的消化吸收。
脂肪肝是鱼类养殖过程中易发的营养性疾病,表现为肝脏中脂肪大量沉积和肝脏肥大。脂肪肝会对罗非鱼肝细胞产生病理危害,造成细胞结构变化。较高的HSI表明脂肪在肝脏中大量积累,使得肝细胞受到损伤,容易引起脂肪肝病[24-25]。本试验中,刺五加超微粉添加量为0.5‰~1.0‰时能显著降低罗非鱼的HSI,这说明饲料中添加0.5‰~1.0‰的刺五加超微粉对预防脂肪肝具有一定的效果。
3.2 刺五加超微粉对吉富罗非鱼血常规指标的影响鱼类血液成分受新陈代谢、营养状况和免疫机能的影响。RBC、WBC、HGB和HCT等参数普遍运用于评估鱼体营养情况、健康状态和对环境的应激反应,可以作为一种有效的生理、病理和毒理学指标[26-27]。红细胞和白细胞参与鱼类细胞免疫反应,其中白细胞中的粒细胞、单核细胞和淋巴细胞与集体的抗传染免疫有密切联系[28]。因此,WBC的变化可用于检测鱼类的疾病和机体损伤情况[19]。王晓光[29]分析了刺五加的药理作用和临床应用,发现刺五加能在一定程度上预防和治疗白细胞减少症。刘小玲[30]发现应激能明显抑制黄颡鱼白细胞的吞噬功能并能使WBC发生显著改变。在本试验中,饲料中添加8.0‰的刺五加超微粉后,WBC显著高于对照组,我们认为这是因为刺五加对鱼体自身免疫功能产生了积极的影响,较高添加量的刺五加超微粉使得WBC显著增加,提高了吉富罗非鱼的非特异性免疫力。
3.3 刺五加超微粉对吉富罗非鱼血清生化指标的影响体内能量代谢调节是鱼类适应外界环境变化的重要手段。当受到外界应激时,鱼体通过加强自身代谢活动来维持生理平衡[31]。ALT和AST主要分布于肝脏和心肌等组织中,在血清中活性较低且相对恒定。然而,胁迫导致肝脏损伤时,会造成组织细胞膜通透性增大,组织内ALT和AST活性降低,但血清中的活性将增强[32]。所以血清ALT与AST活性可以作为评价肝脏损伤程度的重要指标[33],本研究发现,刺五加超微粉添加量为1.0‰时血清ALT和AST活性显著低于对照组,说明1.0 ‰的刺五加超微粉添加量能够起到保护肝脏的作用。血清Glu在受到外界病菌和温度等胁迫时其含量会出现明显的升高,是鱼类面对胁迫时代谢调节的重要指示物[31, 34]。本研究中,刺五加超微粉添加量在0.5‰和1.0‰时血清Glu含量显著低于对照组。TG和TC是血脂的重要组成部分,且其主要合成部位均在肝脏,因此血清中TG和TC含量的变化可以评估肝脏内脂肪的代谢情况[35],血清TG和TC含量的增加代表肝脏中脂肪沉积较多,容易引起脂肪肝病。在本研究中,刺五加超微粉添加量为1.0‰时血清TG含量显著低于对照组。然而,过量的刺五加的添加可能会导致鱼体脂肪代谢功能减弱,血清TG含量和HSI均出现升高的情况。这说明适量的刺五加有利于饲料中脂肪的利用,但过多的添加会导致脂肪沉积,不利于吉富罗非鱼的健康生长。本研究结果表明,饲料中添加1.0‰的刺五加超微粉可能有助于提高吉富罗非鱼的非特异性免疫力,减少对肝脏的损伤。
本试验中,各组血清TP含量不存在显著差异,可能是因为TP在血液中相对稳定本试验设定的刺五加超微粉添加量不足以对其产生显著影响。同时,各组血清免疫球蛋白含量无显著差异,可能是因为试验环境适宜,吉富罗非鱼应激反应较弱。
3.4 刺五加超微粉对吉富罗非鱼肝脏生化指标的影响MDA是生物膜上多不饱和脂肪酸受到氧自由基攻击而产生的重要物质,它会引起核酸、蛋白质等生物大分子的交联聚合,造成细胞损伤,其含量间接反映了体内活性氧和脂质的过氧化水平,体现出细胞的损伤程度[36-37]。本试验发现,刺五加超微粉添加量为2.0‰时肝脏MDA含量较低,显著低于对照组。这表明饲料中添加2.0‰的刺五加超微粉能减轻肝脏损伤,提高吉富罗非鱼的抗氧化应激能力。
正常生理代谢情况下,抗氧化系统可以及时清除体内产生的活性氧。但当机体受到外界环境因素影响时,体内会产生大量的活性氧,若未能被系统及时清除,则会对细胞造成氧化损伤[38]。SOD和CAT是抗氧化系统中的关键酶。在清除活性氧过程中,超氧阴离子(O2-)被SOD歧化成过氧化氢(H2O2)与O2,而CAT可将产物H2O2进一步还原成水(H2O),因此通过体内SOD和CAT的作用可以减轻O2-对细胞的氧化损伤[39-40]。本研究中,刺五加超微粉添加量为2.0‰时肝脏SOD活性显著高于对照组;同时,随刺五加超微粉添加量的增加,吉富罗非鱼肝脏CAT活性先上升后下降。所以,为了避免机体内过多的脂质过氧化,在饲料中添加适量的刺五加可以保证机体有效、及时地清除所产生的自由基,维护和保障鱼体的生理平衡和健康状态。刺五加超微粉添加量为1.0‰时吉富罗非鱼肝脏中TG和TC含量均显著低于对照组,表明饲料中添加1.0‰的刺五加超微粉可以促进肝脏脂肪代谢,减少吉富罗非鱼肝脏肝脏中脂肪沉积。本试验中,血清TG含量和HSI都在该添加量下最低也说明了这一点。
3.5 刺五加超微粉对吉富罗非鱼血清和肝脏中LZM活性以及肝脏中免疫相关基因表达的影响LZM是一类有溶菌活性的碱性蛋白,是鱼类血淋巴细胞酶系统中的重要组成成分,它能够作为一种调理素激活机体的补体系统和吞噬细胞,从而防止病害侵入,抵抗病原微生物感染。LZM活性的高低变化反映了机体非特异性免疫力的强弱[41-44]。本研究发现,在1.0‰的刺五加超微粉添加量下血清LZM活性显著高于对照组,而肝脏LZM活性最高时刺五加超微粉添加量为2.0‰,说明1.0‰~2.0‰的刺五加超微粉添加量可以显著提高吉富罗非鱼的非特异性免疫能力。
随着疾病发生与防治研究的深入,许多细胞因子基因的功能研究得到了广泛开展。IL-1β、INF-γ、TNF-α作为鱼类中重要的免疫调控细胞因子基因,在机体的非特异性免疫中发挥着重要作用[45]。鱼体中由抗原激活的T淋巴细胞,特别是CD4+亚群会产生一些促使淋巴细胞活化、生长与分化以及促进炎症反应发生的细胞因子[46]。Velázquez等[47]用qRT-PCR证明了INF-γ在罗非鱼鳃上的表达量非常低,并用感染源刺激罗非鱼造成炎症反应,发现感染组的INF-γ表达量上调。这说明在正常生理状态下,INF-γ的表达量维持在一个低水平,但当机体受到外界应激时就会出现表达量上调。而在本试验中,添加刺五加超微粉的各添加组肝脏INF-γ mRNA相对表达量显著低于对照组,可能说明刺五加可能有缓解应激状态的作用。TNF-α具有双重生物学效应,较低浓度时,起着调节白细胞和内皮细胞分泌的作用,参与抵抗病原微生物的感染,调节炎症反应和促进组织修复,并引起肿瘤细胞凋亡等;高浓度时,体内过量的TNF-α会破坏机体免疫平衡,并与其他促炎性因子作用对机体造成多种病理损伤[48]。在本研究中,对照组肝脏中TNF-α mRNA有过高水平的表达,容易引起机体病理损伤,而在饲料中添加一定量的刺五加超微粉有助于降低肝脏中TNF-α mRNA的表达,抑制TNF-α的产生。Yi等[49]也得出了类似的结论。
IL-1β是一种具有多种免疫调节功能并诱发炎症反应以及机体防御反应的炎性细胞因子,在多种脏器损伤中具有重要作用[46]。补体是一种由肝细胞和巨噬细胞合成的具有类似酶活性的糖蛋白,在抵御病原微生物侵袭和炎症反应中发挥着重要作用。补体系统是机体非特异性免疫系统中不可缺少的一部分,该系统的后续反应离不开C3的激活[50]。本研究中,在不同刺五加超微粉添加量下并未观察到肝脏C3和IL-1β mRNA相对表达量的显著变化,可能是因为刺五加只参与调控鱼体非特异性免疫的部分途径。
4 结论① 饲料中添加1.0‰的刺五加超微粉有利于减少吉富罗非鱼肝脏脂肪的积累,减轻肝脏损伤,提高非特异性免疫能力。
② 饲料中添加2.0‰的刺五加超微粉有利于促进吉富罗非鱼的生长,提高机体的抗氧化应激能力。
③ 本试验条件下,建议在吉富罗非鱼饲料中添加1.0‰~2.0‰的刺五加超微粉。
| [1] |
齐遵利, 张秀文, 孙步太, 等. 复方中草药饲料添加剂对草鱼生长性能和免疫保护力的影响[J]. 科学养鱼, 2009(12): 64-66. |
| [2] |
许友卿, 丁兆坤. 水产动物饲料添加剂促进营养与免疫的研究[J]. 水产科学, 2013, 32(5): 300-305. |
| [3] |
孔江红.复方中草药对斜带石斑鱼生长性能及非特异性免疫功能的影响[D].硕士学位论文.福州: 集美大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10390-1014165125.htm
|
| [4] |
段雪磊, 马奎红, 包永占, 等. 刺五加免疫调节功能的研究进展[J]. 中兽医学杂志, 2015(6): 72-75. |
| [5] |
YI J M, KIM M S, SEO S W, et al. Acanthopanax senticosus root inhibits mast cell-dependent anaphylaxis[J]. Clinica Chimica Acta, 2001, 312(1): 163-168. |
| [6] |
GAFFNEY B T, HÜGEL H M, RICH P A. Panax ginseng and Eleutherococcus senticosus may exaggerate an already existing biphasic response to stress via inhibition of enzymes which limit the binding of stress hormones to their receptors[J]. Medical Hypotheses, 2001, 56(5): 567-572. DOI:10.1054/mehy.2000.1163 |
| [7] |
GUO M Q, SONG F R, LIU Z Q, et al. Characterization of triterpenoidic saponin mixture in crude extracts from leaves of Acanthopanax senticosus Harms by saponin structural correlation and mass spectrometry[J]. Analytica Chimica Acta, 2006, 557(1/2): 198-203. |
| [8] |
CHEN R Z, LIU Z Q, ZHAO J M, et al. Antioxidant and immunobiological activity of water-soluble polysaccharide fractions purified from Acanthopanax senticosu[J]. Food Chemistry, 2011, 127(2): 434-440. |
| [9] |
FANG J, YAN F Y, KONG X F, et al. Dietary supplementation with Acanthopanax senticosus extract enhances gut health in weanling piglets[J]. Livestock Science, 2009, 123(2/3): 268-275. |
| [10] |
YAMAZAKI T, SHIMOSAKA S, SASAKI H, et al. (+)-syringaresinol-di-O-β-D-glucoside, a phenolic compound from Acanthopanax senticosus Harms, suppresses proinflammatory mediators in SW982 human synovial sarcoma cells by inhibiting activating protein-1 and/or nuclear factor-κB activities[J]. Toxicology in Vitro, 2007, 21(8): 1530-1537. DOI:10.1016/j.tiv.2007.04.016 |
| [11] |
陈思, 孙春玉, 王义. 药用植物刺五加研究进展[J]. 园艺与种苗, 2011(4): 108-111. |
| [12] |
陈芬芳.刺五加多糖对肉鸡免疫功能和抗氧化性能的研究[D].硕士学位论文.聊城: 聊城大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10447-1015955081.htm
|
| [13] |
YOON T J, YOO Y C, LEE S W, et al. Anti-metastatic activity of Acanthopanax senticosus extract and its possible immunological mechanism of action[J]. Journal of Ethnopharmacology, 2004, 93(2/3): 247-253. |
| [14] |
KONG X F, YIN Y L, WU G Y, et al. Dietary supplementation with Acanthopanax senticosus extract modulates cellular and humoral immunity in weaned piglets[J]. Asian-Australasian Journal of Animal Sciences, 2007, 20(9): 1453-1461. DOI:10.5713/ajas.2007.1453 |
| [15] |
阮国良, 杨代勤, 王金龙. 几种中草药饲料添加剂对黄鳝免疫功能和生长性能的影响[J]. 饲料工业, 2005, 26(24): 34-36. |
| [16] |
王永玲, 蔡春芳. 中草药免疫增强剂对银鲫促生长效果的研究[J]. 水生态学杂志, 2002, 22(4): 42-43. |
| [17] |
陈开文, 谭涌. 中药超微粉碎应用研究概况[J]. 中国药业, 2006, 15(2): 75-77. |
| [18] |
QIANG J, YANG H, WANG H, et al. Interacting effects of water temperature and dietary protein level on hematological parameters in Nile tilapia juveniles, Oreochromis niloticus (L.) and mortality under Streptococcus iniae infection[J]. Fish & Shellfish Immunology, 2013, 34(1): 8-16. |
| [19] |
MA X Y, QIANG J, HE J, et al. Changes in the physiological parameters, fatty acid metabolism, and SCD activity and expression in juvenile GIFT tilapia (Oreochromis niloticus) reared at three different temperatures[J]. Fish Physiology and Biochemistry, 2015, 41(4): 937-950. DOI:10.1007/s10695-015-0059-4 |
| [20] |
TAO Y F, QIANG J, BAO J W, et al. miR-205-5p negatively regulates hepatic acetyl-CoA carboxylase β mRNA in lipid metabolism of Oreochromis niloticus[J]. Gene, 2018, 660: 1-7. DOI:10.1016/j.gene.2018.03.064 |
| [21] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [22] |
谢丽玲, 曹俊辉, 杨素霞, 等. 中草药作为饲料添加剂养殖罗非鱼试验[J]. 水产科学, 2009, 28(1): 11-14. |
| [23] |
于明超, 李卓佳, 林黑着, 等. 饲料中添加芽孢杆菌和中草药制剂对凡纳滨对虾生长及肠道菌群的影响[J]. 热带海洋学报, 2010, 29(4): 132-137. |
| [24] |
黄凯, 杨鸿昆, 甘晖, 等. 饲料中添加胆碱预防罗非鱼脂肪肝病变的作用[J]. 中国水产科学, 2007, 14(2): 257-262. |
| [25] |
张海涛, 王安利, 李国立, 等. 营养素对鱼类脂肪肝病变的影响[J]. 海洋通报, 2004, 23(1): 82-89. |
| [26] |
BHASKAR B R, RAO K S. Influence of environmental variables on haematology, and compendium of normal haematological ranges of milkfish, Chanos chanos (Forskal), in brackishwater culture[J]. Aquaculture, 1989, 83(1/2): 123-136. |
| [27] |
HARIKRISHNAN R, KIM M C, KIM J S, et al. Protective effect of herbal and probiotics enriched diet on haematological and immunity status of Oplegnathus fasciatus (Temminck & Schlegel) against Edwardsiella tarda[J]. Fish & Shellfish Immunology, 2011, 30(3): 886-893. |
| [28] |
王军, 鄢庆枇, 苏永全, 等. 免疫添加物对大黄鱼血液白细胞数量及其吞噬功能的影响[J]. 海洋科学, 2001, 25(9): 44-46. |
| [29] |
王晓光. 浅析刺五加的药理作用及其临床应用[J]. 中国医药指南, 2014, 12(30): 271-272. |
| [30] |
刘小玲.应激对黄颡鱼非特异性免疫细胞的影响[D].博士学位论文.武汉: 华中农业大学, 2006. http://cdmd.cnki.com.cn/article/cdmd-10504-2007210056.htm
|
| [31] |
QIANG J, YANG H, WANG H, et al. Physiological responses and HSP70 mRNA expression in GIFT tilapia juveniles, Oreochromis niloticus under short-term crowding[J]. Aquaculture Research, 2015, 46(2): 335-345. DOI:10.1111/are.12189 |
| [32] |
CASILLAS E, MYERS M, AMES W E. Relationship of serum chemistry values to liver and kidney histopathology in English sole (Parophrys vetulus) after acute exposure to carbon tetrachloride[J]. Aquatic Toxicology, 1983, 3(1): 61-78. DOI:10.1016/0166-445X(83)90007-3 |
| [33] |
强俊, 杨弘, 王辉, 等. 急性温度应激对吉富品系尼罗罗非鱼(Oreochromis niloticus)幼鱼生化指标和肝脏HSP70 mRNA表达的影响[J]. 海洋与湖沼, 2012, 43(5): 943-953. |
| [34] |
强俊, 杨弘, 王辉, 等. 海豚链球菌感染对不同品系罗非鱼血液生化指标和肝脏HSP70 mRNA表达的影响[J]. 水产学报, 2012, 36(6): 958-968. |
| [35] |
LEEMEN C L, LAPPE R, CRESTANI M, et al. Effect of different temperature regimes on metabolic and blood parameters of silver catfish Rhamdia quelen[J]. Aquaculture, 2004, 239(1/4): 497-507. |
| [36] |
LUEDER C G K, ALGNER M, LANG C, et al. Reduced expression of the inducible nitric oxide synthase after infection with Toxoplasma gondii facilitates parasite replication in activated murine macrophages[J]. International Journal for Parasitology, 2003, 33(8): 833-844. DOI:10.1016/S0020-7519(03)00092-4 |
| [37] |
方允中, 郑荣梁. 自由基生物学的理论与应用[M]. 北京: 科学出版社, 2002: 1-24.
|
| [38] |
FRANCO R, SANCHEZ-OLEA R, REYES-REYES E M, et al. Environmental toxicity, oxidative stress and apoptosis:menage a trois[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2009, 674(1/2): 3-22. |
| [39] |
PARIHAR M S, JAVERI T, HEMNANI T, et al. Responses of superoxide dismutase, glutathione peroxidase and reduced glutathione antioxidant defenses in gills of the freshwater catfish (Heteropneustes fossilis) to short-term elevated temperature[J]. Journal of Thermal Biology, 1997, 22(2): 151-156. DOI:10.1016/S0306-4565(97)00006-5 |
| [40] |
叶继丹, 韩友文, 赵吉伟, 等. 喹乙醇对鲤肝胰脏抗氧化酶系统的影响[J]. 水产学报, 2004, 28(3): 231-235. |
| [41] |
HIKIMA S, HIKIMA J I, ROJTINNAKORN J, et al. Characterization and function of kuruma shrimp lysozyme possessing lytic activity against Vibrio species[J]. Gene, 2003, 316: 187-195. DOI:10.1016/S0378-1119(03)00761-3 |
| [42] |
HOFFMANN J A, KAFATOS F C, JANEWAY C A, Jr., et al. Phylogenetic perspectives in innate immunity[J]. Science, 1999, 284(5418): 1313-1318. DOI:10.1126/science.284.5418.1313 |
| [43] |
GOPALAKANNAN A, ARUL V. Immunomodulatory effects of dietary intake of chitin, chitosan and levamisole on the immune system of Cyprinus carpio and control of Aeromonas hydrophila infection in ponds[J]. Aquaculture, 2006, 255(1/2/3/4): 179-187. |
| [44] |
ELLIS A E. Immunity to bacteria in fish[J]. Fish & Shellfish Immunology, 1999, 9(4): 291-308. |
| [45] |
ŠKUGOR S, ŠKUGOR A, TODORČEVIĆ M, et al. Exposure to lipopolysaccharide induces immune genes in cultured preadipocytes of Atlantic salmon[J]. Fish & Shellfish Immunology, 2010, 29(5): 817-824. |
| [46] |
NAKAE S, ASANO M, HORAI R, et al. Interleukin-1 beta, but not interleukin-1 alpha, is required for T-cell-dependent antibody production[J]. Immunology, 2010, 104(4): 402-409. |
| [47] |
VELÁZQUEZ J, ACOSTA J, HERRERA N, et al. Novel IFNγ homologue identified in Nile tilapia (Oreochromis niloticus) links with immune response in gills under different stimuli[J]. Fish & Shellfish Immunology, 2017, 71: 275-285. |
| [48] |
王家敏.复方中草药对吉富罗非鱼免疫相关基因表达的影响[D].硕士学位论文.湛江: 广东海洋大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10566-1012273763.htm
|
| [49] |
YI J M, HONG S H, KIM J H, et al. Effect of Acanthopanax senticosus stem on mast cell-dependent anaphylaxis[J]. Journal of Ethnopharmacology, 2002, 79(3): 347-352. DOI:10.1016/S0378-8741(01)00403-2 |
| [50] |
SMITH L C, CLOW L A, TERWILLIGER D P. The ancestral complement system in sea urchins[J]. Immunological Reviews, 2001, 180(1): 16-34. |




