2. 云南农业大学动物科学技术学院, 昆明 650201
2. Faculty of Animal Science and Technology, Yunnan Agricultural University, Kunming 650201, China
肠道与脑之间存在着密切的双向交流, 交流通信途径包括神经、激素和免疫介质等。胃肠道微生物通过参与肠道与大脑之间的交流, 影响正常肠道稳态与功能, 维持机体适当的行为[1]。人类和动物胃肠道存在数量巨大且体外培养困难的微生物, 目前为阐明胃肠道微生物菌群在肠脑交流中的作用及作用途径与机制, 多利用高科技设备的高通量组学分析方法[2]和限制菌群小鼠模型[3]等来进行研究。微生物代谢具有产生和调节多种化合物的能力, 越来越多的证据表明微生物菌群及其营养物质代谢产物在双向肠脑交流中发挥关键作用[4]。微生物某些代谢产物与宿主神经系统产生的内源性神经化学物质结构完全类似, 因此可以将胃肠道微生物菌群视作机体的一个虚拟内分泌器官[5]。微生物与脑交流互作所通过的这种双向通信系统即为微生物-肠-脑轴[6]。微生物-肠-脑轴作为机体的一种双向通信神经内分泌系统, 微生物代谢产物能够通过该系统影响大脑功能及机体应激反应。同样, 来自大脑的神经通讯信号可以影响胃肠道的运动、感觉和分泌方式进而影响微生物稳态[4-5]。微生物稳态变化可能与某些疾病特别是神经退行性疾病的发病相关, 利用微生物-肠-脑轴间的互作机理对一些疾病的治疗能够起到重要的作用。微生物代谢在微生物-肠-脑轴双向系统中发挥着重要作用, 如微生物代谢产物[色氨酸、血清素、5-羟色胺、短链脂肪酸(SCFA)和肽类等]通过神经、体液循环和免疫途径与脑间发生互作, 影响机体脑功能, 进而影响膳食等正常行为和健康(图 1)。
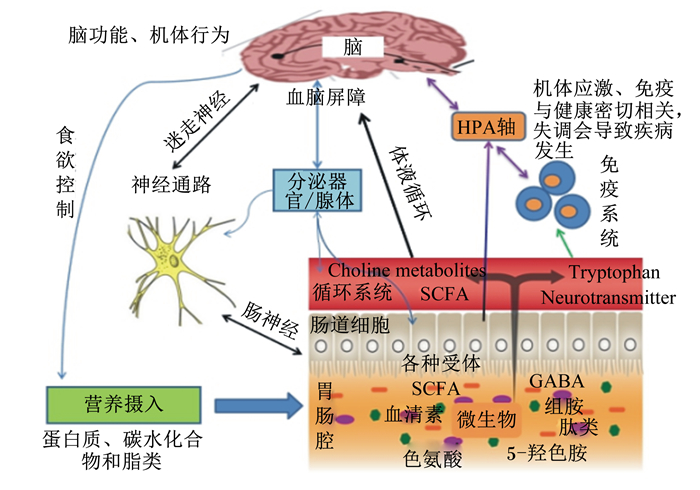
|
HPA:下丘脑-垂体-肾上腺hypothalamus-pituitary-adrenal; SCFA:短链脂肪酸short-chain fatty acid; GABA:γ-氨基丁酸γ-aminobutyric acid; Tryptophan:色氨酸; Choline metabolites:胆碱代谢产物; Neurotransmitter:神经传递素。 图 1 微生物-肠-脑轴间互作途径及影响 Fig. 1 Interaction pathways and effect of microbiota-gut-brain axis |
微生物与宿主间是长期共生关系, 研究表明早在新生儿期膳食营养素就可以调节宿主初始围产期肠道微生物的定植[7]。微生物在机体内主要参与营养物质代谢过程, 肠道微生物菌群有助于宿主能量获取和代谢调节。到目前为止, 研究很少发现由细菌直接调节神经系统的证据, 微生物主要通过氨基酸和SCFA的营养物质代谢产物来参与微生物-肠-脑轴的互作调控。同时, 氨基酸与SCFA之间可以相互转化, 氨基酸可作为微生物衍生的SCFA的前体, SCFA也可以用于合成氨基酸[8]。微生物营养物质代谢及代谢产物的研究对微生物-肠-脑轴通信系统研究意义重大。
1.1 微生物的氨基酸代谢微生物参与胃肠道中膳食蛋白质的消化、吸收、代谢和转化过程。膳食蛋白质的代谢产物氨基酸是人体和动物的必需营养素。胃肠道微生物菌群的氨基酸代谢途径有2种[8]:1)微生物菌群利用来自食物或宿主产生的氨基酸作为原料合成微生物蛋白质; 2)微生物菌群通过转化或发酵蛋白质和氨基酸促进宿主营养物质代谢。色氨酸、酪氨酸和组氨酸作为前体物质, 可被微生物代谢为神经递质血清素、多巴胺、去甲肾上腺素、肾上腺素和组胺等[9]。大多数血清素位于肠道, 它是肠道和脑之间的双向通信网络中肠神经系统的关键信号分子, 由肠道中肠嗜铬(EC)细胞内的色氨酸合成[10]。微生物的色氨酸代谢产物(吲哚、吲哚丙酸、吲哚乙酸、粪臭素和色胺)可作为芳香烃受体(AHR)的配体参与对肠道免疫的调节, 并影响色氨酸经5-羟色胺途径转化为血清素和褪黑激素[11]。5-羟色胺可调节垂体生长激素(GH)、生长激素受体(GHR)、胰岛素样生长因子1(IGF1)的表达, 参与神经内分泌调节生长激素-胰岛素样生长因子(GH-IGF)轴对动物生长起重要调控作用[12]。微生物的蛋白质代谢产物γ-氨基丁酸(GABA)是大脑中最重要的抑制性神经递质[5], 其通过调节脑内GABA信号的重要调节因子GABA转运蛋白来影响大脑[13]。GABA、谷氨酸、胰高血糖素样肽等肠源性激素肽可能参与机体食欲的调控[14]。微生物的蛋白质代谢对其自身同样有着很大的影响, 膳食蛋白质的来源和浓度及氨基酸平衡是影响肠道微生物菌群的结构与功能的主要因素, 其影响肠道微生物组成及微生物代谢产物的生成[15]。由此可见, 微生物参与蛋白质代谢过程与微生物-肠-脑轴作用密切相关。
1.2 微生物的SCFA代谢微生物参与宿主膳食中的碳水化合物和脂类的代谢, 将其发酵生成为SCFA加以利用。肠道微生物产生的SCFA能够改善肠道微生态环境, 还可通过直接影响宿主外周组织对宿主能量代谢发挥多种有益作用。如乙酸、丁酸和丙酸等SCFA可用于脂质和葡萄糖的合成, 被认为是重要的宿主能源。同时, SCFA还是微生物-肠-脑轴双向通信系统中极为重要的信号分子。微生物参与多糖和膳食纤维代谢所产生的SCFA与机体健康关系密切, 研究发现SCFA通过抑制组蛋白脱乙酰酶(HDAC)作为基因表达的表观遗传调节因子, 且与G蛋白偶联受体结合作为信号转导分子发挥作用, SCFA与相关SCFA受体游离脂肪酸受体2/G蛋白偶联受体43(FFAR2/GPR43)、游离脂肪酸受体3/G蛋白偶联受体41/(FFAR3/GPR41)、G蛋白偶联受体109A(GPR109A)和嗅觉受体78(OLFR78)等作用, 参与宿主能量稳态与炎症和癌症的调控[16]。无菌小鼠中发现结肠细胞酶表达降低致使三羧酸循环中还原型辅酶Ⅰ/氧化型辅酶(NADH/NAD+)、氧化磷酸化和ATP水平显着降低, 进而导致腺苷酸活化蛋白激酶(AMPK)活化、p27kip1磷酸化和自噬(自噬是负责维持细胞稳态的分解代谢机制)。当丁酸加入无菌的结肠细胞中时, 可以挽救其线粒体呼吸中的缺陷并防止发生自噬[17-18]。肠糖异生(IGN)释放的葡萄糖通过门静脉葡萄糖传感器被检测, 进而通过外周神经系统将其信号传递给大脑, 影响食物摄入和葡萄糖代谢。De Vadder等[19]研究发现丁酸能够依赖环磷酸腺苷(cAMP)机制影响FFAR2基因的表达从而直接激活IGN, 而丙酸作为底物与肠细胞脂肪酸受体FFAR3结合并调节葡萄糖-6-磷酸酶(G6PC)和磷酸烯醇式丙酮酸羧激酶1(PCK1)基因的表达, 经迷走神经复合体接受迷走神经通路输入作用于下丘脑和弓状核(ARC)影响食欲和代谢。乙酸、丙酸和丁酸能够通过抑制叉头翼状螺旋转录因子P3(FoxP3)启动子中的HDAC活性来调节性免疫T细胞的扩增和抑制巨噬细胞复制影响免疫[7]。研究表明肠道SCFA含量与肾上腺素、皮质酮和胰高血糖素释放有关, 宿主缺乏微生物会选择性地损害宿主肾上腺并影响儿茶酚胺对低血糖的反应[20]。SCFA与微生物-肠-脑轴关系极为密切, 是互作系统中神经免疫方面极为重要的信号物质。
2 宿主能量稳态与微生物菌群组成调节 2.1 能量平衡与稳态调节微生物能够通过微生物-肠-脑轴间的双向通信调节机体能量平衡, 这种作用较好地体现于大脑对食欲的控制, 摄食行为调节。大脑能够整合外围饥饿和饱腹感相关信号, 产生获取、摄取和消化食物所必需的积极行为。机体的某些周围器官组织(如ARC)和颅神经[如孤束核(NTS)接受迷走神经输入的食欲通路]参与食欲网络构成。ARC和NTS神经元能够投射到下丘脑、脑干和前脑等其他区域, 形成一个复杂的用于自主控制食欲的神经网络[14]。色氨酸含量可以影响机体神经肽Y和饥饿素表达, 通过中枢神经系统发出的信号介导摄食行为调节, 并影响宿主胃蛋白酶在胃中的活性和胰酶、胰凝乳蛋白酶、脂肪酶及淀粉酶的分泌量[12]。大脑通过食欲调节摄食行为进而影响微生物菌群的组成和胃肠道能量稳态, 同时各种微生物都旨在通过膳食营养素的特定发酵和产生代谢产物来增加其自身的适应性、栖息地和存活率, 其中许多代谢产物可直接影响营养感知以及饱腹感调节系统进而影响宿主的食欲和进食行为[21]。微生物能够影响肠内分泌细胞产生的肠肽释放如胆囊收缩素、胰高血糖素样肽1和肽YY, 并能通过肠-脑信号通路使宿主食物摄入量减少, 同时能量消耗增加[22]。宿主能量平衡的控制与微生物稳态调节密不可分, 微生物的代谢产物在微生物-肠-脑轴互作调控过程中起着非常关键的作用。
2.2 微生物菌群的组成调节微生物-肠-脑轴能够通过多种方式调控胃肠道内微生物菌群组成, 目前已知的方式有以下几种:1)大脑可能通过将神经化学物质特异性释放到肠腔, 从而影响微生物菌群的组成。如去甲肾上腺素能够影响细菌的复制率[23]。2)脑调节胃肠道环境使微生物通过自身代谢产物调节其组成。如一定环境下细菌通过产生细菌素来保护它们免受病原体的定植, 维持其最佳种群规模[24]。3)大脑控制宿主食欲来影响所摄入的营养素, 影响微生物组成。微生物营养来源主要由宿主摄食提供, 蛋白质来源、浓度和氨基酸平衡均可以影响肠道微生态系统[15]。饮食成分和营养状况被证明是调节肠道微生物菌群最关键且可改变的因素之一[25]。
3 微生物-肠-脑轴的作用途径微生物-肠-脑轴间的密切交流与神经系统关系紧密, 肠道内层存在一种神经元系统即肠神经系统, 它通过神经及内分泌、免疫和体液循环途径来实现肠道与大脑的沟通[4]。目前已知在肠道微生物和中枢神经系统之间存在相关串扰途径, 包括迷走神经及内分泌途径、信号分子通过循环系统和肠脑屏障传播以及免疫途径。
3.1 迷走神经及内分泌途径根据微生物菌群调控宿主功能的大量研究结果得知, 微生物-肠-脑轴可被认为是一种机体的神经内分泌系统。微生物菌群产生神经活性化学物质不仅可以用于其与宿主间的相互作用, 而且还可以作为微生物菌群成员之间信号传递的手段[26]。微生物-肠-脑轴中的微生物的营养物质代谢产物作用巨大, 微生物能够利用分泌产生的神经化学物质影响大脑行为[6]。
肠道细菌群落能够影响中枢神经系统中神经递质的产生, 此外, 肠道微生物菌群还产生许多神经递质。神经递质可分为4大类:氨基酸(甘氨酸、谷氨酸、GABA、天冬氨酸)、多肽(血管加压素、生长抑素、神经降压素)、生物胺(去甲肾上腺素、5-羟色胺、多巴胺)和乙酰胆碱[13]。研究显示微生物可通过调控色氨酸、血清素和5-羟色胺代谢系统的多样性和稳定性影响大脑。如微生物菌群控制海马内犬尿氨酸代谢基因的miRNA表达, 参与调节犬尿氨酸代谢途径(色氨酸代谢途径)[27]。机体所摄入的营养素经微生物代谢后产生的物质会诱导肠道肽(胆囊收缩素、胰高血糖素样肽1、肽YY等)的分泌, 这些肽通过迷走神经和非迷走神经元继发进行旁分泌, 或通过进入循环以内分泌方式发挥作用, 最终向中枢神经系统发出信号, 使机体产生适当的反应[22]。SCFA可以抑制组蛋白去乙酰化酶, 通过增强3'端RNA(如酪氨酸羟化酶基因中一种新的上游5'端调节元件)降解或改变转录, 加速儿茶酚胺的生物合成[20]。机体应激反应受神经内分泌系统控制, 丁酸促进宿主儿茶酚胺的合成, 并在一定浓度范围内能够激活下丘脑-垂体-肾上腺(HPA)轴, 使宿主产生应激[9]。研究表明一些与肠-脑轴相关的病症和微生物介导的HPA轴失调相关[28]。肠道微生物与宿主神经内分泌系统元件相互作用, 通过微生物生成的神经递质(像血清素)影响大脑认知和决策[29]; 改变与压力、饮食行为、性行为、社会行为和成瘾相关的行为[30]; 或通过SCFA来影响组蛋白乙酰转移酶和HDAC对组蛋白乙酰化的调控, 进而调节基因表达来调控表观遗传[16]。
3.2 循环系统与肠脑屏障胃肠屏障和血脑屏障是机体重要防线能够保护大脑与胃肠道细胞等下层结构, 使之免遭受有害外界刺激, 宿主屏障结构的完整性关乎胃肠道和中枢神经系统中各种疾病发病与否[31]。胃肠道微生物菌群及其代谢产物在调节屏障完整性中发挥着重要的作用, 其能够通过影响胃肠内分泌细胞的分泌来改变胃肠黏膜通透性。微生物菌群产生的大量神经活性物质(如儿茶酚胺、组胺和其他化合物), 可以通过与胃肠道内的受体直接结合, 或通过肠壁吸收和被动扩散进入门脉循环刺激宿主神经[6]。肠道微生物菌群加工摄入的多酚所产生的代谢产物可直接穿过血脑屏障作为神经递质, 或参与调节脑血管系统间接发挥作用[32]。微生物色氨酸代谢产物中的犬尿氨酸可以穿过血脑屏障参与犬尿喹啉酸和喹啉酸等神经活性代谢物的中枢神经系统合成[10], 与微生物的代谢产物相关的AHR作为一种介导异生物质代谢的细胞溶质配体激活的转录因子参与微调适应性免疫和黏膜屏障功能[11]。乙酸经循环系统穿过血脑屏障被大脑吸收后, 其可激活乙酰辅酶A羧化酶和改变调节神经肽的表达, 进而影响下丘脑神经元GABA、谷氨酸、谷氨酰胺等物质的产生, 导致食欲抑制[33]。微生物的代谢产物通过循环系统与肠脑屏障与大脑作用是微生物-肠-脑轴的重要作用途径, 其研究相对较少, 还有待继续深入。
3.3 免疫途径微生物菌群对胃肠道稳态有重要影响, 胃肠道微生态与免疫的关系十分密切。为确定微生物在正常胃肠道生理与免疫中所发挥的作用, 人们进行了较多研究。研究表明微生物可作为宿主免疫的调节剂通过微生物-肠-脑轴发挥作用[1]。微生物-肠-脑轴间互作异常所导致的HPA轴失调与某些免疫病症相关[28]。肠-脑轴功能受到干扰可导致大脑、免疫系统、内分泌系统和肠道功能发生障碍, 宿主肠道内微生物早期定植与此类功能障碍引起的很多疾病相关[29]。微生物对色氨酸的代谢对肠道免疫耐受和肠道微生物菌群间的平衡维持起着至关重要的作用。AHR参与介导微生物的色氨酸代谢产物(作为AHR的配体)对肠免疫的调节, 有益于免疫稳态维持[34]。内源性的色氨酸代谢产物(犬尿氨酸、5-羟色胺和褪黑激素)和微生物的色氨酸代谢产物(吲哚、吲哚酸、粪臭素和色胺)对肠道微生物的组成和代谢、宿主免疫系统与宿主行为有着深远影响[11]。
4 微生物-肠-脑轴对宿主健康的影响肠道微生物菌群的组成和完整性与疾病(如糖尿病、炎症及自身免疫性疾病)的病理与生理控制有关, 对抑郁症、自闭症、帕金森病和阿尔茨海默病等神经精神疾病也有着重要影响。通过胰岛素诱导的低血糖小鼠模型研究, 发现缺乏微生物或微生物的代谢产物(如SCFA)的小鼠会出现交感神经-肾上腺系统不平衡, 导致脑神经传递系统受到干扰, 进而改变小鼠神经内分泌对急性应激的行为反应[20]。具有遗传易感性个体的肠道微生物菌群代谢造成免疫应答失调会引起炎症性肠病[35], 除此之外, 研究还表明肺疾病[36]、肝性脑病[37]、慢性肾病[38]甚至艾滋病[39]都与肠道微生物菌群组分密切相关。
肠道微生物代谢与心理健康间的关系是微生物组研究中有趣且争议颇大的主题之一, 利用微生物-肠-脑轴间的互作机理来治疗某些精神障碍是如今的热门话题。异常的微生物菌群和微生物-肠-脑轴功能障碍是导致精神障碍的可能原因之一。肠道微生物菌群异常与抑郁症直接相关, 研究表明纠正此类异常干扰可以缓解抑郁症状[40]。肠道存在以细菌为主的微生物区系能够合成并释放淀粉样肽和脂多糖等细胞因子激活炎症信号, 对阿尔茨海默病的病理和生理级联有潜在影响[41]。同样, 真菌在多发性硬化症和其他神经系统疾病中可能发挥重要作用[42]。通过饮食诱导影响肠道微生物菌群组成可能参与马的压力调节, 并能改变马的行为反应[43]。微生物能够影响大脑中肥大细胞与胶质细胞分子间的互作, 多发性硬化症、阿尔茨海默病、肌萎缩侧索硬化症、帕金森病、癫痫等中枢神经疾病被认为与此相关[44]。
利用益生菌治疗疾病也是研究热点之一, 益生菌已被证明可预防和改善消化系统疾病。益生菌能够改善肠道生态失调, 使微生物菌群组成发生定量和定性的变化, 进而影响微生物的代谢并改善健康状况[45]。使用益生菌调节肠道微生物菌群组成和功能特征能够治疗结肠炎患者的肠道失调和改善结肠炎[35]; 用益生菌调节肠道菌群为基础的各种预防和辅助治疗方法已被提出用于肝损伤和抗肝衰竭的治疗[46]; 最近发现微生物能够调节内脏过敏和痛觉(内脏疼痛的调节涉及脊髓和高级脑结构)[47]。此外, 肠道菌群对药物药动学的影响与药物的治疗效果和副作用密切相关, 微生物菌群产生的各种酶能够影响肠道内药物的吸收和代谢。研究发现药物吸收前通过肠道微生物的代谢可以改变某些药物的系统生物利用度, 肠道微生物通过代谢能够生成肝脏中不能形成的特定药物代谢产物[48]。微生物调控于疾病的治疗与药物的吸收和代谢方面发挥着重要的作用, 对宿主健康有着极大的影响。
5 小结微生物-肠-脑轴间的互作研究对动物的营养物质代谢调控意义重大, 营养膳食对微生物和宿主神经内分泌生理的调控有着直接的作用和影响。当前对微生物内分泌机制研究还是相对较少, 根据已知的微生物-肠-脑轴作用途径与机制可知, 通过调节微生物组成及代谢对机体行为与健康进行调控是可行的。未来营养导向的微生物-肠-脑轴研究可为利用饮食代谢调控宿主行为与健康, 探究宿主-微生物双向互作机制和驱动途径提供更多的指导。
| [1] |
DE PALMA G, COLLINS S M, BERCIK P, et al. The microbiota-gut-brain axis in gastrointestinal disorders:stressed bugs, stressed brain or both?[J]. The Journal of Physiology, 2014, 592(14): 2989-2997. DOI:10.1113/jphysiol.2014.273995 |
| [2] |
CHEN X, D'SOUZA R, HONG S T. The role of gut microbiota in the gut-brain axis:current challenges and perspectives[J]. Protein & Cell, 2013, 4(6): 403-414. |
| [3] |
LYTE J M, PROCTOR A, PHILLIPS G J, et al. Altered Schaedler flora mice:a defined microbiota animal model to study the microbiota-gut-brain axis[J]. Behavioural Brain Research, 2019, 356: 221-226. DOI:10.1016/j.bbr.2018.08.022 |
| [4] |
LIU X F, CAO S Q, ZHANG X W. Modulation of gut microbiota-brain axis by probiotics, prebiotics, and diet[J]. Journal of Agricultural and Food Chemistry, 2015, 63(36): 7885-7895. DOI:10.1021/acs.jafc.5b02404 |
| [5] |
CLARKE G, STILLING R M, KENNEDY P J, et al. Minireview:gut microbiota:the neglected endocrine organ[J]. Molecular Endocrinology, 2014, 28(8): 1221-1238. DOI:10.1210/me.2014-1108 |
| [6] |
LYTE M. Microbial endocrinology in the microbiome-gut-brain axis:how bacterial production and utilization of neurochemicals influence behavior[J]. PLoS Pathogens, 2013, 9(11): e1003726. DOI:10.1371/journal.ppat.1003726 |
| [7] |
NASH M J, FRANK D N, FRIEDMAN J E. Early microbes modify immune system development and metabolic homeostasis—the "restaurant" hypothesis revisited[J]. Frontiers in Endocrinology, 2017, 8: 349. DOI:10.3389/fendo.2017.00349 |
| [8] |
LIN R, LIU W T, PIAO M Y, et al. A review of the relationship between the gut microbiota and amino acid metabolism[J]. Amino Acids, 2017, 49(12): 2083-2090. DOI:10.1007/s00726-017-2493-3 |
| [9] |
LYTE J M. Eating for 3.8×1013:examining the impact of diet and nutrition on the microbiota-gut-brain axis through the lens of microbial endocrinology[J]. Frontiers in Endocrinology, 2019, 9: 796. DOI:10.3389/fendo.2018.00796 |
| [10] |
O'MAHONY S M, CLARKE G, BORRE Y E, et al. Serotonin, tryptophan metabolism and the brain-gut-microbiome axis[J]. Behavioural Brain Research, 2015, 277: 32-48. DOI:10.1016/j.bbr.2014.07.027 |
| [11] |
GAO J, XU K, LIU H N, et al. Impact of the gut microbiota on intestinal immunity mediated by tryptophan metabolism[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 13. DOI:10.3389/fcimb.2018.00013 |
| [12] |
ZHAO Y, WU X Y, XU S X, et al. Dietary tryptophan affects growth performance, digestive and absorptive enzyme activities, intestinal antioxidant capacity, and appetite and GH-IGF axis-related gene expression of hybrid catfish (Pelteobagrus vachelli♀×Leiocassis longirostris)[J]. Fish Physiology and Biochemistry, 2019. DOI:10.1007/s10695-019-00651-4 |
| [13] |
MALINOVA T S, DIJKSTRA C D, DE VRIES H E. Serotonin:a mediator of the gut-brain axis in multiple sclerosis[J]. Multiple Sclerosis Journal, 2018, 24(9): 1144-1150. DOI:10.1177/1352458517739975 |
| [14] |
FETISSOV S O. Role of the gut microbiota in host appetite control:bacterial growth to animal feeding behaviour[J]. Nature Reviews Endocrinology, 2017, 13(1): 11-25. DOI:10.1038/nrendo.2016.150 |
| [15] |
ZHAO J F, ZHANG X Y, LIU H B, et al. Dietary protein and gut microbiota composition and function[J]. Current Protein and Peptide Science, 2019, 20(2): 145-154. |
| [16] |
KASUBUCHI M, HASEGAWA S, HIRAMATSU T, et al. Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation[J]. Nutrients, 2015, 7(4): 2839-2849. DOI:10.3390/nu7042839 |
| [17] |
DONOHOE D R, GARGE N, ZHANG X X, et al. The microbiome and butyrate regulate energy metabolism and autophagy in the mammalian colon[J]. Cell Metabolism, 2011, 13(5): 517-526. DOI:10.1016/j.cmet.2011.02.018 |
| [18] |
JIAO Q, DU X X, LI Y, et al. The neurological effects of ghrelin in brain diseases:beyond metabolic functions[J]. Neuroscience & Biobehavioral Reviews, 2017, 73: 98-111. |
| [19] |
DE VADDER F, KOVATCHEVA-DATCHARY P, GONCALVES D, et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J]. Cell, 2014, 156(1/2): 84-96. |
| [20] |
GIRI P, HU F R, LA GAMMA E F, et al. Absence of gut microbial colonization attenuates the sympathoadrenal response to hypoglycemic stress in mice:implications for human neonates[J]. Pediatric Research, 2019, 85(4): 574-581. DOI:10.1038/s41390-018-0270-y |
| [21] |
VAN DE WOUW M, SCHELLEKENS H, DINAN T G, et al. Microbiota-gut-brain axis:modulator of host metabolism and appetite[J]. The Journal of Nutrition, 2017, 147(5): 727-745. DOI:10.3945/jn.116.240481 |
| [22] |
BAUER P V, HAMR S C, DUCA F A. Regulation of energy balance by a gut-brain axis and involvement of the gut microbiota[J]. Cellular and Molecular Life Sciences, 2016, 73(4): 737-755. DOI:10.1007/s00018-015-2083-z |
| [23] |
AMBROSE P G, VANSCOY B D, ADAMS J, et al. Norepinephrine in combination with antibiotic therapy increases both the bacterial replication rate and bactericidal activity[J]. Antimicrobial Agents and Chemotherapy, 2018, 62(4): e02257-17. |
| [24] |
DUSZKA K, WAHLI W. Enteric microbiota-gut-brain axis from the perspective of nuclear receptors[J]. International Journal of Molecular Sciences, 2018, 19(8): 2210. DOI:10.3390/ijms19082210 |
| [25] |
SANDHU K V, SHERWIN E, SCHELLEKENS H, et al. Feeding the microbiota-gut-brain axis:diet, microbiome, and neuropsychiatry[J]. Translational Research, 2017, 179: 223-244. DOI:10.1016/j.trsl.2016.10.002 |
| [26] |
SPIELMAN L J, GIBSON D L, KLEGERIS A. Unhealthy gut, unhealthy brain:the role of the intestinal microbiota in neurodegenerative diseases[J]. Neurochemistry International, 2018, 120: 149-163. DOI:10.1016/j.neuint.2018.08.005 |
| [27] |
MOLONEY G M, O'LEARY O F, SALVO-ROMERO E, et al. Microbial regulation of hippocampal miRNA expression:implications for transcription of kynurenine pathway enzymes[J]. Behavioural Brain Research, 2017, 334: 50-54. DOI:10.1016/j.bbr.2017.07.026 |
| [28] |
FARZI A, FRÖHLICH E E, HOLZER P. Gut microbiota and the neuroendocrine system[J]. Neurotherapeutics, 2018, 15(1): 5-22. DOI:10.1007/s13311-017-0600-5 |
| [29] |
BRETT B E, DE WEERTH C. The microbiota-gut-brain axis:a promising avenue to foster healthy developmental outcomes[J]. Developmental Psychobiology, 2019, 61(5): 772-782. DOI:10.1002/dev.21824 |
| [30] |
CUSSOTTO S, SANDHU K V, DINAN T G, et al. The neuroendocrinology of the microbiota-gut-brain axis:a behavioural perspective[J]. Frontiers in Neuroendocrinology, 2018, 51: 80-101. DOI:10.1016/j.yfrne.2018.04.002 |
| [31] |
BHATTARAI Y. Microbiota-gut-brain axis:interaction of gut microbes and their metabolites with host epithelial barriers[J]. Neurogastroenterology&Motility, 2018, 30(6): e13366. |
| [32] |
FILOSA S, DI MEO F, CRISPI S. Polyphenols-gut microbiota interplay and brain neuromodulation[J]. Neural Regeneration Research, 2018, 13(12): 2055-2059. DOI:10.4103/1673-5374.241429 |
| [33] |
FROST G, SLEETH M L, SAHURI-ARISOYLU M, et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism[J]. Nature Communications, 2014, 5: 3611. DOI:10.1038/ncomms4611 |
| [34] |
ROTHHAMMER V, QUINTANA F J. The aryl hydrocarbon receptor:an environmental sensor integrating immune responses in health and disease[J]. Nature Reviews Immunology, 2019, 19(3): 184-197. DOI:10.1038/s41577-019-0125-8 |
| [35] |
CAI Y, LIU W, LIN Y X, et al. Compound polysaccharides ameliorate experimental colitis by modulating gut microbiota composition and function[J]. Journal of Gastroenterology and Hepatology, 2018. DOI:10.1111/jgh.14583 |
| [36] |
MENDEZ R, BANERJEE S, BHATTACHARYA S K, et al. Lung inflammation and disease:a perspective on microbial homeostasis and metabolism[J]. IUBMB Life, 2019, 71(2): 152-165. DOI:10.1002/iub.1969 |
| [37] |
KAWAGUCHI T, SUZUKI F, IMAMURA M, et al. Rifaximin-altered gut microbiota components associated with liver/neuropsychological functions in patients with hepatic encephalopathy:an exploratory data analysis of phase Ⅱ/Ⅲ clinical trials[J]. Hepatology Research, 2019, 49(4): 404-418. DOI:10.1111/hepr.13300 |
| [38] |
SUN C Y, LIN C J, PAN H C, et al. Clinical association between the metabolite of healthy gut microbiota, 3-indolepropionic acid and chronic kidney disease[J]. Clinical Nutrition, 2018. DOI:10.1016/j.clnu.2018.11.029 |
| [39] |
QING Y, XIE H Y, SU C, et al. Gut microbiome, short-chain fatty acids, and mucosa injury in young adults with human immunodeficiency virus infection[J]. Digestive Diseases and Sciences, 2019, 64(7): 1830-1843. DOI:10.1007/s10620-018-5428-2 |
| [40] |
LIANG S, WU X L, HU X, et al. Recognizing depression from the microbiota-gut-brain axis[J]. International Journal of Molecular Sciences, 2018, 19(6): 1592. DOI:10.3390/ijms19061592 |
| [41] |
DE J.R.DE-PAULA V, FORLENZA A S, FORLENZA O V.Relevance of gutmicrobiota in cognition, behaviour and Alzheimer's disease[J]. Pharmacological Research, 2018, 136: 29-34.
|
| [42] |
FORBES J D, BERNSTEIN C N, TREMLETT H, et al. A fungal world:could the gut mycobiome be involved in neurological disease?[J]. Frontiers in Microbiology, 2019, 9: 3249. DOI:10.3389/fmicb.2018.03249 |
| [43] |
DESTREZ A, GRIMM P, JULLIAND V. Dietary-induced modulation of the hindgut microbiota is related to behavioral responses during stressful events in horses[J]. Physiology & Behavior, 2019, 202: 94-100. |
| [44] |
GIROLAMO F, COPPOLA C, RIBATTI D. Immunoregulatory effect of mast cells influenced by microbes in neurodegenerative diseases[J]. Brain, Behavior, and Immunity, 2017, 65: 68-89. DOI:10.1016/j.bbi.2017.06.017 |
| [45] |
PLAZA-DIAZ J, RUIZ-OJEDA F J, GIL-CAMPOS M, et al. Mechanisms of action of probiotics[J]. Advances in Nutrition, 2019, 10(Suppl.1): S49-S66. |
| [46] |
LI Y T, LV L X, YE J Z, et al. Bifidobacterium adolescentis CGMCC 15058 alleviates liver injury, enhances the intestinal barrier and modifies the gut microbiota in D-galactosamine-treated rats[J]. Applied Microbiology and Biotechnology, 2019, 103(1): 375-393. DOI:10.1007/s00253-018-9454-y |
| [47] |
PUSCEDDU M M, GAREAU M G. Visceral pain:gut microbiota, a new hope?[J]. Journal of Biomedical Science, 2018, 25(1): 73. DOI:10.1186/s12929-018-0476-7 |
| [48] |
ZHANG J H, ZHANG J M, WANG R. Gut microbiota modulates drug pharmacokinetics[J]. Drug Metabolism Reviews, 2018, 50(3): 357-368. DOI:10.1080/03602532.2018.1497647 |




